餐厨垃圾和市政污泥配料比对厌氧产甲烷特性及微生物多样性的影响
2018-06-12朱英东雍晓雨谢欣欣仉丽娟贾红华
朱英东,周 俊,雍晓雨,谢欣欣,仉丽娟,贾红华,韦 萍
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800;2.南京工业大学 生物能源研究所,江苏 南京 211800)
餐厨垃圾(FW)与市政污泥(MS)等固体废弃物一直是学者们研究的热点问题[1]。Zhang等[2]发现:2020年中国餐厨垃圾产生量将达到每年1.4×108t,且每年的增长率将超过10%。餐厨垃圾因其易腐、易臭和易吸引害虫的特点,会导致严重的环境问题[3]。另一方面,随着我国污水处理量的不断加大,大量的市政污泥将不可避免的产生[4-5]。市政污泥中的许多有毒物质都会造成严重的环境污染,因此市政污泥的处理不当将会危害社会[6-8]。如何有效地处置餐厨垃圾与市政污泥已成为国内外的研究热点。
餐厨垃圾与市政污泥常规的处理方法主要有填埋、堆肥、焚烧与厌氧消化等。而在众多处理方式中,餐厨垃圾因其高的产甲烷潜力一直被认为是一种非常有吸引力的厌氧消化原料[9]。但是当餐厨垃圾作为厌氧消化的单独底物时,其在水解阶段会产生大量的有机酸从而抑制产甲烷菌的活性,甚至终止后续产甲烷的过程[10]。而当市政污泥作为唯一底物进行厌氧消化时,其中的胞外聚合物难以被打破,大分子有机物难以降解,从而导致产气不佳[11-12]。将市政污泥与餐厨垃圾进行混合厌氧消化,除了能改善厌氧消化系统的营养组成外,混合厌氧消化比单一处理更具有经济效益,减少了处理装置中单位体积的成本,并且能够冲淡混合物中潜在的有毒化合物,发挥微生物的协同作用,提高可生物降解有机物负荷率和消化装置的使用效率。Dai等[13]研究了污泥与餐厨垃圾混合与单独厌氧消化的性能差异时,指出混合消化能够稀释毒性物质从而提高系统稳定性,同时大幅提高沼气产量。段妮娜等[14]研究了餐厨垃圾与污泥联合干法中温厌氧消化性能,发现在污泥中添加餐厨垃圾有助于在利用原有消化罐容积的前提下,显著提高了有机负荷和体积产气率,同时随着混合系统中餐厨垃圾的比例不断增大,系统的产气率和甲烷产率也呈上升趋势。王永会等[15]研究了餐厨垃圾的加入量对污泥厌氧消化的影响时指出,污泥与餐厨垃圾的挥发性固体质量比为1∶ 1时,产甲烷效果最佳,整个过程中单位质量的挥发性固体的产甲烷量达到了224.1 mL/g。可见混合厌氧消化不仅可以提高进料的固体含量,促进营养平衡;同时还能够稀释重金属离子浓度,提高有机物的降解能力,而原料的混合比例对混合厌氧消化效率同样具有非常重要作用[16]。
传统微生物的分析方法由于其局限性,使得难以对环境中的微生物进行深入的研究。随着分子生物学领域的迅速发展,基于16S rDNA 基因的分子生物学方法被广泛运用于复杂微生物种群的研究中[17-18]。Li等[19]试验证明:微生物群落动态与系统性能密切相关,菌群适应环境变化的灵活性对生物反应器的功能稳定性是至关重要的。而在厌氧消化体系中,对餐厨垃圾与市政污泥混合厌氧消化的产甲烷性能结合微生物变化同步分析的报道相对较少。
因此,本文旨在探讨中温条件下不同进料累计产甲烷量达到挥发物固体含量(VS)配比对整个混合厌氧消化过程的影响。同时,对厌氧消化过程中微生物的多样性进行分析,以揭示微生物活性和群落结构,从而在此基础上对餐厨垃圾与市政污泥混合厌氧消化过程中的系统参数进行分析,其结果对厌氧消化过程的机理的研究具有重要意义。
1 材料与方法
1.1 实验材料
实验使用的餐厨垃圾取自江苏省南京市浦口区南京工业大学浦园食堂,其中主要成分为米饭、肉类和蔬菜等,剔除其中的骨头等硬物后,用食物粉碎机将其充分粉碎。市政污泥取自江苏省南京市江心洲污水处理厂的浓缩污泥。以上所有原料均在-4 ℃下冷冻保存待用。
接种厌氧消化液取自江苏省南京市南京工业大学生物能源研究所沼气站,取其中的混合消化液,在餐厨垃圾与市政污泥的混合体系中驯化2个月左右,待产气量与甲烷含量稳定后,备用。其目的在于通过合理的驯化,以提高体系中优势菌种的活性,从而在后期实验开展过程中,可作为接种物接入类似体系中,以缩短新的体系的产气启动时间。餐厨垃圾、市政污泥与接种污泥的基本性质见表1。表中:总固体含量为Total Solid,TS;氨氮为NH4+-N;溶解性化学需氧量为Soluble Chemical Oxygen Demand,SCOD;总有机碳为Total Organic Carbon,TOC;凯式氮为Total Kjeldahl Nitrogen,TKN。

表1 消化物料的基本性质
1.2 实验方法
采用批式厌氧消化法,在1 L实验室自制反应器(有效体积为800 mL)中,加入总VS为30 g的餐厨垃圾、市政污泥和接种污泥。餐厨垃圾和市政污泥的混合物与接种污泥的VS质量比为2∶ 1,然后将餐厨垃圾与市政污泥按照不同的挥发性固体质量比设定成5组实验组(1∶ 0、0∶ 1、1∶ 1、1∶ 2和2∶ 1),文中实验组的比例均为餐厨垃圾与市政污泥的挥发性固体质量之比。使用1 mol/L HCl/NaOH调节实验组的初始pH为(7.30±0.06)。由于在加入餐厨垃圾后,体系在初始阶段容易产生酸化的现象,因此在整个周期前5天每天实时监测与调节体系的pH状态,使之基本维持在7.00~8.00,从而缓解酸化现象对体系中的产甲烷菌带来的不利影响,在后续厌氧消化过程中同样实时监控pH的状态。最后,在厌氧反应器中通入5 min N2以保证在厌氧条件下进行消化实验。整个厌氧消化周期持续50 d。密闭厌氧反应器上接有2根导管,一根用于排水集气法收集气体,另一根用于取样测定数据。装置放置按照文献[20-22]的方法,在中温(38±0.5) ℃的培养箱中进行厌氧消化,每日手动摇匀3次。厌氧消化阶段所有测定均做3个平行实验,结果以均值±标准偏差表示。
1.3 仪器与试剂
GZX-9140 MBE型数显鼓风干燥箱,上海博迅实业有限公司;KSL-1100X型马弗炉,合肥科晶材料技术有限公司;K9860型总碳采用重铬酸钾滴定法全自动凯氏定氮仪,上海海能实验仪器科技有限公司;UB-7型pH值测定仪,美国丹佛仪器有限公司;SP6800A型气相色谱仪、热导检测器,山东鲁南瑞虹化工仪器有限公司;HayeSep Q型多孔高聚物类不锈钢填充柱φ3 mm×2 m;载气为He,流速53 mL/min;柱温45 ℃;检测器温度120 ℃;气化室温度120 ℃;进样量1 mL。
待测样品经过7 500 r/min离心15 min,离心沉淀待DNA提取用。上清液过0.45 μm水系滤膜,收集可溶性组分,采用文献[22]中美国公共卫生协会(APHA)的方法测定上清液中SCOD和NH4+-N。有机酸(VFAs)以高效液相色谱仪(1260 Infinity,上海安捷伦科技有限公司)测定,C18色谱柱(φ250 mm×4.6 mm,5 μm),流动相A为甲醇,流动相B为0.01 mol/L K2HPO4(用H3PO4调至pH为2.7),流动相A与流动相B的体积比为1∶ 99;检测器为210 nm紫外检测器;流速为0.6 mL/min;柱温为30 ℃。
1.4 DNA提取与多样性测序
取所有体系厌氧消化产气初期与产气高峰的有代表性的样品,首先于7 500 r/min离心15min,离心所得的样品使用PowerSoil DNA提取试剂盒(MO BIO Laboratories)按照其说明书步骤提取样品中的基因组DNA。提取完成的DNA样品交由上海美吉生物医药科技有限公司进行琼脂糖凝胶电泳与PCR纯化(引物为515F_909R),然后进行高通量测序分析。
1.5 数据分析
微生物的多样性分析采用上海美吉生物提供的i-sanger平台。该平台是上海美吉生物医药科技有限公司最新研发的一站式生物信息分析平台。经过数据的除杂与过滤之后,使用平台进行样品中物种的注释、评估与组成分析等测试。
2 结果与讨论
2.1 不同原料配比对混合厌氧消化系统产甲烷量的影响
不同原料配比对日产甲烷量的影响结果见图1。由图1可知:在整个厌氧消化阶段,日产甲烷量都呈现出先升后降的趋势。餐厨垃圾单独厌氧消化组(1∶ 0)在第24天开始出现上升趋势,然后分别在28 d(502.67 mL)和31 d(525.04 mL)出现了2个日产甲烷峰值。实验组(1∶ 0)出现2个峰值是因为餐厨垃圾中含有丰富的碳水化合物、蛋白质和脂肪等有机物,碳水化合物首先被降解,之后难降解的蛋白质和脂肪等大分子物质开始降解,这与Yang等[23]所提出的物料中碳水化合物快速降解产生抑制蛋白质酶,从而导致蛋白质的降解速率小于碳水化合物的降解速率的观点相一致。市政污泥单独厌氧消化组(0∶ 1)的日产甲烷量在整个周期中都处于比较低的阶段,日产甲烷最高值仅为388.36 mL(第13天)。较低的产甲烷量可能是因为市政污泥中存在大量难破壁的细胞,胞内物质不能充分的释放到环境中参与降解,同时市政污泥中有机质的含量相对较低。
3组餐厨垃圾和市政污泥混合厌氧消化组(1∶ 1、1∶ 2和2∶ 1)均只出现了一个日产甲烷量的峰值,分别为718.99 mL(第13天)、632.45 mL(第13天)和592.64 mL(第20天)。这与餐厨垃圾单独厌氧消化组相比,产甲烷峰值的时间分别提前了15、15和8 d,说明3组混合厌氧消化组中添加的市政污泥减轻了餐厨垃圾单独厌氧消化时有机酸累积对功能微生物的毒害作用,缩短了厌氧消化的时间。同时,市政污泥与餐厨垃圾混合厌氧消化系统营养配比更为均衡,餐厨垃圾中的易降解有机质促进了功能微生物的生长活性和市政污泥细胞的水解能力,从而提高了甲烷的转化效率[24]。赵云飞等[25]的研究指出:餐厨垃圾单独厌氧消化时易导致有机酸的积累,体系中产甲烷过程受到抑制,产气阶段滞后,在市政污泥中添加餐厨垃圾进行混合厌氧消化可缩短发酵时间,与本实验研究结果一致。

图1 不同质量原料配比下餐厨垃圾与市政污泥的厌氧消化的日产甲烷量Fig.1 Daily methane production of different mix ratio(FW and MS) during anaerobic digestion
不同原料配比的厌氧消化系统中累计产甲烷量见图2。由图2可知:在50 d的厌氧消化结束后,添加餐厨垃圾的实验组累计产甲烷量均远高于市政污泥单独厌氧消化组(0∶ 1),这表明餐厨垃圾有着较好的厌氧消化产甲烷潜力。添加餐厨垃圾的4个实验组(1∶ 0、1∶ 1、1∶ 2和2∶ 1)的单位质量的挥发性固体含量的产甲烷量分别为229.00、232.86、209.14和217.35 L/kg ,而市政污泥单独厌氧消化时的单位质量的挥发性固体含量的产甲烷量仅为119.89 L/kg,由此可见:添加餐厨垃圾厌氧消化比市政污泥单独厌氧消化时产甲烷效果更佳。而在添加餐厨垃圾的厌氧消化实验组中,实验组(1∶ 1)是添加餐厨垃圾实验组中累计产甲烷量最高的,而实验组(1∶ 0)和实验组(2∶ 1)虽然在累计产甲烷量上与实验组(1∶ 1)相接近,但是由于前期大量餐厨垃圾降解导致有机酸的积累,出现了酸化阶段,使功能微生物受到了抑制,从而出现了产气滞后现象。

图2 不同质量原料配比下餐厨垃圾与市政污泥的厌氧消化累计产甲烷量Fig.2 Cumulative methane production of different mix ratio (FW and MS) during anaerobic digestion
综上所述,实验组(1∶ 1)较(1∶ 0)、(0∶ 1)、(1∶ 2)和(2∶ 1)共4个实验组产甲烷量分别提高了1.68%、94.23%、11.34%和7.14%,且实验组(1∶ 1)无产气滞后现象发生,所以当餐厨垃圾与市政污泥混合比为1∶ 1时,累计产甲烷量不仅比市政污泥单独厌氧消化时高,同样也高于其他添加餐厨垃圾厌氧消化实验组,同时实验组(1∶ 1)没有出现餐厨垃圾单独消化过程中的产气滞后现象。因此,建议工程应用中选择餐厨垃圾与市政污泥的挥发性固体的质量比为1∶ 1。
2.2 不同原料配比混合厌氧消化系统产气中甲烷浓度的变化
图3为不同原料配比对厌氧消化系统日产气中甲烷浓度的影响。由图3可知:在厌氧消化体系中甲烷浓度水平随着餐厨垃圾在体系中占比越高,维持越久。市政污泥单独厌氧消化组(0∶ 1)在第13天达到峰值,为62.17%,而添加餐厨垃圾厌氧消化组(1∶ 0、1∶ 1、1∶ 2和2∶ 1)中甲烷浓度峰值均高于市政污泥单独厌氧消化组,分别在第34天(71.92%),第13天(73.52%),第13天(73.74%)和第19天(74.91%)达到峰值,而且添加餐厨垃圾厌氧消化组中甲烷浓度在一段时间内均维持在较高且稳定的水平。所有厌氧消化组随着厌氧消化时间的延长,沼气中甲烷浓度逐渐降低。实验组(0∶ 1)在第16天呈现出小幅的下降趋势,推测其原因可能是实验组(0∶ 1)的氨氮浓度在16 d前呈现持续上升的趋势,在16 d时达到了峰值,从而产生了对产甲烷菌活性轻微的抑制作用;实验组(2∶ 1)在第23天、第29天达到了峰值之后出现了下降趋势,推测其原因可能是第22天、第28天时体系的pH值分别达到了8.05和8.06(图4),过高的pH抑制了产甲烷菌的活性,从而导致了体系中的甲烷浓度在该时间段内下降幅度较大,与Zhou等[26]研究结果一致。
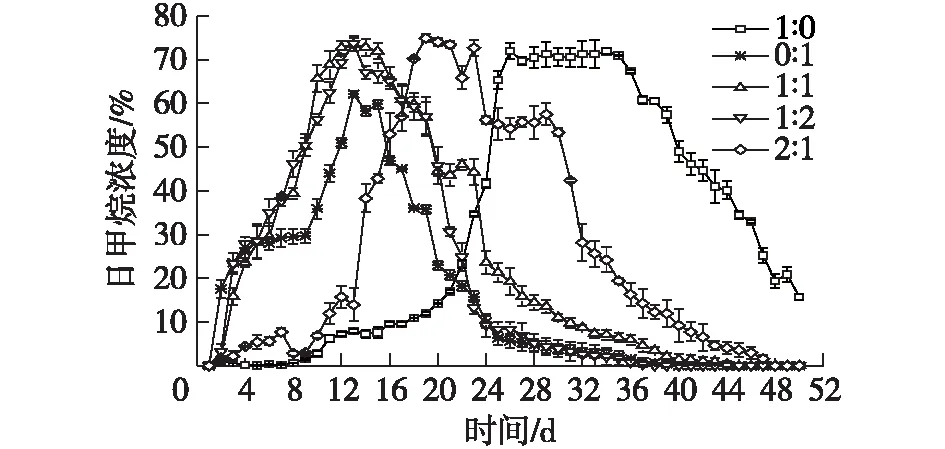
图3 不同质量原料配比下餐厨垃圾与市政污泥的厌氧消化产气中甲烷浓度的变化Fig.3 Methane content of different mix ratio (FW and MS)during anaerobic digestion

图4 不同质量原料配比下餐厨垃圾与市政污泥的厌氧消化过程中pH的变化Fig.4 pH of different mix ratio (FW and MS) during anaerobic digestion
2.3 不同原料配比混合厌氧消化pH、有机酸和氨氮浓度的变化
厌氧消化过程中的pH变化见图4。如图4所示:在厌氧消化初期时,pH处于较低状态,特别是餐厨垃圾单独厌氧消化组(1∶ 0)在第13天出现了1个小幅度的降低。而其他体系随着有机酸的利用与消耗,在第4天以后pH开始回升,最终含有餐厨垃圾体系消化液的pH均维持在7.50~8.00,而市政污泥单独厌氧消化组的pH则维持在7.50左右。不同比例厌氧消化过程中有机酸浓度的变化均见图5。由图5可以看出:在整个厌氧消化周期中,餐厨垃圾单独厌氧消化组(1∶ 0)的乙酸浓度峰值出现在第4天,随后出现逐渐下降的趋势,从第10天开始,出现了一个小幅上升的趋势,随后逐渐下降。而其他体系的乙酸浓度在整个厌氧消化周期中均呈现出先升后降的趋势;在整个厌氧消化周期中,餐厨垃圾单独厌氧消化组(1∶ 0)的丙酸浓度同样出现了2个峰值,分别在第4天与第13天。而在其他体系中丙酸的浓度均呈现先升后降的趋势。所有体系的有机酸浓度在厌氧消化周期的末期均降至0 mg/L。

图5 原料不同质量配比下餐厨垃圾与市政污泥的厌氧消化有机酸浓度的变化Fig.5 Variation of volatile fatty acids during anaerobic digestionin different mix ratio (FW and MS) system
综合分析厌氧消化过程中产甲烷变化(图1)、pH的变化(图4)以及有机酸浓度的变化(图5)可以看出:餐厨垃圾单独厌氧消化组(1∶ 0),在厌氧消化初期产生了非常严重的酸积累,导致厌氧消化系统产气启动滞后,并且餐厨垃圾单独厌氧消化组(1∶ 0)的pH初期也呈现出明显下降趋势;而在实验组(2∶ 1)中,厌氧消化系统前期也经历了一个有机酸累积的过程,导致厌氧消化体系启动滞后,但是体系中加入的市政污泥有效地缓解了酸化阶段,因此相对于餐厨垃圾单独厌氧消化组的启动时间有所提前。上述2组都表明在厌氧消化初期底物快速水解成有机酸,而厌氧消化水解阶段由于体系中甲烷菌的数量不足,水解酸化所产生的酸物质和甲烷菌数量未达到平衡,与王阳等[27]的研究结果一致。因此,在这个阶段维持体系中快速分解有机物,又不引起酸化是非常重要的;而从另外3个实验组中(0∶ 1、1∶ 1和1∶ 2)中可以看出:在第1到第4 天是产气的启动阶段,该阶段产气量与甲烷浓度均不高,且有机酸的浓度快速提升,在第4天达到峰值,同时pH在前4天也呈现较低的状态,但从第5天开始3个实验组的产气量逐渐上升,同时产生的乙酸在第4天出现下降的趋势。这表明乙酸正在逐渐被产甲烷菌有效的利用,而当消化液中的乙酸降解到一定程度时,微生物开始利用丙酸,丙酸逐渐下降,通过体系中的微生物将丙酸转化为产甲烷菌,可利用的乙酸和H2/CO2[28],同时3组中的pH也逐渐回升,并趋于稳定(7.50~8.00)。因此在餐厨垃圾厌氧消化体系中,添加具有一定缓冲能力的市政污泥可有助于缓解餐厨垃圾厌氧消化时易水解导致的有机酸的积累以及pH急剧下降的情况,也有利于产甲烷菌的生长和系统运行状态的稳定[29-30]。
氨氮是微生物生长所需要的重要营养物质,主要由含氮有机物(如蛋白质或氨基酸)分解产生,在厌氧消化系统主要以NH4+形式存在。氨氮浓度过高对厌氧消化产甲烷微生物具有毒害作用,如Lay等[31]研究发现:NH4+浓度在1 670~3 720 mg/L时,产甲烷菌活性会降低10%;在4 090~5 550 mg/L时,产甲烷菌活性降低50%;当提高到5 880~6 600 mg/L时,产甲烷菌完全失去活性。图6为不同原料配比下NH4+的变化情况,从图6可以看出:在不同的厌氧消化体系下,NH4+在整个厌氧消化阶段中呈现缓慢上升并趋于稳定的状态,由于市政污泥中氮含量较高,所以在添加有市政污泥的实验组中(0∶ 1、1∶ 1、1∶ 2和2∶ 1)氨氮最终浓度分别为1 429、1 545、1 673和1 571 mg/L;而餐厨垃圾中碳含量较高,氨氮浓度较低,所以餐厨垃圾单独厌氧消化实验组(1∶ 0)的最终氨氮质量浓度为919 mg/L。因此,本研究中所有厌氧消化系统中的NH4+都处于合理的范围内,不同配比均未出现严重的氨抑制现象。

图6 原料不同质量配比下餐厨垃圾与市政污泥的厌氧消化氨氮浓度的变化Fig.6 NH4-N+ of different mix ratio (FW and MS) during anaerobic digestion
2.4 原料不同质量配比混合厌氧消化系统中SCOD和有机物的去除率
厌氧消化的主要目的之一是生化降解有机物,使得其处理基质达到稳定状态,同时产生清洁的沼气。表2和3给出了底物不同配比混合厌氧消化TS、VS和SCOD的去除率。

表2 不同质量原料配比下餐厨垃圾与市政污泥中厌氧消化进出料的溶解性化学需氧量

表3 不同质量原料配比下餐厨垃圾与市政污泥中的厌氧消化进出料参数
从表2可以看出:添加餐厨垃圾的实验组SCOD去除率均远高于市政污泥单独厌氧消化组(0∶ 1)。因为市政污泥中有机质大都为难降解物质,所以SCOD的去除率不高。在添加餐厨垃圾的实验组中,实验组(1∶ 1)的SCOD去除率最高为77.77%。由表3可知:在市政污泥单独厌氧消化空白对照组中TS和VS的去除率均低于添加餐厨垃圾的实验组,餐厨垃圾单独厌氧消化空白对照在TS和VS的去除率是最佳的,但是鉴于其容易酸化导致体系崩溃,单独厌氧消化是不可取的。所以综合各种因素,餐厨垃圾与市政污泥以1∶ 1的配料比混合厌氧消化时TS与VS的去除率效果较为理想。
2.5 原料不同质量配比厌氧消化系统中微生物菌落Alpha的多样性指数
表4为原料不同质量配比在产气高峰时期厌氧消化系统中微生物菌群的Alpha多样性指数(Alpha多样性是指一个特定区域或者生态系统内的多样性)分析。

表4 原料不同质量配比下餐厨垃圾与市政污泥样品丰度及多样性的指数
注:Ace指数用来估计群落中含有OTU数目的指数(OTU全称operational taxonomic unit,指在数量分类学方面作为对象的分类单位的总称);Chao 指数用Chao算法估计群落中含OTU 数目的指数;香农指数用来估算样品中微生物的多样性指数之一。
从表4可以看出:添加市政污泥的厌氧消化系统中微生物的丰度与多样性比餐厨垃圾单独厌氧消化时要高。结合不同比例启动时间及产甲烷的特性分析可知,餐厨垃圾与市政污泥混合厌氧消化系统中能为微生物的生长提供更适宜的环境,增加微生物的多样性,优化厌氧微生物的群落结构,进而加快有机质分解和提高甲烷产量[32]。而当餐厨垃圾单独消化时,系统内可能存在有机酸以及其他有毒有害物质的积累使得某些敏感微生物生长受到抑制甚至死亡,从而导致微生物群落丰度与多样性的降低。
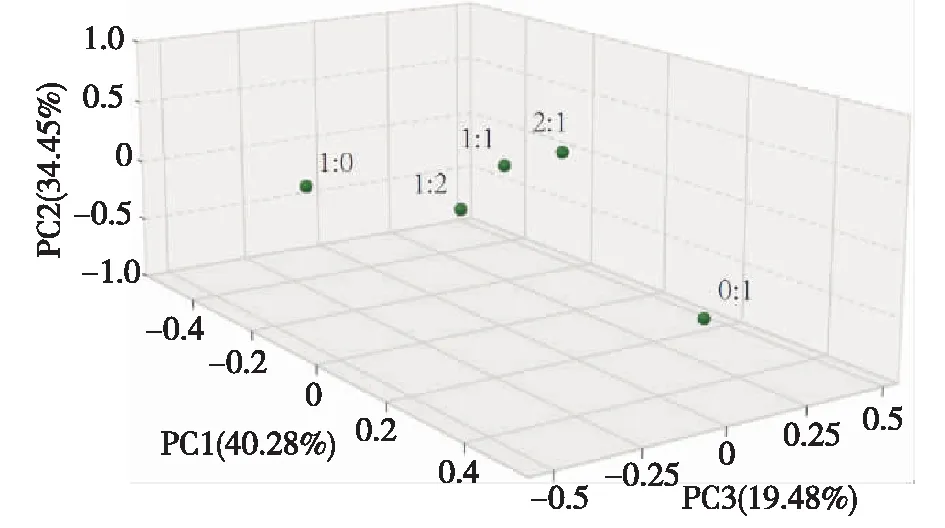
通过主坐标分析法(principal co-ordinates analysis,PCoA)分析产气高峰时期微生物群落的组成与结构,结果见图7。从图7可以看出:不同比例混合厌氧消化样品因为消化底物的不同,而被分成了3个明显不同的组别,其中3个餐厨垃圾和市政污泥混合厌氧消化实验组被聚类到了一起,单独厌氧消化的2个实验组分别在另外2个丛(cluster),说明消化底物对塑造系统微生物群落组成起到了重要作用。
注:主坐标分析(PCoA);主坐标1(PC1);主坐标2(PC2);主坐标3(PC3)图7 原料不同质量配比下餐厨垃圾与市政污泥主坐标分析的微生物差异性Fig.7 The principal co-ordinates analysis (PCoA) score plot based on weighted Unifrac metrics in different mix ratio (FW and MS) system (principal co-ordinates,PC)
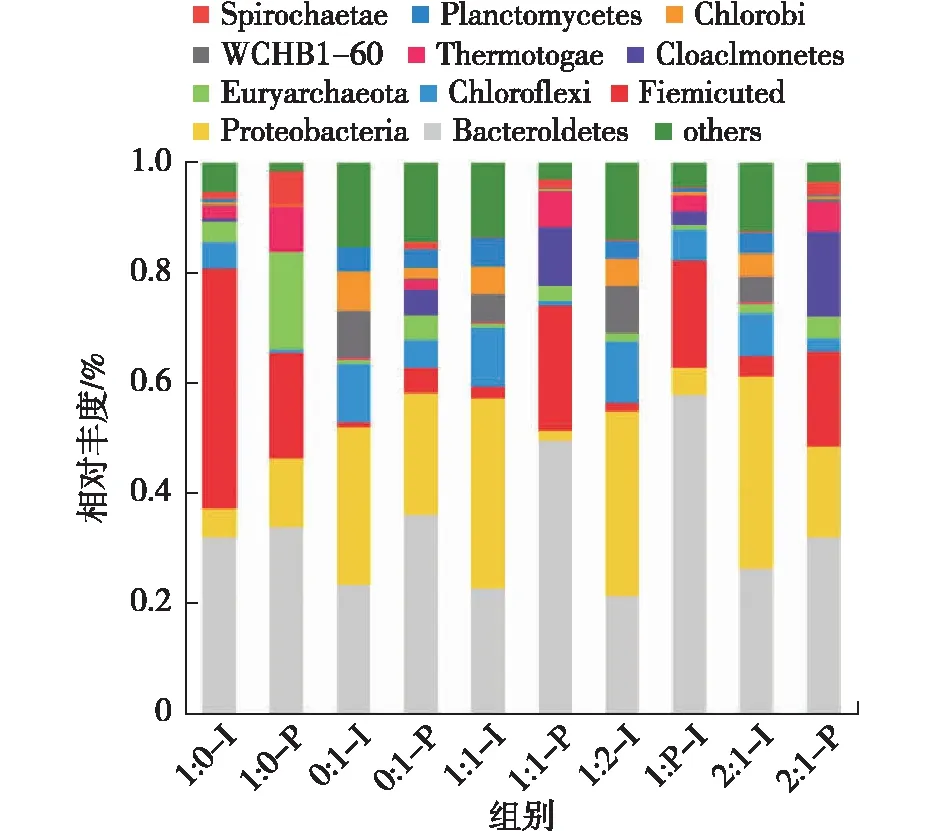
图8 原料不同质量配比下厌氧消化系统中微生物群落在细菌门水平上的相对丰度Fig.8 Relative abundance of phylum at the bacterial level in different ratio during anaerobic digestion
微生物群落动态变化的结果分别从门、纲、目、科和属这5个水平来分析,其中主要分析了整个周期中所有体系的产气初期与产气高峰的微生物所属的门和属水平[33-35]。图8为不同比例菌群门水平上的优势门类柱状图(初始阶段为I,产气高峰阶段为P);相对丰度(relative abundance,即群落内物种数目的多少)大于5%,由图8可知:所有体系中主要的菌群分别为Firmicutes、Bacteroidetes、Euryarchaeota、Proteobacteria、Chlorobi、Chloroflexi和Spirochaetes。其中:Bacteroidetes、Firmicutes和Proteobacteria是相对丰度最高的3个从属于细菌的门。不同处理厌氧消化初期到产气高峰期厌氧消化系统中Bacteroidetes的相对丰度含量呈现出上升趋势,并逐渐占据主导地位,推测其对于稳定高效的厌氧消化过程能起到重要作用。有Chen等[36]报道称:Bacteroidetes能将多种多糖降解为有机酸,实验组(1∶ 1-I、1∶ 1-P)的Bacteroidetes从初期的相对丰度为22.88%增长到了高峰的49.76%,比例提高了26.88%,提高幅度在所有比例中处于优势地位;同时在添加有市政污泥厌氧消化系统中相对丰度含量较高的Firmicutes,在厌氧消化过程中呈现出逐渐上升的趋势,该门类已被证明是一类重要的发酵细菌,它能产生胞外酶来水解有机质[37],实验组(1∶ 1-I、1∶ 1-P)的Firmicutes高峰相对丰度较初期提高了10倍;而在餐厨垃圾单独厌氧消化系统中,Firmicutes呈现与Bacteroidetes相反的趋势,所以这2个门的细菌在餐厨垃圾单独厌氧消化体系中可能在降解多糖的过程中存在竞争关系。另一种占比很高的Proteobacteria是在污泥中比较常见的门类菌群,在添加有市政污泥厌氧消化体系中,Proteobacteria都呈现出下降的趋势,其中实验组(1∶ 1)的Proteobacteria相对丰度从初期34.40%降至高峰阶段的1.78%,在所有不同比例中下降幅度是最高的,可能是由于初期挥发性脂肪酸(volatile fatty acid,VFA)的积累导致Proteobacteria中某些菌种被抑制甚至死亡。丰度稳定的优势细菌属使厌氧消化过程中水解、酸化及产酸效率更高,为下一步高效产甲烷提供基础。在所有不同比例厌氧消化体系初期到产气高峰阶段,Euryarchaeota的相对丰度呈现出持续上升的趋势。

图9 原料不同质量配比下厌氧消化系统中微生物群落在古菌属水平上的相对丰度Fig.9 Relative abundance of genus at the archaeal level in different ratio during anaerobic digestion
不同比例厌氧消化系统中古菌的群落结构组成见图9,其中产甲烷菌都从属于古菌[38]。从图9可以看出:添加有餐厨垃圾的厌氧消化实验组中,Methanosarcina和Methanobacterium从产气初期到产气高峰都呈现出增长的趋势。同时在添加有餐厨垃圾的厌氧消化实验组中,Methanosarcina和Methanobacterium的高峰时期的相对丰度均在各自的厌氧消化体系中占据主导地位。Methanosarcina是实验组(1∶ 0-I、1∶ 0-P、1∶ 1-I、1∶ 1-P、2∶ 1-I和2∶ 1-P)中丰度最高的产甲烷菌,也是最重要的产甲烷菌,从厌氧消化初期到产气高峰阶段,Methanosarcina呈现出上升的趋势,并占据主导地位。Methanosarcina在实验组(1∶ 0-I、1∶ 0-P、1∶ 1-I、1∶ 1-P、2∶ 1-I和2∶ 1-P)中相对丰度分别从产气初期的5.51%达到产气高峰的55.75%、1.71%达到55.22%及从1.38%达到57.86%。Methanosarcina是混合型的产甲烷菌,可以利用多种产甲烷途径包括乙酸型产甲烷途径、氢型产甲烷途径和甲基型产甲烷途径[39],而这3个实验组也是累计产甲烷量在所有体系中处于优势的实验组,从而证明了丰度优势在一定方面能够反应产甲烷量情况。而Methanobacterium是所有比例厌氧消化体系中次重要的产甲烷菌,Methanobacterium是产甲烷菌中种类最多的属,大部分只能利用H2产生甲烷,为氢营养型产甲烷菌[40]。而在市政污泥单独厌氧消化实验组(0∶ 1-I;0∶ 1-P)中,Methanosarcina和Methanobacterium相对丰度并没有大幅提高,但是体系中WCHA1-57的相对丰度从初期的15.31%提升到了高峰的56.59%。Saito等[41]通过对4种厌氧颗粒污泥进行了mcrA基因(产甲烷古菌的功能分子标记)的克隆分析,发现WCHA1-57代表一个新的产甲烷古菌群,有助于在厌氧消化中产甲烷。所有不同原料配比厌氧消化系统中,优势产甲烷菌相对丰度高且在厌氧消化过程中呈现出上升趋势,因此使得产甲烷效率相对较高。
3 结论
研究了餐厨垃圾与市政污泥在不同挥发性固体含量配比下的厌氧消化特性,与市政污泥单独厌氧消化相比,添加餐厨垃圾混合厌氧消化能大幅提高甲烷产量,且所有混合消化组中消化液各指标均维持在较适范围内。当餐厨垃圾与市政污泥的挥发性固体的质量比为1∶ 1时效果最优,单位质量的挥发性固体含量的产甲烷量最高为232.86 L/kg,且VS去除率达到46.09%。最佳配比下的餐厨垃圾与市政污泥混合厌氧消化给系统提供了更强大的缓冲能力,在整个厌氧消化周期中启动时间相比其他4种比例的体系都提前了;同时该比例下厌氧消化系统运行稳定性最好。通过高通量测序技术对厌氧消化系统中的微生物分析发现:餐厨垃圾与市政污泥混合厌氧消化系统中的微生物Alpha多样性指数比餐厨垃圾及市政污泥单独厌氧消化体系更佳,证明添加市政污泥共消化能明显提高系统内微生物的多样性,进而提高厌氧消化系统的稳定性。另外,餐厨垃圾与市政污泥混合厌氧消化系统内优势微生物主要为Bacteroidetes和Methanosarcina等,推测它们可能对于稳定高效的厌氧消化过程起到了重要的作用。
混合厌氧消化有助于促进底物的营养平衡,同时能够稀释底物中的有毒物质浓度,加快系统产气启动时间,提高系统产甲烷量。本文深入地探讨餐厨垃圾与市政污泥的不同配料比对混合厌氧消化性能及微生物多样性的影响。下阶段还须从微生物的环境功能方面着手,以揭示环境因子与微生物间复杂的关联作用,从而进一步对产甲烷的古细菌的变化进行深入研究。
参考文献:
[1] GROSSER A,NECZAJ E,SINGH B R,et al.Anaerobic digestion of sewage sludge with grease trap sludge and municipal solid waste as co-substrates[J].Environ Res,2017,155:249-260.
[2] ZHANG J,LV C,TONG J,et al.Optimization and microbial community analysis of anaerobic co-digestion of food waste and sewage sludge based on microwave pretreatment[J].Bioresour Technol,2016,200(2):253-261.
[3] IACOVIDOU E,OHANDJA D,GRONOW J,et al.The household use of food waste disposal units as a waste management option:a review[J].Crit Rev Environ Sci Technol,2012,42(14):1485-1508.
[4] NI B J,YU H Q.Growth and storage processes in aerobic granules grown on soybean wastewater[J].Biotechnol Bioeng,2008,100(4):664-672.
[5] NI B J,YU H Q.Storage and growth of denitrifiers in aerobic granules:part I.model development[J].Biotechnol Bioeng,2008,99(2):314-323.
[6] SHEHU M S,MANAN Z A,SHARIFAHRAFIDAH W A.Optimization of thermo-alkaline disintegration of sewage sludge for enhanced biogas yield[J].Bioresour Technol,2012,114:69-74.
[7] DONG B,LIU X,DAI L,et al.Changes of heavy metal speciation during high-solid anaerobic digestion of sewage sludge[J].Bioresour Technol,2013,131(3):152-158.
[8] YANG G,ZHANG G,WANG H.Current state of sludge production,management,treatment and disposal in China[J].Water Res,2015,78:60-73.
[9] DAVIDSSON A,BERNSTAD S A,MAGNUSSON N,et al.Technical evaluation of a tank-connected food waste disposer system for biogas production and nutrient recovery[J].Waste Manag,2017,65:153-158.
[10] KONG X,WEI Y,XU S,et al.Inhibiting excessive acidification using zero-valent iron in anaerobic digestion of food waste at high organic load rates[J].Bioresour Technol,2016,211:65-71.
[11] TYAGI V K,LO S L.Application of physico-chemical pretreatment methods to enhance the sludge disintegration and subsequent anaerobic digestion:an up to date review[J].Rev Environ Sci Bio/Technol,2011,10(3):215-242.
[12] D′ABZAC P,BORDAS F,VAN H E,et al.Extraction of extracellular polymeric substances (EPS) from anaerobic granular sludges:comparison of chemical and physical extraction protocols[J].Appl Microbiol Biotechnol,2010,85(5):1589-1599.
[13] DAI X,DUAN N,DONG B,et al.High-solids anaerobic co-digestion of sewage sludge and food waste in comparison with mono digestions:stability and performance[J].Waste Manag,2013,33(2):308-316.
[14] 段妮娜,董滨,李江华,等.污泥和餐厨垃圾联合干法中温厌氧消化性能研究[J].环境科学,2013,34(1):321-327.
[15] 王永会,赵明星,阮文权.餐厨垃圾与剩余污泥混合消化产沼气协同效应[J].环境工程学报,2014,8(6):2536-2542.
[16] SREELA-OR C,PLANGKLANG P,IMAI T,et al.Co-digestion of food waste and sludge for hydrogen production by anaerobic mixed cultures:statistical key factors optimization[J].Int J Hydrogen Energy,2011,36(21):14227-14237.
[17] WIRTH R,KOVCS E,MARTI G,et al.Characterization of a biogas-producing microbial community by short-read next generation DNA sequencing[J].Biotechnol Biofuels,2012,5(1):41.
[19] LI J,YANG F,LIU Y,et al.Microbial community and biomass characteristics associated severe membrane fouling during start-up of a hybrid anoxic-oxic membrane bioreactor[J].Bioresour Technol,2012,103(1):43-47.
[20] 罗娟,田宜水,宋成军,等.玉米秸秆厌氧产氢工艺参数优化[J].农业工程学报,2015,31(2):235-240.
[21] 甘荣,葛明民,刘勇迪,等.活性炭在中高温条件下对玉米秸秆厌氧发酵的影响[J].环境科学,2017,38(6):2607-2616.
[22] GILCREAS F W.Standard methods for the examination of water and wastewater[J].Am J Public Health Nation′s Health,1961,56(3):387-388.
[23] YANG G,ZHANG P,ZHANG G,et al.Degradation properties of protein and carbohydrate during sludge anaerobic digestion[J].Bioresour Technol,2015,192:126-130.
[24] 李晓帅,张栋,戴翎翎,等.污泥与餐厨垃圾联合厌氧消化产甲烷研究进展[J].环境工程,2015,33(9):100-104.
[25] 赵云飞,刘晓玲,李十中,等.餐厨垃圾与污泥高固体联合厌氧产沼气的特性[J].农业工程学报,2011,27(10):255-260.
[26] ZHOU J,ZHANG R,LIU F,et al.Biogas production and microbial community shift through neutral pH control during the anaerobic digestion of pig manure[J].Bioresour Technol,2016,217:44-49.
[27] 王阳,林聪,侯雨,等.吸附型添加剂对玉米秸秆厌氧消化的影响[J].中国沼气,2011,29(6):3-6.
[28] STAMS A J M,PLUGGE C M.Electron transfer in syntrophic communities of anaerobic bacteria and archaea[J].Nature Rev Microbiol,2009,7(8):568-577.
[29] RASDI Z,ZAINON M N,NURUL S O.The preliminary anaerobic fermentation of food wastes using anaerobic sludge[J].Adv Environ Biol,2015,9(22):11-15.
[30] PRABHU M S,MUTNURI S.Anaerobic co-digestion of sewage sludge and food waste[J].Waste Manag Res,2016,34(4):307-315.
[31] LAY J J,LI Y Y,NOIKE T,et al.Analysis of environmental factors affecting methane production from high-solids organic waste[J].Water Sci Technol,1997,36(6/7):493-500.
[32] HUANG X F,MU T,SHEN C,et al.Effects of bio-surfactants combined with alkaline conditions on volatile fatty acid production and microbial community in the anaerobic fermentation of waste activated sludge[J].Int Biodeterior Biodegrad,2016,114:24-30.
[33] LIU Y,ZHU Y,JIA H,et al.Effects of different biofilm carriers on biogas production during anaerobic digestion of corn straw[J].Bioresour Technol,2017,244(1):445-451.
[34] LIN L,WAN C,LIU X,et al.Anaerobic digestion of swine manure under natural zeolite addition:VFA evolution,cation variation,and related microbial diversity[J].Appl Microbiol Biotechnol,2013,97 (24):10575-10583.
[35] 梅冰,彭绪亚,谢影.采用Biolog法分析餐厨垃圾厌氧消化微生物群落多样性[J].中国沼气,2016,34(1):14-18.
[36] CHEN S,CHENG H,WYCKOFF K N,et al.Linkages of firmicutes and bacteroidetes populations to methanogenic process performance[J].J Ind Microbiol Biotechnol,2016,43(6):771-781.
[37] LIM J W,CHIAM J A,WANG J Y.Microbial community structure reveals how microaeration improves fermentation during anaerobic co-digestion of brown water and food waste[J].Bioresour Technol,2014,171:132-138.
[38] PAUL K,NONOH J O,MIKULSKI L,et al."Methanoplasmatales," thermoplasmatales-related archaea in termite guts and other environments,are the seventh order of methanogens[J].Appl Environ Microbiol,2012,78(23):8245-8253.
[39] DE V J,HENNEBEL T,BOON N,et al.Methanosarcina:the rediscovered methanogen for heavy duty biomethanation[J].Bioresour Technol,2012,112(5):1-9.
[40] TEJERIZO G T,KIM Y S,MAUS I,et al.Genome sequence ofMethanobacteriumcongolensestrain Buetzberg,a hydrogenotrophic,methanogenic archaeon,isolated from a mesophilic industrial-scale biogas plant utilizing bio-waste[J].J Biotechnol,2017,247:1-5.
[41] SAITO Y,AOKI M,HATAMOTO M,et al.Presence of a novel methanogenic archaeal lineage in anaerobic digesters inferred frommcrAand 16S rRNA gene phylogenetic analyses[J].J Water Environ Technol,2015,13(3):279-289.
