Desulfovibrio desulfuricans G20生理特性及处理含铬(Ⅵ)硫酸盐废水的研究
2018-06-12张雪英沈蔚然
李 想,张雪英,王 婷,沈蔚然,姜 添,周 俊
(1.南京工业大学 环境学院,江苏 南京 211800; 2.南京工业大学 生物与制药工程学院,江苏 南京 211800)
硫酸盐还原菌(sulfate reducing bacteria,SRB)是一类以有机物为电子供体,以硫酸盐、亚硫酸盐和硫代硫酸盐等以及元素硫为电子受体,通过异化作用将其还原为硫化物的细菌[1]。SRB广泛存在于自然界,在海水、土壤、生活生产、工业废水、海水及河水底泥中均有分布,由于SRB普遍存在于厌氧环境中,它们在硫和碳循环中起重要作用。但是,SRB会对海洋石油等工业造成严重影响,因为代谢过程中产生硫化物,具有高度反应性、腐蚀性和毒性。由此可见,SRB可以去除废水中的硫酸盐及重金属,在一定程度上可以修复环境。尽管对于SRB的研究已经超过一个世纪,但是随着分子生物学和基因组技术的不断进步,对SRB的生活方式的详细解析成为可能[2]。SRB的代谢过程可以简单地分为分解阶段、电子传递阶段和氧化阶段这3个阶段[3]。图1表明描述这一过程的分解代谢、电子传递和SRB的关系。
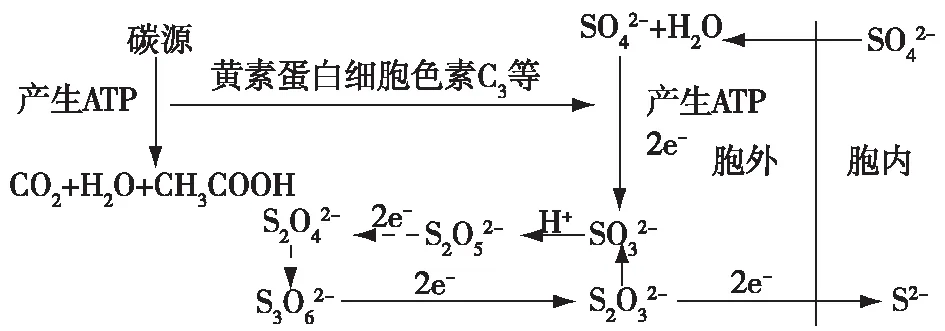
图1 SRB 的分解代谢过程Fig.1 Metabolic degrading process of SRB

笔者前期通过从南京某污水处理厂浓缩污泥中驯化混合硫酸盐还原菌,探究其对硫酸盐废水的处理效果[11],在本文中,完全模拟此污水处理厂废水性质,选取一株纯种硫酸盐还原菌D.desulfuricansG20为研究对象,考察其在不同条件下的生长状况,再研究它对Cr6+的耐受浓度及处理含铬(Ⅵ)硫酸盐废水的效果,为将来D.desulfuricansG20的工业应用建立基础。
1 材料与方法
1.1 材料
1.1.1 菌株
D.desulfuricansG20菌株由中国科学院成都生物研究所提供。
1.1.2 培养基
D.desulfuricansG20采用培养基为Postgate C[12],其成分为KH2PO40.5 g/L、NH4Cl 1.0 g/L、CaCl2·2H2O 0.06 g/L、Na2SO40.5 g/L、MgSO4·7H2O 2.0 g/L、酵母膏1.0 g/L、柠檬酸钠0.3 g/L、60%乳酸钠6 mL/L。
还原剂:配制0.25 g/L L-半胱氨酸溶液,用N2吹5 min,加盖密封,灭菌,冷却。培养基中加入1%的上述半胱氨酸溶液(注:一般用100 mL厌氧瓶配制50 mL,4 ℃下保存)。
氧气指示剂:配制1%刃天青水溶液。
1.2 D.desulfuricans G20的富集培养
在洁净工作台中,用无菌注射器按照10%的接种量将D.desulfuricansG20注入上述制作好的培养基中,置于恒温培养箱中,在37 ℃、100 r/min的条件下进行恒温振荡培养。待菌液由澄清透明变为浑浊,即表明此富集的D.desulfuricansG20浓度较高。
1.3 D.desulfuricans G20的生长曲线
采用18 mm×150 mm的玻璃厌氧管,分装Postgate C培养基4.45 mL,加入0.05 mL 0.25 g/L L-半胱氨酸溶液,充入N2,密封,灭菌。在洁净工作台上接种0.5 mL的菌液,置于37 ℃、100 r/min的摇床中,振荡培养20 h。不定时用紫外-可见分光光度计以培养基为参比,测定菌体生长情况,通过OD600测量细菌培养液的浓度。每组做3个平行试验,试验结果取平均值。
1.4 菌株生理生化性质
1.4.1 温度对菌体生长的影响
设定22、27、32、37、42和47 ℃的温度梯度培养20 h,通过OD600测量细菌培养液的浓度。
1.4.2 pH对菌体生长的影响
设定pH为4.2、5.2、6.2、7.2、8.2、9.2和10.2的梯度,通过OD600测算细菌培养液的浓度。
1.4.3 碳源对菌体生长的影响
以甲酸、乙酸、甲醇、乙醇、丙三醇、蔗糖、葡萄糖、乳酸钠和乙酸钠为碳源培养D.desulfuricansG20,不定时通过 OD600测量细菌培养液的浓度。
1.4.4 硫源对菌体生长的影响
以硫、MgSO4、Na2SO4、亚硫酸钠、硫代硫酸钠为硫源培养D.desulfuricansG20,不定时通过 OD600测量细菌培养液的浓度。
1.5 D.desulfuricans G20对含Cr6+的硫酸盐废水的研究
1.5.1D.desulfuricansG20对Cr6+的耐受度
玻璃厌氧管分装Postgate C培养基后分别加入K2Cr2O7无菌溶液,使之与培养基混合后的Cr6+质量浓度分别为25、50、75、100、125、150、175和200 mg/L。每隔12 h观察菌体生长状况,观察持续3 d。同时,每隔4 h测定试验中菌液生长OD600值,持续测定24 h。
1.5.2D.desulfuricansG20处理不同浓度含Cr6+废水的效果

2 结果与讨论
2.1 D.desulfuricans G20的生长曲线
通过对D.desulfuricansG20进行40 h的监测,不定期测量其OD600,绘制该菌生长曲线,结果见图2。由图2可以看出,D.desulfuricansG20菌株在前2 h处于生长延滞期,2~18 h 菌株进入对数生长期,18~26.5 h 进入稳定期,期间菌密度 OD600达到最大值(0.697),26.5 h后开始进入衰亡期。为保证菌株活跃度及均量一致,一般接种18~26.5 h的菌株进行试验。

图2 D.desulfuricans G20在postgate C培养基中的生长曲线Fig.2 Growth curves of D.desulfuricans G20 in postgate C medium
2.2 菌株生理生化性质
2.2.1 温度对D.desulfuricansG20生长的影响
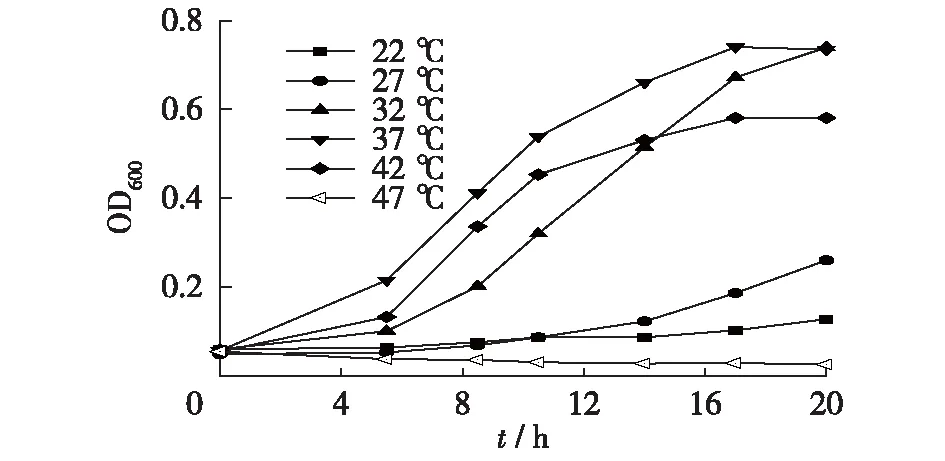
图3 不同温度下D.desulfuricans G20生长量Fig.3 Biomass of D.desulfuricans G20 at different temperatures
温度的变化会影响微生物的生长、代谢和繁殖。适宜的温度能刺激微生物的生长;当温度过高时,微生物的蛋白质和核酸会变性失活;当温度过低时,会抑制酶活性,减弱细胞新陈代谢[13]。设置温度梯度为22、27、32、37、42和47 ℃,考察温度对D.desulfuricansG20的生长的影响,结果见图3。由图3可以看出,D.desulfuricansG20菌株在不同的温度条件下,生长状况不同。在32~42 ℃时,D.desulfuricansG20均生长良好,最佳生长温度为37 ℃,培养17 h时生长量达到最高OD600(0.741)。在14 h内,42 ℃下菌株生长速度高于32 ℃,之后32 ℃下菌株生长速度高于42 ℃的菌株生长速度,其在20 h时分别达到最高OD600,32 ℃为0.740,42 ℃为0.581。22、27 ℃时可生长,但生长缓慢。47 ℃时菌株基本不生长。废水研究的纯种菌体系中,硫酸盐还原菌的最佳生长温度大多在30 ℃左右,但混合菌群体系的实际应用中,硫酸盐还原菌的生长速度还取决于菌群中的竞争因素[14]。
2.2.2 初始pH对D.desulfuricansG20生长的影响
设置不同初始pH分别为4.2、5.2、6.2、7.2、8.2、9.2和10.2,考察其对D.desulfuricansG20生长的影响,如图4所示。由图4可以看出,在初始pH为6.2~9.2时,菌株生长状况良好。硫酸盐还原菌可容忍的pH最大范围在4.0~9.5[15]。当pH超出菌株忍受浓度,会通过降低SRB酶活性抑制菌株生长和代谢[16]。菌株在初始pH值为8.2时,生长速度最快,10 h进入稳定期,最高OD600值达到0.661。随着初始pH的升高,菌株生长速度呈现下降趋势。在初始pH为7.2和9.2时,菌株的生长量及生长速度差不多。当初始pH达到10.2时,菌株生长速度明显减慢,20 h时达到最高OD600,为0.333。初始pH为6.2时,生长速度比初始pH为7.2时稍慢,到20 h时进入稳定期,并达到最高OD600,为0.627。但是在初始pH下降到5.2及以下时,菌株基本不生长。因此,可认为D.desulfuricansG20生长的最佳初始pH为8.2。当初始pH偏酸性时,体系中较多的游离硫化氢含量会对D.desulfuricansG20生长产生抑制作用;当pH偏碱性时,体系中主要是以HS-状态存在的硫化物,这些硫化物会和菌体细胞中的铁物质结合,从而使得电子传递失活[17]。因此,初始pH通过影响游离H2S在体系中的比重影响菌株的生长活性。
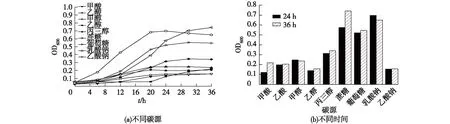
图5 D.desulfuricans G20利用不同碳源在不同时间的生长量Fig.5 Biomass of D.desulfuricans G20 at different carbon source and time
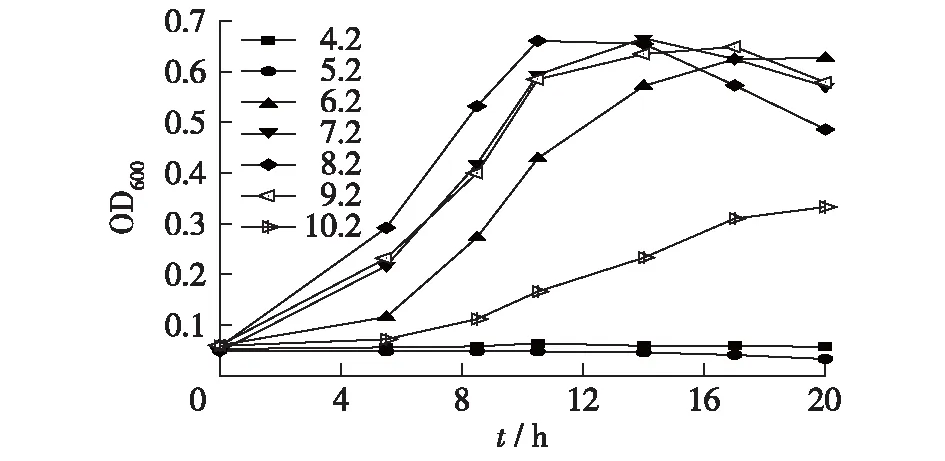
图4 不同初始pH下D.desulfuricans G20的生长量Fig.4 Biomass of D.desulfuricans G20 at different pH
2.2.3D.desulfuricansG20对不同碳源的利用
目前,有动物粪便、木屑、肥料和一些其他农林废弃物等天然有机物和合成有机物如乙酸、丙酸、丁酸以及乳酸钠等,可作为碳源以供硫酸盐还原菌生长繁殖[18]。在富集培养基中,丰富且适宜的碳源可以给菌体提供氮源、维生素、氨基酸等营养物质,促进菌体生长。本文中,笔者选取甲酸、乙酸、甲醇、乙醇、丙三醇、蔗糖、葡萄糖、乳酸钠和乙酸钠作为碳源,考察D.desulfuricansG20对其的利用情况。图5为D.desulfuricansG20对不同碳源的利用及其24、36 h的生长量。由图5可以看出,D.desulfuricansG20对不同碳源的利用情况不同。当碳源为乳酸钠、蔗糖和乳糖时,菌株生长较快,菌液密度较高,其中,碳源为乳酸钠时菌株生长最快,其次是葡萄糖及蔗糖,利用蔗糖的菌株后期生长比葡萄糖快。在24 h时,利用乳酸钠的菌株OD600最高,达到0.698,其次是蔗糖和葡萄糖,分别为0.576和0.520。在36 h时,利用蔗糖的菌株的生长量OD600超过其他碳源,达到0.742。还可看出,D.desulfuricansG20均可利用以上碳源,利用甲酸、乙醇及乙酸钠较慢。由此可得出,D.desulfuricansG20的最佳生长碳源为乳酸钠及蔗糖。
2.2.4D.desulfuricansG20对不同硫源的利用
考察D.desulfuricansG20对硫、MgSO4、Na2SO4、亚硫酸钠和硫代硫酸钠等的利用情况,结果见图6。由图6可以看出:D.desulfuricansG20以亚硫酸钠为硫源时,菌株生长速度最快,10.5 h时菌株生长量达到最高(0.637)。而在硫酸镁、硫酸钠和硫代硫酸钠的培养基中,生长状况差不多。在以硫单质为硫源的培养基中,菌株不生长,说明D.desulfuricans不能利用硫单质作为碳源,此现象与马忠友等[19]研究结果相似。因此可见,D.desulfuricansG20最适硫源为亚硫酸钠。

图6 D.desulfuricans G20利用不同硫源在不同时间的生长量Fig.6 Biomass of D.desulfuricans G20 at different sulfur sources
2.3 D.desulfuricans G20对含Cr6+的硫酸盐废水的研究
2.3.1D.desulfuricansG20对Cr6+的耐受度的研究
硫酸盐还原菌对Cr6+有去除作用,但当Cr6+浓度过高会对硫酸盐还原菌产生毒害作用[20]。当过高浓度的Cr6+进入硫酸盐还原菌细胞体内,会与大分子结合导致蛋白质变性[21],从而对硫酸盐还原菌有较强的毒性[22]。因此,研究硫酸盐还原菌对Cr6+的耐受度对于研究硫酸盐还原菌处理含Cr6+的硫酸盐废水具有重要的意义。笔者研究D.desulfuricansG20在含Cr6+体系中为期3 d的生长状况,结果见表1。由表1可知,D.desulfuricansG20能在Cr6+质量浓度低于150 mg/L的条件下生长。Cr6+对菌体的毒害作用会随着Cr6+浓度的增加而加剧,导致菌体生长代谢缓慢,影响硫酸盐还原菌对Cr6+的脱除[23]。



表1 D.desulfuricans G20在含Cr6+体系中的生长状况
注:+表示生长,-表示未生长。

图7 不同Cr6+浓度的条件下的含量的变化Fig.7 Variations of sulfate content at different Cr6+ content
2.3.3 在不同浓度的Cr6+体系中Cr6+的脱除效果
硫酸盐还原菌对Cr6+的去除有2种方式:吸附作用和生物转化[24]。吸附作用是SRB吸附富集Cr6+以降低环境中Cr6+的浓度[25],此过程一般较快,持续5~10 min。生物转化是SRB通过生长代谢将高毒性的Cr6+还原为低毒性的Cr3+[26],整个过程与菌株的生长周期和Cr6+的耐受度有关。近几年,已经发现有一些微生物通过这两种方式去除环境中Cr6+[25,27-30]。不同Cr6+浓度的条件下,各体系中Cr6+浓度随时间的变化结果见图8。由图8可知,反应刚开始时,体系中Cr6+的脱除率均达到80%以上,分别为92.87%、89.9%和83.56%。这是由于培养基及菌体对Cr6+具有吸附作用。随后,反应体系中Cr6+浓度降低可能是由于反应体系中的S2-与Cr6+的反应[31]。S2-还原Cr6+为Cr3+,而Cr3+又会与OH-发生反应生成Cr(OH)3沉淀,从而对Cr6+有一定的脱除率。从图8中还可看出,1 h后,在初始Cr6+质量浓度为50和90 mg/L的体系中,Cr6+基本被全部去除。而此时初始Cr6+质量浓度为120 mg/L的体系中,Cr6+的去除率为90.24%。随着反应的进行,Cr6+的浓度继续降低,到18.5 h时,体系中Cr6+去除率接近100%。这说明,D.desulfuricansG20对Cr6+有着良好的脱除效果。Laxman等[32]和Thacker等[33]都发现细菌对Cr6+的脱除能力会随着Cr6+初始浓度的升高而降低。

图8 不同Cr6+浓度的条件下Cr6+含量及脱除率的变化Fig.8 Variations of Cr6+ content and removal rate at different Cr6+ content
3 结论
D.desulfuricansG20菌株用10%的接菌量在37 ℃下培养前2 h处于生长延滞期,2~18 h 菌株进入对数生长期,18~26.5 h 进入稳定期,26.5 h后开始进入衰亡期。
D.desulfuricansG20菌株适宜的生长温度在32~42 ℃,最适宜温度为37 ℃;适宜初始pH为6.2~9.2,最佳初始pH为8.2,在初始pH为4.2及5.2时,菌株基本不生长;最佳生长碳源为乳酸钠和蔗糖。D.desulfuricansG20不能利用硫单质,最适硫源为亚硫酸钠。

参考文献:
[1] 吴庆庆,邱贤华,熊贞晟,等.硫酸盐还原菌处理含硫酸盐有机废水的原理及其应用[J].安全与环境工程,2015,22 (1):90-96.
[2] MUYZER G,STAMS AJ M.The ecology and biotechnology of sulphate-reducing bacteria[J].Nat Rev Microb,2008,6 (6):441-454.
[3] ANANDKUMAR B,GEORGE R P,MARUTHAMUTHUS,et al.Corrosion behavior of SRBDesulfobulbuspropionicusisolated from an Indian petroleum refinery on mild steel[J].Mater Corros,2012,63 (4):355-362.
[4] 张子栋.六价铬毒性作用及其影响因素[J].生物技术世界,2013(8):71.
[5] 闫旭,李亚峰.含铬废水的处理方法[J].辽宁化工,2010,39(2):143-146.
[6] 任军俊,肖利萍.硫酸盐还原菌处理废水的研究进展与展望[J].水资源与水工程学报,2009,20(2):52-56.
[7] 安文辉,马斯然,王磊峰.硫酸盐还原菌处理含铬废水的研究现状[J].广东化工,2012,17(39):97-98.
[8] 贺气志,陈辉,王丹,等.混合硫酸盐还原菌与Cu/Fe颗粒协同处理含铬废水的研究[J].环境科学,2011,32(7):2000-2005.
[9] 陈炜婷,张鸿郭,罗定贵,等.硫酸盐还原菌处理含重金属酸性废水的研究[J].安徽农业科学,2013,42(31):12422-12424.
[10] 李猛,张鸿郭,周子倩,等.固定化SRB处理低浓度含铬废水[J].环境工程,2016(4):20-24.
[11] 王婷,周俊,徐为中,等.生长因子对SRB处理硫酸盐废水的影响研究[J].工业水处理,2016,36(6):38-42.
[12] 任南琪,王爱杰,赵阳国.废水厌氧处理硫酸盐还原菌生态学[M].北京:科学出版社,2009.
[13] 胡永娟,李学梅,王海磊,等.抗铬菌株的筛选鉴定及其生物学特性和吸附特性[J].环境工程学报,2014,8(6):2585-2591.
[14] 梁宇.硫酸盐还原菌的生长因子的探讨[J].山西建筑,2010(30):199-200.
[15] 王辉,戴友芝,刘川,等.混合硫酸盐还原菌代谢过程的影响因素[J].环境工程学报,2012,6(6):1795-800.
[16] 陈炜婷,张鸿郭,陈永亨,等.pH、温度及初始铊浓度对硫酸盐还原菌脱铊的影响[J].环境工程学报,2014,10(8):4105-4109.
[17] 许雅玲,伍健东.pH值对硫酸盐还原菌颗粒污泥性能的影响[J].工业用水与废水,2010,4(1):32-35.

[19] 马忠友,邓盾,汪建飞,等.一组混合菌群还原硫酸盐的特性[J].中国农学通报,2013,29(8):184-188.
[20] 肖利萍,张镭,李月.硫酸盐还原菌及其在废水厌氧治理中的应用[J].水资源与水工程学报,2011,22(1):45-48.
[21] 郑家传,张建荣,刘希雯,等.污染场地六价铬的还原和微生物稳定化研究[J].环境科学,2014,35(10):3882-3887.
[22] 徐莲,孙纪全,吴晓磊,等.菌株Rhodococcussp.Chr-9和Exiguobacteriumsp.Chr-43的除铬(VI)特性[J].应用与环境生物学报,2012,18(6):971-977.
[23] 秦利玲,王天贵.用细菌解毒水溶液中六价铬的实验研究[J].化学工程师,2010(10):37-41.
[24] 王谦,李延,孙平,等.含铬废水处理技术及研究进展[J].环境科学与技术,2013,36(12):150-156.
[25] 张莹,章莹颖,唐杰,等.微小杆菌Exiguobacteriumsp.MH3对六价铬的还原特性[J].应用与环境生物学报,2014,20(5):791-797.
[26] KANMANI P,ARAVIND J,PRESTON D.Remediation of chromium contaminants using bacteria[J].Int J Environ Sci Technol,2011,9 (1):183-193.
[27] SARANGI A,KRISHNAN C.Comparison of in vitro Cr(VI) reduction by CFEs of chromate resistant bacteria isolated from chromate contaminated soil[J].Bioresour Technol,2008,99(10):4130-4137.
[28] FERRO OROZCO A M,CONTRERAS E M,ZARITZKY N E.Cr(VI) reduction capacity of activated sludge as affected by nitrogen and carbon sources,microbial acclimation and cell multiplication[J].J Hazard Mat,2010,176(1/2/3):657-665.
[29] ALAM M Z,MALIK A.Chromate resistance,transport and bioreduction byExiguobacteriumsp.ZM-2 isolated from agricultural soil irrigated with tannery effluent[J].J Basic Microbiol,2008,48(5):416-420.
[30] ALAM M Z,AHMAD S.Chromium removal through biosorption and bioaccumulation by bacteria from tannery effluents contaminated soil[J].CLEAN - Soil,Air,Water,2011,39(3):226-237.
[31] 李福德,李昕,谢翼飞,等.微生物去除重金属和砷:复合硫酸盐还原菌法的机理与技术[M].北京:化学工业出版社,2011.
[32] LAXMAN R S,MORE S.Reduction of hexavalent chromium byStreptomycesgriseus[J].Minerals Eng,2002,15(11):831-837.
[33] THACKER U,PARIKH R,SHOUCHE Y,et al.Reduction of chromate by cell-free extract ofBrucellasp. isolated from Cr (VI) contaminated sites[J].Bioresour Technol,2007,98(8):1541-1547.
