黑曲霉突变菌株产糖化酶的酶学特性表征
2018-11-27庄若
,,, ,庄若, ,,,*
(1.吉林农业大学食品科学与工程学院,吉林长春 130118 2.长春科技学院,吉林长春 130600)
黑曲霉(Aspergillusniger)[1]是一类重要的发酵菌种,最适生长条件一般为33 ℃、相对湿度88%,一般在各类的粮食作物、植物及其相关产品中分布较广[2-3],其重要性体现在黑曲霉所产生的酶类及酸类产物,可用于发酵工业及其相关产业[4]。糖化酶是黑曲霉在发酵过程中产生的一种重要酶,糖化酶也叫做葡萄糖淀粉酶[5],其系统命名法为淀粉α-1,4-葡萄聚糖水解酶[6],由甘露糖、葡萄糖胺、半乳糖等物质构成的糖蛋白[7],不仅是酸性糖苷酶且具备外切酶活性,水解产物为葡萄糖[8]。糖化酶的最佳酶活力条件一般在50~65 ℃,pH4.0~5.0之间[9]。糖化酶在食品、酿造、轻工纺织业等都有重要的用途[10]。糖化酶是将麦芽糖糊精水解生成D-葡萄糖,其最大反应速度呈线性变化,随反应物的碳链结构的不同而改变[11],可作为产淀粉的原料用于谷氨酸、柠檬酸的生产[12]。
各类糖化酶的结构和功能对淀粉水解程度有所不同[13],真菌是各类微生物中水解淀粉能力最强的[14]。目前报道的能够产糖化酶的菌株主要有[15]:台湾根霉、雪白根霉、黑曲霉、泡盛曲霉等共26个属38个种[16]。但目前大多酶制剂来源于被食品药品管理中心鉴定可安全使用的根霉和曲霉,在我国运用较广泛的是根霉、黑曲霉及其突变菌[17]。采用电子束辐照诱变黑曲霉菌株产糖化酶具有较强的安全性、成本低、仪器操作简便、可控性强等特点[18]。
本文以电子束诱变黑曲霉突变菌株为研究对象,通过最适pH、作用温度、热稳定性试验、酸碱稳定性试验和金属离子影响等方面的研究,探明黑曲霉低能电子束诱变突变菌株产糖化酶的酶学特性。
1 材料与方法
1.1 材料与仪器
黑曲霉原始菌株 编号CICC-40099,CICC工业微生物菌种保藏中心;黑曲霉突变菌株 编号为1712,食品微生物研究室保藏;磷酸、氢二钾、硫代硫酸钠、葡萄糖、可溶性淀粉 陇西化工股份有限公司;磷酸氢二钠、乙酸钠、3,5-二硝基水杨酸 北京化工厂;氯化钠、磷酸二氢钾 分析纯,天津市科密欧化学试剂有限公司;黑曲霉斜面保藏培养基:可溶性淀粉0.1 g、酵母粉0.3 g、KH2PO40.1 g、琼脂2 g、MgSO4·7H2O 0.05 g、豆汁100 mL;察氏液体培养基:NaNO33.0 g、K2HPO4·3H2O 1.0 g、MgSO40.5 g、KCl 0.5 g、FeSO40.01 g、蔗糖30 g、蒸馏水1000 mL;种子培养基[19]:葡萄糖16 g、胰蛋白胨5 g、KH2PO40.4 g、MgSO4·7H2O 0.04 g、蒸馏水200 mL;发酵培养基[20]:葡萄糖10 g、玉米淀粉20 g、豆粉6 g、玉米糖浆6 g、K2HPO40.2 g、蒸馏水200 mL。
FE20 pH计 梅特勒-托利多仪器(上海)有限公司;CY-1CG离心机 上海安亭科学仪器厂;752N紫外可见光分光度计 上海仪电分析仪器有限公司;HNY-2102C恒温培养震荡器 天津市欧诺仪器仪表有限公司;Fuhua78-1磁力加热搅拌器 金坛市富华仪器有限公司。
1.2 实验方法
1.2.1 菌体活化 用接种环从4 ℃冰箱保藏的一株黑曲霉斜面培养基中刮取一环菌落于0.9%质量分数生理盐水,使菌落分布均匀,以10%培养基体积分数接种至察氏液体培养基,每代于32 ℃、转速180 r/min条件下培养36 h并测定酶活,传代培养3~5代[21],选择活力最高者进行下步实验。
1.2.2 菌体发酵培养 将活化菌液转接至种子培养基中,在32 ℃、转速180 r/min培养72 h,再将上述菌液转接于发酵培养基。在250 mL的锥形瓶中,接种量为10%培养基体积分数、装液量为100 mL、32 ℃、转速180 r/min恒温培养震荡器中培养发酵7 d[22]。
1.2.3 粗酶液制备 发酵液进行离心处理,8000 r/min处理15 min,使菌体沉淀后得到上层澄清液,用4层滤纸进行过滤除去多余菌丝体,余留下棕色澄清粗酶液后测定其糖化酶活力。
1.2.4 粗酶液的分离纯化
1.2.4.1 (NH4)2SO4盐沉淀 将50 mL 1.2.3的粗酶液用80%(NH4)2SO4盐沉淀,4 ℃静置过夜后进行12000 r/min,15 min高速离心处理,保留沉淀并用10 mL的0.05 mol/L中性Tris-HCl 缓冲液溶解,并在同条件下进行12000 r/min,15 min离心处理,保留上清。
1.2.4.2 Sephadex-100层析 将1.2.4.1的清液注入凝胶色谱柱中,层析条件为上样体积:5 mL,洗脱液:0.05 mol/L中性Tris-HCl,洗脱流速:0.25 mL/min,各管收集5 mL,752N紫外可见光分光度计测定每管酶活及280 nm下的OD值,OD值(280 nm)与蛋白质浓度呈正相关,可表示蛋白含量。并以酶活(kU/mL)、OD值(280 nm)为纵坐标,以试管编号为横坐标,绘制洗脱曲线。
1.2.4.3 蛋白浓度测定及相对分子质量检测 以牛血清白蛋白作为标准,采用Bradford法测蛋白浓度,进一步结合SDS-PAGE电泳可测定相对分子量[23]。lgMr-m标准曲线回归方程为:y=-1.109x+5.2239,R2=0.9955。计算公式:lgMr=K-bm。式中:Mr-蛋白质相对分子质量,1;b、K-常数;m-相对迁移率,1。
1.2.5 糖化酶活力测定 酶活定义为在40 ℃、pH4.6条件下,1 h水解可溶性淀粉生成1 mg葡萄糖所需要的酶量,符号单位为U/mL[24]。测定方法采用DNS比色法[25],每组分别进行5组平行试验取均值。葡萄糖标准曲线回归方程为:y=0.6465x+0.001,R2=0.9997。计算公式:X=(A1/A0)×N×b。式中:X-糖化酶活力单位,U/mL;A1-样品OD值,1;A0-标曲OD值,1;N-稀释倍数;b-(酶活定义用时×所得酶液)/(反应用时×所用酶液),1。
1.2.6 突变菌株产糖化酶的酶学性质表征
1.2.6.1 糖化酶最适pH的确定 在40 ℃温度下,将5 mL原始菌株及突变菌株酶液分别置于pH为2、2.5~8条件下,与5 mL的2%可溶性淀粉反应10 min,测定酶活,确定最适pH区域,再对该区域进行pH梯度为0.1的最佳pH确定试验,测定酶活以确定糖化酶最适pH,每组进行5组平行试验取平均值。
1.2.6.2 糖化酶最适作用温度 在pH4.6,将5 mL原始菌株及突变菌株酶液分别置于温度为40、45~85 ℃的条件下,与5 mL的2%可溶性淀粉反应10 min,测定酶活,确定最适温度区域,再对该区域进行温度梯度为1 ℃的最适温度确定试验,测定酶活以确定糖化酶最适作用温度,每组进行5组平行试验取均值。
1.2.6.3 糖化酶热稳定性试验 取原始菌株及突变菌株酶液各100 mL,置于温度为50、55、60、65、70、75、80 ℃的恒温水浴锅中进行保温,每10 min取10 mL反应液于0 ℃冰浴中冷却,在40 ℃、pH4.6下测定糖化酶的酶活,每组进行5组平行试验取均值。
1.2.6.4 糖化酶对pH稳定性试验 取原始菌株酶液及突变菌株酶液各50 mL,分别置于pH2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、7.5、8的缓冲溶液中,40 ℃水浴条件下反应1 h,以残余糖化酶酶活为指标用来研究糖化酶热稳定性。测定糖化酶的酶活力,每组进行5组平行试验取均值[26]。
1.2.6.5 不同金属离子对糖化酶活力的影响 取原始菌株酶液及突变菌株酶液各50 mL,分别置于50 mL各含K+、Ca2+、Ag+、Fe2+、Mg2+、Cu2+、Zn2+及EDTA 的2%可溶性淀粉溶液中,金属离子浓度梯度为0.5、1.0、1.5 mol/L。每组进行5组平行试验取均值,测定酶活力[27]。对照组不添加金属盐并设该组所测酶活力为100%。
1.3 数据处理
本文图表数据处理采用Excel 2007及SPSS Statistics 20.0。
2 结果与分析
2.1 酶的分离纯化
酶的洗脱结果如图1。
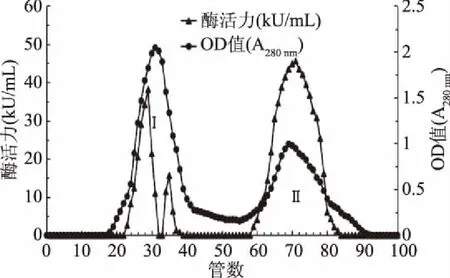
图1 Sephadex-100洗脱曲线Fig.1 Elution curve of Sephadex-100
经处理得到两个明显的洗脱峰,峰Ⅰ及峰Ⅱ均有糖化酶酶活检出,最高酶活分别为38.1、45.5 kU/mL。峰Ⅱ有较高的酶活,将该部分真空冻干后可进行蛋白浓度测定及相对分子质量检测。
电子束诱变菌株产糖化酶的粗酶液经(NH4)2SO4盐沉淀及Sephadex-100层析,糖化酶蛋纯化效果明显,结果如表1。

表1 糖化酶纯化结果Table 1 Glucoamylase purification results
经SDS-PAGE电泳有一条清晰蛋白带出现在66.4~97.2 kDa间,如图2。计算得到其分子质量为:69.2 kDa。
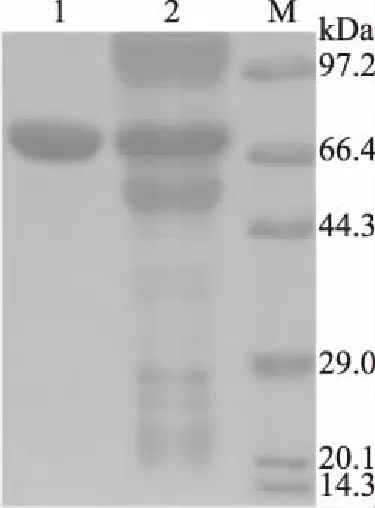
图2 突变菌株糖化酶电泳图Fig.2 Mutant strains glucoamylase electrophoresis注:1:纯化酶液;2:粗酶液;M:Marker。
2.2 糖化酶最适pH
pH对糖化酶活力的影响如图3所示:pH在4.0~5.0之间糖化酶具有较高酶活力,初步确定最佳酶活力pH在该区域之间。
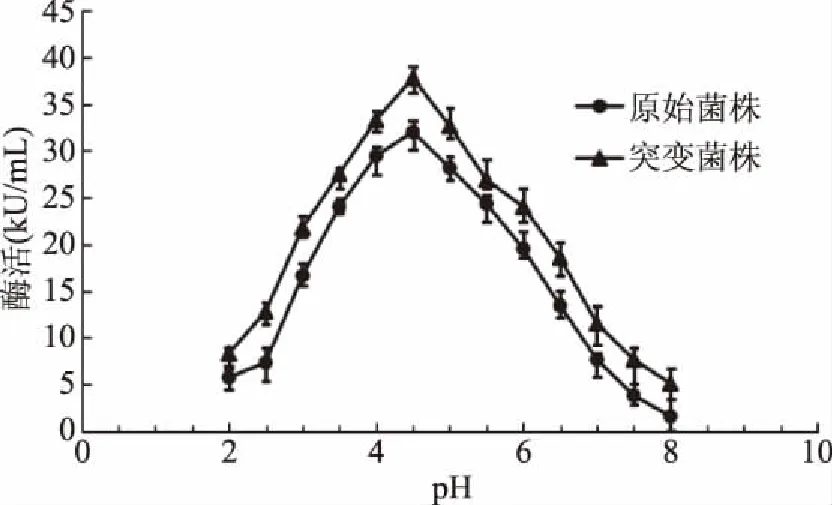
图3 pH对糖化酶酶活力的影响Fig.3 Effect of pH on the glucoamylase activity
糖化酶最适pH的确定,结果如图4所示,在pH为4.6时糖化酶活力最佳,确定糖化酶最佳反应pH为4.6,较原始菌株提高24%,所测最高酶活为46.6 kU/mL。
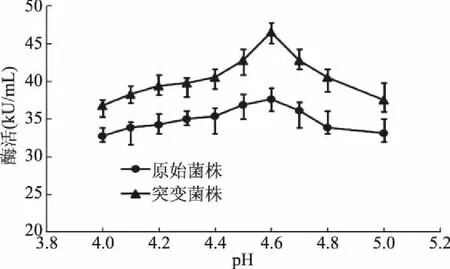
图4 pH对糖化酶酶活力的影响Fig.4 Effect of pH on the glucoamylase activity
2.3 糖化酶最适温度的确定
在不同温度下测定原始菌株与突变菌株糖化酶作用于底物的能力,结果如图5所示,随着温度的上升糖化酶活力也逐步提高,当温度为65 ℃时酶活最佳,且诱变菌株相对原始菌株酶活提高28%,而超过65 ℃后酶活力大幅度下降。原始菌株的最适温度为60 ℃,而突变菌株的最适温度有所上升,原因可能与其氨基酸组成有关。Krohn等[28]的研究表明,酶分子中甘氨酸、丙氨酸、脯氨酸及亮氨酸等疏水性氨基酸数量的增加有助于提高其热稳定性,并随酶分子中疏水氨基酸成分改变而不同。关于突变菌株的氨基酸组成对其糖化酶热稳定性的影响有待进行下一步实验。
糖化酶最适作用温度的确定,结果如图6所示,突变菌株糖化酶最高酶活力出现在作用温度为63 ℃时,因此确定突变菌株糖化酶最佳作用温度为63 ℃。原始菌株最佳作用温度为60 ℃,突变菌株糖化酶最高酶活较原始菌株提高26%,所测突变菌株糖化酶最高酶活为48.2 kU/mL。
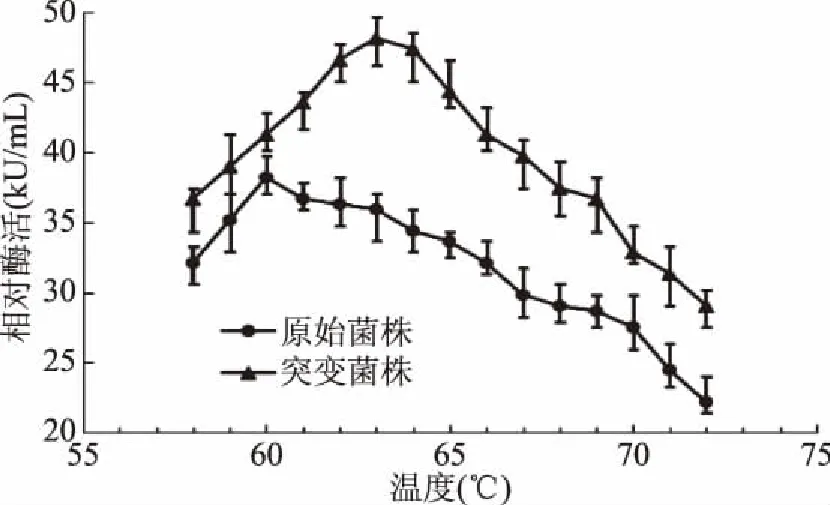
图6 温度对糖化酶酶活力的影响Fig.6 Effect of temperature on the glucoamylase activity
2.4 糖化酶热稳定性
糖化酶热稳定性结果如图7所示,原始菌株产糖化酶在50~60 ℃条件下保温30 min后出现不同程度的损失,突变菌株糖化酶在50~60 ℃条件下保温1 h后酶活基本没有损失,稳定性很好;65 ℃条件下反应1 h,原始菌株产糖化酶活力为22.1 kU/mL,在同条件下突变菌株糖化酶酶活力仍可达到35.7 kU/mL,酶活保持稳定;70 ℃条件下反应30 min后,原始菌株产糖化酶活力为24.8 kU/mL,突变菌株产糖化酶活力仍有32 kU/mL保留;但温度超过75 ℃后两种酶液酶活力大量损失;在80 ℃条件下保温1 h原始菌株所产糖化酶失活,突变菌株产糖化酶仍有8.4 kU/mL酶活剩余。由试验结果发现,经电子束诱变的突变菌株所产糖化酶具备较好的热稳定性。
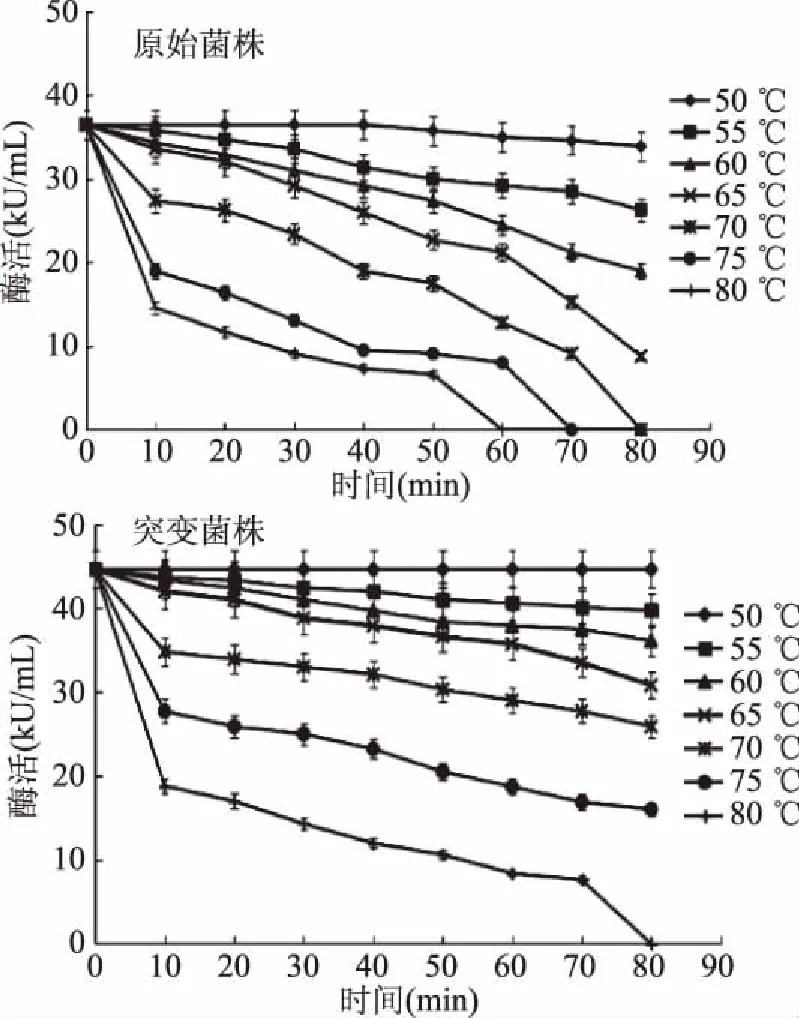
图7 不同温度下糖化酶的热稳定性Fig.7 Thermal stability of glucoamylase at different temperatures
2.5 糖化酶对pH稳定性试验
经电子束诱变的突变菌株糖化酶的pH稳定性试验结果如图8所示。该酶在pH4.5时,酶活出现最高值,且原始菌株最高酶活为突变菌株最高酶活的86%;当pH>7.0时,酶活力严重降低(均小于其最高值的一半),但突变菌株的酶活较高;当pH=8时,原始菌株所产糖化酶失活,突变菌株所产糖化酶仍有6.9 kU/mL酶活检出。说经电子束诱变的突变菌株糖化酶pH稳定性有着较明显的提升。
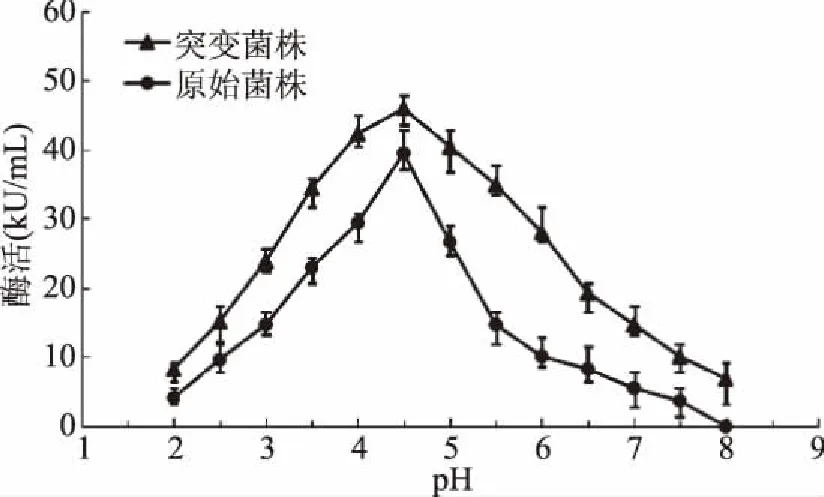
图8 pH对糖化酶稳定性的影响Fig.8 Effect of pH on the stability of thermophilum glucoamylase
2.6 不同金属离子对糖化酶活力的影响
在反应体系浓度分别为0.5、1、1.5 mol/L的K+、Ca2+、Ag+、Fe2+、Mg2+、Cu2+、Zn2+及 EDTA 对糖化酶活力的影响结果如表2。

表2 金属离子对糖化酶活力的影响Table 2 Effect of different metal ions on the glucoamylase activity
反应体系中加入终浓度为0.5 mol/L的金属离子后,K+、Ca2+对糖化酶活力的促进效果均在7%以上,其中促进效果最明显的为Ca2+,此时原始菌株所产糖化酶相对糖化酶活为118%;Ag+、Fe2+、Cu2+对糖化酶活力的影响均表现为抑制作用,最明显的是Ag+对原始菌株所产糖化酶的抑制效果,在该条件下糖化酶的相对酶活为55%;Mg2+、Zn2+、EDTA对糖化酶活力的影响不明显。在终浓度为1.0 mol/L的金属离子中,K+、Mg2+、Ca2+对糖化酶活力影响表现为促进作用,其中Ca2+对突变菌株所产糖化酶的影响最明显,此时相对酶活为122%;Ag+、Fe2+、Zn2+、Cu2+则抑制糖化酶活力,Ag+抑制效果最明显,此时原始菌株及突变菌株所产糖化酶相对酶活分别为42%和37%,EDTA对糖化酶的活力影响较小。在终浓度为1.5 mol/L的金属离子中,K+、Mg2+、Ca2+对糖化酶活力影响表现为促进作用,促进效果最明显的为Ca2+,此时原始菌株及突变菌株所产糖化酶相对酶活分别为112%和117%;抑制效果最明显的是Ag+,此时原始菌株及突变菌株所产糖化酶相对酶活分别为47%和45%;Zn2+、EDTA对糖化酶的活力影响较小。
综上实验结果表明,在反应体系中加入终浓度为0.5、1.0、1.5 mol/L的金属离子后,K+、Mg2+、Ca2+在一定程度上促进了糖化酶活力的表现;Ag+、Fe2+、Cu2+则抑制糖化酶活力;Zn2+、EDTA对糖化酶的活力影响较小。
3 结论
电子束辐照黑曲霉突变菌株产糖化酶分离纯化效果明显,分子量为69.2 kDa。突变菌株糖化酶最适pH为4.6,且最高酶活为46.6 kU/mL,较原始菌株提高24%;在pH超过8.0后,原始菌株所产糖化酶失活时,突变菌株所产糖化酶仍有6.9 kU/mL酶活剩余,突变菌株糖化酶的pH稳定性有着明显提高。突变菌株产糖化酶最适作用温度为63 ℃,原始菌株为60 ℃,突变菌株产糖化酶最高酶活为48.2 kU/mL,较原始菌株产糖化酶提高26%,在80 ℃条件下保温1 h,原始菌株产糖化酶失活时突变菌株产糖化酶仍有8.4 kU/mL酶活剩余,突变菌株所产的糖化酶具有较高的热稳定性。不同金属离子对经电子束诱变的突变菌株糖化酶活力存在不同的影响,在各金属离子浓度为0.5、1、1.5 mol/L时K+、Mg2+、Ca2+均在一定程度上增强其酶活力;Ag+、Fe2+、Cu2+则抑制了糖化酶活力;Zn2+、EDTA对其活力影响较小或无明显现象。
