氨基酸分析研究进展
2018-06-12丁松,黄和,胡燚
丁 松,黄 和,胡 燚
(南京工业大学 药学院,江苏 南京 211800)
蛋白质在生物界具有无与伦比的地位,而作为蛋白质基础结构的氨基酸同样与生命活动息息相关。参与蛋白质合成的基本氨基酸有20种,非蛋白质氨基酸在自然界中被发现的已超过1 000种[1]。氨基酸也可作为能量来源,是神经递质、卟啉、多胺和一氧化氮等生物合成的前体[2]。氨基酸分析在生物化学、蛋白质组学、临床医学、食品科学、化工等领域有着广泛的应用,也是分析化学中的一个研究热点。氨基酸的分析方法纷繁多样,主要体现在衍生剂、检测器的种类多,分析方法又优劣各异,这无疑给科研工作者的选择带来了困难。国内外许多研究者从不同角度对氨基酸的分析进行了综述。于泓等[3]主要对柱前衍生反向高效液相色谱法(HPLC)做了总结及比较,并着重叙述了高效阴离子交换色谱-积分脉冲安培检测法在分析氨基酸方面的应用。Poinsot等[4-6]连续多年追踪报道了毛细管电泳分析氨基酸近20年的研究进展,为毛细管电泳分析氨基酸带来了重要参考。
本文对无需衍生化的直接检测氨基酸和需要衍生化的间接测定氨基酸的2种方法进行了综述,直接检测法主要从检测器方面论述近年来主要的检测非衍生化氨基酸的基本理论及实例;间接检测法从衍生试剂及相应衍生物的检测器(紫外、荧光和液相-电喷雾离子质谱)方面分析了各种衍生试剂的优劣及衍生化方法。
1 非衍生化方法
无需进行衍生的直接分析氨基酸方法一直是科研工作者所追求的。非衍生直接分析氨基酸不仅更便捷、灵活、简单且具有准确性,也能避免引入衍生化过程的重现性,衍生的不稳定性以及副反应和试剂的干扰等问题。近十多年来,非衍生化分析氨基酸的方法层出不穷。笔者就非衍生分析氨基酸的色谱方法和检测器进行系统的总结。
1.1 紫外检测器
有多种氨基酸带有芳香基团,比如L-色氨酸、L-酪氨酸和L-苯丙氨酸以及它们的衍生物,都能在紫外254 nm处有吸收峰,其余的氨基酸虽然羧基能在低紫外波长(190~210 nm)处被检测出,但是敏感度太低。Wadud等[7]用HPLC(Mightysil RP-18 GP分析柱)联合紫外检测器成功分析出了肝脏试样中的组氨酸,色谱条件为柱温39 ℃,流速1.2 mL/min,波长220 nm,进样量10 μL。此外,Agrafiotou等[8]用UV检测器分析了18种非衍生氨基酸,通过双波长紫外吸收190和210 nm波来增强分析效果。
1.2 荧光检测器
荧光能检测带有苯酚、邻苯二酚、吲哚基的氨基酸,如酪氨酸(Tyr)、DL-m-酪氨酸(m-Tyr)、DL-α-甲基酪氨酸(me-Tyr)、β-(3,4-二羟苯基)-L-丙氨酸(dopa)、5-羟基-色氨酸(5htp)、L-a-甲基多巴(me-dopa)、L-色氨酸(Trp)。检测以上氨基酸的激发和发射波长分别为220和320 nm,检出限在12~58 ng/mL。液相色谱条件为pH 2.5的0.02 mol/L磷酸缓冲液和乙腈作为流动相,流速1 mL/min,进样质量浓度10 μg/mL,柱温25 ℃[8]。
1.3 电导检测器
电导检测在近十几年兴起是因为非接触电导检测器(C4D)的引入。传统的接触式电导检测器由于对带电离子的检测具有通用性,并且可以用于检测对紫外-可见光不敏感的离子,受到研究者的重视。但接触式电导检测器容易造成电极污染,难以清洗,且难以检测出谷氨酸[9]。非接触电导检测器把交流电压信号通过电容耦合作用于检测池,更加有利于装置的制作,使用也更加方便。有相关论文报道了C4D用于非衍生氨基酸的检测,Kubáňp等[10]、Strieglerov等[11]、Shen等[12]和Tuma等[13]用电导检测器联合HPLC分析了 6种氨基酸(缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、酪氨酸和苯丙氨酸),色谱条件为Purospher RP-18e 柱,流速0.7 mL/min,流动相A为体积分数0.002 5%三氟乙酸,流动相B为体积分数0.001 5%三氟乙酸和体积分数10%甲醇,分析物浓度为500 μmol/L。C4D在高效液相色谱的应用中会由于梯度洗脱造成基线漂移,这种情况可以通过合理的调电导率、缓冲溶液比例及合理使用软件等来改善[14]。
1.4 蒸发光散射检测器(ELSD)
蒸发光散射检测(ELSD)是目前公认的被用于液相色谱的通用检测方法。与紫外检测器相比, ELSD通用性更高,其响应作用与物质的本身结构和光学性质无关。可直接检测无紫外吸收或荧光官能团物质,对直接检测未衍生氨基酸十分适用。ELSD相对于质谱来说廉价得多,但灵敏度较低,响应值常与被测物浓度不呈线性关系。近年来,许多研究者针对ELSD的改进做了不少工作,如:Petritis等[15]用HPLC结合挥发性离子对试剂全氟羧酸和蒸发光散射检测器验证检测了8种非衍生氨基酸(苏氨酸、赖氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸和色氨酸),氨基酸样品粉末用体积分数为0.1%的七氟丁酸溶解,色谱条件为Purospher RP18e柱(Merck;125 mm,4 mm),柱温25 ℃,流速1 mL/min,进样量20 μL。与标准氨基酸分析仪检测的方法保持98.6%~102.5%的结果一致。ELSD也被应用于一些真实样品非衍生氨基酸的检测,如水蛭、茶等[16-17]。Cobb等[18]通过减小喷雾器管道直径(0.254~0.127 mm)来改善ELSD检测非衍生氨基酸的基线稳定性、灵敏度和线性相关性,取得了良好的效果。
1.5 质谱检测器
在过去的十多年中,质谱检测技术为天然氨基酸的测定提供了新的机会。目前用于分析复杂生物基质中氨基酸的质谱都是和各种检测工具联用的,主要有液相色谱、气相色谱和毛细管电泳。无需衍生化的直接分析氨基酸的方法有离子对液相色谱串联质谱(IP-LC-MS/MS)、亲水作用色谱-质谱联用(HILIC-MS)和毛细管电泳-质谱联用(CE-MS)等。Piraud等[19]在20 min内运用反相高效液相质谱(IP-HPLC-MS)定性测定了76种氨基酸,其中通过稳定同位素标记物内标法,有16种氨基酸可以定量测定。色谱条件为十八烷基键合硅胶柱,柱温26 ℃,以全氟羧酸和乙腈为流动相,流速200 μL/min,进样量5 μL。Armstrong等[20]通过离子对反相高效液相色谱(IP-RP-HPLC)/耦联时间飞行质谱(TOF-MS)对人体血液中25种未衍生氨基酸进行了定量测定,线性动态范围在1.56~400 μmol/L。Langrock等[21]在25 min内运用聚酰胺柱结合亲水色谱-电喷雾离子化质谱(HILIC-ESI-MS),在中性丢失扫描模式下分离出了16种蛋白氨基酸[21]。Qi等[22]用0.08 mmol/L邻苯二甲酸作为流动相添加剂,通过HILIC-ESI-MS测定甲状腺癌组织中的氨基酸,定量限(LOQ)和检测限(LOD)相较于未加添加剂提升了4~50倍。Rodrigues等[23]用毛细管电泳-电喷雾质谱联用(CE-ESI-MS)定量分析了尿液中的27种氨基酸,分析时间在30 min之内,检测限达到0.6~29 μmol/L。
1.6 积分脉冲安培检测器(IPAD)
积分脉冲安培检测器(IPAD)的原理是氨基酸中的羧基在强碱性条件下变成阴离子,而氨基只有在金电极表面施加一定电位才能发生氧化反应,积分脉冲安培检测器从而实现了对氨基酸的检测,检出限为pmol~fmol级。Yu等[24]对高效阴离子交换色谱-积分脉冲安培检测法(HPAEC-IPAD)分析氨基酸的影响因素进行了考察,洗脱液氢氧化钠和醋酸钠的浓度在一定限度的增高会提高氨基酸检测的敏感度,在优化的条件下,19种氨基酸的检测限为0.15~4.52 pmol。色谱条件为AminoPac PA 10柱(250 mm×2 mm),流速0.25 mL/min,柱温35 ℃,进样量25 μL。因为糖类化合物也含有多羟基,会导致有糖及糖类化合物存在时影响氨基酸的分析。由于氨基酸的检测点位高于糖类化合物,在较高的电位下,两者均被检测,而在较低的积分电位下只能检测糖类化合物,氨基酸(羟基氨基酸除外)很难被检测或检测信号很弱。对含有大量糖类化合物样品中的氨基酸进行测定,Jandik等[25]和Ding等[26]分别提出了在线和离线除糖测定氨基酸的方法。
2 衍生化方法
最普遍的定性和定量分析氨基酸的方法涉及高效液相色谱和各种检测器的耦合系统,这种方法不可避免地要引入衍生试剂。许多氨基酸在相应的检测器下没有吸收峰,只有和衍生试剂反应生成相应的衍生物才能在检测器中被检测出来。笔者就3种不同的检测器(紫外检测器、荧光检测器和电喷雾电离质谱检测器)及对应的衍生剂、衍生化方法进行了综述,旨在满足科研工作者对氨基酸分析方法的选择具有多样性。
2.1 紫外检测
紫外检测器在氨基酸分析中是最常见的。1958年,Spackman等[27]让氨基酸首先在酸性环境中形成阳离子,进而在阳离子交换柱中进行分离,然后用茚三酮衍生分离后的氨基酸,最后采用紫外检测器进行检测,奠定了现代氨基酸自动分析技术的基础。随后,各种衍生试剂及衍生方法随之涌现,详见表1。紫外吸收衍生试剂主要有异硫氰酸苯酯(PITC)、4-硝苯基异硫氰酸苯酯(NPITC)、异硫代氰酸丁酯(BITC)、苄基异硫氰酸酯(BZITC)、茚三酮、2,4-二硝基氟苯(FDNB)、磺酰氯二甲胺偶氮苯(DABS-Cl)、N-N-二乙基 -2,4-二硝基-5-对氟苯胺(FDNDEA)、乙氧亚甲基丙二酸二乙酯(DEEMM)和4-氯-3,5-二硝基三氟甲苯(CDNBTF)等。
作为一种常用衍生试剂,PITC广泛应用于氨基酸分析领域[28-31]。它可同时与一级和二级氨基快速发生反应,生成稳定的苯氨基硫甲酰衍生物(PTC),PTC在紫外254 nm处有很好的吸收峰。Okunev等[31]用PITC衍生土壤溶液中的17种蛋白氨基酸,分析时间达72 min,其中35 min进行衍生化反应,37 min用于色谱分离,其检测限为0.22~0.48 pmol。色谱条件为Brownlee Analytical C18柱(150 mm×4.6 mm, 5 μm),流动相A为0.05%三乙胺,流动相B为乙腈-水(体积比为60∶ 40),进样量20 μL。Cohen等[32]在保留PITC各种优点的基础上为了提高检测的敏感性,首次运用了PITC的类似物4-硝苯基异硫氰酸苯酯(NPITC)作为氨基酸的衍生试剂,检测波长为254或340 nm,总检测时间为40 min。但NPITC的一大不足是在高真空系统下,过量的试剂无法被简单移除。要解决这个问题,就亟需开发易挥发的衍生试剂,异硫代氰酸丁酯(BITC)应时而生。BITC除了有很好的挥发性以外,还兼有分离胱氨酸和半胱氨酸的能力,这是PITC所不具有的,但美中不足的是天冬酰胺和丝氨酸峰完全重叠。苄基异硫氰酸酯(BZITC)作为PITC的类似物,BZITC的挥发性虽然没有BITC的好,但同PITC相比,在相同条件下具有更好的反相分辨率和再现性。Woo等[33]以BITC和BZITC作为食品中22种氨基酸分析的衍生剂,并同PITC作比较。BITC和BZITC的衍生物检测波长分别为240和246 nm,分析时间都为35 min,BITC衍生对于过量的试剂和副产物的移除只要10 min,而PITC和BZITC要花费1 h。
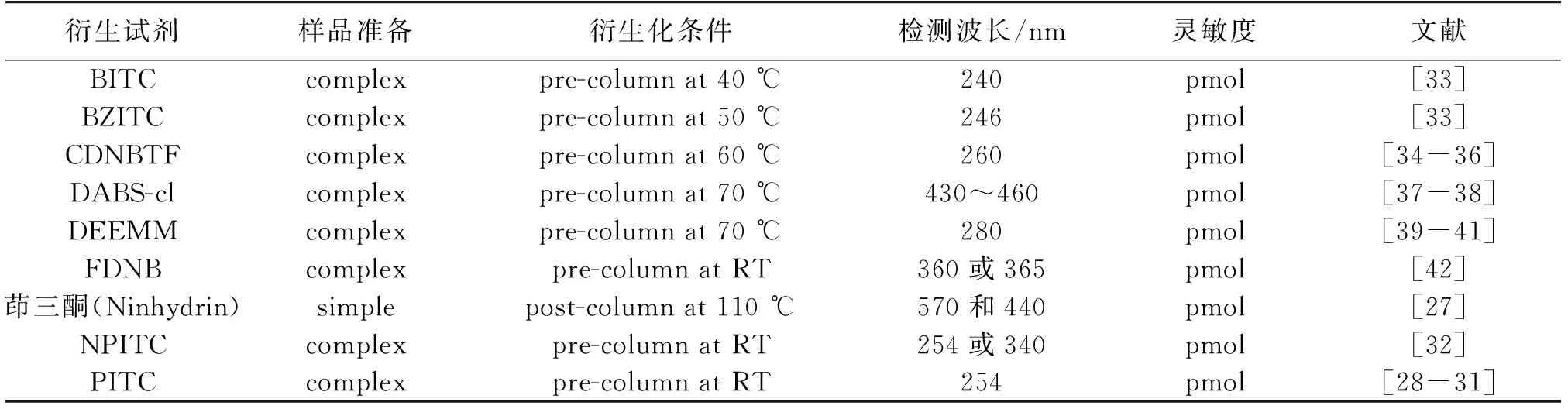
表1 紫外衍生试剂特点的比较
注:RT代表室温;pre-column表示柱前;post-column表示柱后;simple表示去除蛋白加一个额外的操作步骤(例如去除过量试剂或干扰物质);complex表示去除蛋白加2个及以上额外的操作步骤。
2,4-二硝基氟苯(DNFB)(Sanger试剂),又称作1-氟-2,4-二硝基苯(FDNB),是一种通用的、廉价的氨基酸柱前衍生试剂,它能与一级和二级氨基反应生成稳定的黄色2,4-二硝基苯(DNP)氨基酸。DNP氨基酸在紫外360或365 nm处有强的吸收峰。与DNFB结构类似的4-氯-3,5-二硝基三氟甲苯(CDNBTF)也常见于氨基酸分析[34-36]。CDNBTF亦能检测一级和二级氨基,反应式如图1所示,衍生物稳定,吸收波长260 nm,分析时间45 min。Lin等[35]运用CDNBTF作为老陈醋中氨基酸的衍生剂,然而这种操作方法实施时亮氨酸和异亮氨酸不能分开。
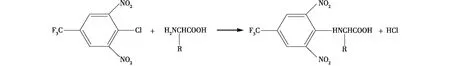
图1 CDNBTF和氨基酸的衍生反应Fig.1 CDNBTF and amino acid derivatization
磺酰氯二甲胺偶氮苯(DABS-Cl)作为一个氨基酸柱前衍生试剂得到了相当大的关注。DABS-Cl有许多PITC所没有的优点,其氨基酸的衍生物在室温下能稳定数周,检测限达到了pmol级,在紫外430~460 nm处有很强的吸收峰[37-38]。缺点是与一些氨基酸(精氨酸、谷氨酸、丝氨酸、苏氨酸和天门冬氨酸)不能进行定量反应, 而且产物成分复杂。
乙氧基亚甲基丙二酸二乙酯(DEEMM)是近年来比较受欢迎的一种衍生试剂,与氨基酸的反应如图2所示,其衍生物稳定,紫外检测波长为280 nm。Megías等[39]用DEEMM柱前衍生化方法检测了L-刀豆氨酸,LOD和LOQ分别为0.15和0.5 μmol/L。Redruello等[40]用DEEMM定量分析了奶酪中的22种氨基酸,检测限为0.08~3.91 μmol/L,衍生时间45 min,但还须70 ℃加热2 h,以降解过量的DEEMM和副产物,操作较为繁杂和耗时。也有研究者对蜂蜜中的23种氨基酸分析进行,虽然取得了良好的分析效果,但唯一不足的是衍生结束后要等24~48 h才能用HPLC分析[41]。

图2 DEEMM与氨基酸的衍生反应Fig.2 DEEMM and amino acid derivatization
2.2 荧光检测
荧光衍生试剂有3-(4-羧基苯甲酰基)-2-喹啉吡咯甲醛(CBQCA)、异硫氰酸荧光素(FITC)、氯甲酸芴甲酯(FMOC-Cl)、荧光胺(FRA)、4,7-菲咯啉-5,6-二酮(PHA)和邻苯二甲醛(OPA)等,以上试剂各自特点见表2。
异硫氰酸荧光素(FITC)是一种荧光衍生试剂,与氨基酸反应的衍生物激发波长490 nm,发射波长515 nm[43]。它有3方面优势:1)氩气灯的发射波长与FITC的激发波长一致;2)很容易与氨基酸发生衍生反应,衍生物的荧光效果好;3)能通过微波辅助衍生把衍生时间降到3 min[44]。
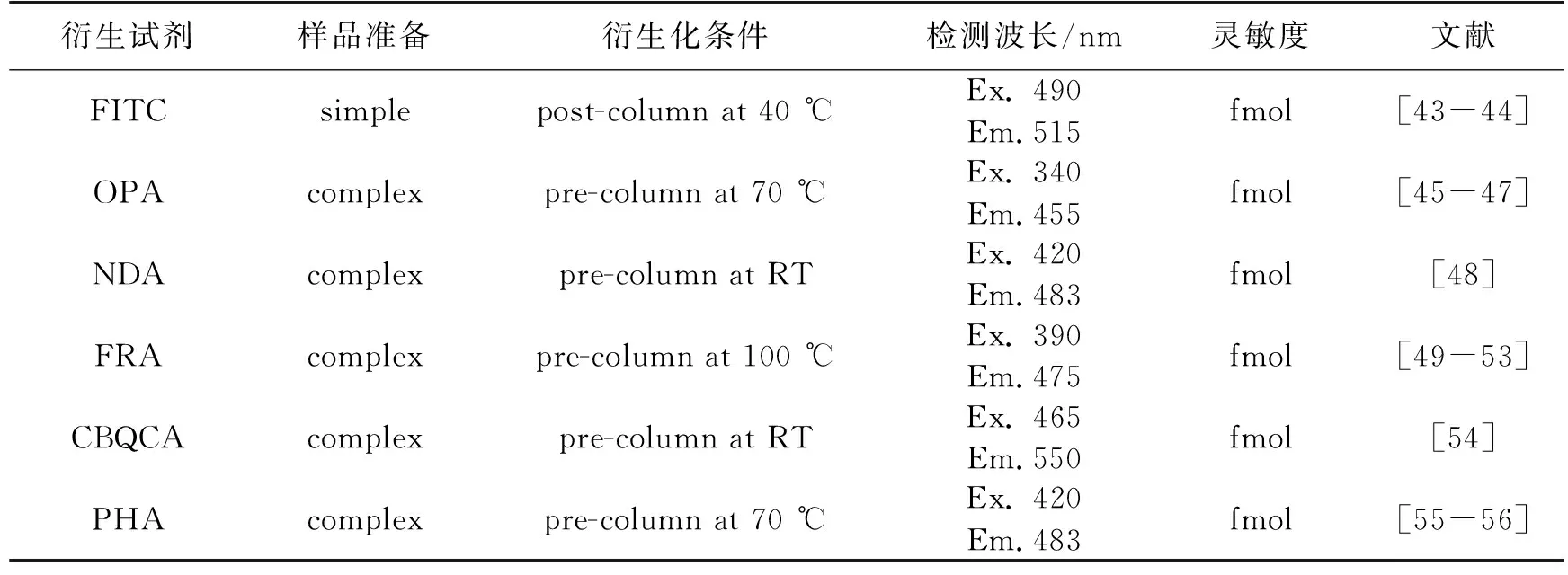
表2 荧光衍生试剂特点的比较
注:Ex.为激发波长;Em.为发射波长。
最近二十多年来,柱前OPA衍生方法分析氨基酸很受欢迎。除了胱氨酸和半胱氨酸,OPA能在2-巯基乙醇或3-巯基丙酸存在的条件下,与一级氨基酸反应生成荧光化合物[45],激发波长340 nm,发射波长455 nm。OPA衍生的优点很多,衍生时间可快至1 min,灵敏度达到fmol级,基本没有副产物生成,同时还具有稳定的色谱基线,不存在不规则峰形的特点[46-47]。新的衍生试剂萘-2,3-二甲醛(NDA)的设计是为了解决OPA衍生物降解快的问题(大约10 min)[48],但价格对于OPA来说贵得多,荧光检测的激发和发射波长分别为420和483 nm。OPA也可以进行柱后衍生,比茚三酮灵敏度高,是一种应用广泛的柱后衍生试剂。柱后衍生试剂还有荧光胺,荧光胺是一种螺环化合物,于1972年由Udenfriend等[49]首次提出,随后Weigele等[50]在实验室合成了该化合物。荧光胺本身无荧光吸收,能与一级氨基化合物在pH为9的硼酸缓冲液中反应生成蓝绿色荧光衍生物,该衍生物的激发和发射波长分别为390和475 nm[51]。但OPA和荧光胺不能直接与脯氨酸反应,须通过氧化打开脯氨酸的咪唑环才能衍生。但Pravadali-Cekic等[52]和Jones等[53]用反应流色谱联合UV检测器,荧光胺作为柱后衍生剂,在UV 280 nm处分析了氨基酸,并且LOD和LOQ相比较于传统柱后衍生减小了50%,是今后氨基酸柱后衍生的一个新的方向。
CBQCA试剂在水溶液中没有荧光,然而在氰化物的存在下,它能与一级氨基在室温下发生反应,生成强的荧光吸收的衍生物,反应如图3所示。该衍生物在荧光检测器下的激发波长和发射波长分别为465和550 nm,检测限在0.03~0.06 μmol/L[54]。4,7-菲咯啉-5,6-二酮(PHA)也能与一级氨基生成稳定的荧光物质,反应如图4所示,其衍生物激发波长和发射波长分别为400和460 nm,LOD和LOQ分别为10~450和35~1 400 fmol[55-56]。

图3 CBQCA与氨基酸的衍生反应Fig.3 CBQCA and amino acid derivatization

图4 PHA与氨基酸衍生反应Fig.4 PHA and amino acid derivatization
2.3 紫外和荧光检测
一些衍生剂和氨基酸反应既能用紫外检测,也能用荧光检测。常用的这种衍生试剂有6-氨基哇琳基-N-琥珀酰-亚胺基甲酸酯(AQC)、丹磺酰氯(Dansyl-Cl)、9-氯甲酸芴甲酯(FMOC-Cl)、4-氟-7-硝基-2,1,3-苯并氧杂恶二唑(NBD-F)、4-氯-7-硝基苯并-2-氧杂-1,3-二唑(NBD-Cl)等,各自特点比较见表3。

表3 紫外兼荧光衍生试剂特点的比较
柱前衍生试剂6-氨基喹啉基-N-羟基琥珀酰亚胺氨基甲酸酯(AQC)最初是由Cohen[57]等首次提出的,作为一种特殊的分析蛋白质和水解氨基酸的荧光衍生试剂[58],激发波长和发射波长分别是250和395 nm[59]。同时,AQC也是紫外衍生试剂,紫外检测波长250 nm,其与氨基酸的反应如图5所示。Pappa-Louisi等[59]和Wang等[60]以AQC作为氨基酸衍生剂,同时用紫外和荧光检测器分别分析氨基酸。AQC能与一级和二级氨基酸反应,反应时间短,衍生物稳定。但样品中有羟脯氨酸和羟基赖氨酸时,定量分析会受到反应副产物的干扰。丹磺酰氯(Dansyl-Cl)也是近年来氨基酸分析常用的衍生试剂,能与一级和二级氨基反应,衍生物紫外检测波长250 nm,荧光检测激发波长330 nm,发射波长550 nm。衍生须要在避光条件下反应,衍生时间较长,衍生完要立即进样分析,避免产生多级衍生物。Dansyl-Cl与组氨酸容易形成双峰,重复性差,但其胱氨酸的衍生物线性关系好,是胱氨酸定量分析的一种优良衍生试剂。
9-氯甲酸芴甲酯(FMOC-Cl)与氨基酸反应(图6),反应速度快,可在30 s内完成,其衍生物紫外检测波长在254~286 nm[61-62],荧光检测激发和发射波长分别为254和313 nm[63]。但试剂本身和其水解物有荧光,对色谱分离会产生干扰;组氨酸与其产生的衍生物不稳定,继而影响定量分析。

图5 AQC与氨基酸衍生反应Fig.5 AQC and amino acid derivatization

图6 FMOC-Cl与氨基酸衍生反应Fig.6 FMOC-Cl and amino acid derivatization
4-氯-7-硝基苯并-2-氧杂-1,3-二唑(NBD-Cl)是一级和二级氨基酸的柱前衍生试剂,NBD-Cl有许多优点、它的价格低廉、和氨基酸反应的衍生物能同时被紫外和荧光检测器检测、副产物很少[64-65]。紫外检测波长为470或475 nm,荧光检测激发波长和发射波长分别是488和520 nm[66-67]。4-氟-7-硝基-2,1,3-苯并氧杂恶二唑(NBD-F)能与一级和二级氨基反应,敏感度高,在一般情况下其分析时间长,达到80 min,导致分析不便捷,尤其是在临床医疗领域。然而,Song等[68]运用其与硅胶整体柱的快速HPLC方法,应用于小鼠血浆19种氨基酸分析中,整个分析过程只要18 min,效率明显提高,其荧光检测激发波长和发射波长分别为470和530 nm,紫外检测波长为380 nm。
2.4 液相-电喷雾离子质谱的检测
虽然液相色谱-质谱联用(LC-MS)能提供低的检测限,但是还要依靠电喷雾的有效离子化。最近几年,专门用作毛细管电泳-质谱联用法谱-电喷雾串联质谱(LC-ESI-MS)的氨基酸衍生试剂越来越多地被设计出来: 3-aminopyridyl-N-hydroxysuccinimidylcarbamate(APDS)、N-alkylnicotinic acidN-hydroxysuccinimideester(Cn-NA-NHS)、p-N,N,N-trimethylammonioanilylN′-hydroxysuccinimidylcarbamateiodide(TAHS)、2,5-dioxopyrrolidin-1-yl ntri(pyrrolidino) phosphoranylideneamino carbamate(FOSF)和(5-N-succinimidoxy-5-oxopentyl)triphenylphosphoniumbromide(SPTPP)等(结构式见表4)。

表4 LC-ESI-MS检测衍生剂结构
这些不同的衍生试剂中,APDS能进行更好的色谱分离,SPTPP和TAHS只有在正离子模式下才能灵敏地分析。TAHS被认为是这些新型衍生剂中最灵敏的[70]。Inagaki等[71]合成了SPTPP,SPTPP衍生物的检测限为0.015~0.43 fmol。Rebane等[72]用TAHS、FOSF、传统衍生试剂Dansyl-Cl、FMOC-Cl和DEEMM比较分析了7种不同的氨基酸,但结果表明虽然这些新型衍生试剂灵敏度高,但是色谱分离效果没有DEEMM好,线性范围没有DEEMM广。在液相-电喷雾离子质谱检测所用到的衍生试剂是近几年所兴起的新型衍生试剂,对氨基酸的分析起到一定的推动作用,也是今后氨基酸分析的一个新的热点。
3 展望
氨基酸的分析方法多样,其中柱前衍生高效液相色谱法是研究的比较多的一种方法,其发展方向主要集中在柱前衍生剂的稳定性、灵敏度和重复性上。当然,无需衍生的氨基酸分析方法将有更大的发展空间,各种检测器的更新换代以及各种分析设备的联用无疑为直接分析氨基酸提供了更加有力的保障,氨基酸的分析速度、灵敏度和重复性将会在未来走上一个新的台阶。
参考文献:
[1] RODGERS K J.Non-protein amino acids and neurodegeneration: the enemy within[J].Exp Neurol,2014,253(1):192-196.
[2] KASPAR H,DETTMER K,GRONWALD W,et al.Advances in amino acid analysis[J].Anal Bioanal Chem,2009,393(2):445-452.
[3] 于泓,牟世芬.氨基酸分析方法的研究进展[J].分析化学,2005,22(3):398-404.
[4] POINSOT V,BAYLE C,COUDERC F.Recent advances in amino acid analysis by capillary electrophoresis[J].Electrophoresis,2006,27(1):176-194.
[5] POINSOT V,ONG-MEANG V,GAVARD P,et al.Recent advances in amino acid analysis by capillary electromigration methods,2011-2013[J].Electrophoresis,2014,35(1):50-68.
[6] POINSOT V,ONG-MEANG V,GAVARD P,et al.Recent advances in amino acid analysis by capillary electromigration methods,2013-2015[J].Electrophoresis,2016,37(1):142-161.
[7] WADUD S,ORRASHID M M,ONODERA R.Method for determination of histidine in tissues by isocratic high-performance liquid chromatography and its application to the measurement of histidinol dehydrogenase activity in six cattle organs[J].J Chromatogr B,2002,767(2):369-374.
[8] AGRAFIOTOU P,SOTIROPOULOS S,PAPPA-LOUISI A.Direct RP-HPLC determination of underivatized amino acids with online dual UV absorbance,fluorescence,and multiple electrochemical detection[J].J Sep Sci,2009,32(7):949-954.
[9] PETRITIS K,ELFAKIR C,DREUX M.A comparative study of commercial liquid chromatographic detectors for the analysis of underivatized amino acids[J].J Chromatogr A,2002,961(1):9-21.
[11] STRIEGLEROVL,KUBP.Electromembrane extraction of amino acids from body fluids followed by capillary electrophoresis with capacitively coupled contactless conductivity detection[J].J Chromatogr A,2011,1218(37):6248-6255.
[12] SHEN D,LI Y,ZHANG Z,et al.Determination of amino acids by capillary electrophoresis with differential resonant contactless conductivity detector[J].Talanta,2013,104(2):39-43.
[13] TUMA P,GOJDA J.Rapid determination of branched chain amino acids in human blood plasma by pressure-assisted capillary electrophoresis with contactless conductivity detection[J].Electrophoresis,2015,36(16):1969-1975.
[14] 卢艳艳.非接触电导检测法的研究及在毛细管电泳中的应用[D].郑州:郑州大学,2010.
[15] PETRITIS K,DE PERSON M,ELFAKIR C,et al.Validation of an ion-interaction chromatography analysis of underivatized amino acids in commercial preparation using evaporative light scattering detection[J].Chromatographia,2004,60(5/6):293-298.
[16] YAN D,LI G,XIAO X H,et al.Direct determination of fourteen underivatized amino acids from Whitmaniapigra by using liquid chromatography-evaporative light scattering detection[J].J Chromatogr A,2007,1138(1):301-304.
[17] BOURI M,SALGHI R,ZOUGAGH M,et al.Capillary electrophoresis coupled to evaporative light scattering detection for direct determination of underivatized amino acids:application to tea samples using carboxyled single-walled carbon nanotubes for sample preparation[J].Electrophoresis,2013,34(18):2623-2631.
[18] COBB Z,SHAW P N,LLOYD L L,et al.Evaporative light-scattering detection coupled to microcolumn liquid chromatography for the analysis of underivatized amino acids:sensitivity,linearity of response and comparisons with UV absorbance detection[J].J Microcolumn Sep,2001,13(4):169-175.
[19] PIRAUD M,VIANEY-SABAN C,PETRITIS K,et al.Ion-pairing reversed-phase liquid chromatography/electrospray ionization mass spectrometric analysis of 76 underivatized amino acids of biological interest:a new tool for the diagnosis of inherited disorders of amino acid metabolism[J].Rapid Commun Mass Sp,2005,19(12):1587-1602.
[20] ARMSTRONG M,JONSCHER K,REISDORPH N A.Analysis of 25 underivatized amino acids in human plasma using ion-pairing reversed-phase liquid chromatography/time-of-flight mass spectrometry[J].Rapid Commun Mass Sp,2007,21(16):2717-2726.
[21] LANGROCK T,CZIHAL P,HOFFMANN R.Amino acid analysis by hydrophilic interaction chromatography coupled on-line to electrospray ionization mass spectrometry[J].Amino Acids,2006,30(3):291-297.
[22] QI W,GUAN Q,SUN T,et al.Improving detection sensitivity of amino acids in thyroid tissues by using phthalic acid as a mobile phase additive in hydrophilic interaction chromatography-electrospray ionization-tandem mass spectrometry[J].Anal Chim Acta,2015,870(1):75-82.
[23] RODRIGUES K T,MEKAHLI D,TAVARES M F M,et al.Development and validation of a CE-MS method for the targeted assessment of amino acids in urine[J].Electrophoresis,2016,37(7/8):1039-1047.
[24] YU H,DING Y S,MOU S F.Some factors affecting separation and detection of amino acids by high-performance anion-exchange chromatography with integrated pulsed amperometric detection[J].J Chromatogr A,2003,997(1):145-153.
[25] JANDIK P,CHENG J,JENSEN D,et al.Simplified in-line sample preparation for amino acid analysis in carbohydrate containing samples[J].J Chromatogr B,2001,758(2):189-196.
[26] DING Y,YU H,MOU S.Off-line elimination of carbohydrates for amino acid analysis of samples with high carbohydrate content by ion-exchange chromatography[J].J Chromatogr A,2003,997(1):155-160.
[27] SPACKMAN D H,STEIN W H,MOORE S.Automatic recording apparatus for use in chromatography of amino acids[J].Anal Chem,1958,30(7):1190-1206.
[28] HEINRIKSON R L,MEREDITH S C.Amino acid analysis by reverse-phase high-performance liquid chromatography:precolumn derivatization with phenylisothiocyanate[J].Anal Biochem,1984,136(1):65-74.
[29] HARIHARAN M,NAGA S,VANNOORD T.Systematic approach to the development of plasma amino acid analysis by high-performance liquid chromatography with ultraviolet detection with precolumn derivatization using phenyl isothiocyanate[J].J Chromatogr B,1993,621(1):15-22.
[31] OKUNEV R V,GRIGORYAN B R,SHARIPOVA A I.Determination of free proteinogenic amino acids in soil solutions by HPLC with phenyl isothiocyanate derivatization[J].J Siberian Federal Univ:Chemistry,2014,7(4):480-486.
[32] COHEN S A.Analysis of amino acids by liquid chromatography after pre-column derivatization with 4-nitrophenylisothiocyanate[J].J Chromatogr A,1990,512(5):283-290.
[33] WOO K L.Determination of amino acids in foods by reversed-phase HPLC with new precolumn derivatives,butylthiocarbamyl,and benzylthiocarbamyl derivatives compared to the phenylthiocarbamyl derivative and ion exchange chromatography[J].Mol Biotechnol,2003,24(1):69-88.
[34] SHI T,TANG T,QIAN K,et al.High-performance liquid chromatographic method for determination of amino acids by precolumn derivatization with 4-chloro-3,5-dinitrobenzotri fluoride[J].Anal Chim Acta,2009,654(2):154-161.
[35] LIN Q,CHE L,GUO J,et al.Development of 4-chloro-3,5-dinitrobenzotrifluoride derivatization and ultrahigh-performance liquid chromatography method for determination of 20 free amino acids in mature vinegar[J].Asian J Chem,2014,26(13):3909-3916.
[36] LIN Q B,CHE L L,GUO J,et al.Use of 4-chloro-3,5-dinitrobenzotrifluoride (CNBF) derivatization and ultrahigh-performance liquid chromatography tandem mass spectrometry for the determination of 20 free amino acids in Chinese jujube date[J].Food Anal Method,2014,7(3):571-579.
[37] CHEN Y H,SHIH L L,LIOU S E,et al.Analysis of dabsyl-Cl derivated amino acids by high performance liquid chromatography and tandem mass spectrometry[J].Food Sci Technol Res,2003,9(3):276-282.
[38] AKHLAGHI Y,GHAFFARI S,ATTAR H,et al.A rapid hydrolysis method and DABS-Cl derivatization for complete amino acid analysis of octreotide acetate by reversed phase HPLC[J].Amino Acids,2015,47(11):2255-2263.
[40] REDRUELLO B,LADERO V,CUESTA I,et al.A fast,reliable,ultra high performance liquid chromatography method for the simultaneous determination of amino acids,biogenic amines and ammonium ions in cheese,using diethyl ethoxymethylenemalonate as a derivatizing agent[J].Food Chem,2013,139(1):1029-1035.
[41] REBANE R,HERODES K.A sensitive method for free amino acids analysis by liquid chromatography with ultraviolet and mass spectrometric detection using precolumn derivatization with diethyl ethoxymethylenemalonate:application to the honey analysis[J].Anal Chim Acta,2010,672(1):79-84.
[42] BÖHLEN P,MELLET M.Automated fluorometric amino acid analysis:the determination of proline and hydroxyproline[J].Anal Biochem,1979,94(2):313-321.
[43] MURAMOTO K,KAMIYA H,KAWAUCHI H.The application of fluorescein isothiocyanate and high-performance liquid chromatog-raphy for the microsequencing of proteins and peptides[J].Anal Biochem,1984,141(2):446-450.
[44] LIN W C,LIU W L,TANG W Y,et al.Determination of amino acids by micro emulsion electro kinetic chromatography laser induced fluorescence method[J].Electrophoresis,2014,35(11):1751-1755.
[45] JONES B N,GILLIGAN J P.O-phthaldialdehyde precolumn derivatization and reversed-phase high-performance liquid chromatography of polypeptide hydrolysates and physiological fluids[J].J Chromatogr A,1983,266:471-482.
[46] WU G,MEININGER C J.Analysis of citrulline,arginine,and methylarginines using high-performance liquid chromatography[J].Method Enzymol,2008,440:177-189.
[47] DAI Z,WU Z,JIA S,et al.Analysis of amino acid composition in proteins of animal tissues and foods as pre-columno-phthaldialdehyde derivatives by HPLC with fluorescence detection[J].J Chromatogr B,2014,964:116-127.
[48] MARRA M,BONFIGLI A R,TESTA R,et al.High-performance liquid chromatographic assay of asymmetric dimethylarginine,symmetric dimethylarginine,and arginine in human plasma by derivatization with naphthalene-2,3-dicarboxaldehyde[J].Anal Biochem,2003,318(1):13-17.
[49] UDENFRIEND S,STEIN S,BOEHLEN P,et al.Fluorescamine:a reagent for assay of amino acids,peptides,proteins,and primary amines in the picomolerange[J].Science,1972,178:871-872.
[50] WEIGELE M,DEBERNARDO S L,TENGI J P,et al.Novel reagent for the fluorometric assay of primary amines[J].J Am Chem Soc,1972,94(16):5927-5928.
[51] ZACHARIS C K,TZANAVARAS P D.Liquid chromatography coupled to on-line post column derivatization for the determination of organic compounds:a review on instrumentation and chemistries[J].Anal Chim Acta,2013,798:1-24.
[52] PRAVADALI-CEKIC S,JONES A,KAZARIAN A A,et al.Using reaction flow chromatography for the analysis of amino acid:derivatisation with fluorescamine reagent[J].Microchem J,2015,121:141-149.
[53] JONES A,PRAVADALI-CEKIC S,HUA S,et al.Post column derivatization using reaction flow high performance liquid chromatography columns[J].J Vis Exp,2016(110):e53462.
[54] SANLI N,TAGUE S E,LUNTE C.Analysis of amino acid neurotransmitters from rat and mouse spinal cords by liquid chromatography with fluorescence detection[J].J Pharma Biomed,2015,107:217-222.
[55] GATTI R,GIOIA M G,ANDREATTA P,et al.HPLC-fluorescence determination of amino acids in pharmaceuticals after pre-column derivatization with phanquinone[J].J Pharm Biomed,2004,35(2):339-348.
[56] GATTI R,GIOIA M G.Liquid chromatographic fluorescence determination of amino acids in plasma and urine after derivatization with phanquinone[J].Biomed Chromatogr,2008,22(2):207-213.
[57] COHEN S A,MICHAUD D P.Synthesis of a fluorescent derivatizing reagent,6-aminoquinolyl-N-hydroxysuccinimidyl car-bamate,and its application for the analysis of hydrolysate amino acids via high-performance liquid chromatography[J].Anal Biochem,1993,211(2):279-287.
[58] SHARMA G,ATTRI S V,BEHRA B,et al.Analysis of 26 amino acids in human plasma by HPLC using AQC as derivatizing agent and its application in metabolic laboratory[J].Amino Acids,2014,46(5):1253-1263.
[59] PAPPA-LOUISI A,NIKITAS P,AGRAFIOTOU P,et al.Optimization of separation and detection of 6-aminoquinolyl derivatives of amino acids by using reversed-phase liquid chromatography with on line UV,fluorescence and electrochemical detection[J].Anal Chim Acta,2007,593(1):92-97.
[60] WANG H,MCNEIL Y R,YEO T W,et al.Simultaneous determination of multiple amino acids in plasma in critical illness by high performance liquid chromatography with ultraviolet and fluorescence detection[J].J Chromatogr B,2013,940(6):53-58.
[61] BOONCHIANGMA S,RATCHAKRUT P,CHANTHAI S,et al.Reversed phase chromatographic analysis of 13 amino acids in honey samples[J].Chromatographia,2015,78(13/14):923-927.
[62] ZHOU W,ZHANGA X Y,DUANA G L.Liquid-chromatography quantitative analysis of 20 amino acids after derivatization with FMOC-Cl and its application to different origin radix isatidis[J].J Chin Chem Soc-Taip,2011,58(4):509-515.
[64] ELBASHIR A A,KRIEGER S,SCHMITZ O J.Simultaneous determination of polyamines and acetylpolyamines in human urine by capillary electrophoresis with fluorescence detection[J].Electrophoresis,2014,35(4):570-576.
[65] LORENZO M P,NAVARRETE A,BALDERAS C,et al.Optimization and validation of a CE-LIF method for amino acid determination in biological samples[J].J Pharm Biomed,2013,73(2):116-124.
[66] OMAR M M A,ELBASHIR A A,SCHMITZ O J.Capillary electrophoresis method with UV-detection for analysis of free amino acids concentrations in food[J].Food Chem,2017,214:300-307.
[67] CUI Y,JIANG Z,SUN J,et al.Enantiomeric purity determination of (L)-amino acids with pre-column derivatization and chiral stationary phase:development and validation of the method[J].Food Chem,2014,158:401-407.
[68] SONG Y,FUNATSU T,TSUNODA M.Amino acids analysis using a monolithic silica column after derivatization with 4-fluoro-7-nitro-2,1,3-benzoxadiazole (NBD-F)[J].J Chromatogr B,2011,879(5):335-340.
[69] FUJII Y.HPLC-UV analysis of pheroland chloropherol in water after precolumn derivatization with 4-fluoro-7-nitro-2,1,3-benzoxadiazole[J].J Liq Chromatogr R T,2009,32(16):2372-2383.
[70] SHIMBO K,YAHASHI A,HIRAYAMA K,et al.Multifunctional and highly sensitive precolumn reagents for amino acids in liquid chromatography/tandem mass spectrometry[J].Anal Chem,2009,81(13):5172-5179.
[71] INAGAKI S,TANO Y,YAMAKATA Y,et al.Highly sensitive and positively charged precolumn derivatization reagent for amines and amino acids in liquid chromatography/electrospray ionization tandem mass spectrometry[J].Rapid Commun Mass Sp,2010,24(9):1358-1364.
[72] REBANE R,OLDEKOP M L,HERODES K.Comparison of amino acid derivatization reagents for LC-ESI-MS analysis.Introducing a novel phosphazene-based derivatization reagent[J].J Chromatogr B,2012,904:99-106.
