HPV E6/E7 mRNA检测对宫颈锥切术后ASC-US患者分流诊断的价值
2018-05-11张飞芳叶丽燕
张飞芳 叶丽燕
宫颈癌是最常见的妇科恶性肿瘤,发病率居所有恶性肿瘤的第4位[1]。据WHO统计,2008年中国约有75 000例新发病例,约33 000例死于宫颈癌[2]。宫颈上皮内瘤变(CIN)是与宫颈癌发生、发展密切相关的一组癌前病变。近年来随着宫颈癌筛查方式的发展以及人们对宫颈癌预防意识的普遍增强,高级别CIN(Ⅱ、Ⅲ级)和早期宫颈癌检出率不断增加。目前,宫颈锥切术是高级别CIN的主要诊疗手段,但术后仍存在5%~25%[3]的复发率及病灶残留率,发展为宫颈癌的概率约为正常人的4~5倍[4]。不能明确意义的非典型鳞状上皮细胞(ASC-US)是宫颈锥切术后宫颈残端常见的细胞学异常结果,有进一步发展为高级别CIN甚至宫颈癌的可能。对宫颈残端ASC-US患者的分流处理是宫颈锥切术后随访处理中的争论点。现对本院160例有完整随访临床资料,并于宫颈锥切术后随访中宫颈残端细胞学检测结果为ASC-US的患者进行回顾性分析,探讨人乳头瘤病毒(HPV)E6/E7 mRNA检测在宫颈锥切术后宫颈残端ASC-US患者分流中的诊断价值。
1 对象和方法
1.1 对象 从2013年4月至2016年10月在本院妇产科行宫颈锥切术并经组织病理学确诊为CINⅡ、Ⅲ级的4 832例患者中选取术后3、6、12、18和24个月随访门诊复查液基细胞学技术(thinprep cytologic test,TCT)、高危型 HPV(HR-HPV)DNA、HPV mRNA E6/E7,且随访中细胞学检查结果为ASC-US并行阴道镜检查及宫颈活检的患者 160 例,年龄 23~64(41.3±7.5)岁。纳入标准:(1)已婚非妊娠妇女;(2)年龄 21~70 岁;(3)无内科免疫系统疾病及使用相关药物史;(4)无全子宫切除史,无化疗及盆腔放疗史;(5)初次锥切切缘阴性,术后病理结果无升级;(6)临床随访资料完整。本研究经医院伦理委员会批准和患者知情同意。
1.2 方法
1.2.1 TCT检测 月经干净3d后采集标本,使用TCT检测专用刷插入患者宫颈管旋转5周,停留10s,收集宫颈口及宫颈管脱落的上皮细胞,将刷头置入装有CytoRich细胞保存液的收集瓶中待检。采用广州安必平公司生产的TCT系统,全自动染色。按照2001年伯塞斯达系统(the Bethesda system,TBS)标准诊断为 ASC-US。
1.2.2 HR-HPV DNA检测 月经干净后采样,采集标本前3d内禁止性生活。专门的HPV DNA取样刷采集宫颈分泌物,应用PCR反向点杂交技术检测HR-HPV DNA,包括 HPV 16、18、31、33、35、39、45、S1、52、56、58、59、66、68、73。严格按照HPV基因检测试剂盒(深圳亚能生物技术有限公司)说明书操作,1种HR-HPV阳性即为阳性。
1.2.3 HPV E6/E7 mRNA拷贝数测定 使用专用刷在宫颈外口逆时针旋转5周,停留10s,将得到的标本置
于标本保存管中。采用HPV E6/E7 mRNA检测试剂盒和QuantiVirusTM冷光仪(均由郑州科蒂亚生物技术公司生产),结果经电脑软件换算为拷贝数,以HPV E6/E7 mRNA拷贝数<1copy/ml为阴性,≥1copy/ml为阳性。严格按照试剂盒说明进行操作。
1.2.4 阴道镜检查及宫颈活检 由本院专职阴道镜医师用电子阴道镜观察,并于醋酸白试验和碘试验异常区行选择性多点组织活检或取宫颈3、6、9、12点行常规活检,必要时加行宫颈管搔刮。病理报告方式:宫颈正常或炎症、CINⅠ级、CINⅡ级、CINⅢ级和宫颈癌。病理诊断为金标准,以CINⅡ+级(包括CINⅡ级、CINⅢ级和宫颈癌)和CINⅢ+级(包括CINⅢ级和宫颈癌)为研究终点,以CINⅡ-级(包括正常/炎症和CINⅠ级)和CINⅢ-级(包括正常/炎症、CINⅠ级和CINⅡ级)为对照组。
1.2.5 诊断标准 术后3~6个月内复查仍有CIN病变者为病变残留;术后6个月内未发现CIN病变,但6个月后再次发现病变者,判定为CIN病变复发。
1.3 统计学处理 采用SPSS 22.0统计软件。非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Kruskal-Wallis H检验;计数资料组间比较采用χ2检验。以组织病理诊断结果为标准,分别计算HR-HPV DNA检测与HPV E6/E7 mRNA检测两种随访方法的灵敏度、特异度、阳性预测值、阴性预测值及诊断正确率。相关性分析采用Spearman等级相关。P<0.05为差异有统计学意义。
2 结果
2.1 HPV E6/E7 mRNA、HR-HPV DNA检测结果与病理诊断(金标准)比较 160例宫颈锥切术后残端ASCUS患者中,HPV E6/E7 mRNA检测阳性52例,阳性率为32.5%,其中有45例(86.5%)残留/复发;HR-HPV DNA检测阳性98例,阳性率为61.3%,其中67例(68.4%)残留/复发;HPV E6/E7 mRNA检测阳性率低于HR-HPV DNA检测阳性率,差异有统计学意义(P<0.01)。CINⅡ-级HR-HPV DNA检测阳性率明显高于HPV E6/E7 mRNA检测阳性率,差异有统计学意义(P<0.01);但 CINⅡ+级 HR-HPV DNA 与 HPV E6/E7 mRNA检测阳性率比较差异无统计学意义(P>0.05);CINⅡ+级与CINⅢ+级的HPV E6/E7 mRNA检测阳性率比较差异无统计学意义 (P>0.05);CINⅡ+级和CINⅢ+级的HPV E6/E7 mRNA检测阳性率分别高于CINⅡ-级和CINⅢ-级,差异均有统计学意义(均P<0.05)。病理检查结果与HPV E6/E7 mRNA、HR-HPV DNA检测结果见表1。
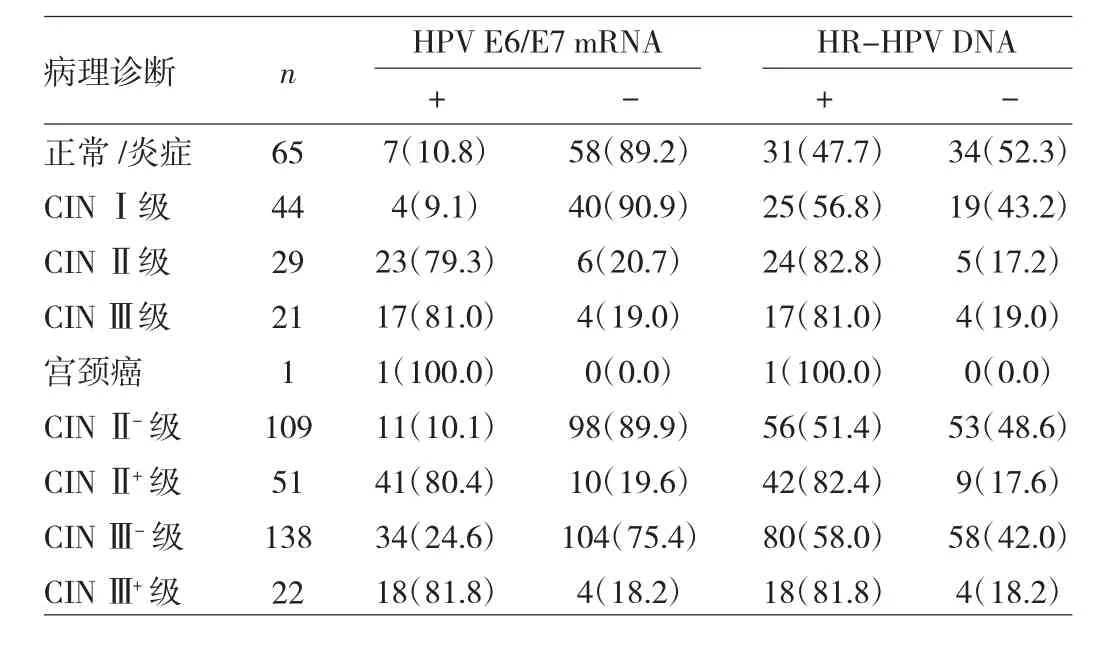
表1 HPV E6/E7 mRNA、HR-HPV DNA检测结果与病理诊断(金标准)比较[例(%)]
2.2HPV E6/E7 mRNA和HR-HPV DNA检测对CINⅡ+级病灶残留/复发的诊断价值 HPV E6/E7 mRNA检测的特异度、阳性预测值和诊断正确率均高于HR-HPV DNA检测,差异均有统计学意义(均P<0.05);而两种方法灵敏度和阴性预测值比较差异均无统计学意义(均P >0.05),见表 2。
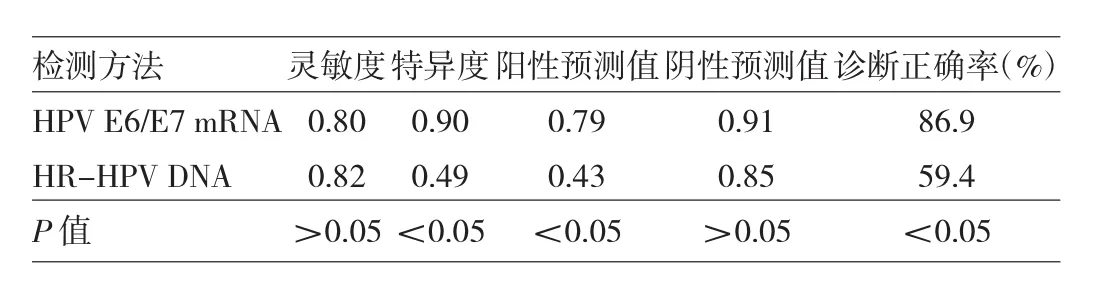
表2 HPV E6/E7 mRNA和HR-HPV DNA检测对CINⅡ+级病灶残留/复发的诊断价值
2.3 不同级别宫颈病变患者HPV E6/E7 mRNA拷贝数比较 不同级别宫颈病变患者HPV E6/E7 mRNA拷贝数比较差异有统计学意义(P<0.01)。另有宫颈癌1例,其HPV E6/E7 mRNA拷贝数为38 935.28copies/ml。宫颈病变级别高的患者HPV E6/E7 mRNA拷贝数明显增加,两者呈正相关(r=0.658,P<0.01),见表 3。
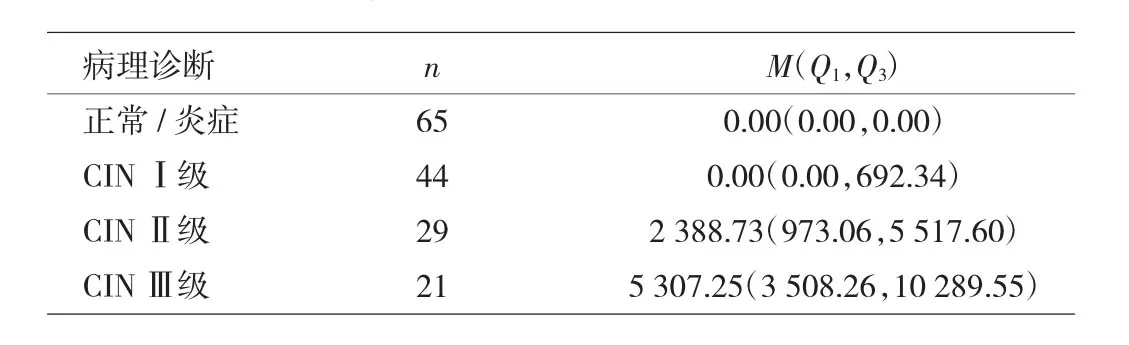
表3 不同级别宫颈病变HPVE6/E7mRNA拷贝数比较(copies/ml)
3 讨论
高级别CIN病灶具有多发、不连续的特点,患者经宫颈锥切术治疗后进展为宫颈浸润癌的概率较未经治疗者显著降低,但仍高于普通人群。病变残留/复发与HR-HPV 感染[5-6]、锥切术切缘阳性[7-8]、多项限受累[9]、年龄[6,10]等因素相关。其中,术后6个月内HPV阳性是预测复发最重要的因素[5]。
ASC-US是宫颈锥切术后常见的细胞学异常结果,ASC-US可能是锥切术后细胞增生活跃的良性改变,也可能是进展为浸润癌的恶性改变。因此,宫颈锥切术后ASC-US的分流管理一直是临床工作中的难点与争论点。2012年美国阴道镜检查与子宫颈病理学会(ASCCP)发布异常宫颈癌筛查和癌前病变的管理指南中指出[11],CINⅡ/Ⅲ级患者宫颈锥切术后随访应在术后12和24个月行细胞学检测及HPV联合检测,若联合检测皆为阴性,则36个月再次行联合检测,若任意一次结果出现异常,则推荐行阴道镜检查及宫颈组织活检。若所有结果未见异常,则按常规筛查20年,即使超过65岁。国内宫颈癌及癌前病变规范化诊疗指南提出CIN患者应每3~6个月行细胞学检查随,连续3次正常可改为一年一次[12]。2016年美国妇产科医师学会(ACOG)宫颈癌筛查指南则指出既往CINⅡ/Ⅲ级治疗后患者需比常规筛查更频繁的筛查[13],均未详细提及术后残端ASC-US患者的管理。宫颈锥切术后存在病灶复发/残留的概率,可能与HR-HPV活化及持续感染、病灶不连续、宫颈管深处存在病灶有关。本研究纳入患者均为切缘阴性患者,术后残端ASC-US患者发生病灶残留/复发的概率为31.9%(51/160),较以往报道高,这与研究对象选择不同有关,也提示残端ASC-US患者需要更为严密的监测。
目前国内联合筛查方式主要为TCT联合HR-HPV DNA检测。HR-HPV DNA检测能判断HPV感染状态,但无法检测病毒的活跃程度,无法准确评估病情进展。环形HPV基因线性随机整合到宿主染色体后发生E6、E7基因非抑制性转录,其转录产物E6/E7 mRNA翻译产生E6、E7癌蛋白,干扰2个关键性肿瘤抑制蛋白p53、pRB的功能并加速其降解,使感染细胞易于出现细胞周期失控、细胞增生及DNA突变累积而发生恶性转化[14-15]。因此,目前认为HPV E6/E7 mRNA可反映与宿主细胞整合的HPV的活跃程度,可用于评估病情进展。一项纳入8项研究的荟萃分析结果显示[16]:在TCT结果为ASC-US及低度鳞状上皮内病变(LSIL),并最终病理结果为CINⅡ+级的患者中,HPV E6/E7 mRNA与HRHPV DNA相比较,两者灵敏度相似,但HPV E6/E7 mRNA有更高的特异度。本研究对高级别CIN术后随访为 ASC-US的160例患者分析显示:HPV E6/E7 mRNA检测与HR-HPV DNA检测CINⅡ+级比较,HPV E6/E7 mRNA检测特异度及阳性预测值分别为0.90、0.79,均明显高于HR-HPV DNA检测的0.49、0.43,但两者灵敏度及阴性预测值比较差异无统计学意义,与此项荟萃分析结果一致。在一项针对中国人群的研究中也得到了同样的结论[17]。相对于HR-HPV DNA检测,HPV E6/E7 mRNA检测作为分流指标,可降低阴道镜转诊率,避免过多随访、过度检查及治疗,减少了医疗资源浪费和患者心理负担。
本研究中宫颈锥切术后ASC-US患者CINⅡ+级和CINⅢ+级的HPV E6/E7 mRNA阳性率分别明显高于CINⅡ-级和CINⅢ-级,表明随着宫颈病变进展,HPV E6/E7 mRNA检出率增加。且宫颈病变级别高的患者HPV E6/E7 mRNA拷贝数明显增加,两者呈正相关,提示HPV E6/E7 mRNA拷贝数可在一定程度上提示患者的宫颈病变组织学改变,这与报道的HPV E6/E7 mRNA用于宫颈癌筛查的结果相一致[18-19]。
综上所述,HPV E6/E7 mRNA检测作为宫颈锥切术后ASC-US患者的分流指标,相比HR-HPV DNA检测具有高特异度,可以很好地预测术后病灶残留/复发的风险,能减少阴道镜转诊率的同时不降低高级别宫颈病变的检出率,可以更精确地选择高危人群,且可在一定程度上评估病变严重程度,具有较大的临床应用前景,但仍需更多多中心、大样本的实验数据的支持。
[1]Zhang Q,Pan E,He Y,et al.Analyses on cancer incidence and mortality in Huai'an area,China,2010[J].Open J Prev Med,2014,4(6):504-512.doi:10.4236/ojpm.2014.46059.
[2]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CACancerJ Clin,2016,66(2):115-132.doi:10.3322/caac.21338.
[3]TornA,FustP,Rodrguez-Carunchio L,et al.Intraoperative post-conization human papillomavirus testing for early detection of treatment failure in patients with cervical intraepithelial neoplasia:a pilot study[J].BJOG,2013,120(4):392-399.doi:10.1111/1471-0528.12072.
[4]Lili E,Chatzistamatiou K,Kalpaktsidou-Vakiani A,et al.Low recurrence rate of high-grade cervical intraepithelial neoplasia after successful excision and routine colposcopy during follow-up[J].Medicine(Baltimore),2018,97(4):e9719.doi:10.1097/MD.0000000000009719.
[5]Leguevaque P,Motton S,Decharme A,et al.Predictors of recurrence in high-grade cervical lesions and a plan of management[J].Eur J Surg Oncol,2010,36(11):1073-1079.doi:10.1016/j.ejso.2010.08.135.
[6]刘莉,陈丽梅,陶祥,等.1502例子宫颈HSIL患者行LEEP锥切术后随访半年的临床结局及术后病灶残留的危险因素分析[J].中华妇产科杂志,2017,52(11):751-756.doi:10.3760/cma.j.issn.0529-567X.2017.11.007.
[7]Shaco-Levy R,Eger G,Dreiher J,et al.Positive margin status in uterine cervix cone specimens is associated with persistent/recurrent high-grade dysplasia[J].Int J GynecolPathol,2014,33(1):83-88.doi:10.1097/PGP.0b013e3182763158.
[8]Sand FL,Frederiksen K,Munk C,et al.Long-term risk of cervical cancer following conization of cervical intraepithelial neoplasia grade 3-ADanish nationwide cohort study[J].Int J Cancer,2017.doi:10.1002/ijc.31202.[Epub ahead ofprint]
[9]Guducu N,Sidar G,Bassullu N,et al.Endocervical glandular involvement,multicentricity,and extent of the disease are features of high-grade cervicalintraepithelialneoplasia[J].Ann Diagn Pathol,2013,17(4):345-346.doi:10.1016/j.anndiagpath.2013.04.002.
[10]Simes RB,Campaner AB.Post-cervicalconization outcomes in patients with high-grade intraepithelial lesions[J].APMIS,2013,121(12):1153-1161.doi:10.1111/apm.12064.
[11]Massad LS,Einstein MH,Huh WK,et al.2012 updated consensus guidelines for the management of abnormal cervical cancer screening tests and cancer precursors[J].Obstet Gynecol,2013,121(4):829-846.doi:10.1097/AOG.0b013e3182883a34.
[12]中华人民共和国国家卫生和计划生育委员会.宫颈癌及癌前病变规范化诊疗指南(试行)[J].中国医学前沿杂志(电子版),2013,5(8):40-49.doi:10.3969/j.issn.1674-7372.2013.08.010.
[13]Chelmow D.Cervicalcancer screening and prevention[J].Obstet Gynecol,2016,127(1):1-20.doi:10.1097/AOG.0000000000001263.
[14]Ren C,Zhu Y,Yang L,et al.Diagnostic performance of HPVE6/E7 mRNA assay for detection of cervical high-grade intraepithelial neoplasia and cancer among women with ASCUS Papanicolaou smears[J].Arch Gynecol Obstet,2018,297(2):425-432.doi:10.1007/s00404-017-4588-1.
[15]Doorbar J,Quint W,Banks L,et al.The biology and lift-cycle of human papillomaviruses[J].Vaccine,2012,20(30 Suppl 5):F55-70.doi:10.1016/j.vaccine.2012.06.083.
[16]Arbyn M,Roelens J,CuschieriK,et al.The APTIMA HPVassay versus the Hybrid Capture 2 test in triage ofwomen with ASC-US or LSIL cervical cytology:A meta-analysis of the diagnostic accuracy[J].Int J Cancer,2013,132(1):101-108.doi:10.1002/ijc.27636.
[17]Wang HY,Lee D,Park S,et al.Diagnostic performance of HPV E6/E7 mRNA and HPV DNA assays for the detection and screening of oncogenic human papillomavirus infection among woman with cervical lesions in China[J].Asian Pac J Cancer Prev,2015,16(17):7633-7640.
[18]Qiu C,ZhiY,Shen Y,et al.Performance of the HPV-16 L1 methylation assay and HPVE6/E7 mRNA test for the detection of squamous intraepithelial lesions in cervical cytological samples[J].J VirolMethods,2015,224:35-41.doi:10.1016/j.jviromet.2015.08.008.
[19]Gage JC,KatkiHA,Schiffman M,et al.The low risk of precancer after a screening result of human papillomavirus-negative/atypical squamous cells of undetermined significance papanicolaou and implications for clinical management[J].Cancer Cytopathol,2014,122(11):842-850.doi:10.1002/cncy.21463.
