Th17细胞在过敏性哮喘发病中的作用及其与Notch信号通路的关系
2018-05-11盛安群钱燕李昌崇张雪雅翁翠叶张维溪
盛安群 钱燕 李昌崇 张雪雅 翁翠叶 张维溪
支气管哮喘(简称哮喘)是儿童最常见的慢性呼吸道疾病之一,目前世界各国哮喘发病率呈明显上升趋势。第三次中国城市儿童哮喘流行病学调查亦显示,我国儿童哮喘患病率由1990年的1.09%上升到2010年的3.02%,其中过敏是哮喘发病的重要原因[1]。既往研究发现辅助性T细胞(Th)1、Th2在过敏性哮喘发病中起着重要作用,而近年来研究发现Th17在过敏性哮喘中发挥重要作用[2]。已有研究表明Notch信号通路在T细胞的分化和活化中发挥重要作用[3]。因此,本研究通过检测过敏性哮喘患儿外周血中Th17细胞比例和Notch1、Notch4、维甲酸相关孤儿核受体(RORγt)mRNA表达情况,分析它们之间的相关性,明确Th17在过敏性哮喘发病中的作用及与Notch信号通路的关系,以进一步阐明过敏性哮喘的发病机制。
1 对象和方法
1.1 对象 选择2016年1月至2017年2月就诊于温州医科大学附属第一医院、温州医科大学附属第二医院专科门诊及住院过敏性哮喘患儿40例(哮喘组),男18例,女22例;中位年龄7岁。儿童哮喘诊断均按照中华医学会儿科学分会呼吸学组制定的《儿童支气管哮喘诊断与防治指南》诊断标准[4]。选择同期在温州医科大学附属第一医院、温州医科大学附属第二医院体检儿童40例作为健康对照组,男17例,女23例;中位年龄7.5岁;无过敏性疾病或其他慢性病史,1周内无急性感染,无长期用药史。入选儿童均检测血总免疫球蛋白E(IgE)。两组儿童性别和年龄比较差异均无统计学意义(均P>0.05);哮喘组嗜酸性粒细胞和血总IgE均明显高于健康对照组,差异均有统计学意义(均P<0.05),见表1。本研究通过温州医科大学附属第一医院伦理委员会、温州医科大学附属第二医院伦理委员会批准和患儿家属知情同意。
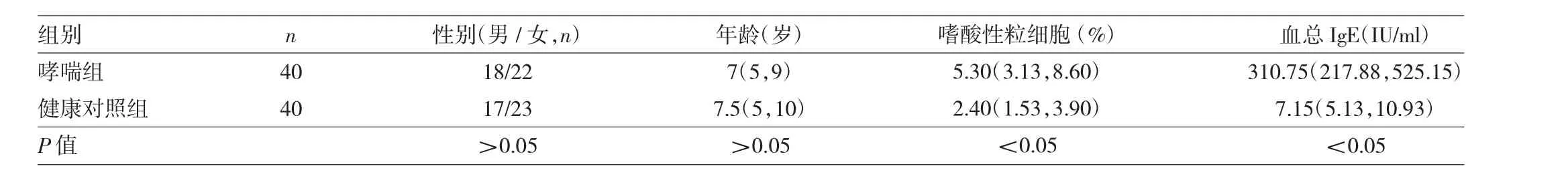
表1 两组儿童基本资料比较
1.2 方法
1.2.1 主要试剂 人淋巴细胞分离液购自荷兰Cedarlane公司,人溶血素购自北京索莱宝科技有限公司,佛波酯、莫能霉素、离子霉素均购自美国Sigma公司,藻红蛋白(PE)标记的抗人IL-17A抗体、IL-17的固定破膜剂均购自美国BD公司,人IL-17 ELISA试剂盒购自美国eBscience公司,引物序列由上海基康生物有限公司合成。
1.2.2 外周血Th17细胞比例检测 Th17细胞以不同荧光标记的CD4抗体及IL-17A抗体标记后,通过流式细胞仪器检测其在淋巴细胞中的比例。取250μl全血,用不含胎牛血清的RPMI164培养液1∶1等体积稀释到500μl,在稀释好的全血中加入50ng/ml的刺激剂佛波酯/离子霉素和 1μg/ml的转运抑制剂布雷非德菌素A/莫能霉素,在37℃,5%CO2浓度的培养箱中培养4~6h后,实验管加入异硫氰酸荧光素(FITC)标记的CD4抗体,对照管加入相应的同型对照抗体,避光孵育30min,加入500μl固定破膜剂,充分混匀,避光孵育30min。重悬细胞,实验管加入PE标记的IL-17A抗体,对照管加入相应的同型对照抗体,避光孵育30min,上机检测。
1.2.3 外周血单个核细胞Notch1、Notch4、RORγt mRNA表达水平检测 采用实时荧光定量聚合酶链反应(qRT-PCR)检测相对表达量。Ficoll密度分离法分离外周血单个核细胞,参照Trizol说明书提取总RNA,逆转录合成cDNA,按照上游引物、下游引物、SYBR Green、Water nuclease-free反应体系进行qRT-PCR检测,目的基因及内参的引物序列如下:GAPDH引物序列:上游引物 5′-TGGGTGGCAGTGATGGCA-3′,下游引物 5′-GGAGAAGGCTGGGGCTCAT-3′;Notch1引物序列:上游引物 5′-GCAGAACAACAGGGAGGAGA-3′,下游引物 5′-CGGTTGGCAAAGTGGTCC-3′;Notch4引物序列:上游引物5′-CTGCCCCGTGCTTCAAT-3′,下游引物5′-CAGGTTGCCCTATTCCTACAG-3′;RORγt引物序列:上游引物 5′-CAATGGAAGTGGTGCTGGTTAG-3′,下游引物 5′-TTAGGGAGTGGGAGAAGTCAAAG-3′。
1.2.4 血清IL-17水平检测 取哮喘组和健康对照组儿童外周血清1.5ml,采用ELISA法检测血清中IL-17水平,具体操作按试剂盒提供的说明书进行,每个样本和标准品均设3个复孔。
1.3 统计学处理 采用SPSS 17.0统计软件。正态分布的计量资料以表示,组间比较采用两独立样本t检验;非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验;计数资料组间比较采用χ2检验。两正态分布数据的相关性分析采用Pearson相关,两非正态分布数据的相关性分析采用Spearman秩相关。P<0.05为差异有统计学意义。
2 结果
2.1 两组儿童外周血Th17细胞比例比较 哮喘组Th17细胞比例为(1.50±0.30)%,显著高于健康对照组的(0.93±0.24)%,差异有统计学意义(P<0.01)。
2.2 两组儿童Notch1、Notch4、RORγt mRNA表达水平比较 哮喘组Notch1、RORγt mRNA表达水平均显著高于健康对照组(均P<0.01),而两组儿童Notch4 mRNA表达水平比较差异无统计学意义(P>0.05),见表2。

表2 两组儿童Notch1、Notch4、RORγt mRNA表达水平比较
2.3 两组儿童IL-17水平比较 哮喘组IL-17水平为2.68(2.05,3.19)pg/L,显著高于健康对照组的 2.20(1.89,2.72)pg/L,差异有统计学意义(P<0.05)。
2.4 Notch1 mRNA与各指标的相关性分析 哮喘组Notch1 mRNA表达水平与Th17细胞比例、RORγt mRNA表达水平、IL-17水平均呈正相关(r=0.780、0.555和0.636,均P<0.01)。
3 讨论
Th17是近年来发现的一类新的CD4+T细胞亚群,主要分泌IL-17A、IL-17F和IL-22等细胞因子,在炎症反应和过敏性疾病中发挥着重要作用,RORγt是其特异性的转录因子[5]。Peters等[6]研究发现致敏小鼠诱发的Th17细胞反应跟气道重塑相关。同时Newcomb等[7]研究发现哮喘患者的支气管肺泡灌洗液中Th17分泌因子表达明显增多,并且通过招募中性粒细胞、促进黏液细胞分化、促进平滑肌细胞增生参与哮喘发病。本研究亦发现哮喘组患儿Th17细胞比例、RORγt mRNA表达水平、IL-17水平均显著高于健康对照组,提示Th17细胞在过敏性哮喘患儿中发挥重要作用。
生命的过程是由遗传信息系统和细胞信号转导系统共同调控的。从信号通路入手,能更好地阐明调控哮喘的发病机制,将为哮喘的诊治提供新思路。Notch受体广泛存在于多种生物体内,Notch信号通路参与多种组织细胞的信号识别、增殖、分化和凋亡等功能,在细胞命运的决定中起重要作用[8-9]。本研究通过qRT-PCR法检测哮喘组患儿外周血单个核细胞中Notch受体的表达情况,发现哮喘组患儿Notch1 mRNA表达水平显著高于健康对照组,但两组Notch4 mRNA表达水平比较差异无统计学意义,提示外周血中Notch1受体参与过敏性哮喘发病,Notch4受体未参与过敏性哮喘发病。
近年研究表明Notch信号通路在T细胞的分化和活化中发挥着重要作用,与哮喘发病关系密切[10]。Amsen等[11]发现抗原刺激机体抗原提呈细胞(APC)表面Notch配体的不同表达,促进了不同淋巴细胞亚群的分化,Delta信号诱导Th1细胞分化,而Jagged信号则诱导Th2细胞分化。Keerthivasan等[12]诱导Notch1基因沉默后的老鼠和人的原始CD4+T淋巴细胞向Th17细胞分化发现,原始CD4+T淋巴细胞向Th17细胞分化的能力明显减弱。Jiao等[13]亦发现在类风湿关节炎细胞模型中,用DAPT(一种γ-促分泌酶抑制剂)作用于脾单个核细胞阻断Notch信号通路,可减少脾单个核细胞在Ⅱ型胶原蛋白刺激下产生Th1、Th17细胞的能力。本研究显示过敏性哮喘患儿Notch1 mRNA表达水平与Th17细胞比例呈正相关,说明Notch1与过敏性哮喘患儿Th17细胞具有密切的关系,Notch1可能通过促进过敏性哮喘患儿Th17细胞的表达参与哮喘的发病机制。T淋巴细胞亚群的分化依赖于相应的特定转录因子和不同细胞因子的作用。RORγt是Th17细胞的特异性转录因子,研究发现Notch1基因沉默后的原始CD4+T淋巴细胞在Th17诱导环境下,其RORγt mRNA表达水平明显降低[14]。IL-17可以促进支气管上皮细胞、支气管成纤维细胞等分泌IL-6、IL-8、IL-1β等炎症因子参与气道炎症反应,同时这些炎症因子可促进Th17细胞分化,从而形成正反馈,进一步促进Th17细胞的分化[15-16]。本研究亦发现Notch1 mRNA表达与RORγt mRNA表达水平和IL-17水平均呈正相关,提示Notch信号通路可能通过调节Th17细胞的特异性转录因子RORγt和主要炎症因子IL-17表达影响Th17的分化,从而参与过敏性哮喘的病理过程。
综上所述,Th17细胞在过敏性哮喘患儿体内发挥重要作用,Notch1受体通过影响Th17细胞表达参与过敏性哮喘患儿的发病机制。进一步深入开展Th17及Notch信号通路在过敏性哮喘患儿的作用研究,将成为哮喘治疗潜在的新靶点。
[1]全国儿科哮喘协作组,中国疾病预防控制中心环境与健康相关产品安全所.第三次中国城市儿童哮喘流行病学调查[J].中华儿科杂志,2013,51(10):729-735.doi:10.3760/cma.j.issn.0578-1310.2013.10.003.
[2]Hoe E,AndersonJ,NathanielszJ,etal.The contrasting roles ofT-h17 immunityinhumanhealthand disease[J].MicrobiolImmunol,2017,61(2):49-56.doi:10.1111/1348-0421.12471.
[3]Radtke F,Macdonald HR,Tacchini-Cottier F.Regulation of innate and adaptive immunity by Notch[J].Nat Rev Immunol,2013,13(6):427-437.doi:10.1038/nri3445.
[4]中华医学会儿科学分会呼吸学组,编辑委员会中华儿科杂志.儿童支气管哮喘诊断与防治指南(2016年版)[J].中华儿科杂志,2016,54(3):167-181.doi:10.3760/cma.j.issn.0578-1310.2016.03.003.
[5]Patel DD,Kuchroo VK.Th17 Cell Pathway in Human Immunity:Lessons from genetics and therapeutic interventions[J].Immunity,2015,43(6):1040-1051.doi:10.1016/j.immuni.2015.12.003.
[6]Peters M,Kohler-Bachmann S,Lenz-Habijan T,et al.Influence of an allergen-specific Th17 response on remodeling of the airways[J].Am J Respir Cell Mol Biol,2016,54(3):350-358.doi:10.1165/rcmb.2014-0429OC.
[7]Newcomb DC,Jr Peebles RS.Th17-mediated inflammation in asthma[J].Curr Opin Immunol,2013,25(6):755-760.doi:10.1016/j.coi.2013.08.002.
[8]Ray LB.Tugging on Notch receptor tunes signaling[J].Science,2017,355(6331):1277-1279.doi:10.1126/science.355.6331.1277-s.
[9]陈微,曹毅,杨晓红.紫草素对HaCaT细胞Notch-1信号通路的调节作用[J].浙江医学,2017,39(3):156-159.
[10]Koyanagi A,Sekine C,Yagita H.Expression of Notch receptors and ligands on immature and mature T cells[J].Biochem Biophys Res Commun,2012,418(4):799-805.doi:10.1016/j.bbrc.2012.01.106.
[11]Amsen D,Blander JM,Lee GR,et al.Instruction of distinct CD4 Thelper cellfates by different notch ligands on antigen-presenting cells[J].Cell,2004,117(4):515-526.
[12]Keerthivasan S,Suleiman R,Lawlor R,et al.Notch signaling regulates mouse and human Th17 differentiation[J].J Immunol,2011,187(2):692-701.doi:10.4049/jimmunol.1003658.
[13]Jiao Z,Wang W,Xu H,et al.Engagement of activated Notch signalling in collagen II-specific T helper type 1(Th1)-and Th17-type expansion involving Notch3 and Delta-like1[J].Clin Exp Immunol,2011,164(1):66-71.doi:10.1111/j.1365-2249.2010.04310.x.
[14]Binger KJ,Corte-RealBF,Kleinewietfeld M.Immunometabolic regulation of interleukin-17-Producing T helper cells:uncoupling new targets for autoimmunity[J].Front Immunol,2017,8:311.doi:10.3389/fimmu.2017.00311.
[15]Kuwabara T,Ishikawa F,Kondo M,et al.The Role of IL-17 and Related cytokines in inflammatory autoimmune diseases[J].Mediators Inflamm,2017,2017:3908061.doi:10.1155/2017/3908061.
[16]Kim BS,Park YJ,Chung Y.Targeting IL-17 in autoimmunity and inflammation[J].Arch Pharm Res,2016,39(11):1537-1547.doi:10.1007/s12272-016-0823-8.
