8株鸭疫里默氏杆菌安徽分离株的生物学特性分析
2018-04-25荆雅玮陈芳芳左佳坤胡剑刚石欣池米荣升陈兆国韩先干
荆雅玮,陈芳芳,左佳坤,胡剑刚,石欣池,米荣升,黄 燕,陈兆国,韩先干
(1. 中国农业科学院上海兽医研究所,上海 200241;2. 安徽农业大学动物科技学院,合肥230036)
鸭疫里默氏杆菌(Riemerellaanatipestifer,RA)感染引起鸭疫里默氏杆菌病,又称鸭传染性浆膜炎,是主要发生于鸭的一种慢性或急性高度接触传染病,特别是雏鸭的病死率较高。目前该病在世界各国养鸭地区均有流行,是鸭群中常见的细菌性病原[1]。
RA在自然界分布广泛,血清型众多,目前已确定的RA至少有21个血清型[2,3],并且不同血清型之间无交叉免疫保护作用。此外,由于临床抗菌药物的滥用,导致RA出现多重耐药[4],严重制约该病的防控[5,6]。
研究表明,RA的毒力因子、群体感应系统(quorum sensing)和生物被膜(biofilm)等对其生物学特性具有重要的调控作用。群体感应系统信号分子AI-2能影响RA的生物被膜形成[7]及其对Vero细胞的粘附[8,9],TonB和ompA影响RA的致病性[10]。与禽致病性大肠杆菌和沙门菌等禽的致病菌研究相比,RA的相关研究亟需加强。因此开展RA分子流行病学研究及致病机制的研究,为该病的防控提供技术支撑。
本实验室2017年从安徽不同养殖场的送检病鸭中分离8株RA。本研究对这8株分离株开展了血清型、抗菌药物敏感性和生物被膜形成等生物学特性研究,以期为安徽省鸭疫里默氏杆菌病的防控提供参考。
1 材料与方法
1.1 试剂 用于RA培养的TSB培养基购自美国BD公司;琼脂糖、2×TaqPCR Mix、DL2000 DNA Marker购自康为世纪生物科技有限公司;PrimeScript RT Reagent Kit(Perfect real time)购自宝生物工程(大连)有限公司;Trizol Regent 购自Life Technology公司;药敏纸片购自杭州微生物试剂有限公司和杭州滨和微生物试剂有限公司。
1.2 鸭疫里默氏杆菌的PCR鉴定及血清型鉴定 根据GenBank 中登录的RA16S rRNA和GroEL基因序列,利用 Primer Premier 5.0软件设计引物(表1),对从安徽省不同地区的3个养殖场送检的病死鸭的心脏、肝脏、脾脏等器官中分离的菌株进行PCR检测。

表1 引物序列表Table 1 Primer Sequences
将分离鉴定的RA菌株接种于TSB琼脂平板中(TSA),置于37℃、5%CO2恒温培养箱中培养,待长出单菌落之后,挑取单菌落接种于TSB液体培养基中,震荡培养12 h,培养后将菌液离心3次后,用PBS将菌体重悬,作为RA分离株玻片凝集抗原。取5 μL上述制备的RA凝集抗原分别和5 μL不同RA阳性血清在玻片上混匀,并分别以对应血清型的阳性菌株作为凝集反应阳性对照,以大肠杆菌和PBS作为凝集反应阴性对照和空白对照,鉴定RA血清型 。结果判定标准:凝集抗原与血清混合之后3 min内出现颗粒状凝集者为阳性(+),不出现颗粒状凝集者为阴性(-)。
1.3 鸭疫里默氏杆菌的药物敏感性检测 参照美国临床和实验室标准化研究所(CLSI)制定的抗菌药物敏感性试验执行标准,并参照临床常用的抗菌药物,选取24种抗菌药物(表2),将新鲜培养的菌液均匀涂布于TSB琼脂平板上,分别将各药敏纸片均匀贴于TSB琼脂平板上,将平板置于37℃、5%CO2恒温培养箱中过夜培养,观察并记录各抑菌圈直径大小。参照CLSI标准,判定被检细菌对每种药物的敏感性,分别为敏感(susceptible,S)、中敏(intermediate,I)和耐药(resistance,R)菌株。
1.4 鸭疫里默氏杆菌的生物被膜检测 参照文献[11]的方法,将8株RA分离株分别接种于TSB液体培养基中培养至OD600为1.0,用TSB按1∶10的比例进行稀释,在Corning的U型底96孔板中分别加入稀释好的菌液,每孔200 μL,每株菌设置8个重复,置于37℃、5%CO2恒温培养箱中分别静置培养36 h。用结晶紫染色法检测各株菌的生物被膜形成情况,具体方法:RA静置培养36 h时后弃孔内培养基,每孔加入200 μL无菌PBS,洗去游离的细菌,重复2次;自然晾干后,每孔加入200 μL 0.1%的结晶紫,室温染色30 min;弃去结晶紫,PBS洗3次,自然晾干后每孔加入200 μL的95%乙醇溶液,充分溶解后用酶标仪检测各孔的OD595值。参照文献[12]的方法,将RA的生物被膜形成能力分为4个等级:OD< ODC,为不形成生物被膜株(OD为被检测细菌的OD595,ODC为阴性对照的OD595);ODC<OD<2ODC,为弱生物被膜形成株;2ODC< OD<4ODC为中等生物被膜形成株;4 ODC< OD,为强生物被膜形成株。所有样品重复8次,取8次结果的平均值作为判定标准。
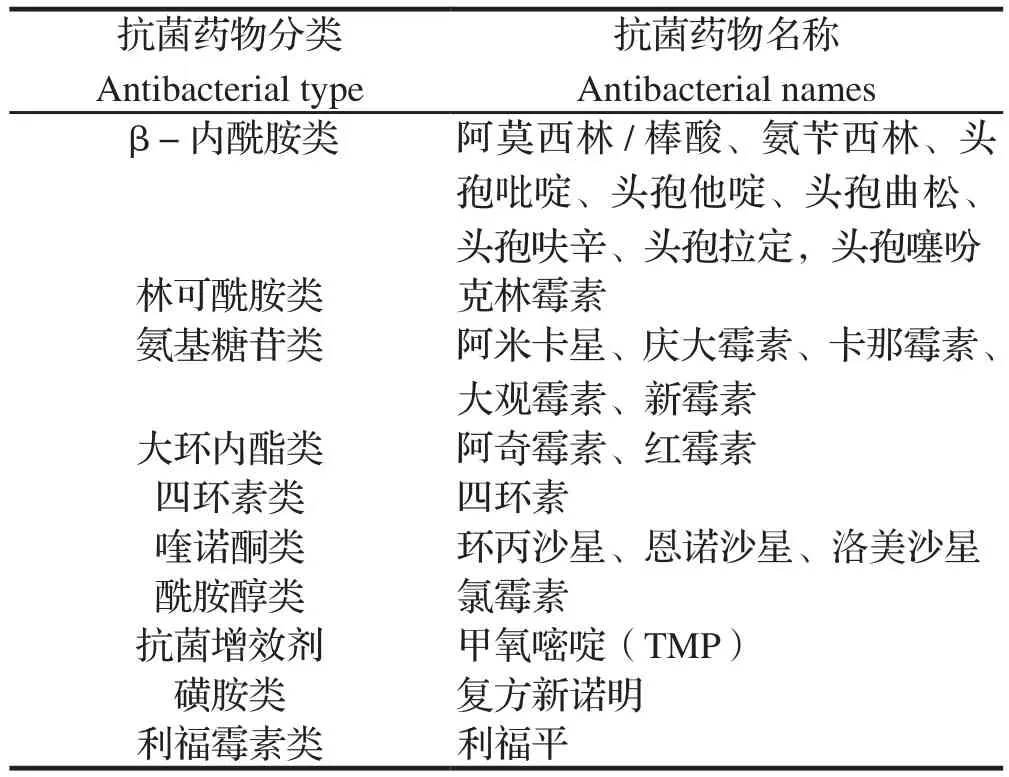
表2 抗菌药物Table 2 Antibacterials
1.5 鸭疫里默氏杆菌总RNA的提取及反转录 将培养至对数生长中期(OD600=1.0)的RA, 参照 Trizol法提取总RNA的方法,提取RA的总RNA,提取的总RNA通过NanoDrop ND-1000分光光度计测定其浓度及纯度。RNA样品经浓度和纯度检测后,采用PrimeScript RT Mster Mix 试剂盒反转录成cDNA。
1.6 real-time荧光定量 PCR检测不同RA菌株与生物被膜形成相关的基因转录情况 参照文献[13]的方法,选取5个显著影响RA生物被膜形成的基因,分别为Rien_0023、Rien_0186、Rien_1039、Rien_0339和Rien_1564。依据其基因序列,应用软件Primer primier 5.0 设计引物(表1),并由上海英潍捷基(英俊)贸易有限公司合成,采用 GoTaqqPCR Mster Mix试剂盒进行实时荧光定量PCR来检测不同生物被膜形成能力菌株间基因的转录水平。每个基因进行3次生物学重复,数据通过内参基因乳酸脱氢酶(L-lactate dehydrogenase gene,Idh)进行标准化,应用2-△△ct(Livak)法进行计算[8]。
2 结果
2.1 菌株分离鉴定结果及血清型鉴定结果 将分离到的疑似RA菌株,分别用16S rRNA和GroEL特异性引物进行PCR鉴定,结果表明,分离到的8株菌株均为鸭疫里默氏杆菌,分别命名为AH-1、AH-2、AH-3、AH-4、AH-5、AH-6、AH-8和AH-35,见图1。血清型鉴定结果表明,AH-4和AH-5为血清型15,AH-1、AH-2、AH-3、AH-6、AH-8和AH-35均为血清型10,见表3。
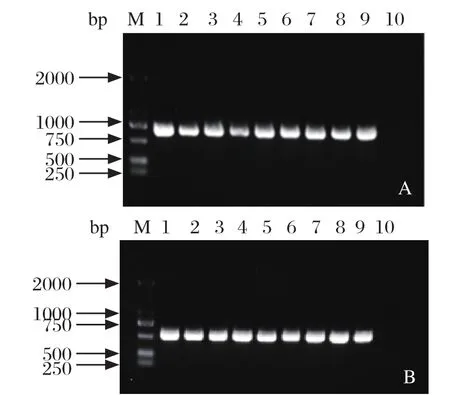
图1 RA 16S rRNA(A)和GroEL(B)基因PCR鉴定Fig 1 Identi fi cation of RA 16S rRNA(A) and GroEL(B)by PCR

表3 RA菌株血清型鉴定结果Table 3 The results of RA strains serotype detection
2.2RA菌株药物敏感性检测实验 对8株鸭疫里默氏杆菌的抗菌药物敏感性检测结果表明,AH-1对17种抗生素耐药, 而AH-35仅对7种抗生素耐药,见表4。8株菌对阿莫西林/棒酸均敏感;7株菌株对头孢吡啶和头孢他啶敏感;8株菌洛美沙星,阿奇霉素均耐药;除AH-1外的7菌株对8种抗生素均耐药,分别为克林霉素、甲氧嘧啶、红霉素、利福平、阿米卡星、四环素、洛美沙星和阿奇霉素,见表5。
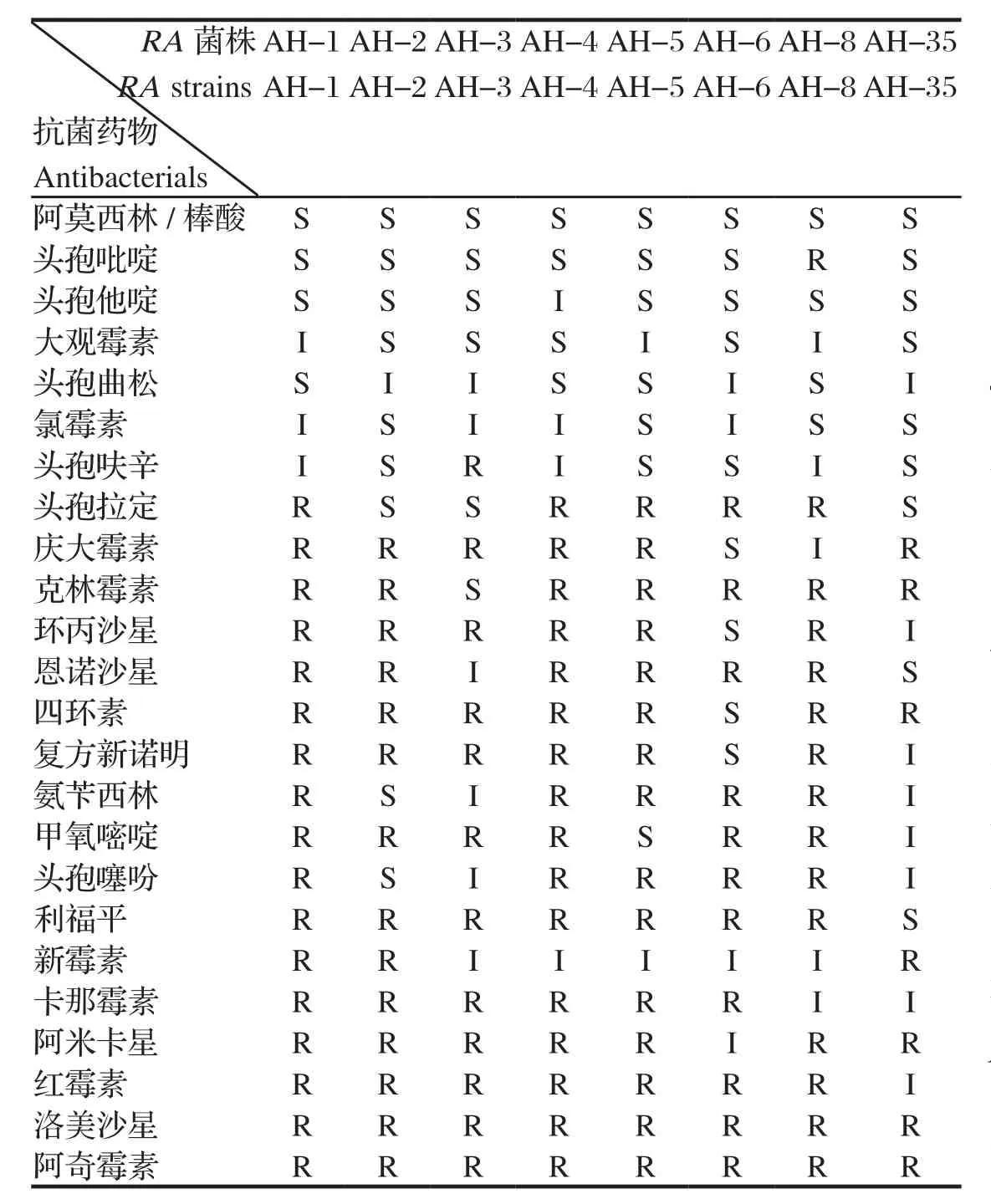
表4 8株RA的药敏结果Table 4 Drug susceptibilities results of 8 RA isolates
2.3RA菌株生物被膜形成能力检测 对8株菌株的生物被膜检测结果,见图2。结果显示,7株菌株(菌株AH-1、AH-2、AH-3、AH-4、AH-5、AH-6和AH-8)具有强生物被膜形成能力(4 ODC<OD),其中AH-1的形成能力最强;具有弱生物被膜形成能力的菌株有1株,为AH-35。AH-1与AH-35的生物被膜形成能力具有极显著统计学意义(p<0.0001)。
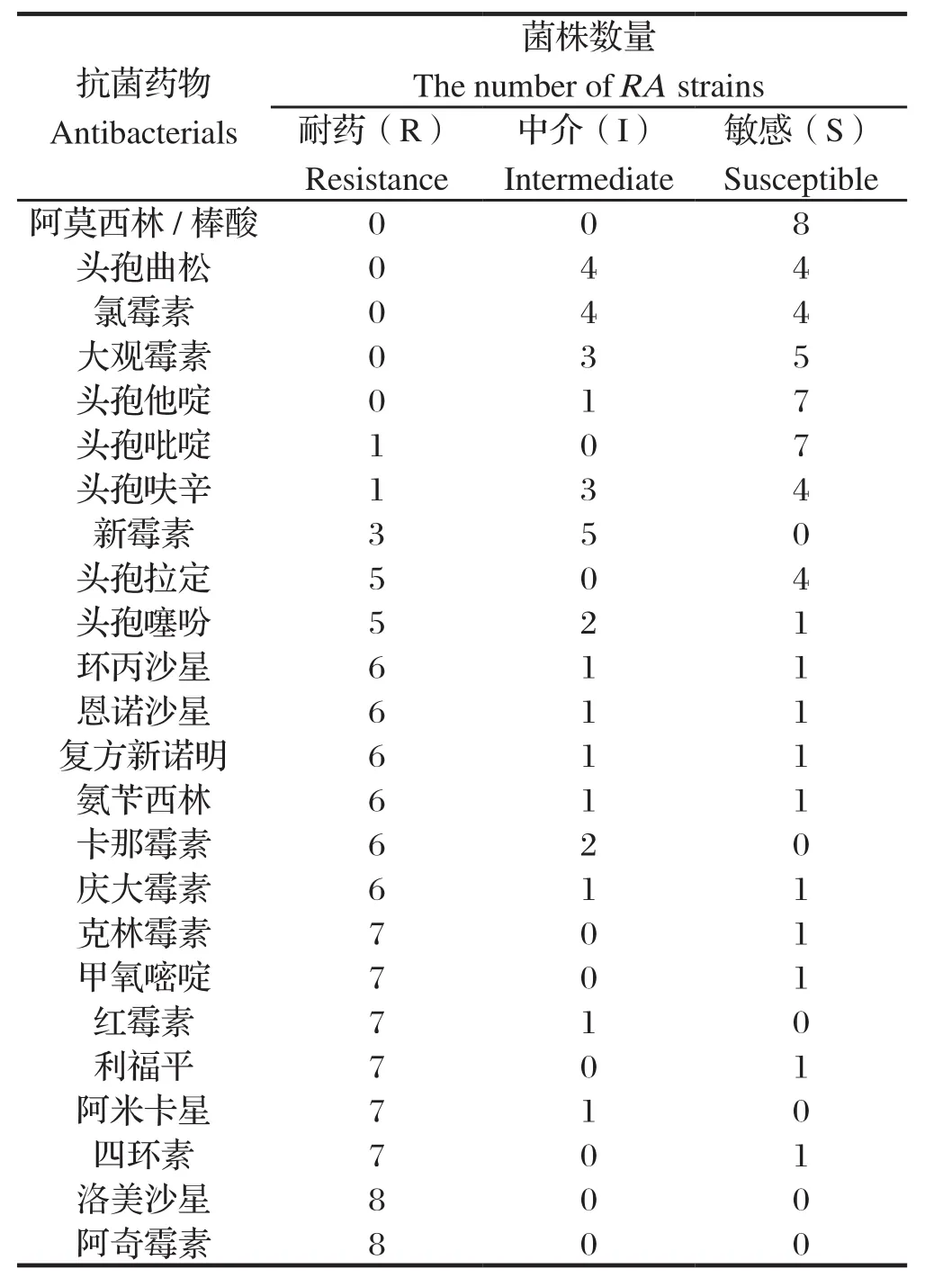
表5 RA菌株的耐药表型Table 5 The resitance-phenotype of RA strains
2.4 real-time荧光定量PCR检测结果 选取 5个显著影响RA生物被膜形成的基因,对菌株AH-1和AH-35中的生物被膜形成有关基因进行real-time荧光定量PCR检测,其结果见图3。结果显示,AH-1与AH-35菌株相比,除Riean_0186、Riean_0039的转录水平下调之外,Riean_0023、Riean_1039和Riean_1564基因的转录水平均显著上调(p<0.01)。
3 讨论
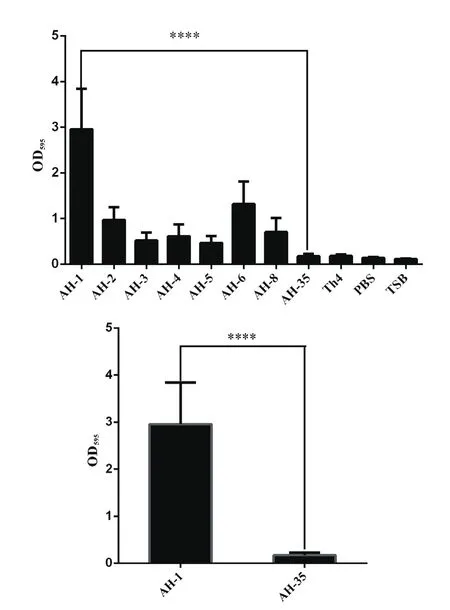
图2 不同菌株生物被膜形成检测结果Fig.2 Bio fi lm formation assay of different isolates
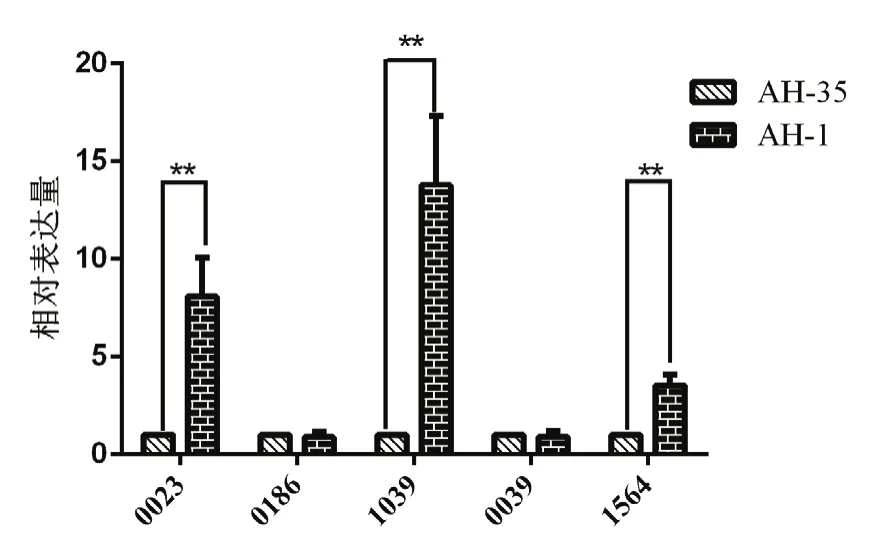
图3 生物被膜相关基因表达水平检测结果Fig 3 The transcriptional levels of selected genes in AH-1 and AH-35
鸭疫里默氏杆菌的血清型有21种,由于RA的血清型众多,并且不同血清型之间缺乏免疫交叉保护,从而严重制约该病的防控。研究表明,我国分离的RA血清型有18种,其中血清1、2、6、10型为优势血清型[14]。林树乾[15]和吉凤涛等[16]的研究表明,吉林省主要流行的RA血清型为1型和2型;袁小远等[17]对山东和河北地区的RA流行病学调查表明,血清1型为其主要流行血清型;程龙飞等[18]对福建省RA研究表明,血清2型和11型为优势血清型。而本研究在对8株RA安徽分离株血清型的鉴定结果表明,6株为血清10型,2株为血清15型,表明在我国不同地区鸭疫里默氏杆菌主要流行的血清型并不相同。因此各地在开展RA的防控时,应对该地区的优势血清型进行鉴定,选择相应血清型的疫苗进行防控。
在对鸭疫里默氏杆菌病的治疗中,抗菌药物的使用一直是重要措施,但由于抗生素的滥用,使得RA临床分离株的耐药性和交叉耐药性越来越强。陆新浩等[19]对宁波地区的RA进行抗菌药物检测,结果表明80%以上细菌对庆大霉素、阿米卡星、壮观霉素、复合磺胺耐药;李兆华[20]对山东省部分地区的菌株检测结果表明,19株鸭疫里默氏杆菌总体上对卡那霉素、丁胺卡那、青霉素、新霉素耐药。而本实验分离的8株菌株,分别对克林霉素、甲氧嘧啶、红霉素、利福平、阿米卡星、四环素、洛美沙星和阿奇霉素8种抗生素耐药。与上述结果有较大出入,表明不同地区的耐药性和交叉耐药性并不相同。因此在对RA的治疗中,应结合当地的耐药情况合理使用抗菌药物。
研究表明,Riean_0023(dhdps)基因是影响某些细菌赖氨酸生物合成的重要基因,在RA中,dhdps缺失导致其生物被膜形成能力[13]显著降低;而Riean_1039(ftsQ)基因则通过影响细胞质膜蛋白的形成从而影响到细胞的分裂,进而影响生物被膜的形成。本实验结果显示,与弱生物被膜形成株AH-35相比,强生物被膜形成株AH-1的Riean_0023、Riean_1039和Riean_1564基因的表达水平均显著上调(p<0.01),表明上述3个基因能够对RA的生物被膜的形成具有调控作用。研究表明,细菌的耐药性与生物被膜的形成有关,本研究结果表明,强生物被膜形成株AH-1对17种抗菌药物耐药;而弱生物被膜形成株AH-35仅对7种抗菌药物耐药,表明在RA中,生物被膜形成能力强的菌株,对抗菌药物耐药性也显著增强,表明RA生物被膜的形成与其耐药性具有一定的相关性[21]。
[1] 查湖生, 聂睿, 孙志辉, 等. 雏番鸭鸭疫里默氏杆菌病的病原鉴定与耐药性分析[J]. 中国家禽, 2014, 36(3): 49-51.
[2] Loh H, Teo T P, Tan H C. Serotypes of 'Pasteurella'anatipestifer isolates from ducks in Singapore: a proposal of new serotypes[J]. Avian Pathol, 1992, 21(3): 453-459.
[3] Pathanasophon P, Phuektes P, Tanticharoenyos T,et al. A potential new serotype ofRiemerella anatipestiferisolated from ducks in Thailand[J]. Avian Pathol, 2002, 31(3):267-270.
[4] 陆新浩, 陈秋英, 诸明涛, 等. 鸭疫里默氏杆菌病病原分离及耐药性调查[J]. 中国家禽, 2010, 32(17): 50-51.
[5] Liu H, Wang X, Ding C,et al. Development and evaluation of a trivalentRiemerella anatipestiferinactivated vaccine[J]. Clin Vaccine Immunol, 2013,20(5): 691-697.
[6] 骆延波, 李兰波, 贾纪美, 等. 山东省肉鸭鸭疫里默氏杆菌流行病学调查及耐药性分析[J]. 中国家禽, 2015,37(21): 79-82.
[7] Han X, Liu L, Fan G,et al.Riemerella anatipestiferlacks luxS, but can uptake exogenous autoinducer-2 to regulate biofilm formation[J]. Res Microbiol, 2015, 166(6): 486-493.
[8] 刘蕾. AI-2对鸭疫里默氏杆菌生物学功能调控的研究[D]. 北京: 中国农业科学院, 2013.
[9] 刘蕾, 韩先干, 刘瑞, 等. AI-2对鸭疫里氏杆菌粘附入侵Vero细胞及其相关基因转录水平的影响[J]. 微生物学报,2013, 53(3): 313-319.
[10] Hu Q, Han X, Zhou X,et al.OmpAis a virulence factor ofRiemerella anatipestifer[J]. Vet Microbiol, 2011,150(3-4): 278-283.
[11] Hu Q, Han X, Zhou X,et al. Characterization of biofilm formation byRiemerella anatipestifer[J]. Vet Microbiol,2010, 144(3-4): 429-436.
[12] 白灏, 冀辉, 韩先干, 等. 禽致病性大肠杆菌江苏、安徽分离株的生物学特性分析[J]. 微生物学通报, 2013,40(7): 1315-1322.
[13] Hu Q, Zhu Y, Tu J,et al. Identification of the genes involved inRiemerella anatipestiferbiofilm formation by random transposon mutagenesis[J]. PLoS One, 2012,7(6): e39805.
[14] 邢林林. 鸭疫里默氏杆菌红霉素耐药机制的研究[D]. 泰安: 山东农业大学, 2015.
[15] 林树乾, 张燕, 何元龙, 等. 鸭疫里默氏杆菌二价灭活疫苗株筛选及免疫原性研究[J]. 中国家禽, 2011, 33(1):25-27.
[16] 吉凤涛, 吕雪峰, 任锐, 等. 吉林省鸭疫里默氏杆菌血清型鉴定及防制[J]. 吉林畜牧兽医, 2010, 31(3): 28-30.
[17] 袁小远, 王友令, 王晓丽, 等. 2015~2016年山东、河北地区鸭疫里默氏杆菌流行病学调查[J]. 中国家禽, 2017,39(4): 70-72.
[18] 程龙飞, 陈红梅, 施少华, 等. 鸭疫里默氏菌的血清型及药物敏感性分析[J]. 中国动物传染病学报, 2013, 21(4):23-28.
[19] 陆新浩, 刘鸿, 黄建勇, 等.宁波地区鹅源鸭疫里默氏杆菌的分离鉴定及药敏试验[J]. 浙江畜牧兽医, 2016, 41(6):3-4.
[20] 李兆华. 山东省部分地区鸭疫里默氏杆菌的分离鉴定及其与鸭圆环病毒共感染的检测[D]. 泰安: 山东农业大学,2011.
[21] Burmolle M, Webb J S, Rao D,et al. Enhanced biofilm formation and increased resistance to antimicrobial agents and bacterial invasion are caused by synergistic interactions in multispecies biofilms[J]. Appl Environ Microbiol, 2006, 72(6): 3916-3923.
