鸡皮脂组织中尼卡巴嗪残留量的测定高效液相色谱-串联质谱法
2018-04-25王霄旸张丽芳张可煜薛飞群
侯 婷,王霄旸,张丽芳,张可煜,薛飞群
(中国农业科学院上海兽医研究所 农业部兽用化学药物及制剂学重点实验室,上海200241)
尼卡巴嗪(双硝苯脲二甲嘧啶醇)是一种广谱、高效、稳定的抗球虫药物,抗原虫作用强,可促进鸡的生长发育,同时能够防治球虫病,具有较好的应用前景,主要用于预防鸡盲肠球虫和堆型、巨型、毒害、布氏艾美耳球虫,常用于禽饲料添加剂[1-3]。
尼卡巴嗪是由4,4-二硝基均二苯脲(DNC)(图1)和2-羟基-4,6-二甲基嘧啶(HDP)这2种成份按1∶1组成的复合物,其中HDP在动物体内由尿液排出,代谢消除迅速; 而作为抗球虫的活性成份DNC,通过粪便排出,且代谢缓慢,因此各国规定了尼卡巴嗪在鸡组织中的残留标示物为DNC[4]。我国235号公告规定DNC在鸡的肌肉、皮/皮下脂肪、肝脏和肾脏中的最高残留限量(MRL)均为200 μg/kg,且蛋鸡产蛋期禁用。尼卡巴嗪在禽畜产品中的测定方法主要有高效液相-紫外法、高效液相-串联质谱法和酶联免疫法[4-9]。国家标准GB 29691-2013中采用高效液相-紫外法对鸡的肌肉、肝脏和肾脏组织中残留的DNC进行检测。国家标准GB 29690-2013中建立了对鸡蛋和鸡肌肉组织中DNC的残留量进行检测的高效液相-串联质谱法[10,11]。然而,目前国内还没有一种公认的检测方法可对鸡食用性组织鸡皮脂中残留的DNC进行有效的监控。因此,建立一种对鸡皮脂中尼卡巴嗪残留标示物4,4-二硝基均二苯脲进行检测的分析方法是势在必行。本研究在参考国家标准GB 29690-2013的基础上进一步完善鸡皮脂组织中尼卡巴嗪残留标示物4,4-二硝基均二苯脲残留的检测,以期达到监督、监控尼卡巴嗪安全使用的目的。
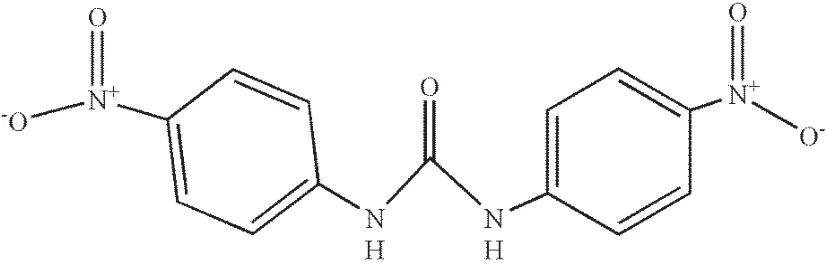
图1 4,4-二硝基均二苯脲结构图Fig.1 The structure of 4, 4-dinitrocarbanilide
1 材料与方法
1.1 仪器 2695型高效液相色谱仪(美国Waters公司),Quattro micromass三重四级杆质谱仪(配ESI源, 美国Waters公司),分析天平(AE240,梅特勒-托利多公司),超声波清洗仪(CQ250,上海超声波仪器厂),离心机(上海安亭科学仪器厂),涡旋混合器(Genie-2,Scientific Industries公司),高速匀浆机(Waring公司),氮吹仪(北京康林公司)。
1.2 材料 4,4-二硝基均二苯脲(C13H10N4O5,纯度大于97%,Sigma-Aldirch);4,4-二硝基均二苯脲-d8(C13D8H2N4O5纯度大于99.9%,Sigma-Aldirch);色谱纯乙腈、甲醇购于美国Fisher 公司;其余试剂均为分析纯;鸡皮脂(鸡皮及皮下脂肪)组织样品为市场购买,绞碎并均质后使用;空白添加样品:称2.00±0.02 g空白试样,添加适宜浓度的标准工作液,涡旋1 min即得。
1.3 溶液的配制 精密称取4,4-二硝基均二苯脲对照品和4,4-二硝基均二苯脲-d8对照品各(5.0±0.2)mg,置于10 mL容量瓶中,用二甲基甲酰胺溶解稀释至刻度,配制成浓度为500 μg/mL的标准贮备液(4℃避光保存);用甲醇稀释成10 μg/mL的标准中间液(4℃避光保存)。使用前用甲醇将标准中间液稀释成适当浓度的标准工作液。
1.4 质谱条件优化 采用MRM模式在负离子扫描方式下对4,4-二硝基均二苯脲和4,4-二硝基均二苯脲-d8进行扫描,质谱条件:毛细管电压为2.0 Kv;离子源温度为120℃;脱溶剂温度为350℃;锥孔气流速为50 L/h;雾化气流速为450 L/h;定性离子对、定量离子对、Dwell、锥孔电压和碰撞能量,见表1。
1.5 液相条件优化 选用Waters XTerra MS C18 液相色谱柱(2.1 mm×100 mm,3.5 μm),以甲醇∶乙酸铵溶液(75∶25,v/v)为流动相进行等度洗脱,见图2。
1.6 鸡皮脂组织样品前处理过程 称取均质组织(2.00±0.02)g于50 mL离心管中,加入浓度为1 μg/mL 4,4-二硝基均二苯脲-d8甲醇溶液100 μL,涡旋1 min,加入8 mL乙腈,涡旋1 min,超声10 min, 5 000×g离心10 min,取上清液,在40℃水浴条件下氮气吹干,加75%甲醇水溶液饱和正己烷1 mL,涡旋30 s,再加75%甲醇水溶液1.0 mL,充分涡旋混合,于40℃水浴中静置5 min、2000×g离心5 min,取下层清液,0.22 μm滤膜过滤,取10 μL续滤液注入液相色谱-串联质谱测定。

表1 化合物的定性、定量离子对、Dwell time值、碰撞能量和锥孔电压Table 1 The qualitative and quantitative ion pair of compounds and the value of Dwell, Collision energy and Cone voltage
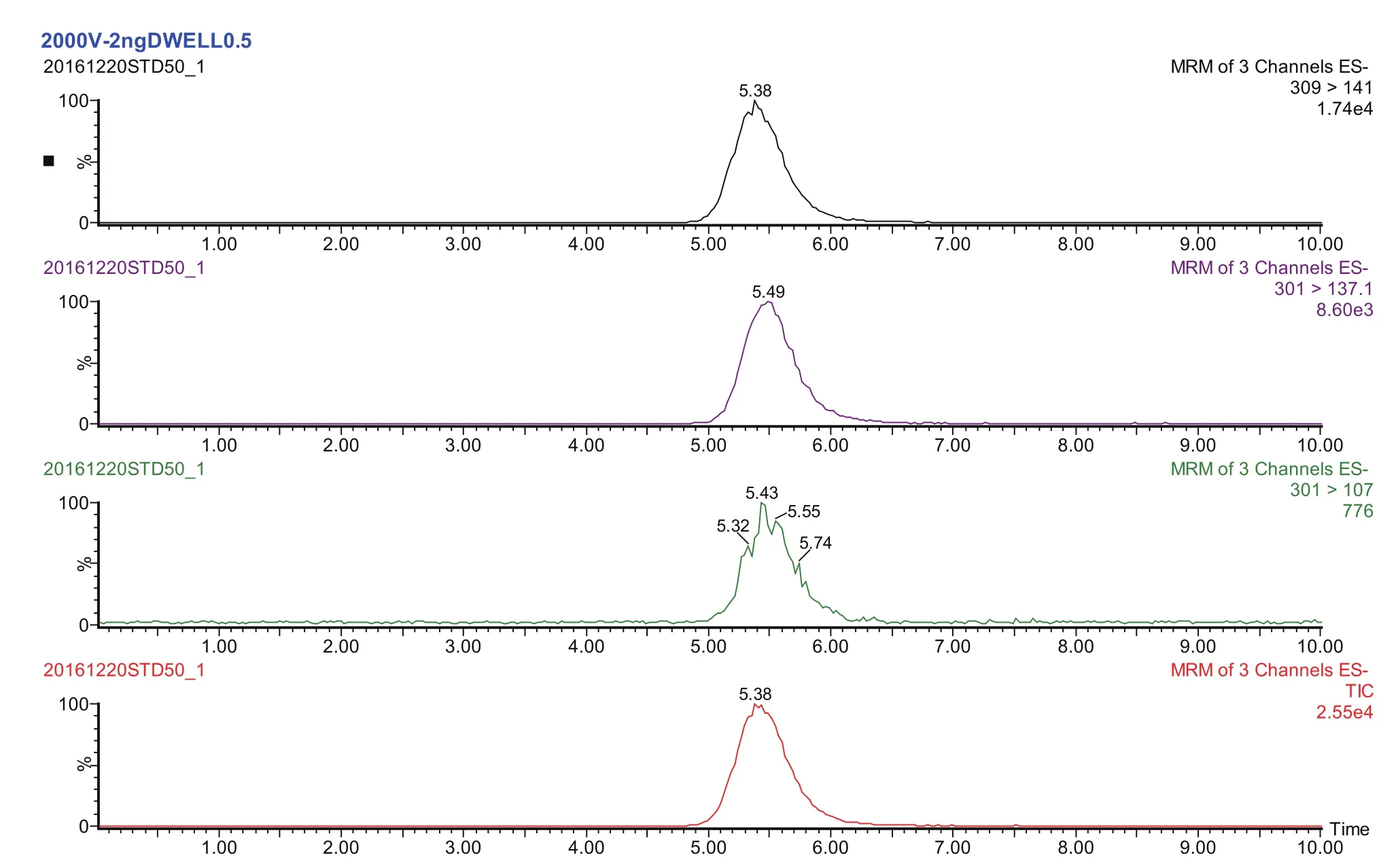
图2 标准溶液中DNC和内标(DNC-d8)的特征离子色谱图Fig.2 The MRM chromatograms of DNC and internal standard (DNC- d8) in standard solution
1.7 方法学研究
1.7.1 标准溶液稳定性 取新配制的4,4-二硝基均二苯脲贮备液适量,稀释成浓度为500 ng /mL的标准工作液,分装24份,分别存贮在-20℃、4℃、室温避光和20℃光照条件下,于7 d、15 d、30 d后拿出并稀释5倍后测定,内标法定量,计算同一条件下平行样的含量百分比的平均值。
1.7.2 特异性 空白试样和空白添加试样按照1.6处理后,按照1.4和1.5条件进行检测,观察空白对4,4-二硝基均二苯脲是否存在干扰。
1.7.3 灵敏度考察 空白添加试样按照1.6处理后,按照1.4和1.5中的条件进行检测,以待测物的信噪比S/N≥3为方法的检测限,信噪比S/N≥10为方法的定量限为原则,确定组织中4,4-二硝基均二苯脲的检测限和定量限。
1.7.4 线性 标准曲线制备方法:精密量取10 μg/mL 4, 4-二硝基均二苯脲标准中间液和4, 4-二硝基均二苯脲-d8标准中间液适量,用75%甲醇水溶液稀释,配制成4, 4-二硝基均二苯脲浓度为50、100、250、500和1000 ng/mL,且4, 4-二硝基均二苯脲-d8浓度均为100 ng/mL的系列对照溶液,供液相色谱-串联质谱法测定。以4, 4-二硝基均二苯脲与内标定量离子质量色谱峰面积比为纵坐标,标准溶液浓度为横坐标,绘制标准曲线。求回归方程和相关系数。
1.7.5 基质效应 按1.7.4操作制备标准曲线样品,测定后绘制标准曲线A;取5份鸡空白皮脂试样,按照1.6方法进行处理空白样品,吹干后的样品加75%甲醇水溶液饱和的正己烷1 mL,涡旋30 s,加1 mL 1.7.4制备的系列标准对照液,充分涡旋混合,于40℃水浴中静置5 min,2000×g离心5 min,取下层清液,0.22 μm滤膜过滤,测定后绘制标曲B。根据标曲B与标曲A的斜率比值判断是否存在基质效应。
1.7.6 精密度和回收率 采用标准添加法,在空白试料中添加定量限浓度、MRL的0.5倍、1倍、2倍的4个水平添加浓度来进行精密度和回收率的考察。每个浓度5个平行样品,3个批次。以测定浓度与添加浓度的百分比计算试样的百分回收率;以批内5个样品百分回收率之间的RSD %计算批内精密度;以3批次15个样品百分回收率之间的RSD %计算批间精密度。
1.7.7 添加试样的稳定性 取鸡空白皮脂组织样品按MRL浓度添加标准液,制备6个平行样品,3份在-40℃冰箱放置3 d,考察3 d稳定性;另外3份放置-40℃冰箱,每隔24 h将样品取出,放置室温融化后,再放置至-40℃储存,连续3 d,考察样品反复冻融稳定性。以待测样品的平均回收率评价试样的稳定性。
2 结果
2.1 标准溶液稳定性研究 测定结果显示,标准溶液在4℃、-20℃和室温避光条件下放置30 d后含量在98.15%~101.9%范围内,较为稳定,而在光照条件下放置15 d后含量只有53.75%,放置30 d后含量只有10.15%。为了保证溶液稳定和方便使用,最终选择4℃避光条件下保存。
2.2 特异性考察 空白试样和空白添加试样的总离子流色谱图,见图3。结果显示,鸡皮脂基质对4,4-二硝基均二苯脲无干扰,且出峰时间适宜,峰形良好。
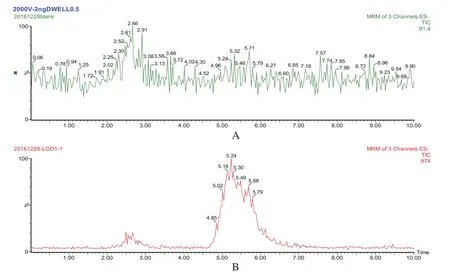
图3 鸡皮脂中4,4-二硝基均二苯脲的色谱图Fig.3 The chromatogram of DNC in chicken skin/fat
2.3 灵敏度考察 以待测物的信噪比S/N≥3为方法的检测限,信噪比S/N≥10为方法的定量限为原则,测得鸡皮脂组织中4,4-二硝基均二苯脲的检测限和定量限分别为2.5 μg/kg和25 μg/kg。此方法的灵敏度可满足目前此化合物的检测技术指标要求。
2.4 基质效应考察 结果显示,鸡皮脂基质标曲B和标准溶液标曲A的斜率比值为101.03%(比值在85%~115%范围内认为不存在基质效应),即鸡皮脂组织中残留的4,4-二硝基均二苯脲采用本文建立的方法定量时不存在基质效应,可直接用标准溶液曲线对待测物进行定量,见图4。
2.5 线性 按1.7.4制备标准曲线,结果显示,4,4-二硝基均二苯脲在50~1000 ng/mL浓度范围内,线性方程为Y=0.0113x-0.1457,线性良好 (r=0.9998),见图4。
2.6 精密度和回收率考察 在25~400 μg/kg添加范围内,空白添加试样的平均回收率在98.10%~114.11%范围内,批内和批间的RSDs均小于5%,具有较好的回收率和精密度,见表1。
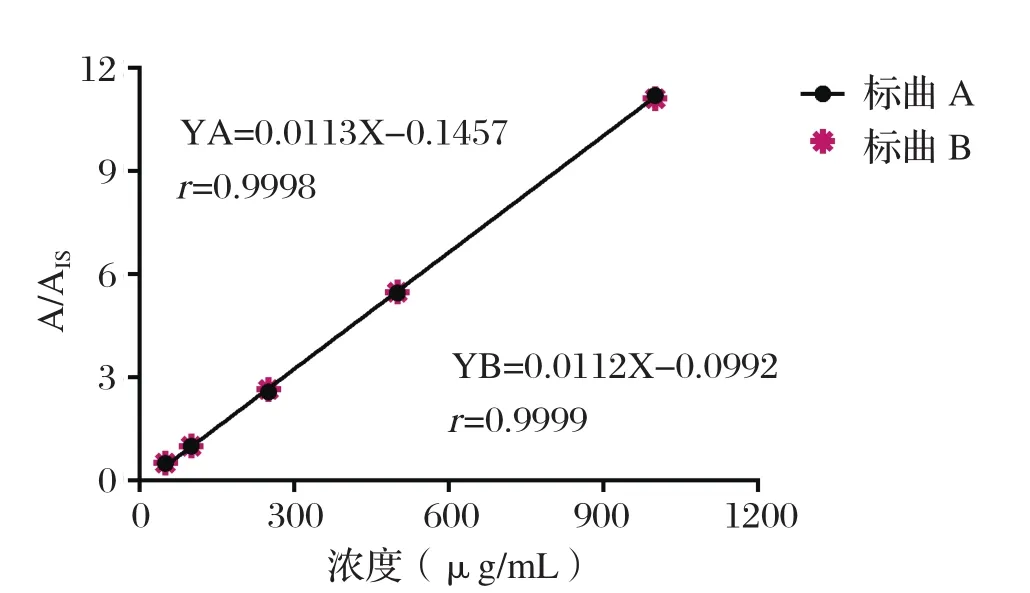
图4 4, 4-二硝基均二苯脲的标准溶液标曲A和鸡皮脂基质标曲B
2.7 添加试样稳定性研究 结果显示200μg/kg的空白添加试样置于-40℃冰箱3天后,其回收率为93.40%;200 μg/kg的空白添加试样置于-40℃冰箱3天,并反复冻融3次后,其回收率为90.20%。结果表明,待测组织样品在-40℃条件下稳定性较好,样品可暂时存放于-40℃冰箱。
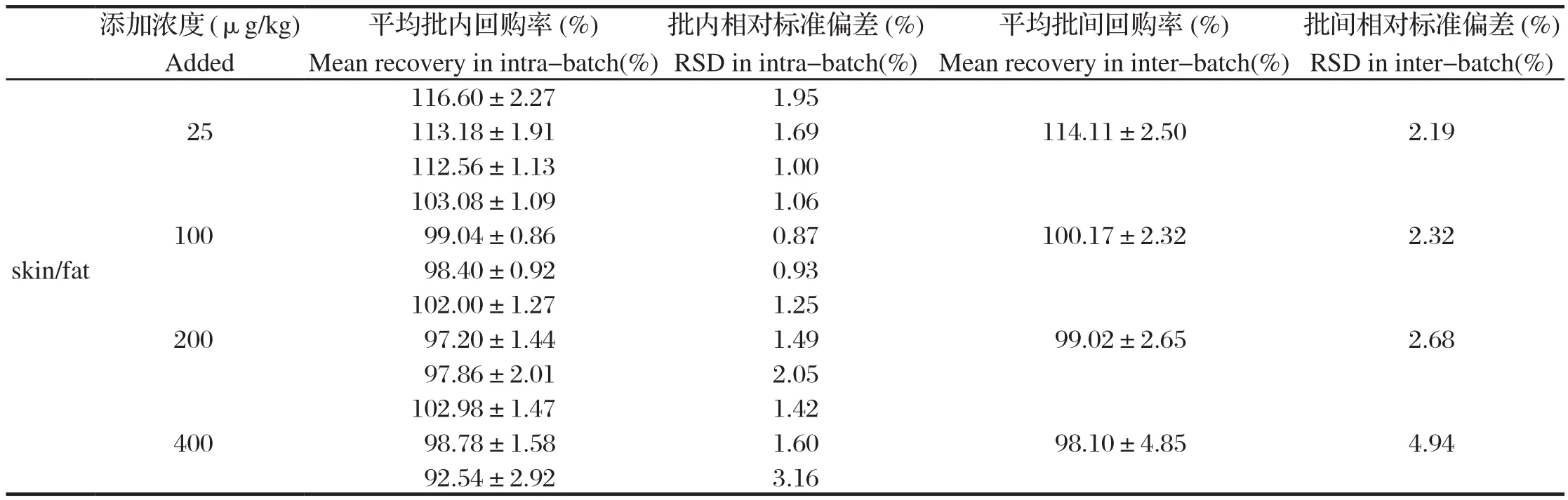
表1 4,4-二硝基均二苯脲在鸡皮脂组织中的添加回收率Table 1 The spiked recoveries of DNC in skin/fat of chicken
3 讨论
本文采用高效液相色谱-串联质谱(HPLCMS/MS)检测系统,灵敏度高、基质干扰少、检测时间短。分离过程采用梯度洗脱,实验结果重复性较好。在样品前处理时采用乙腈提取、氮气吹干浓缩、己烷除脂等步骤,操作简单、快速。采用内标法定量可一定程度上消除基质效应,直接使用溶液标曲进行定量,避免了制备基质标曲的操作过程,节约时间和成本,也简化了样品的净化步骤,此方法完全满足我国市场鸡皮脂中尼卡巴嗪残留量的检测。
本研究采用内标法建立了一个对鸡皮脂组织中残留的4,4-二硝基均二苯脲进行检测的液相串联质谱法,为国内首个对鸡皮脂组织中残留的4,4-二硝基均二苯脲进行检测的分析方法。该方法简单、快速、有效,可用于鸡皮脂中尼卡巴嗪残留标志物残留量的检测,可为市场上蓄禽产品的质量安全检测提供一定的参考。另外,本单位拟将其申请为国家标准,以响应国家农业部的号召,以期实现鸡皮脂组织中残留的4,4-二硝基均二苯脲有标可依、有标可检、执法有标可判。
[1] 刘小艳, 方炳虎, 邱电, 等. 尼卡巴嗪混悬液的研制及其对鸡球虫病的疗效[J]. 动物医学进展, 2010, 31(2): 65-69.
[2] 陈兵, 唐光武, 刘金松, 等. 尼卡巴嗪对鸡球虫的生物活性及对鸡生长的影响[J]. 浙江农业学报, 2003, 15(2):73-77.
[3] 国彬, 姚丽贤, 何兆桓, 等. 高效液相色谱法测定鸡粪中尼卡巴嗪的含量[J]. 环境科学与技术, 2011, 34(4): 97-99.
[4] Coleman M R, Rodewald J M, Brunelle S L,et al.Determination and confirmation of nicarbazin, measured as 4,4-dinitrocarbanilide (DNC), in chicken tissues by liquid chromatography with tandem mass spectrometry:First Action 2013.07[J]. J AOAC Int, 2014, 97(2): 630-640.
[5] 刘素梅, 班付国, 韩立, 等. 高效液相色谱法测定尼卡巴嗪含量的方法建立[J]. 中国兽药杂志, 2014, 48(5): 51-55.
[6] 王鹤佳, 刘智宏, 汪霞, 等. 酶联免疫法测定鸡肉中尼卡巴嗪残留[J]. 中国兽药杂志, 2014, 48(3): 59-61.
[7] 孙雷, 张骊, 刘智宏, 等. 鸡蛋和鸡肉中尼卡巴嗪残留检测高效液相色谱-串联质谱法研究[J]. 中国兽药杂志,2008, 42(5): 1-4.
[8] 周伟伟. 鸡组织中尼卡巴嗪残留的HPLC检测方法及其消除规律研究[D]. 扬州: 扬州大学, 2007.
[9] Kanda M, Ushiyama K, Iqusa K,et al. Simple determination of residual anticoccidial drugs (diclazuril and nicarbazin) in chicken tissues by HPLC[J]. Shokuhin Eisei qaku Zasshi, 2003, 44(2): 110-113.
[10] 中华人民共和国农业部, 中华人民共和国国家卫生和计划生育委员会. GB 29691-2013食品安全国家标准 鸡可食性组织中尼卡巴嗪残留量的测定 高效液相色谱法[S].北京: 中国标准出版社, 2014.
[11] 中华人民共和国农业部, 中华人民共和国国家卫生和计划生育委员会. GB 29690-2013 食品安全国家标准 动物性食品中尼卡巴嗪残留标志物残留量的测定 液相色谱-串联质谱法[S]. 北京:中国标准出版社, 2014.
