鸡源性HMGB1蛋白的原核表达及多克隆抗体制备
2018-04-25曲昱蓉仇旭升
曲昱蓉,詹 媛,仇旭升,丁 铲
(中国农业科学院上海兽医研究所,上海 200241)
高迁移率族蛋白HMGB1(high mobility group box 1)是一种大小约为29 kDa的非组蛋白的核蛋白,在所有真核细胞中都表达并且在进化中高度保守[1]。它的215个氨基酸残基形成了两个DNA结合区(A盒和B盒)以及带负电的C末端。HMGB1蛋白在细胞核内起到重要的作用,核内的HMGB1蛋白无序列特异性的结合至DNA小沟中,引起DNA螺旋结构的弯曲。这使其与DNA和各种因子包括p53、NF-κB、同源包含蛋白、重组激活基因1/2蛋白(RAG1/2)和类固醇激素受体之间形成物理性相互作用[2]。HMGB1蛋白可以由坏死细胞或损伤的细胞被动释放或者通过先天性免疫细胞主动分泌到细胞外[3]。目前已知HMGB1蛋白除了作为核蛋白,同样也是损伤相关模式分子(DAMP),参与到内毒素休克、血管损伤以及全身性炎症反应[4]。
本研究利用RT-PCR技术从CEF细胞中扩增出鸡HMGB1(chicken HMGB1,chHMGB1)基因,在0.5 mmol/L IPTG诱导下表达了chHMGB1重组蛋白,并对表达出的可溶性蛋白进行纯化。同时成功制备了鼠抗chHMGB1多克隆抗体。实验表明chHMGB1重组蛋白具有良好的免疫反应特性,以此蛋白制备的多克隆抗体可以特异性检测到禽源细胞内的HMGB1蛋白,为进一步研究chHMGB1蛋白在细胞内发挥的生物学作用提供重要物质基础。
1 材料和方法
1.1 菌株、质粒和细胞 大肠杆菌DH5α、BL21(DE3)购买于天根生化科技有限公司;原核表达载体pET-28a(+)和本研究所用细胞均由上海兽医研究所禽病研究室保存。
1.2 实验动物 SPF鸡胚购自北京梅里亚维通实验动物有限公司;SPF级BALB/c小鼠购自斯莱克实验动物中心。
1.3 主要试剂EcoRI 和XhoI限制性内切酶、高保真酶PrimeSTAR购自TaKaRa公司;DNA凝胶回收试剂盒购自Axygen公司;DH5α感受态细胞购自天根生化科技有限公司;HRP标记二抗、FITC标记二抗和封片剂购自Sigma公司;蛋白Marker购自Thermo公司;细胞核染色液购自碧云天生物技术研究所;增强型ECL发光试剂盒购自圣尔生物公司;DMEM培养基购自Hyclone公司;胎牛血清FBS购自Biological Industries公司;Opti-MEM培养基、无EDTA胰酶购自Gbico公司;0.45 μm、0.22 μm直径滤器购自Millipore公司。其他试剂为国产分析纯试剂。
1.4 方法
1.4.1 CEF细胞制备 取9~10日龄SPF鸡胚无菌去除肌肉和内脏,用DMEM培养基清洗后剪碎,加入无EDTA的胰酶在37℃消化20~30 min。加入胎牛血清终止消化,1500×g离心15 min后弃去上清。用含有10%FBS的DMEM培养基吹悬沉淀,转移至细胞瓶内,在37℃、5% CO2培养箱中继续培养。
1.4.2 细胞总RNA提取及反转录 待6孔板内CEF细胞/HeLa细胞长成单层后,每孔加入1 mL Trizol吹下细胞后收集到1.5 mL EP管内,加入200 μL氯仿,剧烈震荡15 s,室温放置5 min后,10 000×g离心10 min。离心后取上清至新的1.5 mL EP管内,加入1 μL糖原,并按照总体积1∶1加入异丙醇,混匀后-40℃放置1 h。10 000×g离心10 min后弃去上清,用70%乙醇洗涤两次后风干,最后用20 μL DEPC水70℃溶解5 min。取2 μg RNA作为模板,以18T为引物,按照Promega公司的Reverse Transcription System方法进行,最终获得cDNA。
1.4.3 chHMGB1基因和huHMGB1基因的扩增 根据GenBank上公布的鸡HMGB1基因和人HMGB1(human HMGB1,huHMGB1)基因的CDS序列设计并合成2对引物(chHM-F/chHM-R、huHM-F/huHM-R),其序列见表1。分别以CEF细胞和HeLa细胞的cDNA为模板,采用PrimeSTAT高保真酶进行chHMGB1/huHMGB1基因的扩增。PCR扩增条件:98℃变性10 s,55℃退火15 s,72℃延伸1 min,30个循环。反应产物经1%琼脂糖凝胶电泳鉴定,按照Axygen公司胶回收试剂盒操作说明书进行胶回收纯化目的条带。将回收的目的条带与pZeroblunt载体连接后,转化并提取阳性质粒送生工生物工程有限公司测序。扩增引物见表1。

表1 本研究引物Table 1 Primers in this study
1.4.4 原核表达质粒构建 为构建chHMGB1的原核表达质粒、真核表达质粒和huHMGB1的真核表达质粒,分别合成3对引物(ch28a-F/ch28a-R、chFLAG-F/chFLAG-K、huFLAG-F/huFLAG-R),引物见表1。
将测序阳性的质粒进行50倍稀释作为模板,用上述引物进行PCR扩增。PCR产物经相应酶切后,与载体pET-28a(+)和p3×FLAG-CMV-14,4℃连接过夜、转化,并分别涂布于卡那抗性和氨苄抗性的LB平板,37℃过夜培养,次日挑取单菌落进行鉴定培养,菌液PCR初步鉴定正确的质粒送测序。将测序鉴定正确的重组质粒分别命名为pET-28achHMGB1、FLAG-chHMGB1和FLAG-huHMGB1。1.4.5 重组鸡HMGB1融合蛋白的诱导表达 将pET-28a-chHMGB1重组质粒和pET-28a空载体分别转化感受态BL21(DE3),挑取单菌落接种到5 mL含有卡那霉素的LB液体培养基中,37℃培养过夜,按1∶100的比例接种于含有卡那霉素的2YT培养基中,37℃培养3 h时,加入0.5 mmol/L IPTG,37℃诱导表达6 h。10 800×g离心30 s收集上述大肠杆菌菌液,用PBS 缓冲液重悬菌液后超声裂解,10 000×g离心10 min 分离上清和沉淀。以未加IPTG 诱导的pET-28a-chHMGB1和pET-28a作为对照,进行 SDS-PAGE,分析蛋白在上清和沉淀中的表达情况。
1.4.6 重组鸡HMGB1融合蛋白的纯化 通过实验证明chHMGB1原核表达的融合蛋白28a-chHMGB1以可溶形式存在,离心收集菌液,与1×Ni-NAT Bind Buffer(300 mmol/L NaCl、50 mmol/L磷酸盐缓冲液、10 mmol/L咪唑、1 mmol/L PMSF,pH=8.0)充分混匀后,冰水浴超声裂解至菌液清亮,离心收集上清,在上清中加入Ni-NAT His·Bind Resin,4℃摇晃4 h后,将混合液装入纯化柱,用1×Ni-NAT Wash Buffer(300 mmol/L NaCl、50 mmol/L磷酸盐缓冲液、20 mmol/L咪唑)洗涤,用1×Ni-NAT Elute Buffer(300 mmol/L NaCl、50 mmol/L磷酸盐缓冲液、250 mmol/L咪唑)洗脱,采用SDS-PAGE分析蛋白洗脱情况。
1.4.7 多抗血清的制备 取纯化的chHMGB1蛋白50 μg与相同体积弗式完全佐剂乳化后,腹部皮下多点注射Balb/c小鼠。首免后第14 d、28 d、42 d分别取50 μg chHMGB1蛋白与等体积弗氏不完全佐剂乳化后,对小鼠进行3次加强免疫,最后1次免疫后第14 d小鼠眼球采血,血样37℃放置1 h,4℃放置2 h后,4℃、2000×g离心10 min所得上清即为多克隆抗体。
1.4.8 多克隆抗体鉴定
1.4.8.1 chHMGB1多克隆抗体ELISA效价检测 采用间接ELISA法检测多克隆抗体效价,将纯化的融合蛋白chHMGB1用CBS稀释至5 μg/mL,每孔加入100 μL,4℃包被过夜。PBST洗涤3次后用含5%脱脂乳的PBST,4℃封闭过夜。PBST洗涤3次后,加入用PBST连续倍比稀释的多克隆抗体血清和阴性血清,37℃孵育1 h,PBST洗涤3次后每孔加入100 μL HRP标记的羊抗鼠二抗,37℃孵育1 h,洗涤后每孔加入100 μL四甲基联苯胺(TMB)显色液,37℃显色10 min,加入50 μL 2 mol/L H2SO4终止反应。通过酶标仪检测OD450值。若阳性与阴性的比值大于2.0,则视为阳性,否则为阴性。
1.4.8.2 chHMGB1多克隆抗体Western blot效价检测 在6孔板中分别接种DF1细胞和HeLa细胞,待其长至70%时转染FLAG-14、FLAG-chHMGB1和FLAG-huHMGB1质粒,待转染48 h后用IP细胞裂解液裂解细胞,将已充分裂解的细胞样品经10 000×g离心10 min后,取上清加入5×蛋白上样缓冲液并煮沸10 min,以制备Western blot实验所需样品。将chHMGB1多克隆抗体和FLAG抗体(阳性对照)以适当比例稀释后作为一抗,进行Western blot实验。
1.4.8.3 chHMGB1多克隆抗体荧光效价检测 将DF1细胞接种于孔底置有盖玻片的6孔细胞板内培养,将细胞生长至单层后弃去培养基,以4%的多聚甲醛室温固定20~30 min。PBS洗3次,加入0.5%TritonX-100室温透化10 min。PBS洗3次,使用3%BSA 37℃封闭30 min。以500倍稀释的chHMGB1多克隆抗体作为一抗,以免疫前阴性血清作为阴性对照,37℃孵育1 h,PBS洗3次;以1∶500倍稀释FITC标记的羊抗鼠IgG为二抗,37℃避光孵育30 min,PBS洗3次;最后以1∶500稀释DAPI染核,37℃孵育5 min,PBS洗3次。将盖玻片取出固定于载玻片上,通过荧光显微镜观察并拍照。
1.4.8.4 chHMGB1多克隆抗体特异性分析 6孔细胞培养板中铺满-CEF细胞、-DF1细胞、-HeLa细胞、-HEK293细胞、-MARC-145细胞、-Vero细胞、-MEF细胞、-RAW246.7细胞、-PAM细胞和-PK-15细胞,待其分别长满时弃掉上清,用预冷的PBS洗涤2次后,每孔加入100 μL IP细胞裂解液裂解细胞,将已裂解的细胞样品经10 000×g离心10 min后,取上清加入5×蛋白上样缓冲液并煮沸10 min,以制备Western blot实验所需样品。样品经SDS-PAGE分离后转印至PVDF膜上,以制备的chHMGB1多克隆抗体作为一抗(1∶1000稀释),HRP标记的羊抗鼠IgG(1∶8000稀释)作为二抗进行检测。
2 结果
2.1 chHMGB1基因扩增及原核表达载体构建 PCR扩增产物经1%琼脂糖凝胶电泳分析与预期大小一致,约648 bp(图1)。重组质粒pET-28a-chHMGB1双酶切及PCR产物经1%琼脂糖凝胶电泳分析,与预期的目的片段大小相符,且测序完全正确,表明pET-28a-chHMGB1重组表达质粒构建成功。
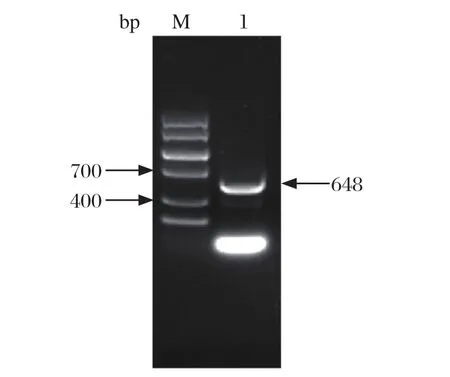
图1 chHMGB1基因PCR扩增Fig.1 Ampli fi cation of chHMGB1 gene
2.2 重组质粒的诱导表达及可溶性分析 SDS-PAGE分析结果显示pET-28a-chHMGB1诱导表达的融合蛋白chHMGB1,约在27 kDa处有一条特异性条带,而空载体对照质粒表达的蛋白中没有此条带,且融合蛋白主要存在于上清中。该结果说明在大肠杆菌BL21(DE3)中成功诱导了pET-28a-chHMGB1蛋白的表达,并且主要以可溶性蛋白形式表达(图2)。
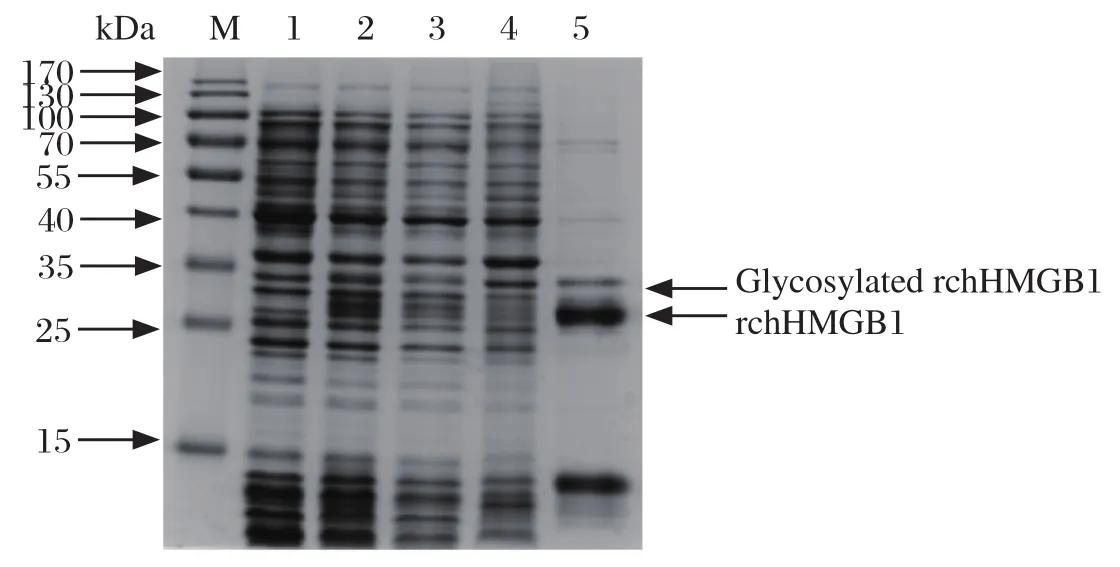
图2 pET-28a-chHMGB1重组蛋白的SDS-PAGE分析Fig.2 SDS-PAGE analysis of the recombinant pET-28achHMGB1 protein
2.3 chHMGB1多克隆抗体ELISA效价检测结果 以纯化的融合蛋白chHMGB1为包被抗原,以未免疫小鼠血清作为阴性对照,测定鸡HMGB1多克隆抗体效价。多克隆抗体和阴性血清按照100×21~100×211(204 800)连续稀释,结果显示当多克隆抗体稀释100×211倍时,OD阳性/OD阴性>2.0,说明该多克隆抗体ELISA效价大于1∶204 800。
2.4 chHMGB1多克隆抗体Western blot效价检测结果 以多克隆抗体作为一抗,检测转染FLAG-14、FLAG-chHMGB1和FLAG-huHMGB1质粒的HeLa细胞样品,以针对FLAG标签的抗体作为阳性对照。结果显示,制备的多克隆抗体与鸡HMGB1蛋白具有良好的反应性,并且条带大小与阳性对照(FLAG抗体)一致(图3),说明该多克隆抗体能够特异性地识别鸡HMGB1蛋白,且Western blot效价为1∶1000。

图3 pET-28a-chHMGB1蛋白多克隆抗体Western blot检测Fig.3 Western blot analysis of pET-28a-chHMGB1 PcAb
2.5 针对融合蛋白chHMGB1的多克隆抗体荧光效价检测 以多克隆抗体作为一抗与DF1细胞进行间接免疫荧光检测,结果显示,多克隆抗体可以检测到DF1细胞核内HMGB1蛋白的绿色荧光与DAPI蓝色细胞核染料染色部位重合,而阴性血清对照组细胞核部位却没有绿色荧光(图4),抗体IFA效价可达1∶500。
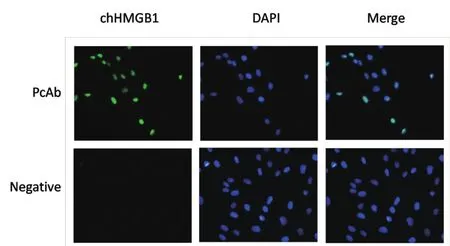
图4 chHMGB1多克隆抗体间接免疫荧光效价检测Fig.4 IFA of pET-28a-chHMGB1 PcAb
2.6 chHMGB1多克隆抗体特异性检测 取鸡源的CEF细胞和DF1细胞、人源的HeLa细胞和293细胞、猴源的Marc-145细胞和Vero细胞、鼠源的MEF细胞和RAW264.7细胞、猪源的PAM细胞和PK-15细胞样品,以针对chHMGB1蛋白的多克隆抗体作为一抗,进行Western blot检测,结果显示,该多克隆抗体仅能检测到禽源细胞中27 kDa大小的chHMGB1蛋白,而不与人源、猴源、鼠源以及猪源细胞中HMGB1蛋白反应,具有良好的细胞特异性(图5)。
3 讨论
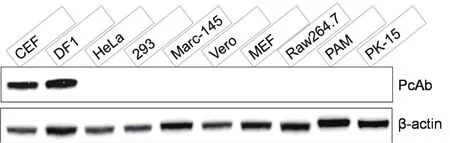
图5 chHMGB1多克隆抗体细胞特异性鉴定Fig.5 The cell speci fi ty of the chHMGB1 PcAb
抗体是一种特异性的检测工具,已被广泛应用于农业、医药以及生物学领域。HMGB1 除了可以作为一种核蛋白,也可以作为一种炎症因子,参与调节病毒感染、损伤和炎症等[2,5,6]。尽管有针对人或小鼠HMGB1的各种单克隆或多克隆抗体且与其他物种如猴、大鼠和狗具有交叉反应性,但没有特异性识别鸡HMGB1的抗体。在本研究中,我们将构建的pET-28a-chHMGB1原核表达载进行原核表达,并通过Ni-NTA柱纯化原核表达chHMGB1蛋白。将纯化后的重组chHMGB1蛋白免疫小鼠,以制备多克隆抗体。该多克隆抗体同时具有ELISA、Western blot和IFA效价。该抗体不仅可以与重组chHMGB1蛋白反应,还能检测到细胞内源性chHMGB1蛋白。Western blot结果显示该多克隆抗体种属特异性强,仅与家禽细胞的HMGB1蛋白反应,而不与哺乳动物细胞中的HMGB1反应。这些实验结果表明,所制备的针对chHMGB1蛋白的多克隆抗体可以被用于研究鸡HMGB1蛋白的功能和其在细胞信号通路里所发挥的作用。
大量证据表明,HMGB1在多种病毒感染性疾病中发挥潜在的致病作用。丙型肝炎病毒HCV感染时,可以观察到细胞核内的HMGB1蛋白转移到细胞质区域,继而又分泌至细胞外环境,而分泌至上清中的HMGB1蛋白又可以阻断HCV的继续感染[7]。HMGB1蛋白可以通过SARS病毒感染介导的细胞溶解而被动释放。一旦被释放,细胞外的HMGB1会刺激产生有害的肺部炎症反应,从而导致呼吸衰竭和死亡。但是,目前对于HMGB1蛋白和禽源病毒之间的关系还未有明确的结论。多种禽源性病毒如禽流感病毒(Avian influenza virus,AIV)、新城疫病毒(Newcastle disease virus,NDV)等天然宿主细胞都为禽源细胞,而本研究制备的特异性针对鸡HMGB1蛋白的抗体未来可以用于研究鸡HMGB1蛋白是否参与到禽源性病毒发病机制。
除了禽流感病毒、新城疫病毒外一些其他病毒也都已被证明可以诱导炎症反应,且对全球养禽业构成严重威胁[8,9]。考虑到HMGB1蛋白与各种炎性疾病相关,并且释放至细胞外环境中的HMGB1蛋白具有细胞因子样功能,针对鸡HMGB1的抗体可在未来用于确定HMGB1和禽源性病毒诱导的炎性反应之间的关系。禽类细胞在病毒感染后,原本位于细胞核的HMGB1迁移至胞质区域和进一步的释放,可以通过使用特异性抗体进行Western blot和IFA实验检测。为探索HMGB1蛋白在禽病病毒复制和病毒感染激活NF-κB信号通路以及随后的炎性因子表达中发挥的作用,通过采用特异性siRNA敲除内源性HMGB1蛋白或使用该抗体阻断细胞外HMGB1蛋白进行研究。而这些实验研究将对了解禽流感病毒、新城疫病毒或其他禽类病毒如何诱导过度的炎症反应提供新的见解,为进一步研究鸡HMGB1蛋白在禽源性病毒发病机制中的作用以及为找到新的潜在治疗靶点提供重要的生物试剂。
[1] Dumitriu I E, Baruah P, Manfredi A A,et al. HMGB1:guiding immunity from within [J]. Trends Immunol, 2005,26(7): 381-387.
[2] Andersson U, Tracey K J. HMGB1 is a therapeutic target for sterile inflammation and infection [J]. Annu Rev Immunol, 2011, 29: 139-162.
[3] Mazarati A, Maroso M, Iori V,et al. High-mobility group box-1 impairs memory in mice through both toll-like receptor 4 and Receptor for Advanced Glycation End Products[J]. Exp Neurol, 2011, 232(2): 143-148.
[4] Lee S A, Kwak M S, Kim S,et al. The role of high mobility group box 1 in innate immunity[J]. Yonsei Med J,2014, 55(5):1165-1176.
[5] Andersson U, Erlandsson-Harris H, Yang H,et al.HMGB1 as a DNA-binding cytokine [J]. J Leukoc Biol,2002,72(6):1084-1091.
[6] Scaffidi P, Misteli T, Bianchi M E. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation[J]. Nature, 2002,418(6894):191-195.
[7] Jung J H, Park J H, Jee M H,et al. Hepatitis C virus infection is blocked by HMGB1 released from virusinfected cells [J]. J Virol, 2011, 85(18): 9359-9368.
[8] Hu Z, Hu J, Hu S,et al. High levels of virus replication and an intense inflammatory response contribute to the severe pathology in lymphoid tissues caused by Newcastle disease virus genotype VIId [J]. Arch Virol, 2015, 160(3):639-648.
[9] Yu M, Zhang K, Qi W,et al. Expression pattern of NLRP3 and its related cytokines in the lung and brain of avian influenza virus H9N2 infected BALB/c mice [J].Virol J, 2014,11: 229.
