两种提取细胞外泌体方法的比较
2018-04-25周昌娈
周昌娈 ,谭 磊 ,谢 军 ,丁 铲
(1.中国农业科学院上海兽医研究所,上海200241;2.西北民族大学,兰州730030)
外泌体是一种由细胞主动分泌的具有脂质双分子层结构的囊泡,直径约在30~150 nm,其形状类似于茶托或一侧凹陷的半球形[1]。20世纪80年代外泌体发现初期,研究者认为其仅仅用于携带细胞废弃蛋白[2],但约十年后发现,外泌体是另一种新型的细胞间通讯方式[3],且对肿瘤细胞的迁移与侵袭能力及肿瘤微环境有至关重要的影响,因而外泌体的相关研究呈现“喷井式”增加。近期研究发现,外泌体内容物极其丰富,包含RNA、蛋白和脂类。截止目前,据Exocarta数据库统计,已有9769种蛋白质、3408种RNA、2838种microRNA和1116种脂类发现于外泌体中(http://www.exocarta.org/)。其中,一些蛋白质如CD63、TSG101和Hsp70等可以用于外泌体的鉴定,因为它们是外泌体表面的共有蛋白[4]。
HeLa细胞来源于一位美国妇女海莉耶塔·拉克斯(Henrietta Lacks)子宫颈癌细胞的细胞系[5],因其增殖迅速、可连续传代、生长环境要求低、感染性强等特点,广泛应用于肿瘤研究及其他生物实验。但目前HeLa细胞外泌体的相关研究仍较少,而得到高质量有效的HeLa细胞外泌体是进行HeLa细胞外泌体研究的第一步。
商品化外泌体提取试剂盒良莠不齐,且昂贵的价格常常令研究者望而却步。2016年Rider等[6]解析了PEG聚沉法分离外泌体的关键步骤,并优化了一整套分离方法,极大降低了PEG聚沉法的成本,且相关成分与商品化外泌体提取试剂盒类似。因此,本文采用优化之后的PEG沉淀法与经典差速离心法提取HeLa细胞分泌的外泌体,利用电镜比较两种方法所提外泌体的形态学差异,蛋白印迹技术及动态光散射技术分别从外泌体表面特有蛋白及颗粒大小与分布两方面来鉴定两种方法所提的外泌体,从而选取最为可靠有效的外泌体提取方法,为进一步高效且经济地研究外泌体提供实验基础。
1 材料和方法
1.1 细胞、试剂及仪器 宫颈癌细胞株HeLa由中国农业科学院上海兽医研究所水禽病毒病团队提供;DMEM培养基、胎牛血清(fetal bovine serum,FBS)和0.25%胰蛋白酶(Trypsin-EDTA)均购自Gibco公司;CD63抗体(EPR5702)购自Abcam公司;PEG6000购自Sangon公司;Optima L-100XP低温差速离心机购自美国Beckman公司;Tecnai G2 Spirit BIOTWIN透射电子显微镜购自荷兰FEI公司,纳米粒径电位分析仪(Malvern,Nano-ZS90)购自英国马尔文公司。
1.2 HeLa细胞培养上清收集 用含10% FBS的DMEM培养基于37℃、5%CO2培养箱中培养HeLa细胞,以0.25%胰蛋白酶消化传代。待细胞生长状态良好且密度达到1×106~1×107个细胞时,换成不含FBS的DMEM培养液继续培养24 h后,收集细胞培养上清。
1.3 差速离心法提取外泌体 具体方法参照外泌体分离的相关文献[4],并进行适当调整。即在4℃下,首先300×g离心10 min,吸取上清液,然后2 000×g离心10 min;吸取上清液后,10 000×g高速离心30 min,吸取上清液;140 000×g超速离心90 min;除去上清液,所获得的沉淀即为外泌体。用PBS缓冲液洗涤沉淀并重悬后,140 000×g再次离心90 min,100 μL PBS缓冲液重悬沉淀,冻存于-80℃备用。
1.4 PEG沉淀法提取外泌体 具体步骤参照Rider等[6]的PEG沉淀法分离外泌体方法,并进行适当调整。在4℃下,首先2 000×g离心30 min,吸取上清液,等体积加入8% PEG6000溶液混合均匀后4℃孵育过夜(至少12 h),10 000×g离心60 min,收集沉淀,加入1 mL PBS重悬沉淀,12 000×g离心30 min,弃上清,以100 μL PBS缓冲液重悬沉淀,冻存于-80℃备用。
1.5 外泌体的形态学分析 吸取15 μL样品滴加于铜网上,沉淀2 min,用滤纸从铜网边缘吸去多余液体,滴加10 μL 3% 磷钨酸(pH7.0),2 min后,用滤纸从铜网边缘吸去多余染液,最后滴加纯水于铜网,吸去多余纯水,常温干燥数分钟后,于80 kV电镜下成像。
1.6 外泌体标志蛋白鉴定 分别提取两种方法所提外泌体的总蛋白,经SDS-PAGE后,转至PVDF膜上,脱脂乳室温封闭2 h后,加入一抗(CD63,1∶3 000;CD81,1∶2 000)4 ℃孵育过夜,TBST洗脱3次后,加入二抗(兔),室温孵育1 h,TBST洗脱3次,显影、定影。
1.7 外泌体颗粒大小分布分析 利用动态光散射,将所提取的外泌体样品用PBS稀释至1 mL,添加至样品池中,打开Zetasizer软件,设置温度为25℃,温度平衡时间为70 s、粘度为0.89 cP、折射率为1.330,同一样本测量3次,而后得到样品的粒径大小与分布。
2 结果
2.1 外泌体形态学鉴定 利用差速离心法与PEG沉淀法提取HeLa细胞培养上清,均分离到一些泡状物,所观察到的样品形态见图1。结果显示,差速离心法与PEG沉淀法提取的疑似外泌体样品呈现典型的外泌体形态结构,即茶托样双层膜结构,直径大小均在30~150 nm,两种方法所提的泡状物在形态上无明显差异。沉淀法提取的样品中均能检测到外泌体标志蛋白的表达,其分子量分别为CD63(53 kDa)、CD81(26 kDa),进一步证明了所提样品可能为外泌体,见图2。

图1 两种不同方法提取的外泌体形态的电镜观察Fig.1 The exosome extracted with two methods under electron microscopy
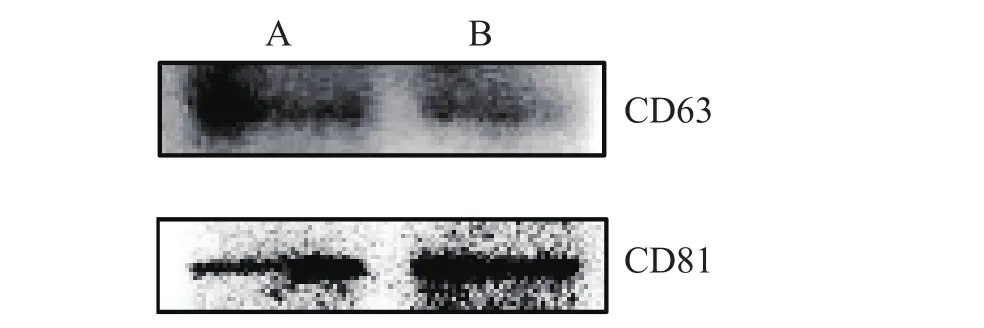
图2 外泌体标志蛋白的表达Fig. 2 Expression of exosome marker protein
2.3 外泌体颗粒大小分布分析 采用动态光散射检测差速离心法与PEG沉淀法获得的外泌体的粒径及分布,结果显示,差速离心法所提外泌体粒径=(58.4 ±23.17)nm,PEG沉淀法所提外泌体粒径=(59.43±21.31)nm,且都呈单峰,占据样品组分100%,该结果表明两种方法所提外泌体粒径及分布无明显差异,见图3。
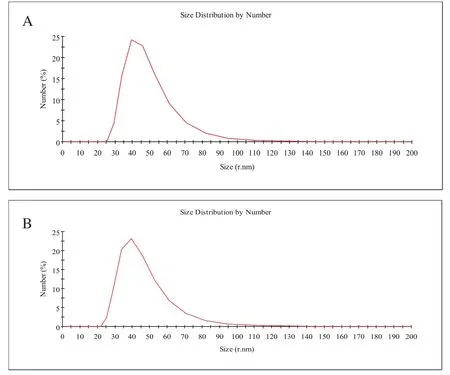
图3 DLS检测HeLa细胞外泌体粒径及分布Fig.3 Particle size and distribution of the exosomes derived from HeLa cells measured by DLS
2.2 外泌体标志蛋白CD63、CD81的表达鉴定Western blot实验结果表明,利用超速离心法与PEG
3 讨论
一直以来,外泌体作为“蛋白垃圾包”不受重视,在2007年,mRNA与microRNA在外泌体中被发现[7],从而改变了大家对外泌体的认识,使其成为当前生物学研究领域的热点。外泌体作为细胞间通讯方式之一,在生长发育、感染、肿瘤发生与转移等多种生理病理过程中扮演着重要角色,而外泌体的载体性质也为药物的靶向研究开辟了新天地[8]。
HeLa细胞作为一种重要的细胞模型,在肿瘤研究、病毒感染等众多实验中广泛应用。如今,各种类型细胞来源外泌体的相关研究不断更新,但关于HeLa分泌的外泌体研究却鲜有报道。不同细胞来源的外泌体,甚至同一类型细胞在不同生理状态下分泌的外泌体常常存在差异,因此,采用什么方法获取有效的HeLa细胞外泌体成为了困扰我们的难题之一。
我们参考了经典离心法提供的具体实验步骤,在超离步骤时发现,当使用100 000×g离心,所提的HeLa外泌体数量极少,电镜下观察时,多个网格中仅能找到1~2个呈现经典茶托样双层膜结构的外泌体,但将此步骤提高至150 000×g后,发现外泌体其他地方出现数量明显增加,但双层膜结构呈现部分破损的现象,最终发现140 000×g进行超离时,电镜下观察到的外泌体数量增加且结构完整。
PEG沉淀法在过去的几十年里,一直作为病毒富集的经典方法[9],而外泌体的颗粒大小与病毒相仿且部分理化性质相似,因而该方法已成为提取外泌体的另一种新途径[6,10],国内已将该方法应用于血清中胎盘来源的外泌体[11]及精液外泌体提取[12]。因而受此启发,利用该方法提取HeLa细胞来源的外泌体,且电镜下观察到的外泌体形态与经典离心法差异不显著,都呈现经典的外泌体双层膜结构,直径约30~150 nm。经典离心法与PEG法提取的外泌体中都表达标志蛋白CD63和CD81。PEG法比经典离心法步骤更简单,耗时更短。若从便捷角度看,PEG沉淀法比经典离心法好,但PEG分子的引入,是否会影响外泌体的生物学活性,我们还尚未知晓,需要进一步研究验证。因此,为保证所提外泌体的质量,差速离心法是一种更可靠的有效提取Hela细胞中的外泌体的方法。
[1] Thé ry C, Zitvogel L, Amigorena S. Exosomes:composition, biogenesis and function[J]. Nat Rev Immunol, 2002, 2(8): 569-579.
[2] Johnstone R M, Adam M, Hammond J R,et al. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles(exosomes)[J]. J Biol Chem, 1987, 262(19): 9412-9420.
[3] Mathivanan S, Ji H, Simpson R J. Exosomes: extracellular organelles important in intercellular communication[J]. J Proteomics, 2010, 73(10): 1907-1920.
[4] Théry C, Amigorena S, Raposo G,et al. Isolation and characterization of exosomes from cell culture supernatants and biological fluids[M]// Curr Protoc Cell Biol. John Wiley & Sons, Inc. 2006: Unit 3.22.
[5] Bj C. HeLa (for Henrietta Lacks)[J]. Science, 1974,184(4143): 1268.
[6] Rider MA, Hurwitz SN, Jr M D. ExtraPEG: A Polyethylene Glycol-Based Method for Enrichment of Extracellular Vesicles[J]. Sci Rep, 2016, 6: 23978.
[7] Valadi H, Ekström K, Bossios A,et al. Exosomemediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells[J]. Nat Cell Biol, 2007, 9(6): 654-659.
[8] Haney M J, Klyachko N L, Zhao Y,et al. Exosomes as drug delivery vehicles for Parkinson's disease therapy[J].J Control Release, 2015, 207: 18-30.
[9] Albertsson P A, Frick G. Partition of virus particles in a liquid two-phase system[J]. Biochim Biophys Acta, 1960,37(2): 230-237.
[10] Weng Y, Sui Z, Shan Y,et al. Effective isolation of exosomes with polyethylene glycol from cell culture supernatant for in-depth proteome profiling[J]. Analyst,2016, 141(15): 4640-4646.
[11] 李玉静, 刁振宇, 薛平平, 等. 血清中胎盘来源外泌体的分离与鉴定[J]. 医学研究生学报, 2015(6): 632-636.
[12] 杨诚, 郭文彬, 张万松, 等. 基于PEG6000富集精液来源外泌体的提取及鉴定[J]. 南方医科大学学报, 2016,36(11): 1531-1535.
