犬干扰素α2的原核表达及抗病毒活性分析
2018-04-25姚凌云王晶宇欧阳伟吴世妍夏兴霞诸玉梅王晓丽潘群兴芮荣王永山
姚凌云,王晶宇,欧阳伟,钱 晶,吴世妍,夏兴霞,诸玉梅,王晓丽,潘群兴,芮荣,王永山
(1.南京农业大学动物医学院,南京 210095;2.江苏省农业科学院兽医研究所 农业部兽用生物制品工程技术重点实验室,南京 210014)
近年来,养犬业发展快速,犬的传染病和非传染病的发病率也在逐年升高,严重威胁着养犬业的健康发展[1]。目前,犬病的研究比较滞后,生物防治性制剂缺乏,远不能满足对犬病防治的实际需求。而犬类感染病毒后,通常采用注射干扰素并辅助特异性单克隆抗体的治疗手段,以控制病情恶化进而转归康复。因此,犬干扰素具有良好的临床应用价值。
干扰素是机体细胞受到病毒感染或其他生物诱导剂的刺激而产生的一类具有抗病毒、抗寄生虫、抗肿瘤和免疫调节等功能的活性蛋白质[2,3]。根据干扰素氨基酸序列和其特异性识别受体的不同,主要分为3种:IFN-α、IFN-β和IFN-γ[4]。IFN-α和IFN-β属I型干扰素,能在几分钟之内激活细胞并建立抗病毒状态,其中IFN-α主要来源于白细胞,因其具有广谱抗病毒活性和免疫调节功能已成为当前研究热点。犬干扰素α(Canine Interferon-α,CaIFN-α)基因全长为564个核苷酸,编码187个氨基酸(包含23个氨基酸的信号肽),CaIFN-α存在8个亚型[5],其同源性达93%~100%。
天然干扰素制备工艺复杂、产量低、成本高,而利用基因工程技术表达外源蛋白的方法具有操作简单、成本低廉和可控性好等优势,已成为当前重组蛋白制备的主要手段。根据外源基因表达宿主的不同,表达系统可大致分为:大肠杆菌表达系统、酵母表达系统、昆虫/杆状病毒表达系统和哺乳动物细胞表达系统[6]。其中,大肠杆菌表达系统是第一个用于重组蛋白生产的表达系统,该系统具有遗传背景清楚、目的蛋白表达水平高、具备可大规模生产等优势,已被广泛地用于外源蛋白的制备[7]。
CaIFN-α的各亚型之间的抗病毒活性存在差异。目前,有关CaIFN-α2的研究较少,因此,本试验通过人工合成CaIFN-α2成熟活性区序列(去除信号肽),利用大肠杆菌表达系统表达重组CaIFN-α2,并探讨了CaIFN-α2的抗病毒活性,为研制新型高效的犬用干扰素奠定基础。
1 材料与方法
1.1 菌株、载体、病毒及细胞E. coliDH5α、E. coliRosetta、原核表达载体pET-28a(+)、水疱性口炎病毒(Vesicular stomatitis virus,VSV)和犬肾细胞(madindarby canine kidney,MDCK)均为本实验室保存。
1.2 主要试剂 限制性内切酶EcoR I和Hind III、T4 DNA连接酶和rTaqmix均购自TaKaRa公司;质粒提取试剂盒、凝胶回收试剂盒、DNA Marker和蛋白Marker均购自北京全式金生物技术有限公司;DMEM培养基购自GIBCO公司;小牛血清购自浙江航天生物有限公司;增强型HRP-DAB底物显色试剂盒购自天根生化科技(北京)有限公司;HisTrap HP蛋白纯化系统购自GE公司;硝酸纤维素(NC)膜购自北京鼎国昌盛生物技术有限责任公司;鼠抗His单克隆抗体购自碧云天生物技术公司;HRP标记的羊抗鼠IgG由本实验室自制;其他化学试剂均为国产分析纯。
1.3 CaIFN-α2基因的设计与合成 根据GenBank中已公布的CaIFN-α2序列(GenBank登录号:M28625.1),去除信号肽,并在目的基因前、后端引入EcoR I和Hind III酶切位点。合成的目的基因序列连在pUC57-simple载体上,重组获得的阳性质粒命名为pUC57-CaIFN-α2。
1.4 重组表达质粒pET-28a-CaIFN-α2的构建 将重组质粒pUC57-CaIFN-α2和表达载体分别用限制性内切酶EcoR I、Hind III双酶切消化后,经1%琼脂糖凝胶电泳观察酶切结果;回收目的基因与载体pET-28a(+)片段,在16℃条件下连接过夜,次日转化至感受态大肠杆菌DH5α中,涂于固体琼脂平板上(100 μg/mL Kan+),37℃培养12~16 h;挑取单个菌落接种于3 mL的LB液体培养基中(100 μg/mL Kan+),提取质粒,采用EcoR I和Hind III进行双酶切鉴定;最后,将鉴定正确的阳性质粒送公司测序,命名为pET-28a-CaIFN-α2。
1.5 CaIFN-α2基因的诱导表达与鉴定 将重组质粒pET-28a-CaIFN-α2转化至Rosetta感受态中,涂布在含卡那霉素(100 μg/mL)的LB固体培养平皿上,放37℃温箱倒置培养12-16 h。挑取单个菌落扩大培养,按1∶100比例转接于50 mL LB液体培养基中,培养至OD600值为0.8时,加入终浓度为1.0 mmol/L的IPTG诱导表达4 h。收集菌体,用10 mL PBS重悬,冰浴超声破碎后,离心收集上清和沉淀;分别用全菌、破碎上清及沉淀制备样品,同时设pET-28a(+)空载体菌及未转化菌作对照,经SDS-PAGE电泳分析,电泳结果用BandScan 5.0软件分析目的蛋白的表达量。Western blot鉴定,一抗为鼠抗His单克隆抗体(1∶2000稀释);二抗为HRP标记的羊抗鼠IgG(1∶1000稀释),DAB溶液显色。将鉴定正确的工程菌命名为pET-28a-CaIFN-α2/Rosetta。
1.6 CaIFN-α2表达条件的优化 取重组工程菌液pET-28a-CaIFN-α2/Rosetta按1%的量接入LB液体培养基中(100 μg/mL Kan+),37℃ 220 r/min振摇培养至OD600值为0.8时,加入终浓度为1.0 mmol/L的IPTG,分别诱导表达2 h、3 h、4 h、5 h和6 h,并同时设立空载体诱导表达的对照组。采用SDS-PAGE鉴定表达产物,利用BandScan 5.0软件分析各个诱导表达时间的表达量,表达产物命名为CaIFN-α。
1.7 重组CaIFN-α2的纯化 将CaIFN-α2包涵体粗制品(200 mL培养体积)中加入10 mL预冷7M盐酸胍,4℃搅拌2~3 h,10 000×g离心10 min,收集上清;将上清加入10倍体积的0.15 mol/L硼酸缓冲液使其缓慢复性,随后装入透析袋中,置于10 mmol/L氯化铵中透析24 h,间隔8 h换液一次;透析后离心收集上清,加入硫酸铵使其达到80%饱和度,缓慢搅拌8 h,离心收集沉淀;沉淀用8 mL去离子水溶解,再次放入透析袋中用去离子水透析24 h,中间换液2次;透析结束后用0.1 N的盐酸调pH至2.0,再放入pH 7.2 20 mmol/L PBS中透析24 h,中间换液1次。10 000×g离心10 min收集上清,即为粗制品CaIFN-α2。将上述复性液上载1 mL HisTraqTMHP亲和层析柱:用5个柱体积结合缓冲液(20 mmol/L磷酸钠、0.5 mol/L氯化钠、20 mmol/L咪唑,pH 7.4)平衡柱子;加复入性液;上载完样品后,用5个柱体积结合缓冲液洗涤柱子,再用5个柱体积洗脱缓冲液(20 mmol/L磷酸钠、0.5 mol/L氯化钠、500 mmol/L咪唑,pH 7.4)进行一步洗脱,收集流出液进行SDS-PAGE分析。
1.8 重组CaIFN-α2的活性测定 采用MDCK/VSV微量细胞病变抑制法检测纯化后重组CaIFN-α2的抗病毒活性:将生长状态良好的MDCK细胞接种于96孔板,待细胞长成单层后,加入用含5%血清的DMEM培养液10倍倍比稀释的纯化后重组CaIFN-α2,每孔加入100 μL稀释样品,置37℃、5%CO2细胞培养箱中培养24 h;弃掉细胞培养液,每孔接种100 μL 100个TCID50的VSV,置37℃、5%CO2细胞培养箱中培养24 h;同时设病毒对照(只加病毒,不加重组CaIFN-α2)和空白对照(不加病毒和重组CaIFN-α2);在倒置显微镜下观察细胞病变,以抑制50%细胞病变的最高CaIFN-α2稀释度作为一个活性单位,根据Reed-Muench法计算重组CaIFN-α2的抗病毒活性。
2 结果
2.1 重组表达质粒的构建 将构建的重组表达质粒pET-28a-CaIFN-α2进行双酶切鉴定,产物经1%琼脂糖凝胶电泳分析显示,可见两条带,分别约为5200 bp与510 bp,与预期大小相符,见图1。测序结果也表明重组表达质粒pET-28a-CaIFN-α2构建成功。
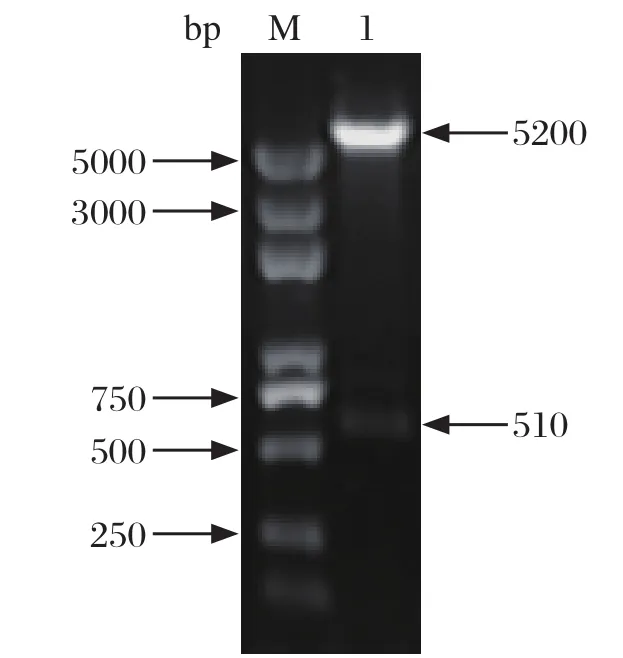
图1 重组表达质粒双酶切鉴定Fig. 1 Identi fi cation of the recombinant plasmid pET-28a-CaIFN-α2 digested with EcoR I and Hind III
2.2 表达产物的SDS-PAGE分析与Western blot鉴定工程菌pET-28a-CaIFN-α2/Rosetta经IPTG诱导表达后的产物,通过SDS-PAGE分析,可见在相对分子质量约23 kDa处有一明显条带,与重组CaIFN-α2大小一致,表达产物主要以包涵体的形式存在;利用BandScan 5.0软件分析,目的蛋白的表达量约占菌体总蛋白的表达量的52.5%,见图2。Western blot检测结果可见约23 kDa的条带,与理论值相符,表明重组CaIFN-α2获得成功表达。
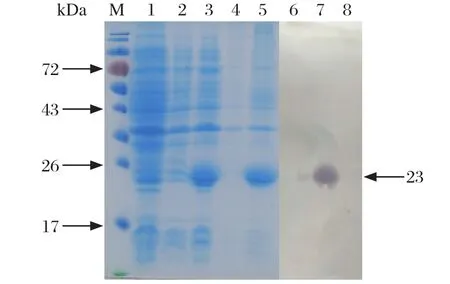
图2 表达产物的SDS-PAGE和Western blot分析Fig. 2 SDS-PAGE and Western blot analysis of the expressed products
2.3 表达产物诱导时间的优化及纯化 在同种宿主菌中,含CaIFN-α2的重组E.coliRosetta经1 mmol/L的IPTG依次诱导表达2 h、3 h、4 h、5 h和6 h后,重组CaIFN-α2的表达量分别为40.5%、46.6%、52.5%、45.3%和41.8%,在诱导表达4 h时最高,因此本试验的最佳诱导表达时间为4 h,见图3。以试验优化的诱导表达时间为条件,扩大培养工程菌,提取的包涵体经变性、复性和亲和层析纯化后,重组CaIFN-α2的纯度可达92%。
2.4 重组CaIFN-α2的抗病毒活性分析 采用MDCK/VSV系统微量细胞病变抑制法检测纯化后的重组CaIFN-α2的抗病毒活性,结果显示重组CaIFN-α2在MDCK细胞上呈现较高的抗病毒活性,见图4,经Reed-Muench法计算,活性为3.16×106U/mL。
3 讨论
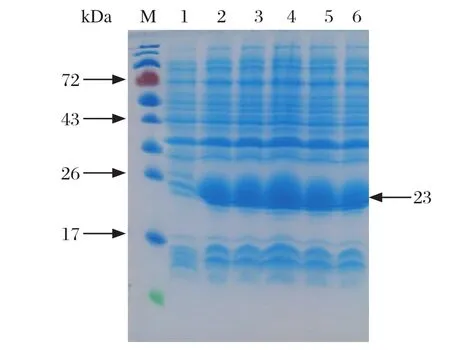
图3 诱导时间的优化结果Fig. 3 Optimization result of induction time

图4 重组CaIFN-α2的抗病毒活性分析Fig. 4 Antiviral activity analysis of the recombinant CaIFN-α2 in MDCK cells
近年来,随着我国养犬业的迅速发展,犬的品种和数量也逐渐增多;与此同时,犬的各种病毒性疾病问题也日益凸显。CaIFN-α具有广谱的抗病毒活性,在犬病毒性疾病的临床治疗过程中起到重要的作用。林德贵[8]使用重组CaIFN-α治疗犬瘟热,结果表明重组CaIFN-α具有明显的临床疗效。苏建东[9]验证了重组CaIFN-α对犬细小病毒病的治疗效果稳定。除此之外,CaIFN-α还具有免疫调节功能。邹勇等[10]研究发现,一定剂量的干扰素α可明显提高狂犬病疫苗的免疫效果,减少免疫接种的副反应。因此,CaIFN-α具有良好的临床应用前景。
目前,CaIFN-α各亚型已成功克隆并表达。Taira等[5]将CaIFN-α的8个亚型分为2组,其中CaIFN-α1、CaIFN-α2和CaIFN-α7为一组;CaIFN-α3~CaIFN-α6和CaIFN-α8为一组;通过大肠杆菌表达系统表达的重组CaIFN-α7,在犬肾细胞上抗水疱性口炎病毒的活性为2.0×107U/mg。徐晓娟等[11]通过对CaIFN-α1基因的优化,实现了在大肠杆菌中的高效表达,表达的重组蛋白经复性后的抗病毒活性为2×106U/mL。第一组中的CaIFN-α2虽然早已克隆出来,但至今尚未有文献报道其生物学活性和功能。本研究制备的CaIFN-α2在MDCK上的抗病毒活性为3.16×106U/mL,这与Taira等[5]报道的第一组亚型CaIFN-α具有较高抗病毒活性结果是一致的。
在表达系统的选择上,由于大肠杆菌表达系统具有表达迅速、产量高,便于规模化操作等优势[12],且已有很多通过大肠杆菌表达系统生产出抗病毒活性较高的动物干扰素的报道[13,14]。因此本试验应用大肠杆菌表达系统来表达CaIFN-α2,表达的重组CaIFN-α2主要以包涵体的形式存在,表达量占菌体总蛋白的比例高达52.5%。对包涵体蛋白而言,复性获得具有生物学活性的蛋白是一个重要且关键的步骤,目前蛋白的复性方法主要有透析复性法、稀释复性法、层析复性法和高流体静压复性法等[15]。有文献报道称,透析复性法对蛋白复性液中的化学环境起到稳定的作用,而稀释复性法则能极大地降低复性过程中蛋白的损失[16]。本试验采用稀释复性和透析复性相结合的方法对CaIFN-α2重组蛋白进行复性,可去除其中大部分杂蛋白,有利于提高重组蛋白的纯度和增加目的蛋白的回收效率。
综上所述,本研究构建了原核表达载体pET-28a-CaIFN-α2,在大肠杆菌Rosetta中实现了高效表达,表达量为52.5%,并建立了一套系统稳定、操作简单的变复性方法,获得的重组CaIFN-α2的抗病毒活性可达3.16×106U/mL,为进一步研究CaIFN-α2的分子生物学特性和功能及其临床生产应用奠定了基础。
[1] 夏咸柱, 才学鹏, 林德贵, 等. 宠物源人兽共患病防控战略研究[J]. 中国动物检疫, 2017, 34(2): 34-37.
[2] Samuel C E. Antiviral actions of interferons[J]. Clin Microbiol Rev, 2001, 14(4): 778-809.
[3] Malmgaard L. Induction and regulation of IFNs during viral infections[J]. J Interferon Cytokine Res, 2004, 24(8):439-454.
[4] Yang L, Xu L, Li Y,et al. Molecular and functional characterization of canine interferon-epsilon[J]. J Interferon Cytokine Res, 2013, 33(12): 760-768.
[5] Taira O, Watanugi I, Hagiwara Y,et al. Cloning and expression of canine interferon-alpha genes inEscherichia coli[J]. J Vet Med Sci, 2005, 67(10): 1059-1062.
[6] 范翠英, 冯利兴, 樊金玲, 等. 重组蛋白表达系统的研究进展[J]. 生物技术, 2012, 22(2): 76-80.
[7] Bis R L, Stauffer T M, Singh S M,et al. High yield soluble bacterial expression and streamlined purification of recombinant human interferon α-2a[J]. Protein Expr Purif, 2014, 99:138-146.
[8] 林德贵. 注射用重组犬干扰素α治疗犬瘟热病犬的临床应用[C]. 北京全国兽医外科学第13次学术研讨会、小动物医学第1次学术研讨会暨奶牛疾病第3次学术讨论会,2006.
[9] 苏建东. 重组犬α干扰素活性检测及对犬细小病毒病的疗效研究[D]. 北京: 中国农业科学院, 2013.
[10] 邹勇, 宋继萍, 吕宏亮, 等. 狂犬病-干扰素联合制剂的免疫原性及治疗作用[J]. 中国生物制品学杂志, 2002,15(5): 287-289.
[11] 徐晓娟, 王怡飞, 王玉, 等. 犬干扰素α1基因在大肠埃希菌中的表达及其抗病毒活性的测定[J]. 中国生物制品学杂志, 2013, 26(8): 1084-1087.
[12] Peciak K, Tommasi R, Choi J W,et al. Expression of soluble and active interferon consensus in SUMO fusion expression system inE. coli[J]. Protein Expr Purif, 2014,99: 18-26.
[13] Srivastava P, Bhattacharaya P, Pandey G,et al.Overexpression and purification of recombinant human interferon alpha2b inEscherichia coli[J]. Protein Expr Purif, 2005, 41(2): 313-322.
[14] Yang L M, Xue Q H, Sun L,et al. Cloning and characterization of a novel feline IFN-omega[J]. J Interferon Cytokine Res, 2007, 27(2): 119-127.
[15] Basu A, Li X, Leong S S. Refolding of proteins from inclusion bodies: rational design and recipes[J]. Appl Microbiol Biotechnol, 2011, 92(2): 241-251.
[16] Leong S S, Middelberg A P. The refolding of different α-fetoprotein variants[J]. Protein Sci, 2006, 15(9):2040-2050.
