蛋鸡Ⅰ群腺病毒湖北株的分离与分子鉴定
2018-04-25墨海峡陈雪姣欧阳金旭杨玉莹汪招雄
墨海峡,陈雪姣,周 鹏,江 涛,欧阳金旭,杨玉莹,汪招雄
(1.长江大学动物科学学院,荆州434025;2.湖北省荆州市畜牧兽医局,荆州434020)
禽腺病毒(Fowl Adenovirus,FAV)根据群特异性抗原的不同分为三个群,Ⅰ群禽腺病毒(FAV1)具有共同的群抗原,包括传统的禽腺病毒及其他禽类分离物,共12个血清型,代表株为鸡胚致死孤儿病毒(Chicken embryo lethal orphan virus,CELOV),属于血清1型腺病毒。该群病毒在鸡、鸭和鹅体内普遍存在,能使鸡群呈现隐性感染,可作为继发病原与其它病原共同作用家禽,并能垂直传播,污染鸡胚。鸡Ⅱ群禽腺病毒可以引起火鸡出血性肠炎(hemorrhagic enteritis,HE)、雏鸡大理石脾病(marble spleen disease,MSDA),这些病毒具有一种与Ⅰ群病毒不同群的抗原,自然界中也存在着无病原性的这类腺病毒并可作免疫预防;Ⅲ群腺病毒,即与减蛋综合征(egg drop syndrome,EDS)有关的一类病毒,可从鸡、鸭、鹅体内分离获得,致病性差异很大,部分含有Ⅰ群腺病毒的共同抗原。
“心包积水—肝炎综合症”(hydropericardium hepatitis syndrome,HHS)是由血清4型禽腺病毒(Fowl adenovirus type 4,FAV 4)引起的一种家禽疾病。典型症状是3~5周龄肉鸡、蛋鸡青年鸡、黄鸡及麻鸡突然死亡,并伴随有心包积水和肝炎。1963年Helmboldt 等在美国的肉用仔鸡中首次发现该病[1-3],之后墨西哥、加拿大、日本、澳大利亚等许多国家均报道有本病的发生[4,5]。1976 年,我国台湾首次报道了该病,随后辽宁省、吉林省、湖南省、江苏省和河南省等相继也发现该病的存在[6,7]。
本试验通过采集疑似“心包积水—肝炎综合症”蛋鸡肝脏,研磨无菌处理后接种SPF鸡胚分离病毒,提取DNA,经过对FAVhexon基因序列分析,确定分离的病毒为Ⅰ群4型禽腺病毒,通过动物回归试验,了解该病发病的临床症状和病理变化。
1 材料和方法
1.1 材料 疑似“心包积水-肝炎综合症”病死蛋鸡来源于湖北省荆州市、宜昌市和荆门市规模化蛋鸡场。
1.2 试剂 DNA提取试剂盒、dNTP、ExTaq酶、DNA Marker、pMD19-T载体购于TaKaRa公司。
1.3 病毒分离 无菌采集病鸡肝脏,按1∶5的比例加入灭菌生理盐水研磨成悬液,反复冻融3次后,5000 ×g离心20 min,上清用0.22 μm微孔滤器过滤,吸取0.2 mL滤液接种9~11日龄SPF鸡胚;弃24 h内死胚,取接种后48 ~72 h未死亡的鸡胚放于4℃冰箱保存5 h,收取尿囊液,盲传3代后,收集尿囊液-20℃保存备用。
1.4 细菌的分离 无菌取肝脏及心包积液,在麦康凯琼脂平板和血平板进行细菌分离,培养12 h,观察结果。
1.5 病毒基因组的提取 用TaKaRa试剂盒提取病料中病毒 DNA和RNA,按照试剂盒提供的方法操作。
1.6 PCR反应 根据GenBank 上已发表的1群腺病毒hexon基因序列,设计3对引物。H1:5'-TGGA CATGGGGGCGACCTA-3';H2:5'-AAGGGATT GACGTTGTCCA-3';H3:5'-AACGTCAACCCC TTCAACCACC-3',H4:5'-TTGCCTGTGGCG AAAGGCG-3';FAV4-F:5'-CGGGATCCA TGTCAGCAGTAGGCGATT-3',FAV4-R:5'-CCCAAGCTTTTACACGGCGTTGCT-3'。其中引物H1、H2扩增片段长度为1219 bp;引物H3、H4扩增的片段长度为1350 bp;引物FAV4-F、FAV4-R扩增片段长度为295 bp。引物用灭菌ddH2O稀释到20 μmol/mL,-20℃保存备用。PCR反应体系为25 μL:DNA模板2 μL、10×PCR buffer(含Mg+)2.5 μL、dNTP 2 μL、ExTaq酶 0.25 μL、上下游引物各1 μL、补充ddH2O至25 μL。反应程序:95℃预变性5 min;然后95℃变性1 min、56℃退火2 min、72℃延伸90 s、30个循环;72延伸10 min。1.7 PCR产物回收,连接及测序 经琼脂糖凝胶检测,切下与目的条带大小一致的片段,用试剂盒回收纯化。取回收产物与pMD-19T载体16℃连接8 h,转化 DH5α感受态细菌,涂布到选择性Amp平板,过夜培养后挑取单个菌落接种5 mL 含Amp的LB液体培养基,摇床转速200 r/min,37℃培养3~5 h,对菌液进行PCR鉴定,并送武汉擎科创新生物有限公司测序 。
1.8 序列比较 采用 DNAStar 软件系统进行将序列与禽腺病毒各群hexon序列进行分析,通过hexon基因序列区分血清型。参考的禽腺病毒信息,见表1。
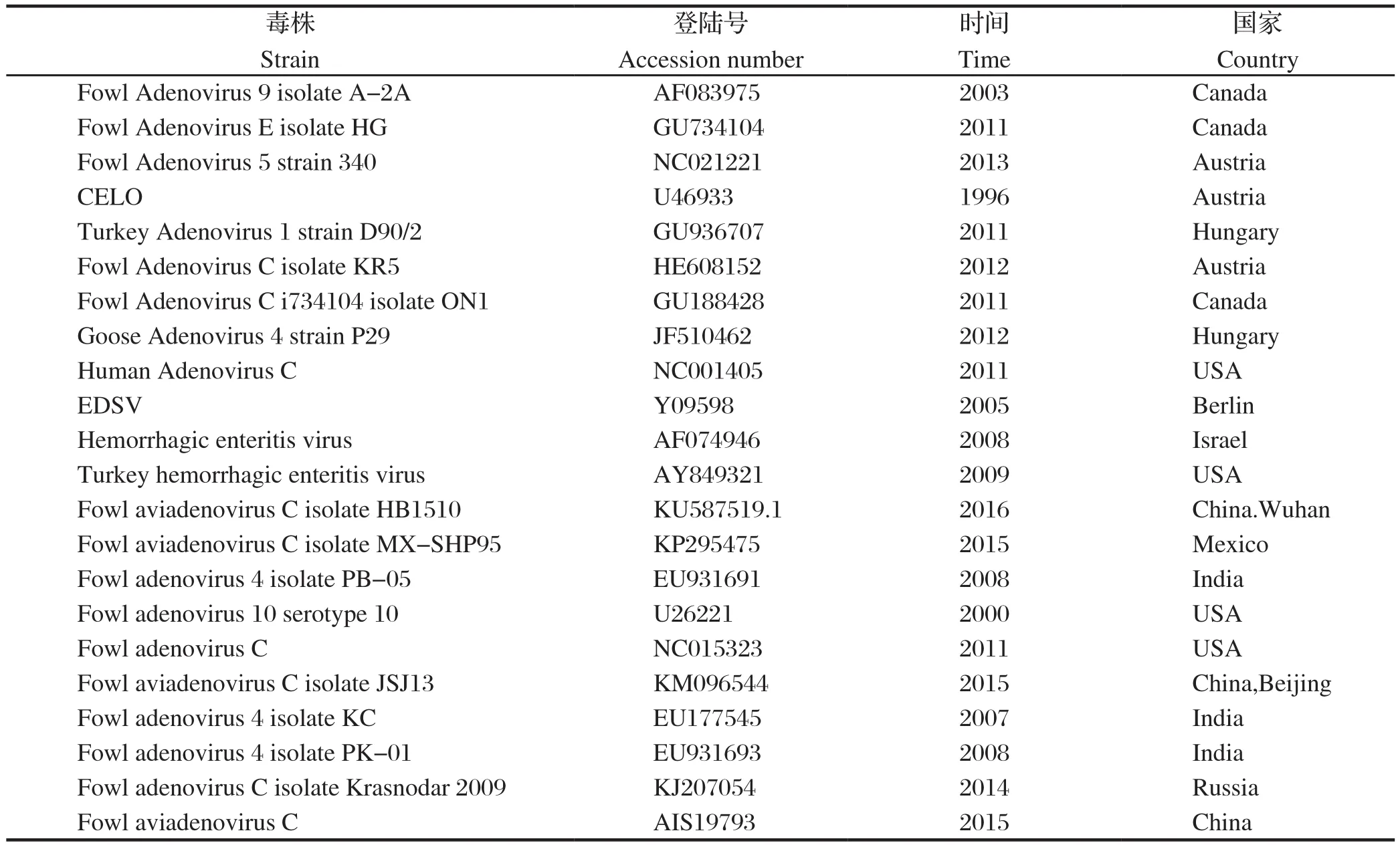
表1 禽腺病毒信息表Table 1 The information of the cited sequences
1.9 动物回归实验 将40只30日龄健康雏鸡随机分为两组,每组20只。A组为试验组,每只颈部皮下注射病毒尿囊液0.2 mL,B组为对照组,每只接种0.2 mL无菌生理盐水。鸡群感染后连续观察15 d,记录饮水、采食和死亡情况,并将试验组未死亡鸡和对照组鸡均解剖观察病理变化;试验组死亡鸡和未死亡鸡以及对照组鸡肝脏处理后,用PCR检测FAV4。
2 结果
2.1 眼观病理变化 临床发病鸡心脏上有黄色果冻状心包积液(图1A),肝脏呈现土黄色和出血点(图1B、E),肾脏肿大、苍白,脾脏肿大,腺胃在乳头基底部,靠肌胃交界处出血(图1C、D、F)。
2.2 细菌分离 将病料接种于麦康凯琼脂平板和血平板分离培养24 h左右后,均未观察到任何细菌生长,可以排除细菌感染。
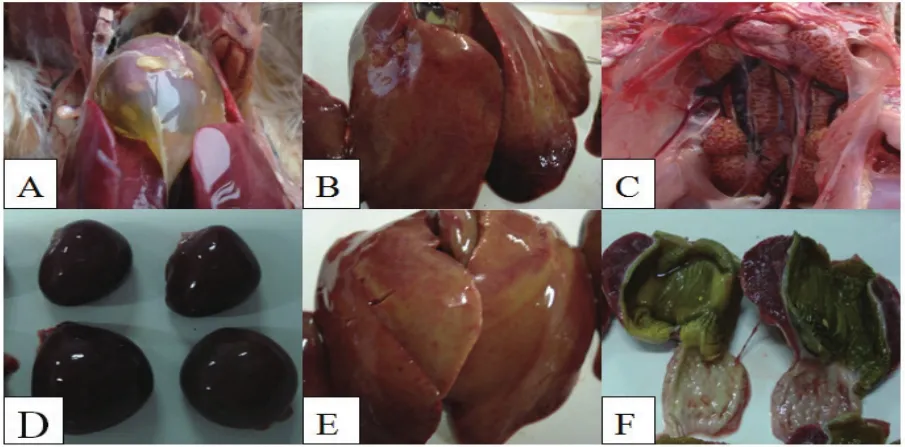
图1 不同器官病理变化Fig. 1 The pathological changes of different organs
2.3 PCR 扩增结果及产物的克隆 对提取的DNA进行PCR扩增,均扩增出相应的片段,与预期的目的片段大小相符,H1、H2引物扩增结果见图2A,H3、H4引物扩增结果见图2B,FAV-4引物扩增结果见图2C。

图2 不同引物PCR扩增结果Fig.2 The result of PCR ampli fi cation products by different primers
2.4 基因序列分析 3株来自不同鸡场病毒的基因同源率为100%。将分离毒株核苷酸序列与其他参考株病毒核苷酸序列(见表1)进行比较。结果如图3所示,分离的病毒与Ⅰ群禽腺病毒同源性相对较高,与2016年湖北武汉分离的HB1510株同源性最高,达到99.8%,与2003年加拿大分离到的Ⅰ群9血清型A-2A株的核苷酸序列相似性为69.6%,与鹅腺病毒4型P29株的同源性是64.2%,与人腺病毒C的同源性是45.9%;分离的毒株与Ⅱ群禽腺病毒2008年以色列分离出来的鸡出血性肠炎病毒同源性是43.3%,与2012年匈牙利分离得到的火鸡出血性肠炎病毒D90/2株同源性为78.6%,与美国2008年分离得到的同源性最高是43.1%;分离的毒株和Ⅲ群禽腺病毒的减蛋综合征病毒(GenBank登录号:Y09598)的同源率为43.8%。
遗传进化树显示,本实验分离株与Ⅰ群FAV亲缘关系最近,特别是与血清4型更接近。分离株与选取的禽腺病毒4血清型参考毒株在同一分支上,与Ⅰ群的其他血清型在不同分支,Ⅱ群和Ⅲ群单独在一个分支上,结果见图4。
2.5 动物回归实验
2.5.1 临床症状和病理变化 试验组在第3 d,2只鸡发病并出现急性死亡,部分鸡只精神沉郁、食欲减退,个别出现拉黄绿色粪便。在第4 d和第5 d出现死亡高峰期,15 d内死亡率达到60%;死亡鸡只心脏有心包积液;肝脏出血,部分出现土黄色肾脏肿大;肾脏肿胀、有出血点,输尿管尿酸盐沉积;肠道出血、腺胃出血。对照组没有出现发病症状和死亡现象,心脏和肝脏正常。
2.5.2 PCR检测结果 将试验组死亡鸡和未死亡鸡,以及对照组鸡均采集肝脏抽提DNA,用FAV-4引物进行PCR扩增鉴定,试验组死亡鸡和试验组未死亡鸡均呈阳性,而对照组鸡PCR扩增阴性。
2.6 病理组织学观察结果 攻毒组急性死亡鸡只病理切片如图5A所示,肝脏发生明显脂肪变性,同时有颗粒变性和水泡变性,无坏死现象,部分淤血出现;典型心包积水肝炎综合征的死亡鸡只病理切片如图5B所示,肝脏发生坏死,核浓缩,甚至部分消失,淤血明显;攻毒组未死亡鸡只如5C图所示,肝脏发生变性;5D图为对照组鸡只肝脏。
3 讨论
鸡心包积水-肝炎综合征的病理特征是心包积液和肝炎,同时心包积液也是禽类的一种疾病。通过病毒分离,可以用电子显微镜确定其与禽腺病毒有关。心包积液的病毒属于FAV4型,并且是高致病性的。从肝脏和鸡胚盲传3代后的尿囊液中均检测到FAV4,但是心包积液中未检测出。与2015年王婉等[8]试验结果不太一样,能直接用肝脏组织分离到病毒。
在之前的报道中,典型症状一般是3~5周龄肉鸡、蛋鸡青年鸡、黄鸡及麻鸡。在该病例中,从湖北地区40、60和240日龄的蛋鸡中均能分离出禽腺病毒,并且出现大面积死亡现象,说明该病毒目前广泛发生并且出现发病日龄扩大的趋势。
将病死鸡与动物攻毒组发病鸡解剖病理比较分析,都有黄色果冻状心包积液产生,心脏出现黄染;肝脏上有出血点,有些肝脏变成土黄色。送检病料中肾脏、脾脏病变比较明显,肾脏肿大,有现尿酸盐沉积,脾脏肿大明显,送检病料中腺胃乳头基底部靠近肌胃交界处有出血点,个别腿肌出血。而攻毒组肾脏肿大不明显,有尿酸盐沉积,脾脏无明显病变,没有肿大现象,而在肌胃腺、胃和腿肌均无出血点。

图3 分离株与参考毒株核苷酸序列分析Fig. 3 Nucleotide sequence analysis between isolates and reference strains
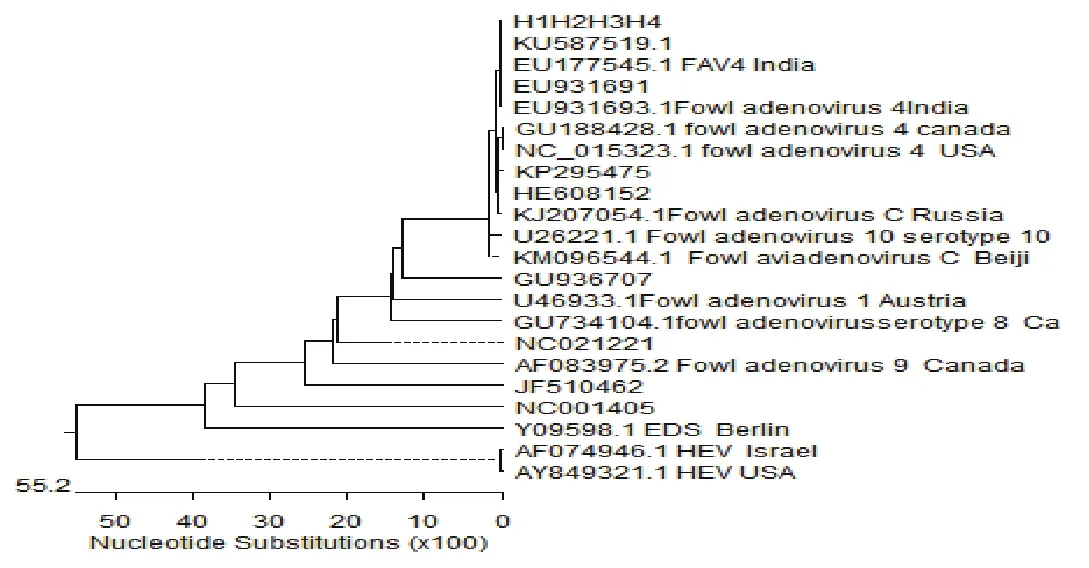
图4 分离株与参考毒株生物进化树分析Fig. 4 The analysis evolutionary tree between isolates and reference strains
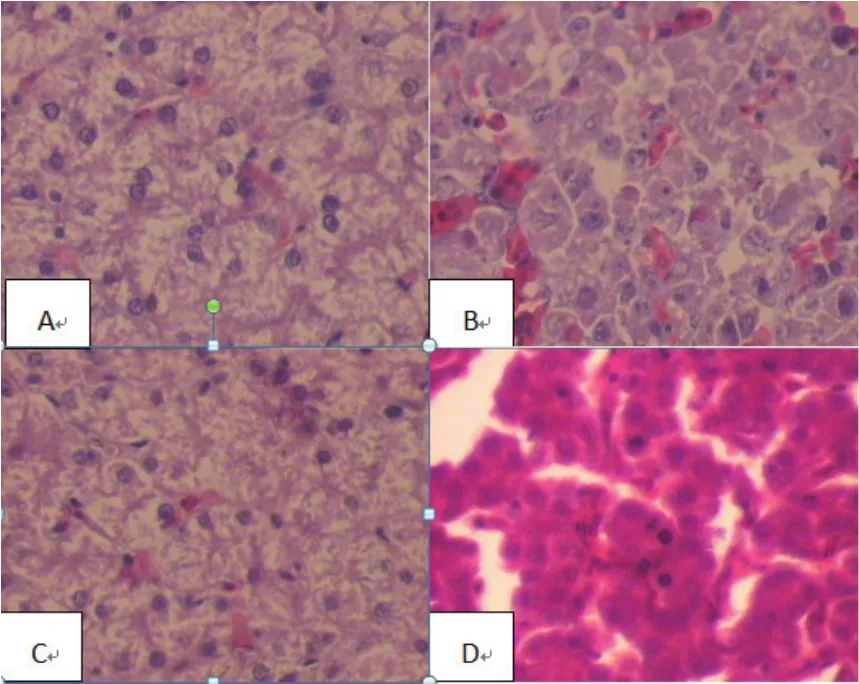
图5 病理组织图(10×40)Fig.5 The pathological chart(10×40)
近年来,越来越多FAdV不同血清型毒株引起的疾病在很多国家有报道[9-11],有些FAdV血清型毒株对鸡具有高致病性,引起很大的经济损失[12-15]。在中国,从2012年以来疫情呈上升趋势,大多数情况下导致3~5周龄肉鸡发病,偶尔发生于10~20周龄母鸡。在这些爆发的死亡率范围从轻微的增加到超过30%。
目前,在该病毒的基因中,hexon基因是研究范围最广的,具有群与型的特异性,包括4个可变环L1~L4结构,不同毒株的hexon基因序列均已公布,本实验中,用hexon基因序列设计的引物进行PCR扩增与克隆,测序片段包括了该基因的全序列,分离株与Ⅰ群FAV同源率最高,亲缘关系最近,特别是血清4型。而与Ⅱ群、Ⅲ群亲缘关系最远,属于不同的进化支,本研究为进一步研究心包积水-肝炎综合症奠定坚实的基础。
[1] Helmboldt C F, Frazier M N. Avian hepatic inclusion bodies of unknown significance[J]. Avian Dis, 1963,7(4):446-450.
[2] Reece R L, Barr D A, Grix D C,et al. Observations on naturally occurring inclusion body hepatitis in Victorian chickens[J]. Aust Vet J, 1986, 63(6):201-202.
[3] 陈昭奕. 鸡包涵体肝炎[J]. 江西畜牧兽医杂志, 1986(1):19-21.
[4] Saifuddin M, Wilks C R. Pathogenesis of an acute viral hepatitis: inclusion body hepatitis in the chicken[J]. Arch Virol, 1991, 116(1-4): 33-43.
[5] 张晟华, 杨文丽, 张连勇, 等. 鸡包涵体肝炎的病因、流行及病理分析[J]. 养殖技术顾问, 2012,10: 107.
[6] Cowen B, Mitchell G B, Calnek B W. An adenovirus survey of poultry flocks during the growing and laying periods[J]. Avian Dis, 1978, 22(1):115-121.
[7] 范秀媛, 张志鸿. 吉林境内发现鸡包涵体肝炎病[J]. 吉林畜牧兽医, 1991(3): 42.
[8] 王婉, 王彦红, 刘伊, 等. 鸡包涵体肝炎病原检测及病理学观察[J]. 畜牧兽医学报, 2015, 46(2): 273-278.
[9] Mase M, Nakamura K, Minami F. Fowl adenoviruses isolated from chickens with inclusion body hepatitis in Japan 2009-2010[J]. J Vet Med Sci, 2012, 74(8): 1087-1089.
[10] Mittal D, Jindal N, Tiwari A K,et al. Characterization of fowl adenoviruses associated with hydropericardium syndrome and inclusion body hepatitis in broiler chickens[J]. Virus Dis, 2014, 25(1): 114-119.
[11] Choi K S, Kye S J, Kim J Y,et al. Epidemiological investigation of outbreaks of fowl adenovirus infection in commercial chickens in Korea[J]. Poult Sci, 2012, 91(10):2502-2506.
[12] Dahiya S, Srivastava R N, Hess M,et al. Fowl adenovirus serotype 4 associated with out-breaks of infectious hydropericardium in Haryana[J]. Avian Dis, 2002, 46(1):230-233.
[13] Schonewille E, Singh A, Göbel T W,et al. Fowl adenovirus (FAdV) serotype 4 causes depletion of B and T cells in lymphoid organs in specific pathogenfree chickens following experimental infection[J]. Vet Immunol Immunopathol, 2008, 121(1-2):130-139.
[14] Mazaheri A, Prusas C, Voss M,et al. Some strains of serotype 4 fowl adenoviruses cause inclusion body hepatitis and hydropericardium syndrome in chickens[J].Avian Pathol, 1998, 27(3): 269-276.
[15] Steer P A, Sandy J R, O'Rourke D,et al. Chronological analysis of gross and histological lesions induced by field strains of fowl adenovirus serotypes 1, 8 and 11 in oneday-old chickens[J]. Avian Pathol, 2015, 44(2): 106-113.
