耳蜗基底膜组织巨噬细胞对噪声的反应
2018-04-19杨卫平许阳胡博华董有毅杨仕明
杨卫平 许阳 胡博华 董有毅 杨仕明
1解放军总医院耳鼻咽喉头颈外科,耳鼻咽喉研究所(北京100853)
2解放军总医院呼吸科(北京100853)
3美国纽约州立布法罗大学听力及聋病研究中心(NY14214USA)
噪声性聋是一种最常见的感音神经性聋,由于交流障碍极大的影响了患者的生活质量。噪声性耳蜗损伤是由耳蜗内组织机械性损伤引起的多方面反应,包括氧化反应、炎性反应、能量代谢障碍等导致耳蜗细胞生物和分子的变化。最新研究通过对噪声暴露后小鼠和大鼠耳蜗感觉上皮相关基因RNA序列变化,及对差异表达基因的转录序列生物信息分析后发现,免疫和炎性反应是噪声暴露后耳蜗的主要反应[1]。
由于血脑、血迷路屏障的存在,内耳曾被认为是一个“免疫豁免器官”。近年来研究证明,内耳具有免疫应答,免疫防疫和免疫调节功能[2-4]。Corti器位于耳蜗基底膜的顶部,由感觉细胞(内、外毛细胞)和支持细胞构成,Corti器的感觉细胞对噪声等损伤因素最为敏感[5]。在生理状态下耳蜗Corti器缺少免疫细胞,噪声暴露后未见单核细胞渗入Cor⁃ti器[6]。耳蜗基底膜底部最接近Corti器,是否由耳蜗基底膜底部的免疫细胞对Corti器损伤的感觉细胞起到免疫监视作用?鉴于噪声暴露后耳蜗基底膜免疫反应问题,我们采用白细胞共同抗原(CD45)荧光免疫抗体标记耳蜗基底膜免疫细胞,观察噪声暴露前后耳蜗基底膜底部的免疫细胞形态的变化,为揭示噪声暴露后耳蜗基底膜免疫反应机制提供研究基础。
1 材料和方法
1.1 实验动物及分组
入选C57BL/6J小鼠(24只,4-8周,雌雄各半),购自杰克逊实验室(Jackson Laboratory,Bar Harbor,ME,USA)。动物随机分为实验组和对照组,接触噪声暴露动物为实验组,噪声暴露后1、4和10天处死小鼠各6只,未接触噪声暴露动物6只为对照组。动物均无强噪声暴露和耳毒性药物使用史,所有实验程序均符合美国纽约州立布法罗大学动物管理和使用委员会的伦理认证。
1.2 实验步骤
所有实验动物首先接受听力学基线评估。噪声暴露1天、4天和10天后处死动物,观察噪声暴露后耳蜗基底膜免疫细胞的变化。噪声暴露10天组动物处死之前检测ABR,定量观察耳蜗毛细胞缺失数量,目的评估噪声暴露后耳蜗听功能和感觉细胞形态学的变化。
1.3 脑干诱发电位反应阈值(ABR)测试
动物于噪声暴露前及噪声暴露后10天,腹腔内注射氯胺酮(87mg/kg)和赛拉嗪(3mg/kg)混合剂麻醉后,将动物置于加热毯上维持体温在37.5℃。记录电极置于动物颅顶皮下,参考电极和接地电极分别置于测试耳和对侧耳后皮下。应用电位反应测听仪(SigGen,Turker-Davis Technologies,TDT,Alachua,FL,USA)检测不同频率(4、8、16和 32 kHz)短声诱发的动物双耳听性脑干反应阈值(ABR),刺激重复率21次/秒。带通滤波100~3000Hz,刺激强度为20 ~100 dBSPL,间隔 5 dB。
1.4 噪声暴露
噪声信号由实时信号处理器(RP2.1,Tucker Davis Technologies,TDT,USA)产生,经衰减器(PA5 TDT,USA)和放大器(Crown XLS 202,Harman Inter⁃national Company,USA)传至扬声器(NSD2005-8,Eminence,USA)。噪声暴露在隔声室内进行,扬声器悬挂于动物笼子正上方30cm处。应用声级计(LD-PCB,model 800B,APCB Piezotronics Div.,Lar⁃son Davis,USA)、前置放大器(LD-PCB,model 825,Larson Davis,USA)和电容式微音器(Larson and Da⁃vis,LDL 2559,USA)测量校准噪声强度。噪声暴露条件为:宽带1-7kHz,120dBSPL,1小时。
1.5 损伤的感觉细胞评估
噪声暴露后10天,ABR测试,CO2深度麻醉动物后处死,快速解剖取出双侧耳蜗,10%福尔马林室温固定4小时,为减少解剖因素造成人为的组织损伤,采用本课题组建立的原位耳蜗基底膜毛细胞观察方法[7],染色评估噪声暴露后耳蜗毛细胞损伤情况。显微镜下去除蜗尖和外侧壁部分,充分暴露耳蜗基底膜。用Alexa Fluor 488 phalloidin(1:75,Applied Biosystems,Carlsbad,CA,USA,10mM PBS稀释)染色耳蜗毛细胞丝状肌动蛋白(Filamentous actin,F-actin)。室温避光孵育30分钟,PBS液漂洗后将耳蜗置于培养皿中,荧光显微镜下观察毛细胞形态变化。
1.6 CD45荧光免疫抗体标记耳蜗基底膜
噪声暴露后1、4、10天快速解剖取出双侧耳蜗,经10%福尔马林4°C过夜固定后,分离耳蜗基底膜,将分离的耳蜗基底膜置入10mM PBS液清洗后,移入0.5%聚乙二醇辛基苯基醚(Triton X-100,10%羊血清白蛋白,10mM PBS液稀释,pH 7.40)液中,室温作用1h。10mM PBS液清洗组织后,将耳蜗基膜移入10mM PBS稀释的CD45抗体(goat CD 45 polyclonal antibody 1:200,AF114,RD Inc.,USA)液中4°C过夜。PBS液清洗组织后,将耳蜗基膜移入10 mM PBS稀释的二抗液中(Alexa Fluor®488 donkey anti-goat IgG,1:200 in PBS,Invitrogen)室温孵育2h,PBS液清洗组织。为鉴别非特异性染色,小块标本仅用二抗液孵育。将标本移入5μg/ml碘化丙锭(propidium lodide,PI,Molecular probe,Inc.,Eugene,OR,USA)染色液中(10mM PBS配制),室温避光染色10min。将PBS清洗后的标本平铺于载玻片,抗荧光退变剂(ProlongTM Antifade kit,Molecu⁃lar Probes Inc.USA)封片。
1.7 荧光显微镜观察和计算机图像分析
荧光显微镜下(Leica Z6 APO Manual Macro⁃Fluo,USA)观察,采用显微镜附件数码相机(SPOT RT,Color Diagnostic Instruments,Inc.,Sterling Heights,MI,USA)拍照全耳蜗基底膜,利用计算机图像处理软件(Adobe Photoshop CS6,version 13.0.1,Adobe Systems,San Jose,CA,USA)自动合成视图。观察噪声暴露后小鼠耳蜗基底膜毛细胞和免疫细胞形态变化,自耳蜗顶回到底回计数全耳蜗基底膜缺失的毛细胞和CD45荧光染色阳性的免疫细胞。
1.8 数据分析
使用SigmaStat(Version3.5,San Jose,CA,USA)软件进行数据分析。比较噪声暴露前与噪声暴露后10天小鼠不同频率ABR阈值(x±s),采用两因素方差分析检验(时间×频率)。比较噪声暴露前与噪声暴露后10天小鼠耳蜗基底膜顶回、底回毛细胞缺失数目(x±s),采用两因素方差分析检验(时间×部位)。比较噪声暴露前与噪声暴露后1、4、10天小鼠耳蜗基底膜顶回、底回CD45免疫阳性细胞数目±s),采用两因素方差分析检验(时间×部位)。P<0.05认为具有统计学意义。
2 结果
2.1 噪声暴露后小鼠听阈升高
噪声暴露前和噪声暴露后10天,分别进行ABR检测,了解噪声暴露对实验动物听功能的影响,结果显示噪声暴露后所有检测频率的ABR阈值均明显提高(F=1622.754,df=1,104,P<0.001;Tukey test,P<0.001),4个频率的平均阈值由37.3±15.1 dBSPL提高至75.3±11.1 dBSPL,平均阈移为38.0±9.0 dBSPL,见图1B所示。
2.2 噪声致耳蜗毛细胞损伤
Alexa 488-labeled phalloidin染色毛细胞纤毛、表皮板后,荧光显微镜下观察噪声爆震后10天耳蜗基膜毛细胞形态的变化,如图1A所显示,外毛细胞损伤明显,外毛细胞染色区缺失被记为毛细胞缺失。缺失的细胞出现在三排外毛细胞,第3排外毛细胞损伤最为严重,其次为第2排、第1排外毛细胞。定量观察发现,噪声暴露后全耳蜗基底膜毛细胞缺失数目增多,底回外毛细胞缺失数目明显多于顶回(F=92.484,df=1,40,P<0.001;Tukey test,P< 0.001),见图1C所示。
2.3 免疫细胞在耳蜗基底膜底面的分布和形态特点
荧光显微镜下观察,在生理条件下小鼠耳蜗基底膜底面(鼓阶面)存在CD45阳性免疫细胞,这些阳性免疫细胞主要为巨噬细胞,巨噬细胞分布于全耳蜗外侧壁和骨螺旋板之间的耳蜗基底膜。CD45阳性细胞存在多种形态,其不同形态与耳蜗存在的部位相关。小鼠耳蜗基底膜为两圈,顶回的巨噬细胞胞体呈树枝状,多个细长突起,胞浆少,细胞核多,核呈不规则型(见图2A,细胞核染色未出示)。底回细胞胞体呈树干状或不规则的圆形、卵圆形,枝状突起缩短、减少或消失,胞浆增多(见图2D)。除巨噬细胞外,极少量的单核细胞存在于耳蜗基底膜底面,单核细胞为小圆型,细胞核大而圆。
2.4 噪声暴露后耳蜗基底膜免疫细胞的变化
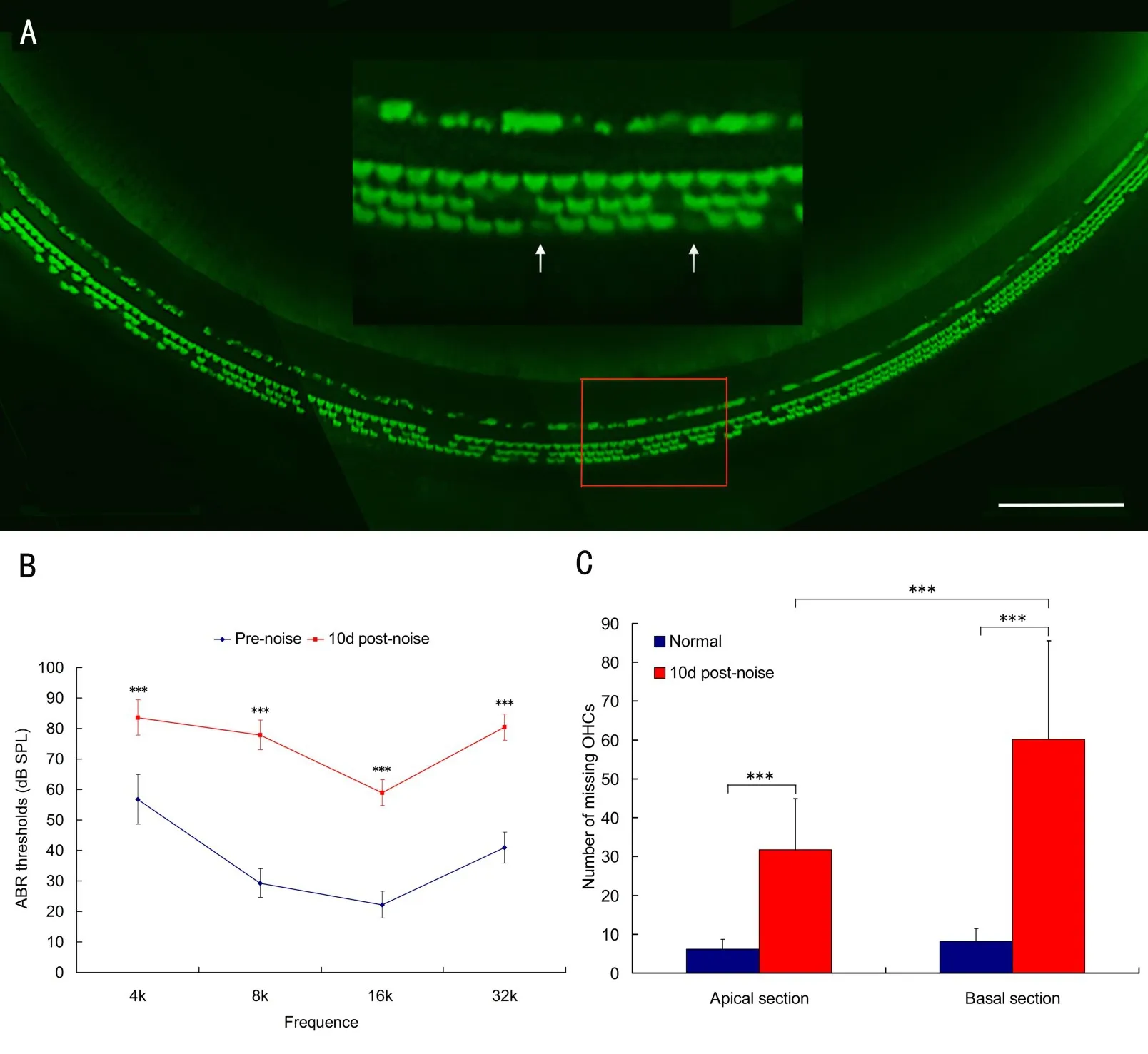
图1 噪声暴露后10天耳蜗听功能下降毛细胞损伤。A:Alexa 488-labeled phalloidin染色的小鼠耳蜗基底膜底回毛细胞(200×),噪声暴露后第3排外毛细胞缺失数目最多,箭头示缺失的外毛细胞区域,标尺=100m;B:比较噪声暴露前后小鼠4个频率ABR阈值的变化,噪声暴露后10天小鼠不同频率ABR阈值均明显高于对照组(P<0.001);C:定量观察噪声暴露后10天耳蜗基底膜顶回、底回外毛细胞缺失数目。与对照组比较,噪声暴露后小鼠耳蜗基底膜顶回、底回外毛细胞缺失数目均增多,实验组底回外毛细胞缺失数目明显多于顶回(P<0.001)。Fig.1 Structural damage and functional loss of the cochleae examined at10 days after exposure to an intense noise at120 dB sound pressure level(SPL)for 1 hour.A:Typical image of F-actin staining using Alexa 488-labeled phalloidin in hair cells in the basal section of cochlea(200×).The third row of out hair cells(OHCs)show the most damage,followed by the second and first rows of OHCs.Arrows point to the areas of missing outer hair cells.Bar=100m.B:Comparison of ABR thresholds at the 4 tested frequencies before and after noise exposure groups.The thresholds are significantly elevated above baseline with an increase at all tested frequencies in animal after noise exposure P<0.001.C:Comparison of the number of missing OHCs before and afternoise exposure in the apical and basal sections in the basilarmembrane of cochlea.The average number of missing cells in the noise-injured ears is significantly higher than in the control ears P <0.001,and the average number of missing cells in the basal section is significantly higher than that observed in the apical section P<0.001.
噪声暴露后1天,单核细胞渗入耳蜗基底膜鼓阶面,侵润的CD45阳性的小圆细胞出现在耳蜗基底膜与外侧壁交界处(见图2E),主要分布于耳蜗基底膜底回的上部,其分布与耳蜗感觉细胞损伤主要区域相吻合。噪声暴露后4天,CD45阳性的小圆细胞胞体变大,出现细而短的突起,表明单核细胞转化为巨噬细胞(见图2C,F)。尽管耳蜗基底膜原有巨噬细胞数量减少,但由于大量单核细胞转化为巨噬细胞,耳蜗基底膜底回CD45阳性细胞密度增加(见图2F)。噪声暴露后10天,耳蜗基底膜CD45阳性细胞形态与对照组无明显改变。噪声暴露后Corti氏器未见单核细胞迁入。图3显示噪声暴露前及噪声暴露后1,4,10天耳蜗基底膜顶回、底回CD45阳性细胞数目。噪声暴露后1天,耳蜗基底膜CD45阳性细胞数目较正常对照组略有增加,但无统计学意义。噪声暴露后4天,耳蜗基底膜顶回、底回CD45阳性细胞数目均较正常对照组明显增加(F=15.205,df=3,46,P<0.001;Tukey test,P<0.001),耳蜗底回CD45阳性细胞数目多于顶回P<0.05。噪声暴露后10天,CD45阳性细胞数目下降接近对照组。
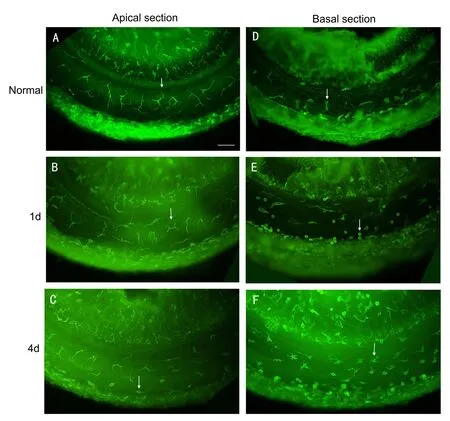
图2 噪声暴露前后耳蜗基底膜底面CD45标记的免疫细胞形态。A,B,C:耳蜗基底膜顶回。D,E,F:耳蜗基底膜底回。A和D,B和E,C和F分别为正常对照,噪声暴露后1天,4天耳蜗基底膜免疫细胞。箭头示不同时间典型的免疫细胞形态,标尺=40m.Fig.2 Typical morphology of immune cells stained w ith CD45 beneath the basil armembrane of cochlea before and after noise exposure.A,B and C:Morphology of immune cells in the apical section.D,E and F:Morphology of immune cells in the basal section.A and D,B and E,Cand F:Morphology of immune cells before and 1day,4 days after noise exposure respectively.Arrowspoint to the typical morphology of immune cells in the different time.Bar=40m.

图3 噪声暴露前及噪声暴露后1天、4天和10天耳蜗基底膜底面顶回、底回CD45阳性细胞数目。与噪声暴露前比较,噪声暴露后4天耳蜗基底膜顶回、底回CD45阳性细胞数目明显多于对照组P<0.001,底回CD45阳性数目明显多于顶回 P<0.05。Fig.3 Comparison of the numbers of CD45 positive cells in the apical and basal sections in the basilarmembrane of cochlea between the control and after noise exposure 1,4 and 10 days groups.The number of immune cells in the apical and basal sections at 4 days post-noise exposure is significantly greater than in the control group P < 0.001,and the average number of CD45 positive cells in the basal section is significantly higher than that observed in the apical section P<0.05。
3 讨论
本实验小鼠ABR检测和缺失毛细胞计数结果表明,噪声暴露后动物存在耳蜗听功能和感觉细胞的损伤。我们研究的主要目的是揭示耳蜗基底膜鼓阶面免疫细胞的形态特点及噪声暴露后的变化。其主要发现:1,正常动物耳蜗基底膜底侧面存在巨噬细胞,这些细胞呈现不同的形态特点。2,噪声暴露后出现时间相关的单核细胞渗入和转化。3,噪声暴露后单核细胞渗入与感觉细胞损伤区域相吻合。4,噪声暴露后耳蜗基底膜底回毛细胞缺失与免疫阳性细胞数目明显增多的趋势相一致。表明单核细胞侵润是噪声暴露后耳蜗基底膜的主要免疫反应。
CD45是白细胞共同抗原,巨噬细胞常用的标记物。本实验采用CD45免疫荧光标记耳蜗基底膜免疫细胞。Hirose K等在2017年报道中指出,耳蜗内的巨噬细胞不是小胶质细胞[8]。主要依据:1,细胞表面标记物和功能蛋白检测发现,巨噬细胞表达CD68,CD45,iba-1,F4/80和CX3CR1,证明这些细胞具有典型的组织巨噬细胞的性质。2,内耳的巨噬细胞体积大,突起粗,分布于内耳组织。与巨噬细胞相比,小胶质细胞体积小,突起细,分布于脑实质组织内。3,定居型耳蜗组织巨噬细胞存在更新,组织巨噬细胞源自血液中的单核细胞,单核细胞源自骨髓中的前体细胞。而小胶质细胞则源于卵黄囊中胚层的原始细胞。γ射线照射杀死耳蜗内巨噬细胞和所有骨髓造血细胞的小鼠,接受健康动物带有内源性荧光标记的骨髓移植后的2-3月内,重新构建了耳蜗内的组织巨噬细胞。证明定居型耳蜗组织巨噬细胞源自骨髓中的前体细胞,而小胶质细胞不能更新定居型耳蜗组织的巨噬细胞。本实验观察到噪声暴露后,单核细胞渗入耳蜗基底膜,并转化为组织巨噬细胞的结果,支持耳蜗基底膜的组织巨噬细胞不是小胶质细胞的观点。
在生理情况下,耳蜗的螺旋韧带、螺旋板、螺旋神经节和血管纹周围血管存在免疫细胞[9-12]。本文报道了耳蜗基底膜的底部存在巨噬细胞的分布特点,这些细胞从顶回到底回分布于整个耳蜗基底膜,广泛的分布模式表明全耳蜗基底膜存在免疫监督。耳蜗基底膜组织巨噬细胞的形态特点为本研究的一个重要发现,值得注意的是,生理条件下巨噬细胞的形态与其在耳蜗基底膜部位相关。顶回的巨噬细胞呈树枝状,而底回的巨噬细胞呈不规则状,推论基底膜巨噬细胞存在多种亚群体。这种异质性表明,耳蜗基底膜顶回和底回的巨噬细胞具有部位相关的不同功能,其在耳蜗基底膜顶回和底回的功能尚不清楚。研究表明,耳蜗基底膜底回的感觉细胞对老化和噪声等损伤较顶回更为敏感[13,5],不同的免疫功能可能是其作用之一。
组织巨噬细胞分为定居型和游走型。巨噬细胞源自于单核细胞,有研究报道,噪声暴露后单核细胞渗入耳蜗组织,其在耳蜗损伤和恢复中的作用尚不清楚[9,11,14]。我们发现噪声暴露后1天单核细胞侵润耳蜗基底膜的底面,噪声暴露后4天转化为巨噬细胞。前期研究发现,噪声暴露后10分钟耳蜗基底膜外毛细胞核出现固缩,30分钟可见核肿胀细胞[15]。噪声暴露后耳蜗基底膜单核细胞的渗入和转化发生在噪声暴露后1-4天,推论耳蜗细胞的免疫反应发生在耳蜗基底膜细胞损伤之后,时间相关的单核细胞渗入及巨噬细胞的转换是耳蜗免疫反应一个重要的起始步骤。噪声暴露后10天耳蜗基底膜免疫细胞数目接近噪声暴露前水平,与噪声暴露后内耳免疫炎性反应的相关报道结果相吻合[14]。
单核细胞从何处进入耳蜗基底膜并不十分清楚,有学者认为单核细胞从骨螺旋板血管和它的分支进入耳蜗基底膜[16]。我们认为耳蜗外侧壁可能是单核细胞进入耳蜗基底膜的主要部位,因为耳蜗外侧壁的血管纹和螺旋韧带存在丰富的血管系统。本研究发现单核细胞簇存在于耳蜗基底膜与外侧壁的连接处,推论单核细胞主要来自耳蜗外侧壁的血管。
单核细胞的渗入和转化主要发生在耳蜗基底膜的底回上部,其与感觉细胞损伤主要区域相吻合。组织的巨噬细胞具有三种基本的免疫功能:损伤细胞的吞噬,产生炎性分子,抗原呈递作用[2,8,17]。巨噬细胞属于抗原呈递细胞,加工处理抗原,将其传递给T淋巴细胞,诱导免疫应答反应。定量研究发现,噪声暴露后耳蜗底回毛细胞缺失和CD45阳性免疫细胞数目增多的结果相一致,推论巨噬细胞参与了噪声性耳蜗基底膜感觉细胞的损伤过程。巨噬细胞分为两种亚型,即M1型和M2型。M1型参与促炎反应,M2型参与抗炎反应[18]。活化的M2型巨噬细胞能够分泌大量的抗炎因子如IL-10等,下调M1型启动的免疫应答,在炎性反应中发挥修复作用[19-20]。噪声暴露后耳蜗毛细胞通过两种方式死亡,即凋亡和坏死。凋亡细胞死亡后被吞噬细胞清除,不造成炎性反应。坏死细胞死亡后,细胞内溶酶体膜破裂,释放大量溶酶体内的水解酶,造成周围细胞的次级损伤。组织巨噬细胞在耳蜗损伤早期阶段可能发挥促进炎症反应的作用,在耳蜗损伤晚期阶段参与组织的修复过程,其具体功能有待于进一步研究揭示。
总之,免疫应答是耳蜗对各种损伤的一种重要反应。作为耳蜗免疫系统的一个重要参与者,耳蜗基底膜组织巨噬细胞存在于耳蜗基底膜鼓阶侧面。巨噬细胞是耳蜗基底膜组织主要的免疫细胞,在生理条件下巨噬细胞分布于整个耳蜗基底膜。这些细胞在耳蜗基底膜的顶回和底回呈现不同的形态。噪声暴露后单核细胞渗入耳蜗基底膜转化为巨噬细胞。单核细胞侵润和转化的时间、主要部位及细胞数量的变化,提示免疫细胞在噪声暴露后耳蜗的损伤和修复中起到重要的作用。
1 Yang SZ, Cai QF, Vethanayagam RR, et al. Immune Defense Is thePrimary Function Associated With the Differentially Expressed,2016,333:283-294.
2 Hu BH, Zhang C, Frye MD. Immune Cells and Non-Immune CellsWith Immune Function in Mammalian Cochleae. Hear Res.2017.12.009.
3 胡博华.噪声性耳聋:基础研究进展和展望[J].中华耳科学杂志.2016,14(6):693-700.Hu BH.Noise-Induced Hearing Loss:A Review of Recent Ad⁃vances[J].Chinese Journal of Otology,2016,14(6):693-700.
4 Kalinec GM,Lomberk G,Urrutia RA,et al.Resolution of Cochle⁃ar In for mmation:Novel Target for Preventing or Ameliorating Drug-,Noise-and Age-Related Hearing Loss.Front Cell Neuro⁃sci,2017,11:192.doi:10.3389/fncel.2017.00192.e Collection 2017.
5 Vethanayagam RR,Yang W,Dong Y,et al.Toll-Like Receptor 4 Modulates the Cochlear Immune Response to Acoustic Injury.CellDeath Dis,2016,7(6):e2245.doi:10.1038/cddis.2016.156.
6 Du X,Choi CH,Chen K,et al.Reduced Formation of Oxidative Stress Biomarkers and Migration of Mononuclear Phagocytes in the Cochleae of Chinchilla After Antioxidant Treatment in Acute Acoustic Trauma.International Journal of Otolaryngology,2011,2011:612-690.
7 Cai Q, Vethanayagam RR, Yang S, et al. Molecular Profile of Co⁃chlear Immunity in the R,2014,11(1)173-194.
8 Hirose K,Rutherford MA,WarcholME.Two Cell Population Par⁃ticipate in Clearance of Damaged Hair Cells From the Sensory Ep⁃itheliaof the Inner Ear.Hear Res,2017,352:70-81.
9 Hirose K,Discolo CM,Keasler JR,et al.Mononuclear Phagocytes Migrate Into the Murine Cochlea After Acoustic Trauma.JComp Neurol,2005,489(2):180-194.
10 Okano T,Nakagawa T,Kita T,et al.Bone Marrow-Derived Cells Expressing Iba1 Are Constitutively Present as Resident Tissue Macrophages in the Mouse Cochlea.JNeurosci Res,2008,86(8):1758-1767.
11 Tornabene SV,Sato K,Pham L,et al.Immune Cell Recruitment Following Acoustic Trauma.Hear Res,2006,222(1-2):115-124.
12 Shi X.Resident Macrophages in the Cochlear Blood-Labyrinth Barrier and Their Renewal via Migration of Bone-Marrow-De⁃rived Cells.Celland Tissue Research,2010,342(1):21-30.
13 Frye MD,YangW,Zhang C,et al.Dynamic Activation of Basilar Membrane Macrophages in Response to Chronic Sensory Cell De⁃generation in Aging Mouse Cochleae.Hear Res,2017,344:125-134.
14 Wakabayashi K,Fujioka M,Kanzaki S,et al.Blockade of Interleu⁃kin-6 Signaling Suppressed Cochlear Inflammatory Response and Improved Hearing Impairment in Noise-Damaged Mice Cochlea.Neuroscience Research,2010,66(4):345-352.
15 杨卫平,于黎明,胡吟燕,等.脉冲噪声暴露后早期大鼠耳蜗外毛细胞死亡时程观察[J].解放军医学杂志.2006,31(6):543-544.YangWP,Yu LM,Hu YY,et al.Time Sequential Analysis of the Death of Rats Cochlear Outer Hair Cells at the Early Stage After Exposure to Impulse Noise[J].Med JChin PLA,2006,31(6):543-544.
16 Harris JP,Fukuda S,Keithley EM.Spiral Modiolar Vein:Its Im⁃portance in Inner Ear Inflammation.Acta Otolaryngol,1990,110(5-6):357-365.
17 Yang W,Vethanayagam RR,Dong Y,et al.Activation of the Anti⁃gen Presentation Function of Mononuclear Phagocyte Populations Associated With the Basilar Membrane of the Cochlea After Acoustic Overstimulation.Neuroscience,2015,303:1-15.
18 Hirayama D,Lida T,Nakase H.The Phagocytic Function of Mac⁃rophage-Enforcing Innate Immunity and Tissue Homeostasis.Int JMolSci,2017,19(1).pii:E92.doi:10.3390/ijms19010092.
19 Wood MB,Zuo J.The Contribution of Immune Infiltrates to Oto⁃toxicity and Cochlear Hair Cell Loss.FrontCellNeurosci,2017,11:106.doi:10.3389/fncel.2017.00106.eCollection 2017.
20 Li YW,Zhang C,Sheng QJ,et al.Mesenchymal Stem Cells Res⁃cue Acute Hepatic Failure by Polarizing M2 Macrophages.World JGastroenterol,2017,23(45):7978-7988.
