马鞍山地区耳聋相关基因变异分析
2018-04-19王栋魏澄章雪芹胡晓武
王栋魏澄 章雪芹 胡晓武
1马鞍山市临床检验中心,马鞍山市立医疗集团(马鞍山243000)
2马鞍山市妇幼保健院,马鞍山市立医疗集团(马鞍山243000)
耳聋是人类的常见疾病之一,与遗传因素密切相关[1]。遗传性耳聋分为综合征型和非综合征型,其中70%为非综合征型。非综合征型耳聋可以分为常染色体显性(DFNA,15-20%)、常染色体隐性(DFNB,80%)、性连锁(DFNX-linked、DFNY-linked,1%)和线粒体遗传性耳聋(<1%)四类[2]。迄今为止,超过200个综合征型和非综合征型耳聋基因被发现,但仍有大量的遗传性耳聋致病基因不明确,而多数耳聋基因突变极为罕见,只在单个或极少数的家庭中被报道[1]。
马鞍山市妇幼保健院儿保科听力筛查中心对6060例新生儿进行DPOAE+AABR联合听力筛查,经听力学诊断,听力异常58例,听力损失检出率为9.57‰(58/6060)[3]。同时遗传性耳聋基因筛查是新生儿听力筛查很好的补充,有助于迟发性耳聋的早期发现及预防[4]。为了解地区人群中的耳聋相关基因位点变异信息,为听力损失的遗传学成因分析提供参考依据,本文通过检出马鞍山地区人群中GJB2、GJB3、SLC26A4和MT-RNR1基因位点的变异,分析各变异的频率和基因型分布,探索听力损失与正常听力人群中的频率分布差异,研究位点变异与听力损失间的关系。本文参照HGVS命名规范[5-6]来描述所有的基因变异,其中c.512insAACG[7]描述为 c.508_511dup,605ins46[8]描述为c.559_604dup。
1 资料与方法
1.1 研究对象
2014年12月-2017年2月于马鞍山市临床检验中心接受遗传性耳聋基因芯片检测的共2705名受检者,包括马鞍山市妇幼保健院及市人民医院出生的新生儿2633名,市妇幼保健院儿保科听力筛查中心门诊的婴幼儿及成人72名。新生儿的平均日龄为3.31±1.02天,门诊婴幼儿及成人的年龄1月至29岁不等,年龄中位数为3个月。男性共1439名,女性共1266名。经听力学评估确诊为听力损失的共58名。经Sanger测序检测的受检者共386名,其中GJB2基因测序的有277名,GJB3基因测序的有46名,SLC26A4基因测序的有97名,MT-RNR1基因测序的有76名,部分受检者对两个及两个以上的基因进行测序。所有受检者均已签署知情同意书。
1.2 方法
1.2.1 标本的采集及处理
新生儿受检者采集足跟血,门诊受检者采集2mLEDTA抗凝全血后,在空白滤纸片上制成血斑标本。人基因组DNA提取采用北京天根生化科技有限公司的干血斑基因组DNA提取试剂盒,操作步骤参照说明书进行。
1.2.2 热点致病变异的检测
应用博奥生物有限公司的晶芯九项遗传性耳聋基因检测试剂盒(微阵列芯片法)检测中国人群中的四个耳聋相关基因上的九个热点致病变异,即GJB2c.35del、c.176_191del、c.235del、c.299_300del,GJB3c.538C>T,SLC26A4c.919-2A>G、c.2168A>G,MT-RNR1m.1494C>T、m.1555A>G。配合芯片洗干仪、微阵列芯片扫描仪和判别软件对芯片进行清洗、扫描和结果判读。对判读结果中的所有阳性标本和随机挑选的部分阴性标本,送至北京博奥晶典生物技术有限公司进行Sanger法测序验证。
1.2.3 其它位点变异的检测
参考四个耳聋相关基因的NCBI参考序列,对测序结果的所有序列文件进行MegAlign比对,去除测序带来的前后段差异,截选中段的一致序列作为每个基因的可监测区域。选择野生型作为参考峰图,应用Mutation Surveyor 2.28软件查找其余峰图中的位点变异。位点变异及其临床表征参考NC⁃BIdbSNP数据库Build 141(https://www.ncbi.nlm.nih.gov/snp)和耳聋变异数据库Version 8(http://deafness⁃variationdatabase.org)。应用的其他生物信息学软件包括 Chromas 2.11、DNA STAR 7.10和 DNA⁃MAN8。
1.2.4 数据分析及统计学方法
最小等位基因频率MAF计算的是总样本群体中的不常见等位基因的发生频率,计算公式为MAF=(低频纯合子×2+杂合子)/(总样本数×2)。总样本群体不区分听力表型,仅区分基因型,相同基因型的听力损失组与正常听力组人数相加。总样本群体是否符合Hardy-Weinberg平衡采用卡方检验,P>0.05表示符合。应用SPSS 19.0软件,比较两组间的热点致病变异检出率,采用校正卡方检验;应用SHEsis软件分析各位点变异的基因型频率组间差异,采用Fisher精确检验;应用Haploview 4.2软件分析连锁不平衡,rs2274084和rs2274083的单体型分布频率组间差异采用卡方检验;P<0.05为差异有统计学意义。
1.2.5 听力学诊断及分组
采用美国智听公司HIS SmartEP诱发电位仪和美国GSI-39中耳分析仪进行双耳ABR和声导抗检查。其中新生儿听力检查采用DPOAE+AABR联合筛查,连续两次未通过DPOAE和/或AABR筛查者,无论是单双耳均进行听力学诊断[3-4]。将ABR V波阈值>30dB nHL纳入听力损失组,其余归为正常听力组。
2 结果
2.1 热点致病变异与听力损失间的关系
听力损失组的热点致病变异检出率达24.14%(14/58),远高于正常听力组的检出率5.21%(138/2647),同时热点致病变异被检出者的听力损失检出率达9.21%(14/152),高于未被检出者的检出率1.72%(44/2553),差异有统计学意义(P=0.000<0.001),见表1。
2.2 热点致病变异的等位基因频率、基因型分布及组间频率差异
大多数热点致病变异的基因型分布都符合Hardy-Weinberg平衡,尽管受检者完全一致,但GJB2c.235del分布并不符合H-W平衡(P=0.000<0.001)。剔除门诊受检者后以新生儿统计,P=0.028,仍然不符合。一方面可能是由于72名门诊受检者中有7名c.235del杂合和2名c.235del纯合,另一方面可能是c.235del本身在受检者中具有较高比例变异的原因。
九个热点致病变异中GJB2c.235del的检出率最高,约占检出总数的46.05%(70/152),其次是SLC26A4c.919-2A>G,约占 24.34%(37/152),未检出GJB2c.35del和MT-RNR1m.1494C>T。同时检出2名GJB2c.235delC并SLC26A4c.919-2A>G双杂合,1名SLC26A4c.919-2A>G杂合并MT-RNR1m.1555A>G均质。GJB2基因变异约占热点致病变异总数的58.06%(90/155),其次是SLC26A4基因,约占27.74%(43/155)。
热点致病变异中,杂合型变异较纯合型多见,多数分布在听力正常人群中。4名GJB2c.235del纯合型都被确诊为听力损失。3名MT-RNR1m.1555A>G均质型和7名异质型都未发生听力损失,对氨基糖苷类药物敏感性个体及其母系亲属的预防宣教,成为预防其发生听力损失的一种有效手段。GJB2c.176_191del和c.235del基因型频率的组间差异有统计学意义(P=0.022<0.05、P=0.000<0.001),见表2。
2.3 四个耳聋相关基因其他位点的变异
2.3.1GJB2基因其他位点变异的基因频率、基因型分布及组间差异
参考NM_004004.5,对277名GJB2基因测序的序列结果进行比对,得到GJB2基因可监测区域为其整个编码序列1-681bp,除4个热点致病变异外,其上共检出14个其他位点变异,见图1。

表1 热点致病变异与听力损失间的关系(n=2705)Table 1 Relationship between hotspotpathogenic variationsand hearing loss(n=2705)
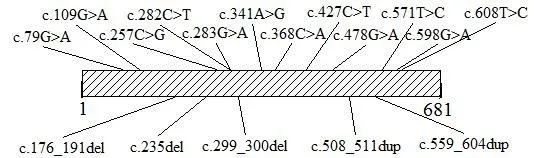
图1 GJB2基因可监测区域上的各位点变异(斜线框表示可监测区域,下文同)Fig.1 Site variationson the detectable region of GJB2(Slash box stands for the detectable region.The follow ing are the same)
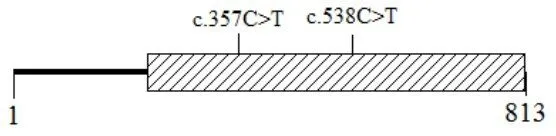
图2 GJB3基因可监测区域上的各位点变异Fig.2 Site variationson the detectable region of GJB3
各位点都符合Hardy-Weinberg平衡。c.79G>A和c.341A>G的MAF高于20%,以常见多态的形式存在于人群中,组间频率差异无统计学意义(P=0.630>0.05,P=0.541>0.05)。c.109G>A的MAF高于5%,基因型频率组间差异有统计学意义(P=0.000<0.001),与耳聋变异数据库中的变异类型相吻合。3名c.109G>A纯合型都被确诊为听力损失。c.608T>C的MAF高于1%,杂合型在两组间的人数分布大致相当,组间频率差异无统计学意义(P=0.451>0.05),见表3。
c.368C>A和c.478G>A仅在正常听力组中检出,c.282C>T、c.283G>A、c.427C>T、c.508_511dup、c.559_604dup、c.571T>C和c.598G>A仅在听力损失组中检出,除c.368C>A外,这些位点的MAF都不大于0.5%,Fisher精确检验P值都大于0.05,组间基因型频率无统计学差异,表4列出了带有这些少见变异的不同GJB2基因型。结合表3中的变异类型,对有c.257C>G、c.283G>A、c.427C>T、c.559_604dup和c.598G>A变异的听力损失患者,建议其父母进行相关位点检测,以明确该复合杂合是顺式还是反式,便于对耳聋病因做出合理的解释。
对常见多态进行关联分析时,发现c.79G>A(rs2274084)和 c.341A>G(rs2274083)的 D’=0.948、r2=0.604,说明存在较弱的连锁不平衡,但各单体型频率组间差异都无统计学意义(卡方检验的P值都大于0.05),见表5。
2.3.2GJB3基因其他位点变异的基因频率、基因型分布及组间差异
参考NM_024009.2,对46名GJB3基因测序的序列结果进行比对,得到GJB3基因可监测区域为其编码序列后半部分区域211-813bp,除1个热点致病变异外,其上仅检出c.357C>T,见图2。
c.357C>T是同义变异,不影响氨基酸组成,属于良性变异,其MAF大于10%,属于常见SNP位点,符合Hardy-Weinberg平衡,组间频率差异无统计学意义(P=0.809>0.05),见表6。
2.3.3SLC26A4基因其他位点变异的基因频率、基因型分布及组间差异
SLC26A4基因测序的有97名,测序结果共104条。参考NG_008489.1,对其中的75条序列进行比对,得到SLC26A4基因的第一段可监测区域为7号外显子、7号内含子和8号外显子全段(27568-27903bp),对其余的29条序列进行比对,得到第二段可监测区域为19号外显子全段(54420-54565bp),除2个热点致病变异外,仅检出c.919-18T>G,见图3。
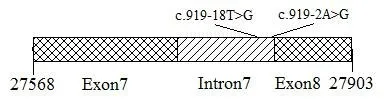
图3 SLC26A4基因可监测区域上的各位点变异(网格框表示外显子)Fig.3 Site variationson the detectable region of GJB3(Grid box stands for theexon)
c.919-18T>G 的 MAF小于 1%,符合 Har⁃dy-Weinberg平衡,组间频率差异有统计学意义(P=0.000<0.001),见表7。
2.3.4MT-RNR1基因其他位点变异的基因频率、基因型分布及组间差异
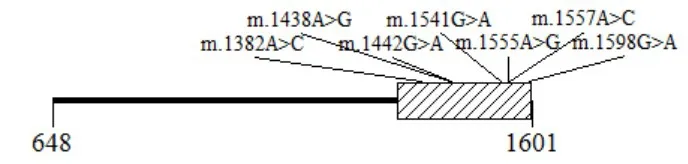
图4 MT-RNR1基因可监测区域上的各位点变异Fig.4 Site variationson the detectable region of MT-RNR1 RNR1是线粒体基因,线粒体属于母系遗传,因
参考NC_012920.1,对76名MT-RNR1基因测序的序列结果进行比对,得到MT-RNR1基因可监测区域为其编码序列后半段1333-1601bp,除2个热点致病变异外,其上共检出6个其他位点变异,见图4。此不能使用Hardy-Weinberg平衡校验所选群体是否具有代表性。除m.1438A>G外,各变异的检出人数仅1-2名,Fisher精确检验P值都大于0.05,基因型分布组间差异无统计学意义,变异以均质和良性多见,但考虑到各变异的检出人数极少,可能存在着个例,判断可能会有失真。m.1438中的A是祖先型等位,G是新生型等位,人群中以新生型等位为主,见表8。
3 讨论
新生儿听力筛查拥有良好的基础设施和随访机制,为遗传性耳聋基因筛查的实施提供了较多的便利,从而实现两者的联合筛查。新生儿听力及耳聋基因联合筛查的实施,将为减少我国耳聋残疾人做出重要的贡献[9]。本文研究对象都是马鞍山市临床检验中心遗传性耳聋基因筛查的受检者,且都在马鞍山市妇幼保健院儿保科听力筛查中心进行了新生儿听力筛查或者听力学诊断。受检者中有2633名新生儿,占总数的97.3%(2633/2705),门诊中有部分婴幼儿是在42天复筛未通过时进行的遗传性耳聋基因筛查,有部分是2-6个月行听力诊断时进行的,因此可以说本文研究人群就是马鞍山地区的新生儿,是基于新生儿个体的群体分析,受家系影响成分非常小。且除GJB2c.235del外的其余各变异的基因型分布都符合Hardy-Weinberg平衡,说明本研究选择的样本具有群体代表性。
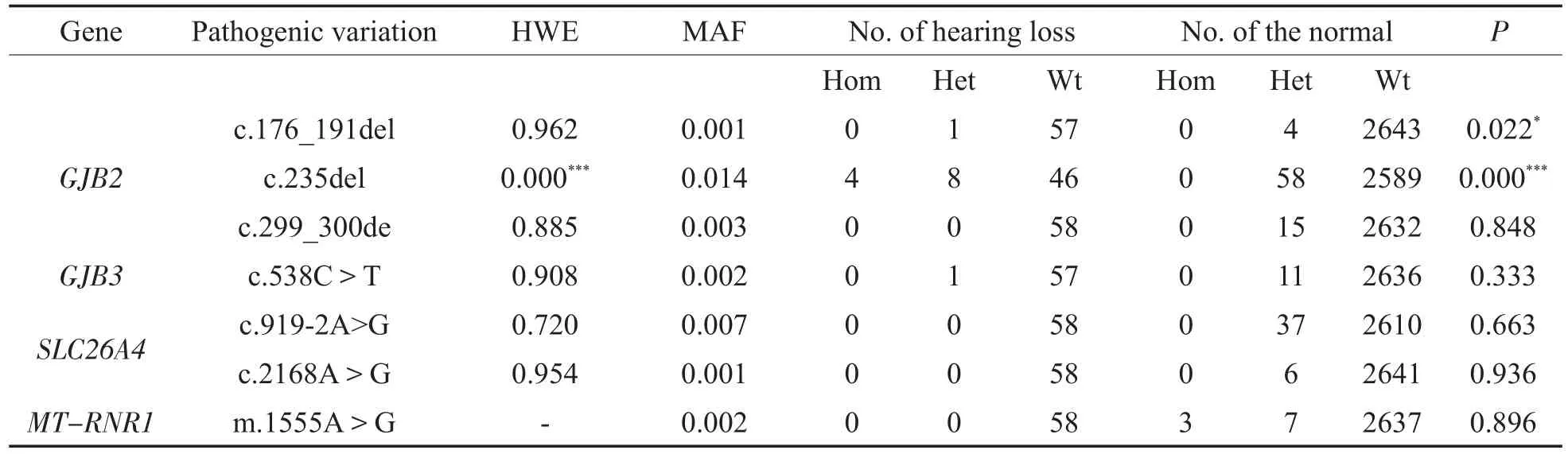
表2 热点致病变异的最小等位基因频率、基因型分布及组间频率差异(n=2705)Table2 The MAF of hot spot pathogenic variations,distribution of genotypes and differences in genotype frequencies bet ween two groups(n=2705)
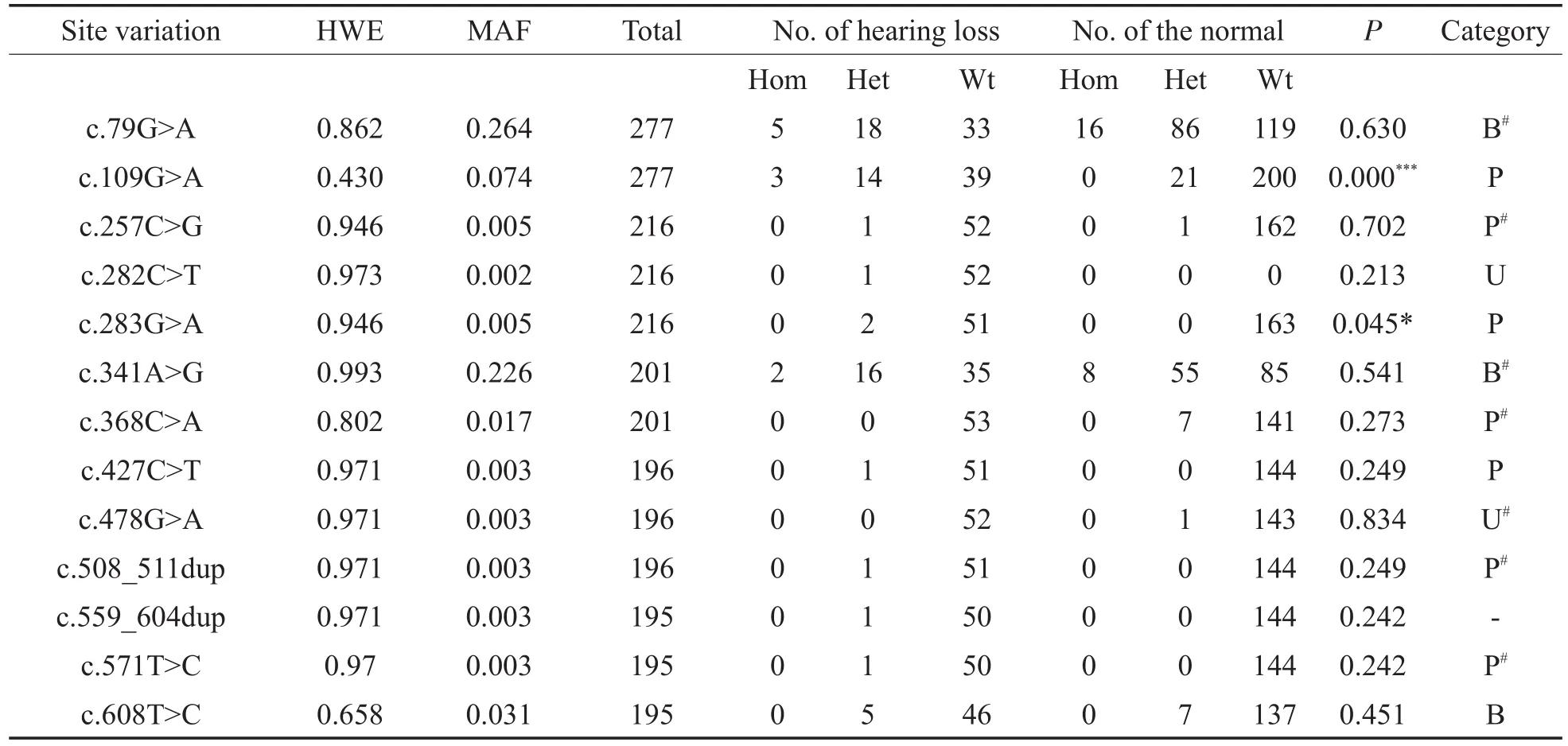
表3 GJB2基因其他位点变异的最小等位基因频率、基因型分布及组间频率差异(n=277)Table3 The MAF of other site variations in GJB2,distribution of genotypes and differences in genotype frequencies bet ween two groups(n=277)
本文采用的是多重等位基因特异性PCR结合基因芯片法,同时检出GJB2、GJB3、SLC26A4和MT-RNR1基因上的九个热点致病变异,具有大规模、快速和高通量等特点。受检者人群的热点致病变异总检出率达5.62%(152/2705),与江浙一带报道的比较接近[10]。将ABR V波阈值高于30dB nHL定义为听力损失组,发现听力损失组的热点致病变异检出率24.14%(14/58)高于正常听力组的5.21%(138/2647),热点致病变异被检出者的听力损失检出率9.21%(14/152)高于未被检出者的1.72%(44/2553),说明致病热点发生变异更容易发生听力损失,即基因变异是新生儿听力受损的一个重要因素。

表4 GJB2基因型的个例Table 4 GJB2 genotype case-by-case
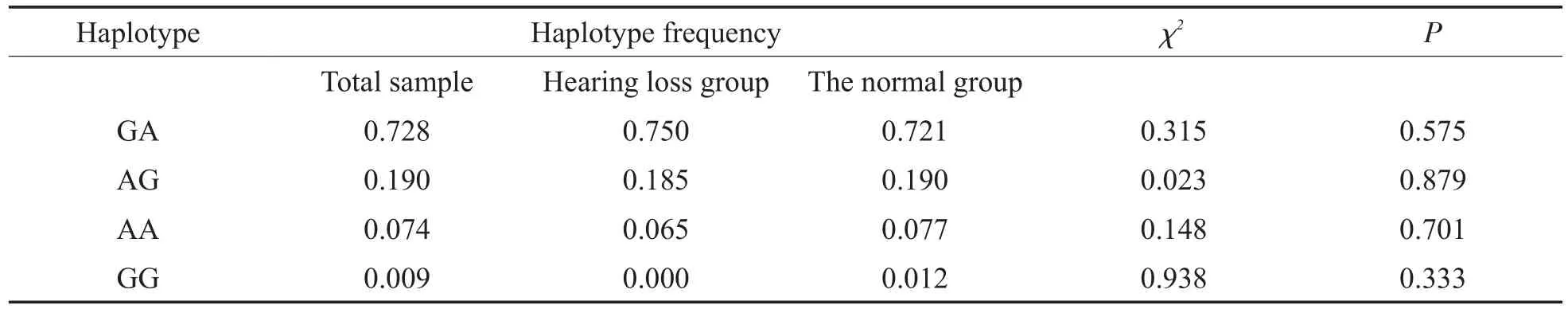
表5 rs2274084和rs2274083的单体型分布(n=277)Table 5 Distribution of haplotype of rs2274084 and rs2274083(n=277)
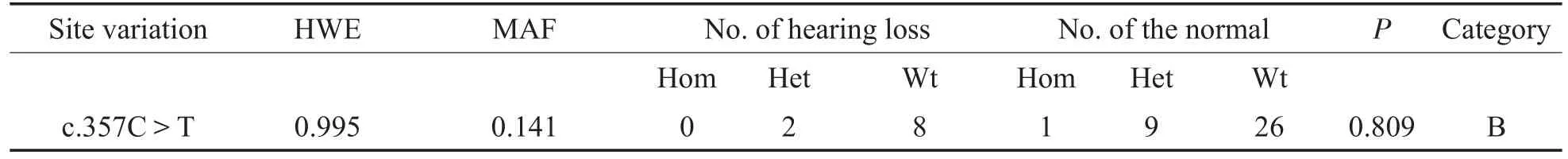
表6 GJB3基因其他位点变异的最小等位基因频率、基因型分布及组间频率差异(n=46)Table6 TheMAF of other site variation in GJB3,distribution of genotypes and differences in genotype frequencies bet ween two groups(n=46)
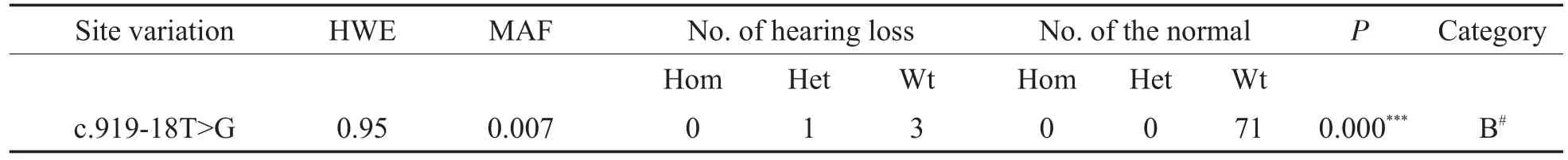
表7 SLC26A4基因其他位点变异的最小等位基因频率、基因型分布及组间频率差异(n=75)Table 7 The MAF of other site variation in SLC26A4,distribution of genotypesand differences in genotype frequencies bet ween two groups(n=75)
在九个热点致病变异中GJB2c.235del的检出率最高,符合GJB2基因在各个民族和地区间的突变分布,东亚人群以c.235del最为多见,而白种人群和阿拉伯人群中则以c.35del为最常见[11]。本文未检出GJB2c.35del,可能存在人种、地域等因素。SLC26A4c.919-2A>G的检出率其次,该剪切位点突变是中国前庭水管扩大(EVA)患者中最常见的突变方式[11],大前庭水管综合征(LVAS)可从出生后至青春期这一年龄段内任何时期开始起病,但多数为出生后几年内发病[12]。对SLC26A4基因突变者的定期随访,结合病史资料、颞骨CT或MRI的影像学检查以及听力学检查,以期早发现早诊断。MT-RNR1基因致病变异[13-14]的检出,明确了氨基糖苷类药物敏感性个体。本文未检出MT-RNR1m.1494C>T,其产生的U-A碱基对与MT-RNR1m.1555A>G产生的C-G碱基对在12SrRNA的二级结构上有相似的致病机制[13],可能是地域、家族等因素使得某种选择没有被人群固定下来。近年来,随着人们对药物性致聋认知的提高,无氨基糖苷类抗生素用药史的敏感个体就不会导致耳聋,出生人口质量得以提升,医务工作者的积极宣传,成为预防耳聋发生的有效手段。目前,在九个热点致病变异中,仅发现GJB2176_191del和GJB2c.235del在听力损失组中有更高的基因型频率。纯合或复合杂合是造成患者先天性听力损失的主要病因,对单杂合者的随访和调查,可能将有因发现迟发性耳聋所导致的基因型频率分布的改变。由于本文所有受检者的随访时间点并不完全一致,主要是追随新生儿出生时间,因此,在比较组间基因型频率时,部分受检者尚未考虑到迟发性耳聋的因素。
测序技术是对微阵列芯片法的有效补充,在确保芯片结果准确的同时,对测序结果有效地分析,还有助于发现其他位点变异,尤其是在听力损失患者的耳聋相关基因中。针对Sanger测序法,可以用可监测区域内已检出的变异位点总数/(可监测区域序列总长度×检测人数)来衡量人群中的某一基因或某一区段是否容易发生变异。对前述的四个基因的可监测区域分析发现,GJB2编码序列和MT-RNR1基因的后段比较容易发生变异,而GJB2基因上发生可能致病或致病变异的风险更高。因此,在基于更广泛人群的测序检验或研究时,针对GJB2基因的分析是寻找耳聋成因较理想的选择。
除热点致病变异外,本文共检出22个其他位点的变异。其中常见多态有GJB2c.79G>A、GJB2c.341A>G和GJB3c.357C>T,遍布在听力损失和正常听力人群中,各基因型分布无统计学差异,关联分析中rs2274084和rs2274083的单体型分布也无统计学差异。GJB2c.109G>A的MAF比较高,3名纯合型均被确诊为听力损失,其左/右耳ABR反应阈分别为40/60、40/30和50/40dB nHL,杂合型在听力损失和正常听力人群中都有分布,推测该变异可能属于常染色体隐性遗传,其基因型分布在两组人群中有显著差异。GJB2c.109G>A与致病位点形成复合杂合的共有12名,其中8名是听力损失患者,文献报道c.109G>A复合杂合相关的听力损失程度多为轻中度[15]。
GJB2基因的c.257C>G、c.282C>T、c.283G>A、c.427C>T、c.478G>A、c.508_511dup、c.559_604dup、c.571T>C和c.598G>A,以及SLC26A4c.919-18T>G和MT-RNR1m.1557A>C,这些变异的MAF<1%,属于少见变异。GJB2基因的c.368C>A和c.608T>C,以及MT-RNR1基因的 m.1382A>C、m.1438A>G、m.1442G>A、m.1541G>A和m.1598G>A,这些变异的MAF在1%-3%左右,基于测序人数有限,本文将它们也归于少见变异。其中MT-RNR1m.1438在人群中主要是以新生型等位为主。上述的18个少见变异中仅发现GJB2c.283G>A和SLC26A4c.919-18T>G的基因型分布差异有统计学意义。同时,GJB2基因的 c.368C>A 和 c.478G>A,以及MT-RNR1基 因 的 m.1442G>A、m.1541G>A、m.1557A>C和m.1598G>A,这些仅在正常听力组中被 检 出 。GJB2基 因 的 c.282C>T、c.283G>A、c.427C>T、c.508_511dup、c.559_604dup、c.571T>C和c.598G>A,以及SLC26A4c.919-18T>G,这些仅在听力损失组中被检出。不过,由于多个少见变异的检出人数仅1-2名,且都是仅在听力损失组中检出,统计学误差可能较大。今后随着检测样本的逐渐增加,也考虑对病例组和对照组同时进行H-W平衡计算,以确保两个组群都有代表性,这样得到的结果可能会更趋于准确。
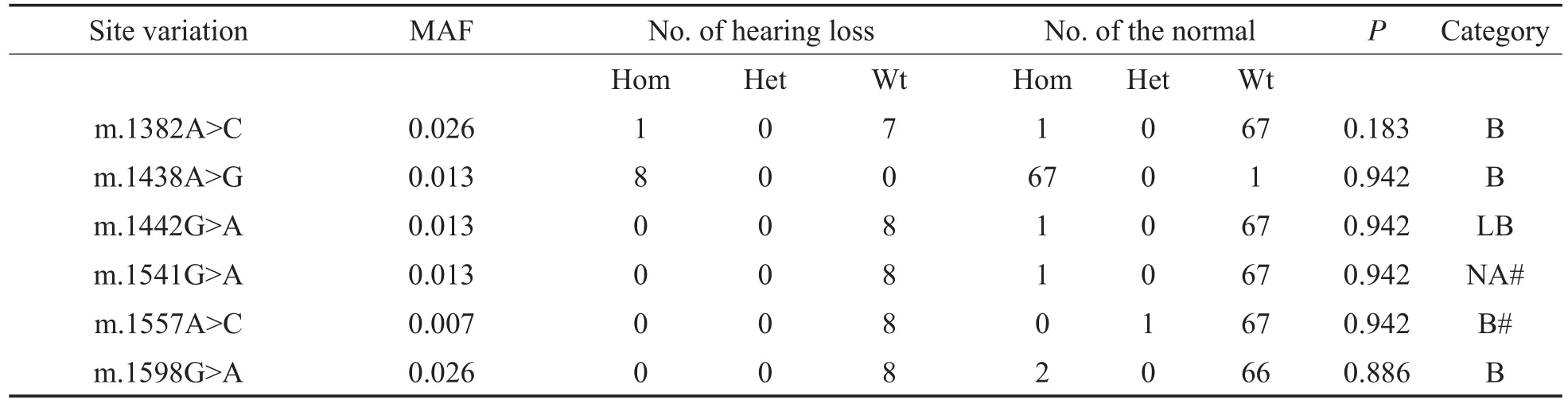
表8 MT-RNR1基因其他位点变异的最小等位基因频率、基因型分布及组间频率差异(n=76)Table8 TheMAF of other site variations in MT-RNR1,distribution of genotypesand differences in genotype frequencies between two groups(n=76)
从MAF中可以得知各变异的稀有程度,结合不同表型人群中各变异的不同分布,探索疾病组中各变异的存在模式,为发现可能的致病病因找到依据。变异方式有同义变异、错义变异、无义变异、插入、缺失等,本文检出的除c.282C>T和c.357C>T是同义变异外,多为错义变异,尤其是在GJB2基因上。生物信息学软件提供了对错义变异所致氨基酸结构改变的算法分析[16],但在研究变异致病性的时候,更需要结合临床实际的表型信息,还需要基于家系,了解变异的遗传类型。本文仅单纯地以ABRV波阈值高于30dBnHL划分了听力表型,并未细分到具体的听力损失程度、类型和发生时间等,因此在细究单一位点变异与听力损失表型关联时,存在着分析的局限性,在评估变异致病性时,应当参考权威数据库。本文从区域群体基因变异分布及差异的角度,试图了解各位点变异在地区人群中的特点,在评估地区个体基因变异时给出更多的风险参考。精准医学倡导的是个体化服务,基于个体基因特征、生存环境及生活习惯,大范围群体的数据调查统计,最终都将被应用在个体服务上。在评估个体表型时,基因变异可能仅仅只是一个风险因素。
1 王翠翠,袁慧军.高通量测序技术在遗传性耳聋研究中的应用及研究进展[J].遗传.2017,39(3):208-219.Wang CC,Yuan HJ.Application and progress of high-throughput sequencing technologies in the research of hereditary hearing loss[J].Hereditas(Beijing),2017,39(3):208-219.
2 代志瑶,戴朴.非综合征型耳聋的基因型与表型关系[J].中华耳科学杂志.2013,11(1):151-155.Dai ZY,Dai P.Relationship between genotype and phenotype of nonsyndromic hearing loss[J].Chinese Journal of Otology,2013,11(1):151-155.
3 章雪芹,顾春丽,陈澄等.DPOAE+AABR联合筛查在婴儿听力筛查中的应用[J].听力学及言语疾病杂志.2016,4(24):397-399.Zhang XQ,Gu CL,Chen C,et al.The Combined Application of DPOAE and AABR to the Newborn Hearing Screening[J].Journal of Audiology and Speech Pathology,2016,4(24):397-399.
4 章雪芹,魏澄,王栋等.遗传性耳聋基因筛查在新生儿听力筛查中应用研究[J].中国实用妇科与产科杂志.2013,32(3):273-275.Zhang XQ,WeiC,Wang D,et al.Research on the significance of genetic deafness gene screening in neonatal hearing screen⁃ing[J].Chinese Journal of Practical Gynecology and Obstetrics,2013,32(3):273-275.
5 http://varnomen.hgvs.org/.
6 Richards S,AzizN,Bale S,et al.Standards and guidelines for the interpretation of sequence variants:a joint consensus recommen⁃dation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology[J].Genetics inmedi⁃cin-e,2015,17(5):405-424.
7 Wu BL,Lindeman N,Lip V,et al.Effectiveness of sequencing con⁃nex in 26(GJB2)in cases of familial or sporadic childhood deaf⁃ness referred for molecular diagnostic testing[J].Genetics in Med⁃icine,2002,4:279-288.
8 Isamu Y,Akihiro O,Tatsuo M,et al.Identification of 605ins46,a novel GJB2mutation in a Japanese family[J].Auris Nasus larynx,2002,29(4):379-382.
9 韩冰,李倩,纵亮等.新生儿听力及基因联合筛查临床实践及筛查模式研究[J].中华耳科学杂志.2013,11(3):380-383.Han B,Li Q,Zhong L,et al.An Clinical Research on Newborn Hearing Concurrent Genetic Screening in 106,513 Neo⁃nates[J].Chinese Journal of Otology,2013,11(3):380-383.
10 章雪芹,李晓璐.我国不同地区新生儿听力和耳聋基因联合筛查的应用与分析[J].中国优生与遗传杂志.2016,24(7):11-12.Zhang XQ,LiXL.Application and analysis of combined screen⁃ing of neonatal hearing and deafness genes in different regions of China[J].Chinese Journal of Birth Health&Heredity,2016,24(7):11-12.
11 李磊,杨涛,吴皓.耳聋基因的筛查与诊断[J].诊断学理论与实践.2010,9(5):409-412.Li L,Yang T,Wu H.Screening and diagnosis of deafness gene[J].Journal of Diagnostics Concepts&Practice,2010,9(5):409-412.
12 张宇,王幼勤,郭洪源等.听力学表型在大前庭水管综合征早期诊断中的意义[J].中华耳科学杂志.2016,14(1):57-62.Zang Y,Wang YQ,Guo HY.Significance of audiological pheno⁃types to early diagnosis of large vestibular aqueduct syn⁃drome[J].Chinese Journal of Otology,2016,14(1):57-62.
13 Zhao H,Li RH,Wang QJ,et al.Maternally Inherited Aminoglyco⁃side-Induced and Nonsyndromic Deafness Is Associated with the Novel C1494T Mutation in the Mitochondrial 12S rRNAGene in a Large Chinese Family[J].American Journal of Human Genetics,2004,74(1):139-152.
14 Zhu YH,Huang SS,Kang DY,et al.Analysis of the heteroplasmy level and transmitted features in hearing-loss pedigrees with mito⁃chondrial 12S rRNA A1555G mutation[J].BMCGenetics,2014,15(26):1-8.
15 Du YT,Huang LH,Cheng XH,et al.Analysis of p.V37I com⁃pound heterozygous mutations in the GJB2 gene in Chinese in⁃fants and young children[J].BioScience Trends,2016,10(3):220-226.
16 Yilmaz A.Bioin formatic Analysis of GJB2 Gene Missense Muta⁃tions[J].Cell Biochemistry and Biophysics, 2015, 71(3):1623-1642.
17 张晚霞,孙慧红,马丽霞等.30835例新生儿听力和基因联合筛查实践研究[J].中华耳科学杂志.2016,14(6):769-773.Zhang WX,Sun HH,Ma LX,et al.Combined Hearing and Genet⁃ic Screening in 30835 Neonates[J].Chinese Journal of Otology,2016,14(6):769-773.
18 袁永一,戴朴.耳聋基因诊断——转化医学推动耳科学发展的范例[J].中华耳科学杂志.2014,12(1):1-5.Yuan YY,Dai P.Deafness Genetic Testing—an Example Transla⁃tional Medicine Accelerating the Progress of Otology[J].Chinese Journal of Otology,2014,12(1):1-5.
