非甲醇诱导重组毕赤酵母表达木聚糖酶的条件优化
2018-04-12蓝娜娜张薷月苏然杨倩张建国
蓝娜娜,张薷月,苏然,杨倩, 张建国
(上海理工大学 医疗器械与食品学院,食品科学与工程研究所,上海,200093)
木聚糖酶是一种广泛用于食品、饲料、造纸工业的酶。它的作用为降解木聚糖产生更小分子的木聚糖,甚至单分子木糖[1]。微生物来源的木聚糖酶约占总木聚糖来源种类的80%。为了生产更多的木聚糖酶,木聚糖酶基因在细菌、酵母、真菌和植物中都得到成功表达[2-3]。毕赤酵母(Komagataellaphaffii)是一种较为理想的外源蛋白表达宿主[4],它以甲醇为唯一碳源而生长。甲醇诱导的醇氧化酶启动子AOX1能大量表达醇氧化酶。毕赤酵母作为真核表达宿主的优点可以总结如下:(1)具有醇氧化酶AOX1基因启动子,这是目前最强,调控机理最严格的启动子之一;(2)表达效率高,其表达的外源蛋白可占总表达蛋白的90%以上,有利于目的蛋白的分离纯化;(3)类似于细菌表达系统,酵母的生长是快速和便宜的,而且酵母细胞是真核生物,因此它们具有翻译后修饰的机制;(4)表达质粒能在基因组的特定位点以单拷贝或多拷贝的形式稳定整合;(5)由于该酵母可以以甲醇为唯一碳源和能源,而绝大多数微生物并不能以甲醇为碳源,可以减少污染。所以毕赤酵母的AOX1表达系统被广泛用来表达外源蛋白[5]。多年来,毕赤酵母已被学术界和工业界证明能表达各种外源蛋白[6],由于毕赤酵母来源的外源蛋白的安全性较好,目前已经有多种毕赤酵母表达的外源蛋白被批准进入市场[7]。目前毕赤酵母利用AOX1启动子表达外源蛋白的诱导物仍采用甲醇。为了避免残留甘油对AOX1启动子的抑制,诱导过程中需要将培养基从甘油培养基转变为甲醇培养基,所以毕赤酵母的外源蛋白诱导步骤仍然较繁琐。另外,由于工业上使用甲醇的危险性和毒性,很多学者拟通过改造AOX1启动子实现非甲醇诱导物诱导毕赤酵母表达外源蛋白[8]。发现其他非甲醇诱导的启动子也是目前的一个选择。目前报道的非甲醇诱导的启动子有甘油诱导的3-磷酸甘油醛脱氢酶启动子(PGAP)[9]、鸟苷三磷酸酶分泌相关联的启动子(PYPT1)[10]、二强丙酮合成酶启动子(PDHAS)[11]、甲醛脱氢酶启动子(FLD1)[12]、乙醇诱导的异柠檬酸裂解酶启动子(PICL1)[13]、转录延长因子1-α启动子(PTEF1)[14]、3-磷酸甘油酸激酶启动子(PPGK1)[15]。但是这些非甲醇诱导启动子的表达强度都没有达到AOX1的表达强度,造成外源蛋白表达量不高。所以AOX1启动子仍是毕赤酵母表达外源蛋白的主要启动子。本研究的非甲醇诱导剂从甲基类水溶性无机物考虑,以甲酸铵诱导毕赤酵母AOX1启动子表达外源蛋白,探讨非甲醇诱导剂诱导毕赤酵母高效表达外源蛋白的途径。
1 材料和方法
1.1 菌株和试剂
表达木聚糖酶的重组毕赤酵母菌株由本实验室构建。酵母粉和蛋白胨购自英国OXOID公司。木聚糖购自上海源叶生物科技有限公司。其他化学试剂均购自国药集团化学试剂有限公司。
精密恒温培养箱(BPH-G082型),上海一恒科学仪器有限公司;单人净化工作台(SW-CJ-1D型),苏州净化设备有限公司;立式压力蒸汽灭菌(LDZX-50KBS型),上海申安医疗器械厂;电子天平(PL2002型),梅特勒-托利多仪器有限公司;pH计(PB-10型),赛多利斯科学仪器(北京)有限公司;可见分光光度计(722S),上海精密科学仪器有限公司;低速大容量多管离心机(飞鸽LXJ-IIB),上海安亭科学仪器厂;、小型高速离心机,德国eppendorf公司;多功能酶标仪,美谷分子仪器有限公司。
1.2 培养基
YPD液体培养基:酵母粉10.0 g、蛋白胨20.0 g、葡萄糖20.0 g(固体另加琼脂粉20.0 g),加水定容至1.0 L,115 ℃灭菌20 min。
BMGY培养基:溶解10.0 g酵母粉、20.0 g蛋白胨于700 mL水中,高压灭菌20 min,冷至室温,加入下列混合液:100 mL 1.0 mol/L PBS缓冲液pH 6.0、100mL 13.4%YNB、100 mL 10%甘油、2 mL 4×10-4g/L生物素,加水定容至1.0 L。
BMMY培养基:溶解10.0 g酵母粉、20.0 g蛋白胨于700 mL水中,高压灭菌20 min,冷至室温,加入下列混合液:100 mL 1.0 mol/L磷酸钾缓冲液pH 6.0,100 mL 13.4%YNB,100 mL 5 %甲醇,2 mL 4×10-4g/L生物素,加水定容至1.0 L。
3,5-二硝基水杨酸(DNS)溶液:取3,5-二硝基水杨酸3.15 g于250 mL水中,45 ℃溶解后加入NaOH 10.48 g,不停搅拌后加入酒石酸钾钠92.5 g,溶解后加入苯酚2.5 g,溶解后加入Na2SO42.5 g,搅拌待全部溶解后定容至500 mL。
PBS缓冲液:称取NaCl 8.0 g,KCl 0.2 g,Na2HPO4·12H2O 3.63g, KH2PO40.24g,溶于900 mL双蒸水中,用HCl调pH值至6.0,加水定容至1.0 L,常温保存备用。
1.3 甲醇诱导重组毕赤酵母表达木聚糖酶的条件优化
将重组毕赤酵母转接至5 mL YPD,在30 ℃、200 r/min条件下活化至OD600达到1.3~1.5之间,按4%接种量接入100 mL BMGY培养基中,24 h后离心,沉淀转入100 mL BMMY培养基中继续培养。本研究中优化了甲醇诱导过程中的温度、pH、甲醇添加量3个条件。在没有特别说明的情况下默认条件为30 ℃,1%甲醇添加量,pH 6.0。其中设置温度为26、28、30、32 ℃,pH设置为5.0、5.5、6.0、6.5、7.0、7.5,甲醇添加量的梯度设置为0.5%、1.0%、1.5%、2.0%、2.5%、3.0%。
1.4 甲醇和山梨醇联合诱导重组毕赤酵母表达木聚糖酶
重组毕赤酵母的培养过程为将重组毕赤酵母转接至5 mL YPD,在30 ℃、200 r/min条件下活化至OD600达到1.3~1.5之间,按4%接种量接入100 mL BMGY培养基中,24 h后离心,沉淀转入100 mL BMMY培养基中继续培养,然后每天添加1.0%甲醇不同量的山梨醇。山梨醇的添加量设置为0.02%、0.05%、0.08%、0.11%、0.14%。
1.5 甲酸铵诱导重组毕赤酵母表达木聚糖酶
重组毕赤酵母的培养过程为将重组毕赤酵母转接至5 mL YPD,在30 ℃、200 r/min条件下活化至OD600达到1.3~1.5之间,按4%接种量接入100 mL BMGY培养基中,24 h后离心,沉淀转入100 mL BMMY培养基中继续培养。甲酸铵单独诱导时甲酸铵添加量梯度设置为0.5%、1.0%、1.5%、2.0%、5.0%。在甲酸铵和山梨醇联合诱导时,采用最优甲酸铵添加条件下,同时添加山梨醇(0.1%、0.5%、1%)。在甲醇和甲酸铵联合诱导时采用每天添加1.0%甲醇和甲酸铵(0.5%、1%、1.5%、2.0%、5.0%)。
1.6 细胞浓度的测定
将细胞样品经过适当稀释后在600 nm下测定吸光度值,计算细胞浓度。
1.7 木聚糖酶活力的测定
以4 ℃、12 000g离心发酵液10 min上清即粗酶液。取20 μL粗酶液加入到1 mL含有10 g/L木聚糖的pH 5.0柠檬酸-磷酸盐缓冲液中。50 ℃保温5 min后加入2 mL DNS溶液煮沸10 min,然后冷却至室温,用酶标仪在540 nm测定吸光度。木聚糖酶酶活的定义为:每分钟水解产生1 μmol木糖的木聚糖酶活力为1个活力单位。
2 结果与分析
2.1 诱导温度对重组毕赤酵母生长和表达木聚糖酶的影响
在诱导温度为26~30 ℃范围内,重组毕赤酵母的生长和表达木聚糖酶活力的情况分别见图1-a和图1-b。重组毕赤酵母在这4个温度梯度下随着时间的延长,细胞浓度不断升高,并在诱导96 h时达到最高值。然后细胞浓度开始下降。相同培养时间时,重组毕赤酵母在30 ℃的条件下有较高的细胞浓度。重组毕赤酵母在30 ℃诱导96 h后达到最高的细胞浓度为20.4 OD600。重组毕赤酵母表达的木聚糖酶活力随着诱导时间的延长显著升高,在诱导96 h时均达到最高值,然后酶活力下降。总体上看,不同诱导温度下的木聚糖酶活力差别不显著。重组毕赤酵母在30 ℃条件下诱导96 h后达到最高木聚糖活力(1 410.2 U/mL)。
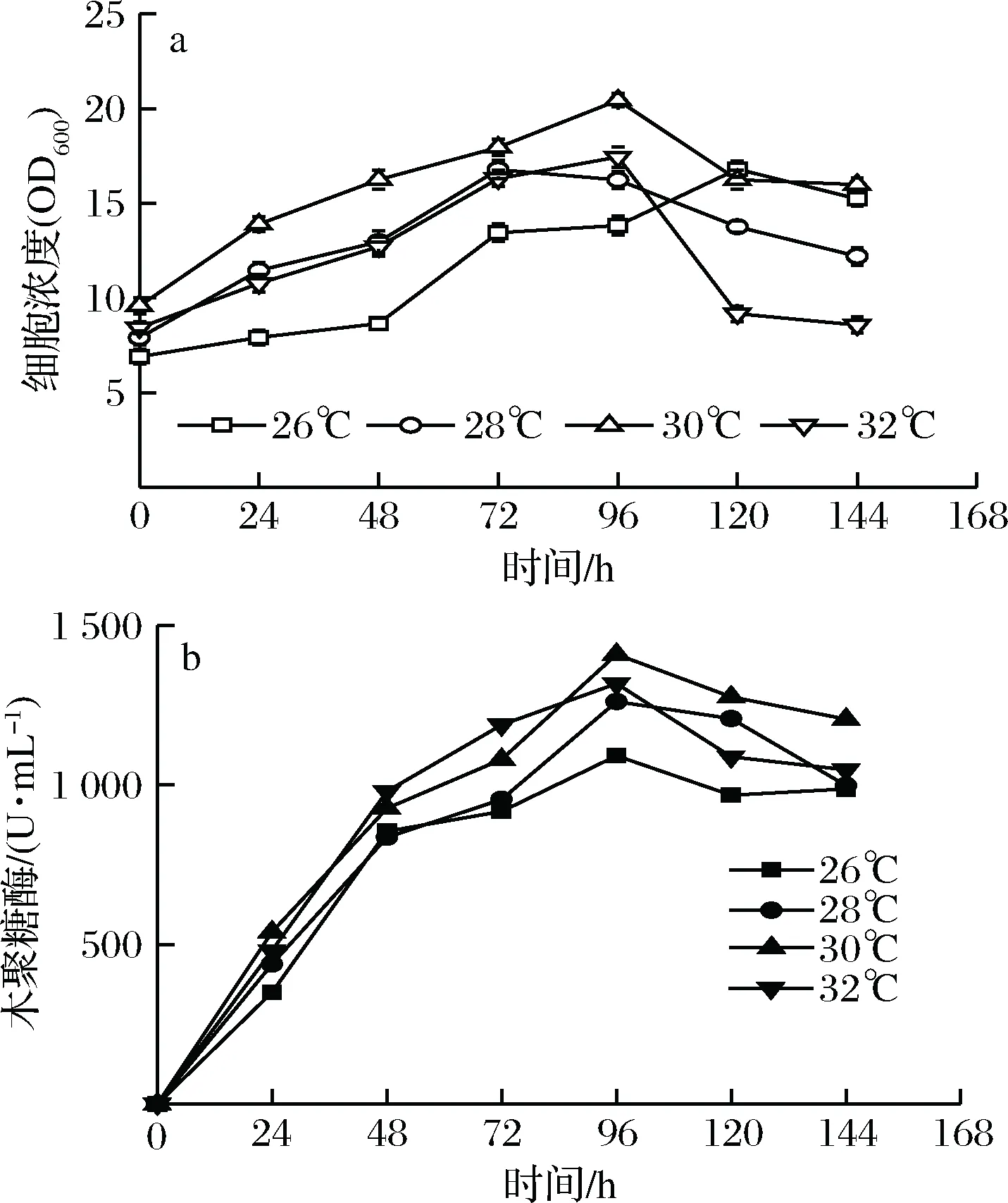
图1 诱导温度对重组毕赤酵母生长和表达木聚糖酶的影响Fig.1 Effects of temperature on the recombinant K. phaffiigrowth and xylanase activity
2.2 pH对重组毕赤酵母生长和表达木聚糖酶的影响
pH对重组毕赤酵母的生长和表达木聚糖酶的影响见图2-a和图2-b。在诱导24 h内,不同pH条件下的细胞浓度差别不明显。随着诱导时间的延长,pH 5.0条件下的重组毕赤酵母细胞浓度保持稳定,并在诱导120 h后出现下降。其他pH条件下重组毕赤酵母细胞浓度不断升高,并在诱导96 h时达到最高的细胞浓度。重组毕赤酵母在pH 5.5条件下诱导96 h时达到最高值(27.6 OD600)。重组毕赤酵母表达的木聚糖酶活力随着诱导时间的延长不断升高,并在96 h时达到最高的木聚糖酶活力。然后木聚糖酶活力保持稳定。在pH 5.5的条件下,木聚糖酶活力达到的最高值为2 602.8 U/mL。
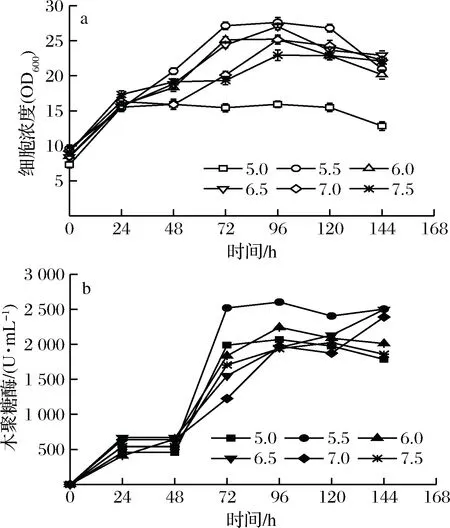
图2 诱导pH对重组毕赤酵母生长和表达木聚糖酶的影响Fig.2 Effects of pH on the recombinant K. phaffiigrowth and xylanase activity
2.3 甲醇添加量对重组毕赤酵母生长和表达木聚糖酶的影响
甲醇添加量对重组毕赤酵母的生长和表达木聚糖酶活力的影响见图3-a和图3-b。
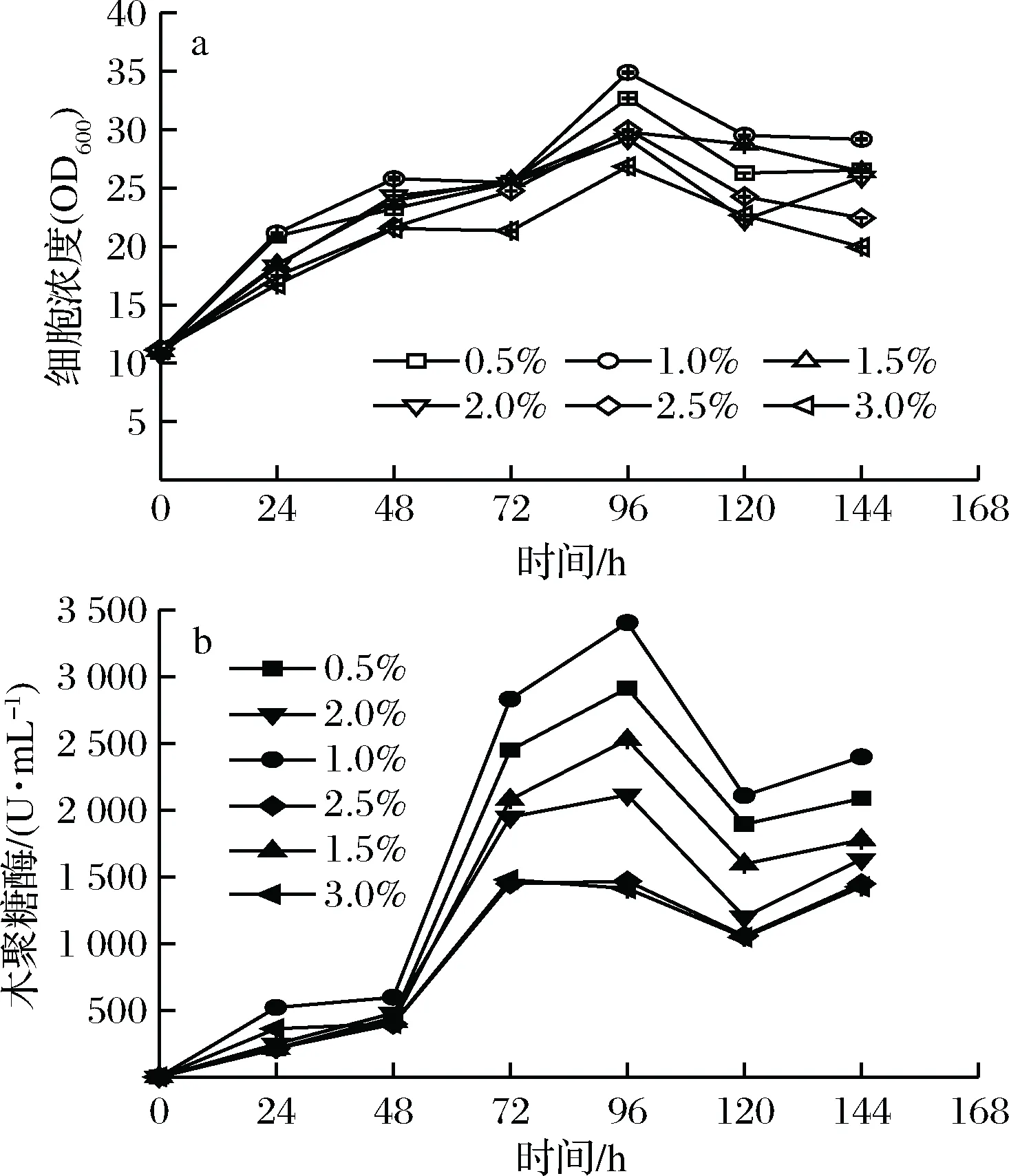
图3 甲醇添加量对重组毕赤酵母生长和表达木聚糖酶的影响Fig.3 Effects of methanol added on the recombinantK. phaffii growth and xylanase activity
重组毕赤酵母的细胞浓度随着诱导时间的延长不断升高,并在诱导96 h时达到最高值,然后细胞浓度逐渐下降。在1.0%甲醇诱导96 h的条件下,重组毕赤酵母的细胞浓度达到最高值为34.9 OD600。木聚糖酶活力也在1.0%甲醇诱导96 h时达到最高值(3 403.8 U/mL),然后木聚糖酶活力出现下降。
2.4 甲醇和山梨醇联合诱导对重组毕赤酵母生长和表达木聚糖酶的影响
山梨醇是一种毕赤酵母AOX1启动子的非抑制性碳源。山梨醇的添加可以为细胞提供额外的能量,提高细胞的生长和外源蛋白的产量[16]。甲醇和山梨醇联合诱导培养能够使毕赤酵母保持诱导强度的同时提供充足的能量。重组毕赤酵母的细胞浓度在诱导48 h内显著升高到22~30 OD600,然后逐渐下降。在不同山梨醇的添加量的条件下,重组毕赤酵母细胞浓度在添加0.05%山梨醇的条件下有最高值32.2 OD600。木聚糖酶活力也随着诱导时间延长而不断升高。但是不同山梨醇添加量的条件下木聚糖酶活力差别不明显。木聚糖酶在诱导120 h时达到最高值(2 615.3 U/mL)。甲醇和山梨醇联合诱导培养在120 h达到最高点,而其中山梨醇添加量为0.08%时,在120 h得到最大酶活2 615.3 U/mL。相比于甲醇添加量为1%时在96 h处达到的最大酶活3 403.8 U/mL,为甲醇诱导时木聚糖酶活力的76.8 %。
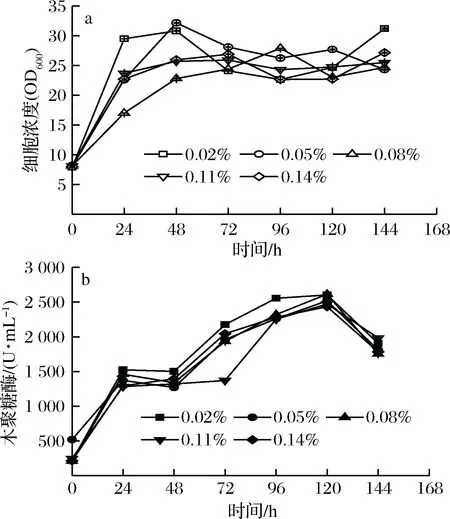
图4 甲醇/山梨醇联合诱导对重组毕赤酵母生长和表达木聚糖酶的影响Fig.4 Effects of methanol and sorbitol on recombinantK. phaffii growth and xylanase activity
2.5 甲酸铵诱导重组毕赤酵母表达木聚糖酶
在甲酸铵添加量为0.5%~5.0%的范围内,重组毕赤酵母细胞浓度逐渐升高,在诱导48 h后达到稳定。重组毕赤酵母在0.5%甲酸铵的条件下有最高的细胞浓度。甲酸铵添加量升高到2.0%时对重组毕赤酵母细胞的生长有微弱的抑制作用。甲酸铵在5.0%添加量对重组毕赤酵母生长有明显的抑制作用。木聚糖酶活力在初始诱导24 h升高明显(约1 000 U/mL),然后出现微弱下降。不同甲酸铵添加量对重组毕赤酵母表达木聚糖酶的影响差别不显著(图5)。
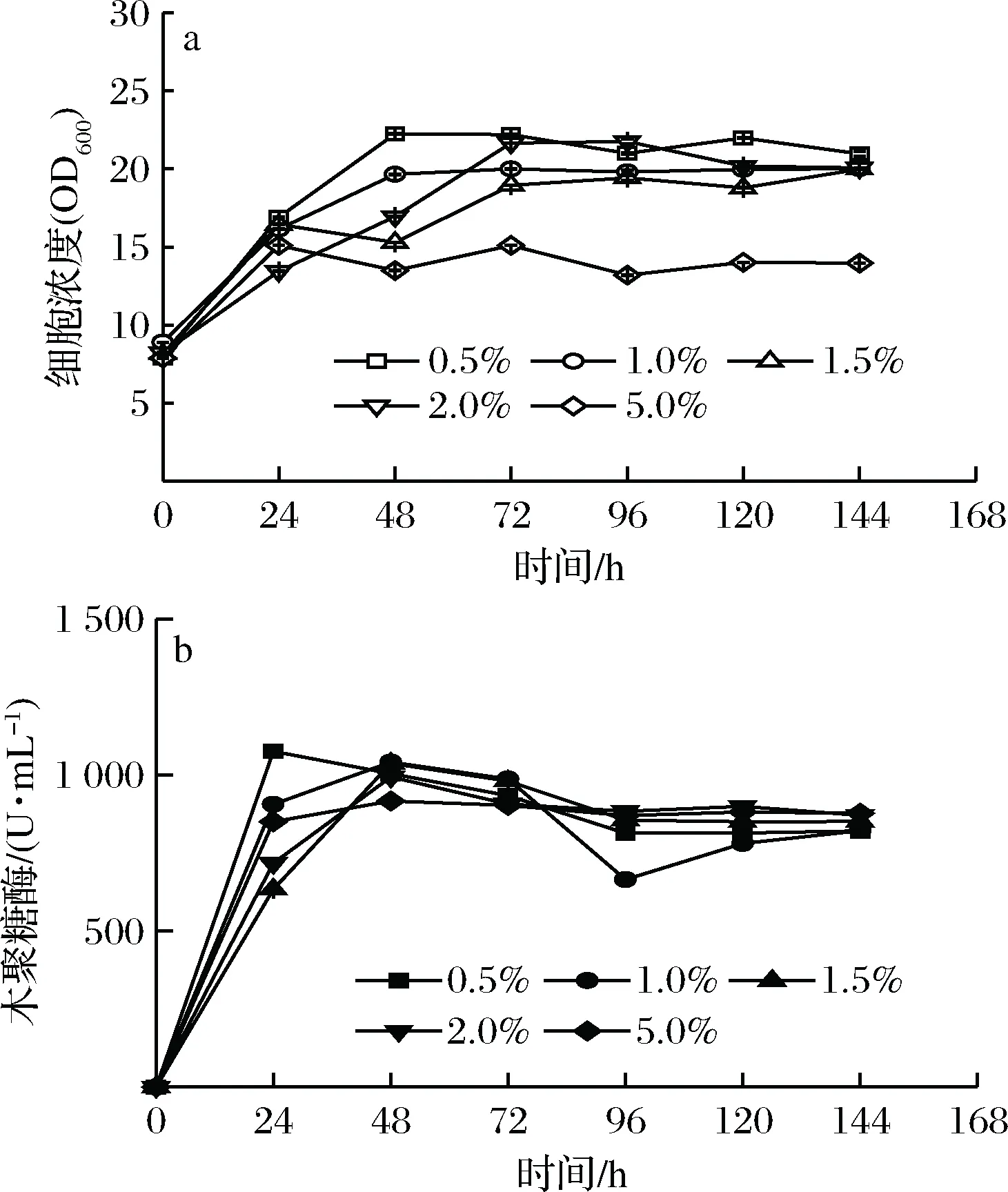
图5 甲酸铵添加量对重组毕赤酵母生长和表达木聚糖酶的影响Fig.5 Effects of ammonium formate added on therecombinantK. phaffii growth and xylanase activity
在甲酸铵诱导的条件下,测定了0~144 h内重组毕赤酵母的AOX活力(图6)。在1.0%甲酸铵的条件下,诱导24 h时的AOX活力最高为6.3 U/mL,在24~144 h内,甲酸铵诱导下的AOX活力呈现逐渐下降,在诱导144 h后AOX活力降低到2.7 U/mL。这与甲酸铵诱导下重组毕赤酵母表达木聚糖酶的活力在24~144 h下降的结果一致。
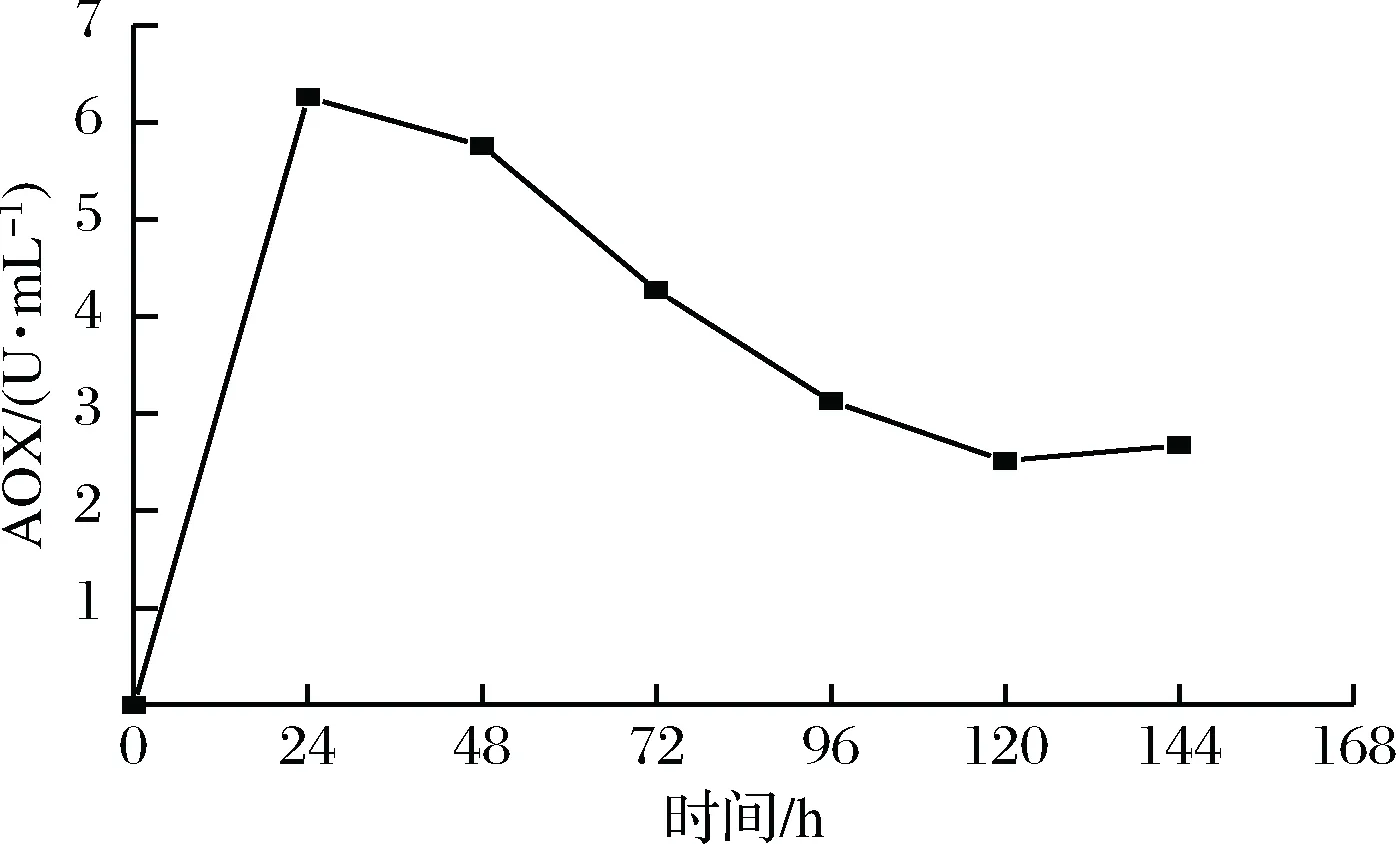
图6 甲酸铵诱导下AOX活力的变化Fig.6 AOX activity of recombinant K. phaffiiinduced by ammonium Formate
2.6 甲酸铵和山梨醇联合诱导对重组毕赤酵母生长和表达木聚糖酶的影响
重组毕赤酵母在甲酸铵和山梨醇混合添加的条件下生长至48 h,达到最高值,然后保持稳定。木聚糖酶活力在甲酸铵和山梨醇联合诱导时活力随着时间的延长显著升高。木聚糖酶在诱导72 h后达到最高活力(2 032.0 U/mL),然后出现微弱下降(图7)。

图7 甲酸铵/山梨醇联合诱导对重组毕赤酵母生长和表达木聚糖酶的影响Fig.7 Effects of combined ammonium formate and sorbitolon recombinant K. phaffii growth and xylanase activity
2.7 甲醇和甲酸铵联合诱导对重组毕赤酵母生长和表达木聚糖酶的影响
重组毕赤酵母在每天1%甲醇和不同量的甲酸铵的条件下继续生长至诱导到48 h,然后细胞浓度保持稳定。在添加0.5%甲酸铵时的细胞浓度约为15 OD600,显著低于其他甲酸铵添加量组别的细胞浓度。甲酸铵添加1.0%及以上时,细胞浓度稳定在约20 OD600。木聚糖酶活力随着诱导时间的延长显著升高。诱导72 h后,在所有甲酸铵添加的组别中木聚糖酶活力都达到最高值,然后明显下降。木聚糖酶活力在甲酸铵添加量为1.5%的条件下有最高活力(3 589.2 U/mL)(图8)。

图8 甲醇/甲酸铵联合诱导对重组毕赤酵母生长和表达木聚糖酶的影响Fig.8 Effects of combined methanol and ammoniumformate on recombinant K. phaffii growth and xylanase activity
3 讨论
毕赤酵母作为外源蛋白表达的宿主已经广泛应用到多种重组蛋白的表达。而且,大约有70多种来自毕赤酵母的重组蛋白被推向市场。但是完善毕赤酵母表达系统的工作仍在继续。一个重要的研究热点就是非甲醇诱导剂的开发。目前开发非甲醇诱导的方式主要分为3个方向。第1个是开发其他非甲醇诱导的启动子。例如3-磷酸甘油醛脱氢酶启动子(PGAP)启动子可以利用甘油诱导[9],与鸟苷三磷酸酶分泌相关联的启动子(PYPT1)[10],二强丙酮合成酶启动子(PDHAS)[11],甲醛脱氢酶启动子(FLD1)[12]。乙醇诱导的异柠檬酸裂解酶启动子(PICL1)[13]。转录延长因子1-α启动子(PTEF1)[14], 3-磷酸甘油酸激酶启动子(PPGK1)[15]。但是这些非甲醇诱导启动子的表达强度都没有达到AOX1的表达强度,造成外源蛋白表达量不高。第2个是改造AOX启动子序列,以企得到非甲醇诱导剂诱导AOX1的毕赤酵母工程菌株。研究AOX1启动子上游序列的调控原件和调控蛋白因子是近年来的热点方向。根据目前的研究结果,Vogl等合成了一个毕赤酵母的核心启动子序列,进而调控不同的表达强度,也为研究其他非甲醇诱导物提供基础[17]。HARTNER等通过一系列人工调整AOX1启动子序列将报告基因表达量提高60%[18]。WANG通过敲除AOX1启动子上游的3个转录抑制因子和1个转录激活因子得到甘油启动的AOX1表达元件。这株重组毕赤酵母表达绿色荧光蛋白(GFP)可以到达甲醇诱导AOX1的77%的水平[19]。并且,构建了另外一株非甲醇诱导AOX1启动子可以达到甲醇诱导启动子的50%的水平[20]。第3个方面是寻找诱导AOX1启动子的非甲醇诱导剂。例如KUMARI巧妙地利用脂肪酸甲酯诱导毕赤酵母表达脂肪酶,脂肪酶水解脂肪酸甲酯释放出的甲醇诱导重组毕赤酵母[21]。但是这种方式不能被推广到表达其他酶的重组毕赤酵母中。TYURIN利用甲酸诱导2株重组毕赤酵母的β-半乳糖苷酶的活性分别达到甲醇诱导水平的35%和95%[22]。本研究以表达木聚糖酶的重组毕赤酵母为试材,确定甲醇诱导的最优条件(温度30℃,pH 5.5,甲醇添加量为1.0 %)和木聚糖酶的最高活力(3 403.8 U/mL)。进而探讨了甲酸铵诱导AOX1的强度。图6结果表明甲酸铵诱导AOX1的强度较弱。利用甲酸铵和山梨醇联合诱导时木聚糖酶的体积产量达到2 032.0 U/mL。甲醇和甲酸铵联合诱导时木聚糖酶的体积产量可以达到3 589.2 U/mL。这说明甲酸铵增加了甲醇单独诱导AOX1的强度。表1分析了不同实验条件下的单位重组毕赤酵母表达木聚糖酶的结果。由表1可知甲酸铵诱导下,单位毕赤酵母细胞浓度的木聚糖酶活力为39.9 U/mL OD600,为甲醇诱导时单位毕赤酵母细胞浓度的木聚糖酶活力(97.5 U/mL OD600)的40.9%。添加0.5%山梨醇后,0.5%甲酸铵诱导毕赤酵母的单位细胞浓度的木聚糖酶活力达到150.5 U/mL OD600,比1.0%甲醇和0.08%山梨醇联合诱导时单位细胞浓度木聚糖酶活力(113.7 U/mL OD600)提高了32.4%。这说明毕赤酵母单独代谢甲酸的通量不大,添加山梨醇提供了表达外源蛋白的能源后,提高了外源蛋白的表达。而且甲酸铵和山梨醇更有利于毕赤酵母细胞表达木聚糖酶。不足之处在于甲酸铵和山梨醇诱导时细胞生长较慢,细胞浓度较低,为甲醇和山梨醇联合诱导时细胞浓度的58.7%。所以在发酵罐上利用细胞生长阶段和诱导阶段分开培养的方式将有利于甲酸铵和山梨醇联合诱导优势的体现。
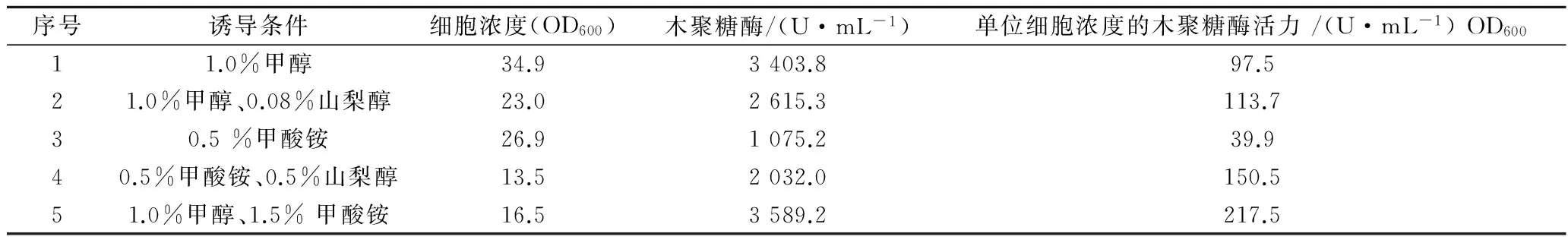
表1 单位重组毕赤酵母细胞表达木聚糖酶的比较Table 1 Specific xylanase activities at different induction conditions
本研究还探讨了甲酸铵对甲醇诱导毕赤酵母表达木聚糖酶的影响。甲酸铵和甲醇联合诱导毕赤酵母时单位细胞浓度的木聚糖酶活力达到217.5 U/mL OD600。这表明甲醇和甲酸铵联合诱导有利于AOX1对外源蛋白的表达,而且表明毕赤酵母还有提高表达木聚糖的空间,为将来研究甲酸铵诱导毕赤酵母的一个内容。但是甲酸铵诱导的条件下毕赤酵母的细胞浓度显著低于甲醇诱导时的生物量。所以,在毕赤酵母高密度发酵时,甲酸铵和山梨醇联合诱导将更有利于毕赤酵母表达外源蛋白。本研究为非甲醇类物质诱导毕赤酵母表达外源蛋白提供了基础。
[1]COLLINS T, GERDAY C, FELLER G. Xylanases, xylanase families and extremophilic xylanases [J]. Fems Microbiol Rev, 2005, 29(1): 3-23.
[2]熊科, 杨玉焕, 闫子祥, 等. 碱性木聚糖酶在毕赤酵母的表达及酶学性质研究 [J]. 食品与发酵工业, 2015, 41(3): 33-38.
[3]王停停, 郑宏臣, 徐健勇, 等. 木聚糖酶XynGl-1在毕赤酵母中的表达及发酵条件优化 [J]. 食品与发酵工业, 2017, 43(1): 37-43.
[4]JUTURU V, WU J C. Microbial xylanases: engineering, production and industrial applications [J]. Biotechnology Advances, 2012, 30(6): 1 219-1 227.
[5]LOOSER V, BR HLMANN B, BUMBAK F, et al. Cultivation strategies to enhance productivity ofPichiapastoris: A review [J]. Biotechnology Advances, 2015, 98(6 Pt 2): 1 177-1 193.
[6]POTVIN G, AHMAD A, ZHANG Z. Bioprocess engineering aspects of heterologous protein production inPichiapastoris: a review [J]. Biochemical Engineering Journal, 2012, 64:91-105.
[7]FIDAN O, ZHAN J. Recent advances in engineering yeast for pharmaceutical protein production [J]. RSC Advances, 2015, 5(105): 86 665-86 674.
[8]LEE J Y, CHEN H, LIU A, et al. Auto-induction ofPichiapastorisAOX1 promoter for membrane protein expression [J]. Protein Expression & Purification, 2017, 137:7-12.
[9]WATERHAM H R, DIGAN M E, KOUTZ P J, et al. Isolation of thePichiapastorisglyceraldehyde-3-phosphate dehydrogenase gene and regulation and use of its promoter [J]. Gene, 1997, 186(1): 37-44.
[10]ABDULAEV N G, RIDGE K D. Heterologous expression of bovine opsin inPichiapastoris[J]. Methods in Enzymology, 2000, 315: 3-11.
[11]TSCHOPP J F, BRUST P F, CREGG J M, et al. Expression of thelacZgene from two methanol-regulated promoters inPichiapastoris[J]. Nucleic Acids Research, 1987, 15(9): 3 859-3 876.
[12]GELLISSEN G. Heterologous protein production in methylotrophic yeasts [J]. Applied Microbiology and Biotechnology, 2000, 54(6): 741-750.
[13]MENENDEZ J, VALDES I, CABRERA N. The ICL1 gene ofPichiapastoris, transcriptional regulation and use of its promoter [J]. Yeast, 2003, 20(13): 1 097-1 108.
[14]AHN J, HONG J, LEE H, et al. Translation elongation factor 1-alpha gene fromPichiapastoris: molecular cloning, sequence, and use of its promoter [J]. Applied Microbiology & Biotechnology, 2007, 74(3): 601-608.
[15]DE ALMEIDA J R, DE MORAES L M, TORRES F A. Molecular characterization of the 3-phosphoglycerate kinase gene (PGK1) from the methylotrophic yeastPichiapastoris[J]. Yeast, 2005, 22(9): 725-737.
[16]GAO M J, LI Z, YU R S, et al. Methanol/sorbitol co-feeding induction enhanced porcine interferon-α production byP.pastorisassociated with energy metabolism shift [J]. Bioprocess & Biosystems Engineering, 2012, 35(7): 1 125-1 136.
[17]VOGL T, RUTH C, PITZER J, et al. Synthetic core promoters forPichiapastoris[J]. ACS Synth Biol, 2014, 3: 188-191.
[18]HARTNER F S, RUTH C, LANGENEGGER D, et al. Promoter library designed for fine-tuned gene expression inPichiapastoris[J]. Nucleic Acids Research, 2008, 36(12): 45-50.
[19]WANG J, WANG X, SHI L, et al. Methanol-independent protein expression by AOX1 promoter with trans-acting elements engineering and glucose-glycerol-shift Induction inPichiapastoris[J]. Scientific Reports, 2017, 7: 41 850.
[20]WEI S, YING X, LIU Y, et al. A novel methanol-freePichiapastorissystem for recombinant protein expression [J]. Microbial Cell Factories, 2016, 15(1): 178.
[21]KUMARI A, GUPTA R. Novel strategy of using methyl esters as slow release methanol source during lipase expression by mut(+)PichiapastorisX33 [J]. Plos One, 2014, 9(8): 10.
[22]TYURIN O V, KOZLOV D. Novel inductor for the promoters of the methanol utilization pathway [J]. International Journal of Heat & Mass Transfer, 2013, 66(11): 324-333.
