环介导等温扩增-无电加热法检测乳中阪崎克罗诺杆菌
2018-04-12付世骞曲艳艳冯晓涵满朝新姜毓君
付世骞,曲艳艳,冯晓涵,满朝新,姜毓君
(东北农业大学,乳品科学教育部重点实验室,黑龙江 哈尔滨,150030)
阪崎克罗诺杆菌(Cronobactersakazakii),原名阪崎肠杆菌(Enterobactersakazakii)[1],隶属于肠杆菌科,氧化酶呈阴性,兼性厌氧,革兰氏阴性,周生鞭毛可运动[2-3]。它是一种能够引起新生儿脑膜炎、坏死性小肠结肠炎和败血症的条件性致病菌[4-5],其主要污染来源为婴儿配方粉,对婴幼儿的致死率高达80%[6-7]。我国食品安全国家标准规定,阪崎克罗诺杆菌在婴儿配方粉中不得检出,这使得建立一种能够快速有效的阪崎肠杆菌的检测方法具有重大意义。
当前现有的检测阪崎克罗诺杆菌的方法包括传统微生物培养法、分子生物学检测方法[8]。传统的微生物培养法具有较长的检测时间和复杂的检测过程。分子生物学检测方法灵敏度高、特异性强、检测速度快,然而却需要电、技术人员、冷藏等条件,因此使用受限[9]。
环介导等温扩增(Loop-mediated isothermal amplification, LAMP)是一种新型的核酸恒温扩增方法,它的特点是快速、简单、灵敏度高、特异性强,并且在恒温条件下就可以完成扩增反应,LAMP产物可通过肉眼观察或琼脂糖凝胶电泳法完成对检测结果的判定[10-12]。基于LAMP的这些特点,特别适用于在资源环境有限的条件下完成对婴儿配方奶粉中阪崎克罗诺杆菌的现场检测,但LAMP扩增需要热源。
本研究利用氧化钙和水反应放热结合特定熔点的相变材料设计一种无电加热器,它与环介导等温扩增技术相结合,能够满足LAMP对时间和温度的要求,最终通过琼脂糖凝胶电泳法检测扩增结果[13-15]。本实验所建立的检测方法,灵敏度较高,检测时间短,整个检测过程中操作不需复杂的仪器且不需要电,没有经过培训的非专业人员也可以操作[16-17],能够应用在资源条件有限的环境中实现婴儿配方奶粉中阪崎克罗诺杆菌的检测。
1 材料与方法
1.1 材料与试剂
1.1.1菌株
本实验使用菌株如表1所示。
1.1.2主要生化试剂
引物,英潍捷基(上海)贸易有限公司;甜菜碱,Sigma公司;琼脂糖,美国Amresco公司;DL 2000 DNA marker,北京百泰克生物技术有限公司;Bst2.0 DNA Polymerase,New England Biolabs 公司;dNTP,宝生物工程(大连)有限公司;TSA琼脂培养基,青岛海博生物有限公司;氧化钙,天津市致远化学试剂有限公司;相变材料,杭州鲁尔能源科技有限公司。
1.2 仪器与设备
Bcn136O型生物超净工作台,上海佳胜仪器制造有限公司;DYY-10C 型电泳仪,北京市六一仪器厂;UVP凝胶成像系统,美国UVP公司;GL-21M高速冷冻离心机,上海市离心机机械研究厂;快速混匀器,姜堰市新康医疗器械有限公司;微量台式离心机,上海安亭科学仪器厂;高压灭菌器,上海三申医疗器械有限公司;电热恒温水浴锅,天津泰斯特仪器有限公司;ZHWY200B型全温度恒温培养摇床,上海智城分析仪器制造有限公司;保温饭盒、温度记录器、K型热偶线,超市购买。
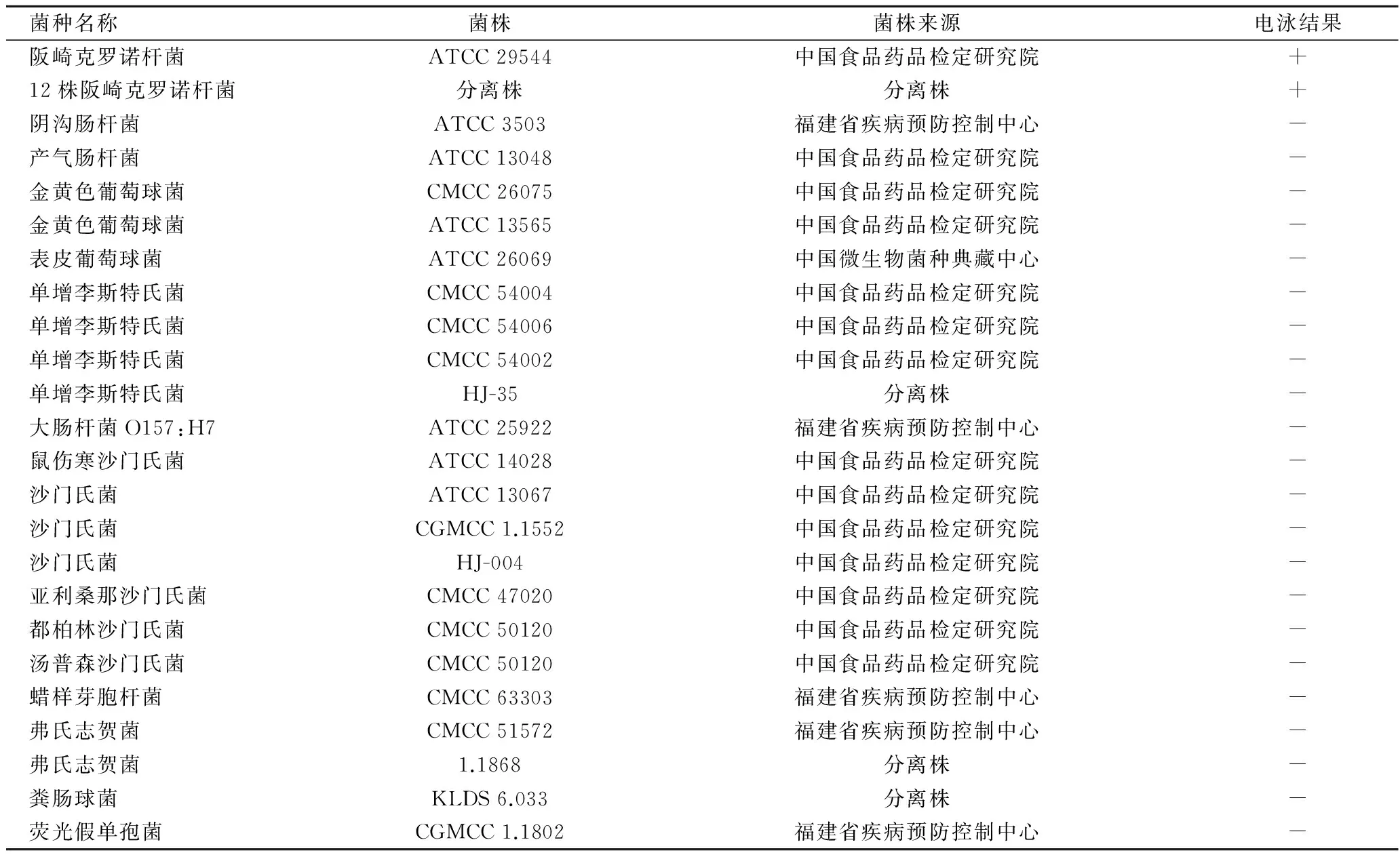
表1 主要菌株及其来源和LAMP电泳结果Table 1 Main strains and sources and the electrophoresis results of LAMP
注:“+”为阳性结果;“-”为阴性结果。
1.3 方法
1.3.1菌株的活化与保藏
在20 mL NB培养基中以2%的接种量接种已纯化的ATCC 29544菌液,于37 ℃、200 r/min的条件下培养8 h,使菌体处于对数生长期,用于后续菌体DNA的提取和菌种保藏。取培养8 h左右的阪崎克罗诺杆菌培养液250 μL加到750 μL含有80%甘油的冻存管中,混匀后密封。在-20 ℃冰箱中保存。
其他细菌培养方法与上述培养方法基本一致,所用的固体和液体培养基分别是NA和NB培养基,按照细菌的最适生长条件进行培养。
1.3.2细菌计数方法
利用经过灭菌的0.85%的生理盐水进行稀释,对阪崎克罗诺杆菌细菌培养液进行连续10倍梯度稀释。然后分别取稀释倍数为10-6、10-7、10-8的3个梯度进行平板涂布。将涂布好的平板放置在37 ℃下培养24 h,使其长出单菌落并进行计数。平板计数选取的菌落范围在30~300之间,菌落平均数乘以稀释倍数再乘10即为原菌液的活菌浓度(CFU/mL)。
1.3.3细菌DNA的提取
本研究采用试剂盒法快速提取细菌基因组DNA,于-20 ℃保存备用。
1.3.4引物的设计与合成
本研究选取了目的基因为阪崎肠杆菌ITS基因,对其设计引物用于环介导等温扩增。运用引物在线设计软件(http://primerexplorer.jp/elamp4.0.0/index.html)进行引物设计。最终设计出6条引物:外引物B3、F3,内引物FIP、BIP和环引物LF、LB。引物序列为:
F3-AAATGCGCGGTGTGTCAG;
B3-GGTTTCCCCATTCGGACAT;
FIP-ACCGTGTACGCTTGTTCGCTTTCTCTCAAACTCGCAG CAC;
BIP-GGCAGTCAGAGGCGATGCGCCGGTTATAACGGTTCA;
LF-AACCTCACAACCCGAAGA;
LB-AGCGCCGGTAAGGTGATA
1.3.5无电加热器
加热器的结构如图1。首先将一定量的氧化钙放到市售的保温饭盒内,添加一定量的水将其和氧化钙搅拌均匀,将称取好的相变材料放到小铝盒内,再将小铝盒放到氧化钙和水的混合物中并被包埋。小铝盒上带有适合尺寸为200 μL PCR管的孔。将连有温度记录器的热偶线插入到相变材料中测定其温度。

a-无电加热器的外观图;b-无电加热器的切面图图1 无电加热器的结构图Fig.1 The structure of the electricity-free heater
1.3.6氧化钙与水的比例的优化
针对65 ℃的相变材料,固定相变材料及氧化钙的质量是10 g和30 g,水的添加量分别是4、5、6、7 mL。将连有温度记录器的热偶插入到相变材料中测定其温度。
1.3.7在无电加热器中进行LAMP扩增的特异性研究
选取13株阪崎克罗诺杆菌和22株非阪崎克罗诺杆菌,提取基因组DNA作为模板并在无电加热器中进行LAMP反应,利用2%的琼脂糖凝胶电泳法进行检测,用以验证所设计引物的特异性,同时检验在无电加热器中是否发生非特异性扩增。
1.3.8LAMP无电检测体系的建立
配置25 μL的环介导等温扩增反应体系,分别将优化到最佳配比的内引物、外引物、环引物、10×ThermoPol Buffer、MgSO4、脱氧核糖核苷酸(dNTPs) 、Bst2.0 DNA 聚合酶及DNA模板混匀,最后加入灭菌水至25 μL。整个恒温反应为64 ℃持续45 min,然后于80 ℃保持5 min结束反应。利用无电加热器和传统的用电加热器分别进行LAMP反应,最终利用2%的琼脂糖凝胶电泳方法分别进行检测。
1.3.9灵敏度的检测
1.3.9.1阪崎克罗诺杆菌纯培养物的灵敏度实验
阪崎克罗诺杆菌三区划线于TSA培养基,培养18~24 h后长出单菌落,挑取单菌落加入到NB培养基中,培养8 h后进行10倍梯度稀释并涂布计数,确定其活菌的浓度。然后采用试剂盒法提取细菌基因组DNA,利用LAMP方法确定克罗诺杆菌纯培养物的检测限,其检测结果通过琼脂糖凝胶电泳法进行观察。
1.3.9.2人工污染的婴儿配方奶粉中阪崎克罗诺杆菌的灵敏度实验
在人工污染婴儿配方奶粉前,利用国标的方法检验,确定不含阪崎克罗诺杆菌。将1 g婴儿配方奶粉加入8 mL生理盐水使其全部溶解,分别取1.3.9.1所述的1 mL进行梯度稀释的菌液加入溶解的婴儿配方奶粉中,并以不污染阪崎克罗诺杆菌的婴儿配方奶粉作为阴性对照。采用试剂盒法提取DNA,并作为LAMP反应的模板。利用LAMP法确定污染阪崎克罗诺杆菌的婴儿配方奶粉的检测限,其中检测结果通过琼脂糖凝胶电泳法进行观察。
1.3.9.3不同环境温度下乳中阪崎克罗诺杆菌灵敏度的检测
婴儿配方奶粉的污染、DNA的提取和LAMP反应及结果的观察如1.3.9.2所述,与其不同的是利用无电加热器进行灵敏度的测定,分别在4、25和37 ℃的环境温度条件下进行。
2 结果与分析
2.1 氧化钙与水的比例优化
LAMP反应温度为65 ℃左右,通过计算温度的平均值和标准偏差得出相变材料的温度谱线如图2所示,蓝色线代表相变材料的温度,随着氧化钙和水的比例的降低,相变材料的温度逐渐升高。如图2-B所示,当氧化钙和水的量分别为30 g和5 mL时,无电加热器能满足LAMP反应的温度和时间。在进行LAMP反应的过程中,200 μL的离心管大约45 min后从加热器中取出来。
2.2 在无电加热器中进行LAMP扩增的特异性研究
在无电加热器中进行LAMP扩增后,LAMP产物通过观察琼脂糖凝胶电泳电泳条带得出检测结果。结果如表1所示,所有13株阪崎克罗诺杆菌均显示阳性,所有22株非阪崎克罗诺杆菌均显示阴性,因此证明了LAMP引物的特异性,并且证明在无电加热器中进行LAMP未发生非特异性扩增。
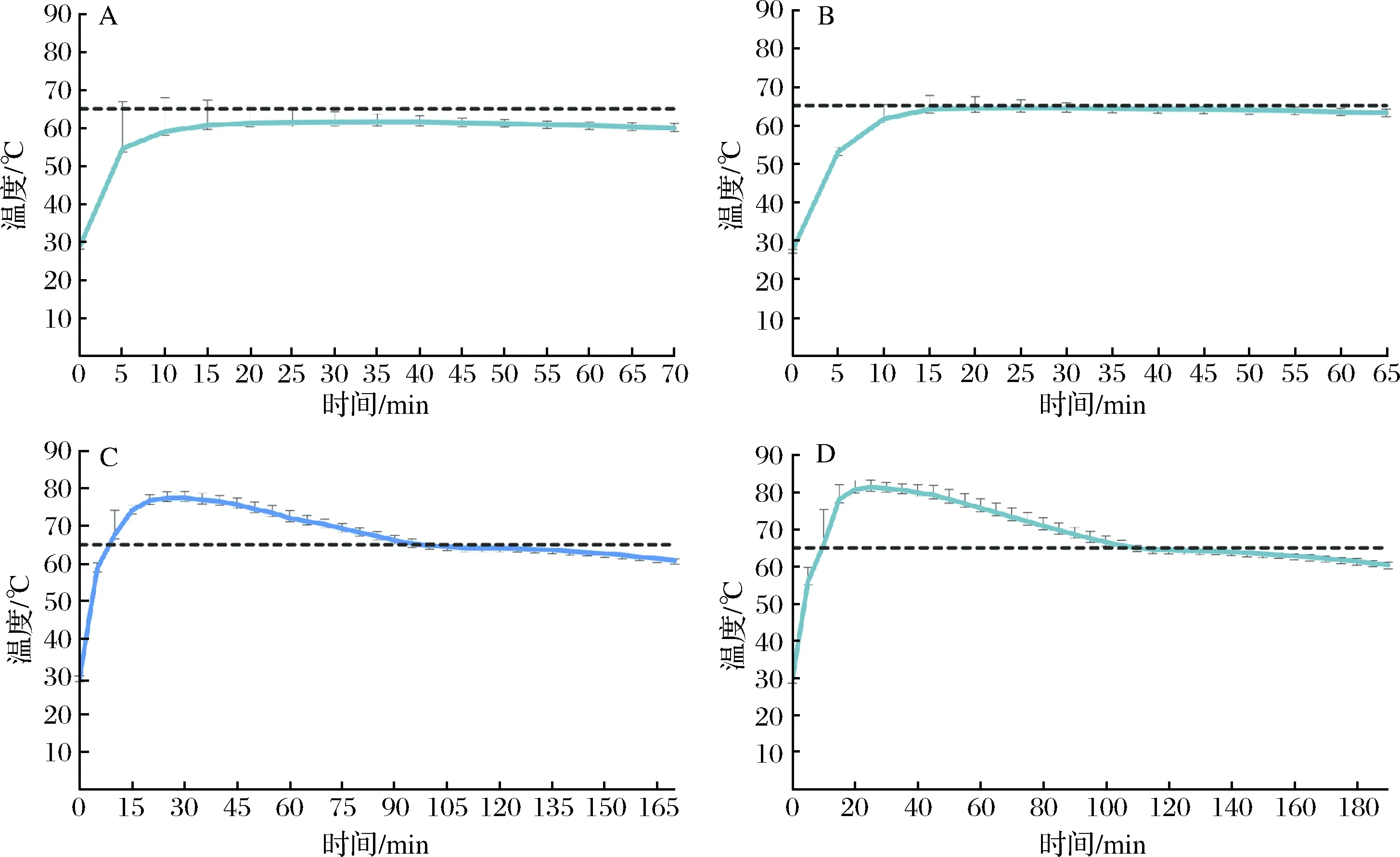
图2 氧化钙与水的比例的优化(65 ℃)Fig.2 Optimization of the proportion calcium oxide and water(65 ℃)(注:1. 固定相变材料及氧化钙的质量为10 g和30 g;2. 水的添加量A-D分别为: 4、5、6、7 mL。)
2.3 LAMP无电检测体系的建立
经过优化,最佳的LAMP体系见表2。

表2 LAMP的最优体系Table 2 The optimal LAMP reaction system
上述LAMP体系在65 ℃条件下反应45 min, 80 ℃条件下终止反应5 min。
利用无电加热器和传统用电加热器分别进行LAMP反应,通过观察电泳条带得出检测结果如图3。结果表明,利用无电加热器能够完成LAMP反应的过程,与传统的带电加热器没有产生显著性差异。
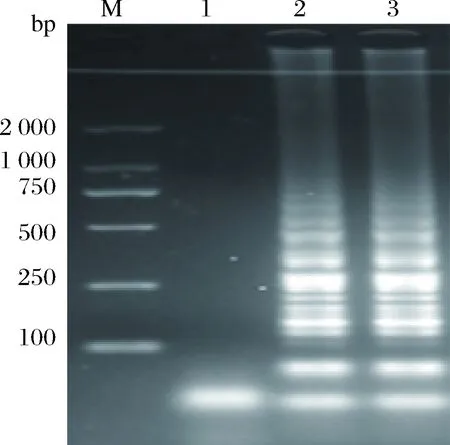
M-Marker;1-阴性;2-用电加热器;3-无电加热器。图3 无电加热器和传统用电加热器检测结果的电泳图Fig.3 The electrophoregram of detection in the portableelectricity-free heater and conventional electric heater
2.4 灵敏度的检测
2.4.1阪崎克罗诺杆菌纯培养物的灵敏度实验
原始菌液浓度为2.6×109CFU/mL,进行梯度稀释后泳道1~7的菌液浓度依次为2.6×105~2.6×10-1CFU/mL。从图4可知,1~4泳道都有典型的LAMP扩增条带,而5~7未见LAMP扩增。由此可见,利用无电加热器和有电加热器对阪崎克罗诺杆菌纯培养物的检测灵敏度均为2.6×102CFU/mL。
2.4.2人工污染的婴儿配方奶粉中阪崎克罗诺杆菌的灵敏度实验
泳道1~7的菌液浓度依次为从4.2×105~4.2×10-1CFU/mL。从图5可见,泳道1~4的LAMP反应都发生扩增,而5~7未见LAMP扩增,由此可知,利用传统用电加热器和无电加热器检测婴儿配方奶粉中阪崎克罗诺杆菌的灵敏度均为4.2×102CFU/mL。

M-DNA marker;1~7-分别对应菌液浓度为2.6×105、2.6×104、2.6×103、2.6×102、2.6×101、2.6×100、2.6×10-1 CFU/mL; 8-阴性对照图4 阪崎克罗诺杆菌纯培养物的灵敏度Fig.4 The detection sensitivity of C. sakazakii in the pure cultures
2.4.3环境温度对检测灵敏度的影响
在不同的环境温度下,对婴儿配方奶粉中阪崎克罗诺杆菌的检测灵敏度见表3,结果表明在4、25 ℃和37 ℃的环境条件下,其检测灵敏度均能达到102CFU/mL,因此证明在操作环境温度4~37 ℃的条件下,利用无电加热器检测婴儿配方奶粉中阪崎克罗诺杆菌的灵敏度是稳定的。

表3 不同环境温度下检测婴儿配方奶粉中阪崎克罗诺杆菌的灵敏度Table 3 The sensitivity of the C. sakazakiiin powderedinfant formula in different ambient temperature
3 结论
在核酸扩增技术中环介导等温扩增法具有较高的灵敏度、特异性、简单、快速、LAMP维持恒温即可实现扩增等特点,与PCR方法相比,LAMP对一些抑制物不敏感[18],制备较简单,而且LAMP产物的检测可以通过横向流动试纸条[19]、添加染料和观察浊度法等进行可视化检测,特别适用于现场检测。本实验利用设计的无电加热器维持LAMP反应所需要的温度和时间,以实现核酸扩增的目的,整个过程操作简单、不需要电和专业人员,在资源有限的环境即可实现检测。
在无电加热器中进行LAMP扩增的特异性检测,通过琼脂糖凝胶电泳图表明,所有13株阪崎克罗诺杆菌均显示阳性,所有22株非阪崎克罗诺杆菌均显示阴性,因此证明了LAMP引物的特异性,和在无电加热器中进行LAMP未发生非特异性扩增。
阪崎克罗诺杆菌检测灵敏度的测定分别利用无电加热器和传统的带电加热器加热,结果表明,2种加热方式对克罗诺杆菌的检测灵敏度并没有产生显著性差异。在资源有限的环境条件下,例如野外、家庭及贫穷的地区等,在检测的过程中可能会遭受低温或者高温,所以需要证明无电加热器在整个检测过程中所得出的检测灵敏度是可靠的,不会因为环境温度过高或者过低影响检测灵敏度,我们针对4、25和37 ℃ 3个环境温度,利用无电加热器对婴儿配方奶粉中阪崎克罗诺杆菌进行灵敏度稳定性的检测。结果表明3个不同环境温度对检测灵敏度并没有产生显著性差异,检测灵敏度均能达到102CFU/g。因此针对乳中克罗诺杆菌检测设计的无电检测体系在现场检测是具有实用性的。
[1]赵贵明, 刘洋, 陈颖, 等. 克罗诺杆菌MALDI-TOF-MS数据库的建立及应用[J]. 食品科学, 2014, 35(8): 105-110.
[2]梁安莉, 石云良, 孙贵娟, 等. 克罗诺杆菌致病性研究进展及流行现状[J]. 中国热带医学, 2016, 16(10): 1 045-1 048.
[3]KALYANTANDA G, SHUMYAK L, ARCHIBALD L K.Cronobacterspecies contamination of powdered infant formula and the implications for neonatal health[J]. Frontiers in Pediatrics, 2015(3): 56.
[4]周文琦, 王蕊, 王喆, 等. 乳中阪崎克罗诺杆菌的快速捕获方法的建立[J]. 中国乳品工业, 2016, 44(12): 19-21.
[5]董鑫悦, 满朝新, 卢雁, 等. 环介导等温扩增法快速检测乳中阪崎肠杆菌[J]. 食品工业科技, 2013, 34(5): 318-320.
[6]SONBOL H, JOSEPH S, MCAULEY C M, et al. Multilocus sequence typing ofCronobacterspp. from powdered infant formula and milk powder production factories[J]. International Dairy Journal, 2013, 30(1):1-7.
[7]SONG X, SHUKLA S, Lee G, et al. Detection ofCronobactergenus in powdered infant formula by Enzyme-linked Immunosorbent Assay using anti-Cronobacterantibody[J]. Frontiers in Microbiology, 2016, 7(e52091).
[8]李春梅, 陶小春. 食源性致病菌快速检测方法研究进展[J]. 医学理论与实践, 2014(5): 590-592.
[9]陶光灿, 李勇, 崔廷婷, 等. 酶联免疫吸附法检测动物源性食品中氨苯砜残留[J]. 食品与生物技术学报, 2013, 32(7): 778-783.
[10]YANG J, GUAN G, NIU Q, et al. Development and application of a loop-mediated isothermal amplification assay for rapid detection of Borrelia burgdorferi s. l. in Ticks[J]. Transboundary & Emerging Diseases, 2013, 60(3): 238.
[11]庞心怡, 满朝新, 赵玥明, 等. 环介导等温扩增技术快速检测肉中沙门氏菌[J]. 中国食物与营养, 2015, 21(8): 12-15.
[12]张胜凯, 张先舟, 王羽, 等. 环介导等温扩增技术检测沙门氏菌反应体系的优化[J]. 安徽农业科学, 2010, 38(22): 11 727-11 729.
[13]LIU C, MAUK M G, HART R, et al. A self-heating cartridge for molecular diagnostics [J]. Lab on A Chip, 2011, 11(16): 2 686.
[14]LIU C, GEVA E, MAUK M, et al. An isothermal amplification reactor with an integrated isolation membrane for point-of-care detection of infectious diseases[J]. Analyst, 2011, 136(10): 2 069-2 076.
[15]SEMA M, ALEMU A, BAYIH A G, et al. Evaluation of non-instrumented nucleic acid amplification by loop-mediated isothermal amplification (NINA-LAMP) for the diagnosis of malaria in Northwest Ethiopia[J]. Malaria Journal, 2015, 14(1): 44.
[16]PAI N P, VADNAIS C, DENKINGER C, et al. Point-of-care testing for infectious diseases: diversity, complexity, and barriers in low-and middle-income countries[J]. Plos Medicine, 2012, 9(9): e1001306-e1001306.
[17]NIEMZ A, FERGUSON T M, BOYLE D S. Point-of-care nucleic acid testing for infectious diseases[J]. Trends in Biotechnology, 2011, 29(5): 240.
[18]CURTIS K A, RUDOLPH D L, OWEN S M. Sequence-specific detection method for reverse transcription, loop-mediated isothermal amplification of HIV-1[J]. Journal of Medical Virology, 2009, 81(6): 966.
[19]LEE D, KIM Y T, LEE J W, et al. An integrated direct loop-mediated isothermal amplification microdevice incorporated with an immunochromatographic strip for bacteria detection in human whole blood and milk without a sample preparation step[J]. Biosensors & Bioelectronics, 2015, 79: 273.
