TTC比色法筛选高存活率的毕赤酵母突变株
2016-11-10刘胜男刘泰瑜张建国
刘胜男,张 燕,刘泰瑜,许 可,张建国
(上海理工大学 食品科学与工程研究所,上海 200093)
TTC比色法筛选高存活率的毕赤酵母突变株
刘胜男,张燕,刘泰瑜,许可,张建国
(上海理工大学 食品科学与工程研究所,上海 200093)
采用TTC比色法筛选高存活率毕赤酵母NTG突变株,探讨了pH值、菌体浓度(OD600)、反应时间、细胞存活率等对TTC显色反应的影响,并与平板计数法进行比较。结果表明,在pH值为4.0~7.0或菌体浓度(OD600)低于50.00时,pH值、OD600均与1,3,5-三苯基甲臜(TPF)生成量(OD485)呈线性正相关关系;反应时间超过9 h后可以保持稳定的TPF生成量;死细胞对TTC显色反应无干扰,在细胞存活率低于50%时,仍然可以采用TTC比色法测定细胞活性。表明,TTC比色法在一定范围内可以筛选高存活率毕赤酵母突变株,且操作简单省时,为筛选高存活率的微生物菌株提供了可靠技术。
TTC比色法;毕赤酵母;存活率;优化;亚硝基胍;筛选
毕赤酵母是一种重要的工业微生物,以毕赤酵母为对象研究工业微生物中的共性问题具有重要的示范意义。毕赤酵母是具有良好应用前景的细胞工厂,尤其是在高效表达外源蛋白质方面受到研究者的重视[1],目前已报道有600多种外源蛋白质在毕赤酵母中成功表达,毕赤酵母表达的外源蛋白在食品工业的应用潜力巨大[2]。毕赤酵母的优点是:基因操作和培养技术简单、成熟,可以分泌表达不同来源的基因[3],有与人相近的蛋白质糖基化系统[4],高密度发酵(130g·L-1)。
目前,毕赤酵母高密度发酵的主要方式是控制溶氧和流加碳源的浓度:(1)控制溶氧浓度在20%以上可以保证毕赤酵母具有一定的代谢甲醇的能力[5],但受甲醇浓度、搅拌、通气等因素的影响,控制稳定的溶氧浓度较困难[6],若溶氧浓度过高会导致细胞死亡[7];另外,以传感器测定甲醇浓度[8]、建立生长模型[9]、调整进气口的氧分压[6]等方式控制溶氧浓度会使发酵液变为非牛顿流体而干扰溶氧的测定[7],导致发酵过程失败。(2)控制流加碳源(甲醇)浓度。在MutS型毕赤酵母的诱导过程中甲醇浓度一般控制在0.2%~0.8%[10],Mut+型毕赤酵母的诱导过程中甲醇浓度一般控制在3%[11]。
由于毕赤酵母以甲醇为碳源的比生长速率较低(0.002~0.14h-1),从而限制了外源蛋白的表达[12],细胞死亡率达到35%[13], 提高微生物细胞存活率因此成为近年来的研究重点[14]。不同学者报道的毕赤酵母高密度发酵过程中细胞存活率有所不同。Xiao等[15]在培养毕赤酵母时发现毕赤酵母的细胞存活率在74%~91%之间;Hohenblum等[13]以批式流加方式培养毕赤酵母时,毕赤酵母的细胞存活率低于70%;Routledge等[16]摇瓶培养毕赤酵母时,细胞存活率达到100%,这可能与分批培养毕赤酵母的培养时间较短有关。
目前,提高细胞存活率的方法有很多,如利用转录因子提高细胞适应耐受环境的压力、利用TATA结合蛋白和σ70提高酿酒酵母耐受酒精的能力[17]、利用产物泄露的方式降低产物对细胞的毒性、动态控制蛋白质的表达和平衡细胞中的代谢过程,但这些方法都需要复杂的技术[17]。而亚硝基胍(NTG)诱变方法较为成熟,操作简单[18],是提高细胞存活率的有效途径。采用人工细胞计数筛选高存活率突变株工作量大、误差大,因此,需要寻找一种简单的筛选方法。基于2,3,5-氯化三苯基四氮唑(TTC)可利用细胞呼吸链中的脱氢酶还原为红色的1,3,5-三苯基甲臜(TPF)[19],可用TTC比色法筛选[20]。为此,作者采用TTC比色法筛选高存活率的毕赤酵母NTG突变株,探讨了pH值、菌体浓度、反应时间、细胞存活率等对TTC显色反应的影响,并与平板计数法进行了比较。
1 实验
1.1菌种与培养基
毕赤酵母GS115,购于生命科学公司(Waltham,MA,USA)。
YPD培养基:酵母粉 10g·L-1,蛋白胨 20g·L-1,葡萄糖 20g·L-1,琼脂粉15g·L-1(平板培养时添加)。
BMGY培养基: 酵母粉 10g·L-1,蛋白胨 20g·L-1,磷酸盐缓冲液(pH值7.0)100mmol·L-1,甘油 20g·L-1,硫酸铵 20g·L-1,生物素4×10-4g·L-1。
1.2毕赤酵母的培养
将25% 甘油保存的毕赤酵母转接到YPD平板培养基上,30 ℃培养3d;然后转接到含有25mLYPD培养基的250mL三角瓶中,30 ℃、200r·min-1培养18~20h;再以4%接种量转接到含有25mLBMGY培养基的250mL三角瓶中,30 ℃、200r·min-1培养2d后每24h加入1.0%甲醇诱导3d。
1.3毕赤酵母的NTG诱变
参照文献[21]进行NTG诱变:10mL毕赤酵母经BMGY培养2d后的菌体浓度(OD600)约为30.00;用100mmol·L-1柠檬酸缓冲液(pH值5.5)洗涤2次后,重悬于10mL100mmol·L-1柠檬酸缓冲液中;加入NTG使终浓度为500μg·mL-1,诱变30min,得到致死率约为88%的毕赤酵母细胞。
1.4TTC显色反应条件探讨
1.4.1pH值对TTC显色反应的影响
取1.0 mL菌液,10 000 r·min-1离心1 min,去上清,加入1.0 mL含0.4%TTC的pH值分别为4.0、5.0、6.0、7.0、8.0的100 mmol·L-1Tris缓冲液,振荡混匀,置于摇床上12 h;10 000 r·min-1离心1 min,去上清,加入1.0 mL的85%二甲基亚砜,振荡混匀;10 000 r·min-1离心1 min,取上清液测OD485。
1.4.2菌体浓度对TTC显色反应的影响
分别取0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL、0.7 mL、0.8 mL、0.9 mL、1.0 mL菌液(菌体浓度在5.71~57.12之间),10 000 r·min-1离心1 min,去上清,加入1.0 mL含0.4%TTC的pH值为8.0的100 mmol·L-1Tris缓冲液,振荡混匀,置于摇床上12 h;10 000 r·min-1离心1 min,去上清,加入1.0 mL的85%二甲基亚砜,振荡混匀;10 000 r·min-1离心1 min,取上清液测OD485。
1.4.3反应时间对TTC显色反应的影响
取1.0 mL菌液于2.0 mL离心管中,10 000 r·min-1离心1 min,去上清,加入1.0 mL含0.4%TTC的pH值为8.0的100 mmol·L-1Tris缓冲液,振荡混匀,置于摇床上12 h,期间每隔1 h对菌液进行10 000 r·min-1离心,去上清,加入1.0 mL的85%二甲基亚砜后振荡混匀;10 000 r·min-1离心1 min,取上清液测OD485。
1.4.4细胞存活率对TTC显色反应的影响
将毕赤酵母活细胞和高温灭活的酵母死细胞混合,得到不同存活率的菌液,毕赤酵母细胞的终体积为2.0 mL。按上述方法进行TTC显色反应,测OD485。
1.5TTC比色法筛选高存活率毕赤酵母NTG突变株
首先测定NTG诱变后毕赤酵母菌株的TTC显色反应的吸光度(OD485),再利用OD485值和活细胞数目之间的关系计算活细胞数目,最后计算毕赤酵母细胞的存活率。
2 结果与讨论
2.1pH值对TTC显色反应的影响(图1)
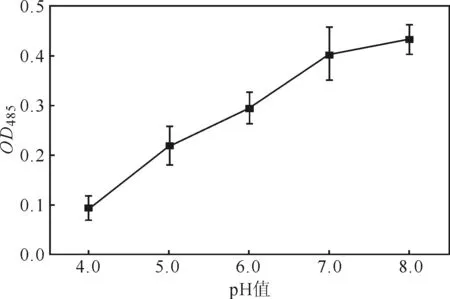
图1 pH值对TTC显色反应的影响Fig.1 Effect of pH value on TTC colorimetric reaction
由图1可以看出,毕赤酵母生长的pH值范围为4.0~8.0,在此范围内,TPF的生成量(OD485)随着pH值的升高而升高;其中,在pH值为4.0~7.0范围内pH值与OD485呈线性正相关关系(OD485=0.1007×pH值-0.3019,R2=0.9922)。表明,低pH值条件下毕赤酵母细胞的呼吸活性较低,升高pH值有利于提高毕赤酵母细胞的呼吸活性。由图1还可以看出,在毕赤酵母可以生长的pH值范围内都可以用TTC显色反应来测定细胞活性。
2.2菌体浓度对TTC显色反应的影响(图2)
由图2可以看出,pH值8.0条件下,OD485随着毕赤酵母菌体浓度(OD600)的升高(从5.71升高到57.12)而升高,且OD485与OD600呈线性正相关关系(OD485=0.0089×OD600+0.0615,R2=0.9264)。表明,菌体浓度(OD600)在5.71~57.12范围内都可以用TTC显色反应测定毕赤酵母细胞活性。由于毕赤酵母在摇瓶中培养的菌体浓度(OD600)最高为50.00[22],所以采用TTC比色法可以不稀释菌体浓度直接测定毕赤酵母细胞活性,简化了操作步骤。
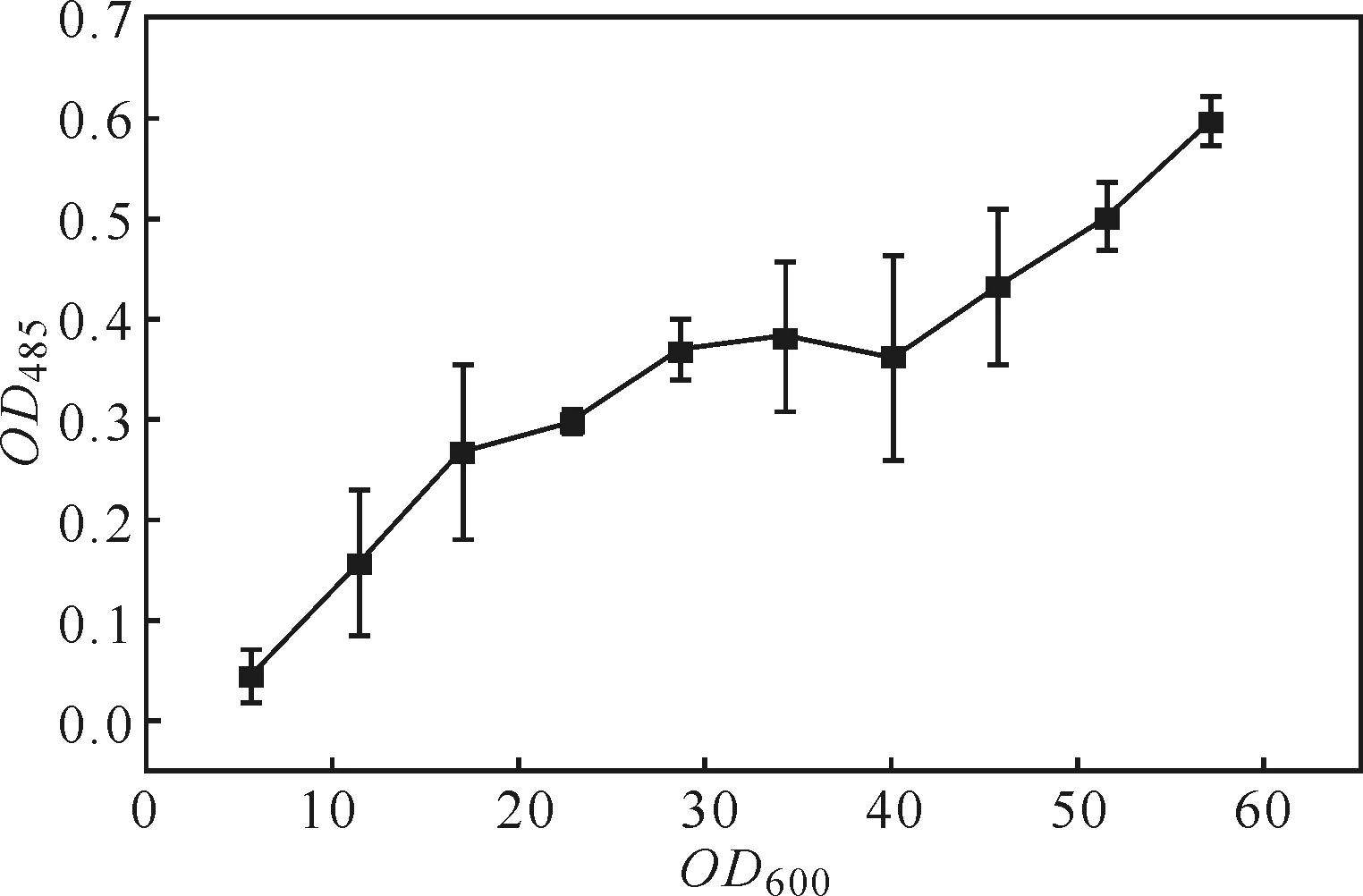
图2 菌体浓度对TTC显色反应的影响Fig.2 Effect of OD600 value on TTC colorimetric reaction
2.3反应时间对TTC显色反应的影响(图3)
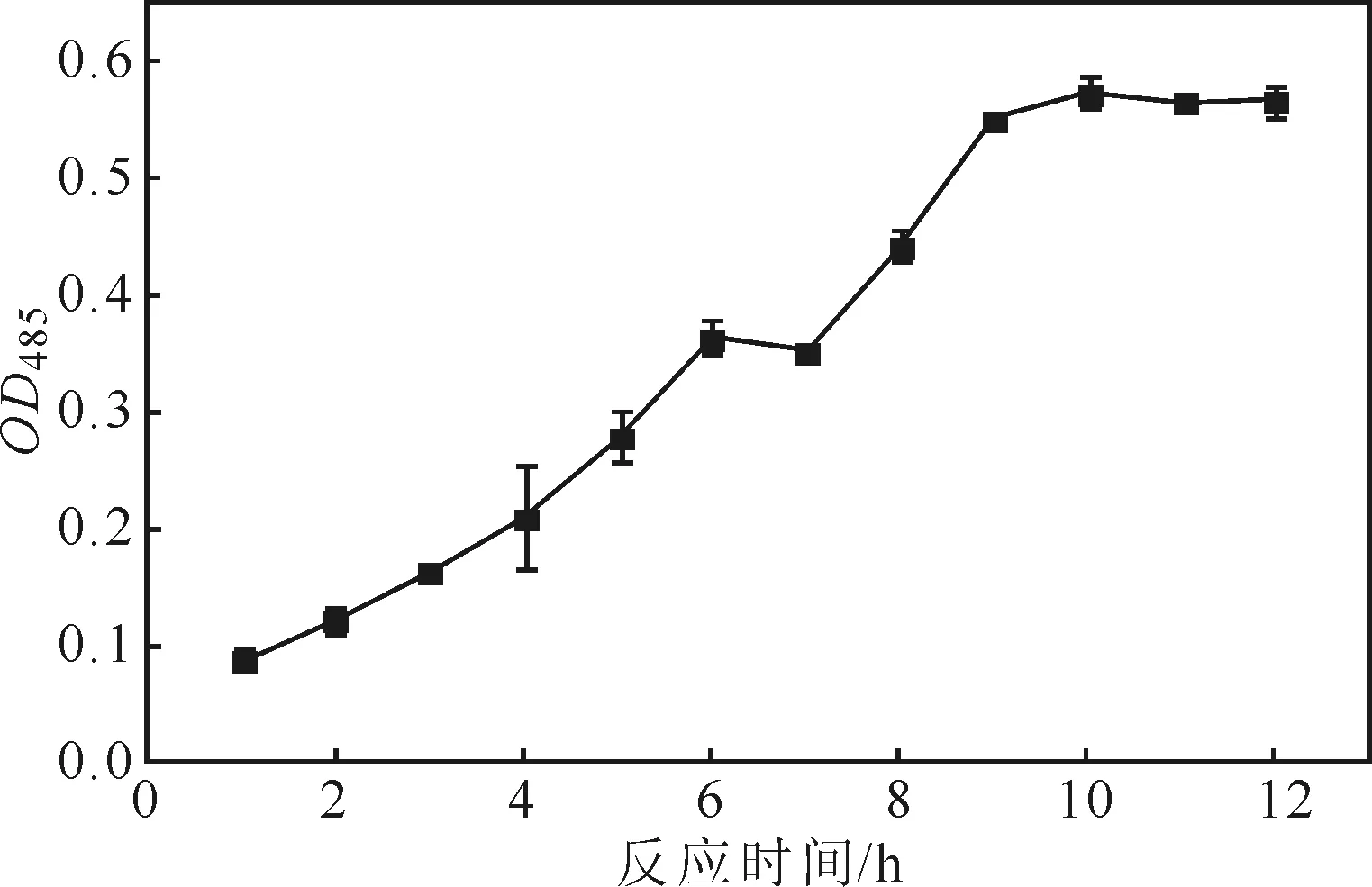
图3 反应时间对TTC显色反应的影响Fig.3 Effect of reaction time on TTC colorimetric reaction
由图3可以看出,随着反应时间的延长,OD485不断升高;当反应时间超过9 h后,OD485保持不变。表明,反应时间超过9 h可以保持稳定的TPF生成量,也可以避免后续操作中反应时间对TTC显色反应的影响。
2.4细胞存活率对TTC显色反应的影响(图4)
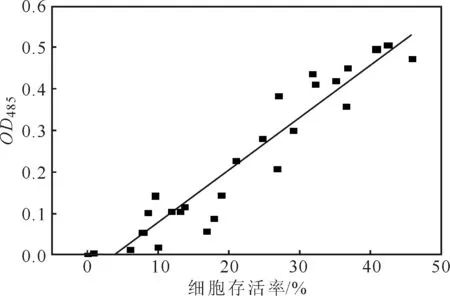
图4 细胞存活率对TTC显色反应的影响Fig.4 Effect of cell viability on TTC colorimetric reaction
由图4可以看出,在细胞存活率小于50%的情况下,随着细胞存活率的升高,OD485逐渐升高,且OD485与细胞存活率呈线性正相关关系(OD485=0.0127×细胞存活率-0.0483,R2=0.9589)。表明采用TTC比色法可以在细胞存活率低于50%的条件下测定毕赤酵母细胞活性,说明死细胞对TTC比色法的干扰不明显。
2.5TTC比色法筛选高存活率毕赤酵母NTG突变株
随机选取20株NTG诱变的毕赤酵母菌株,用TTC比色法测定OD485/OD600值(表征细胞存活率),结果如图5所示。
由图5可知,OD485/OD600值的最低值为37.82,最高值为69.13。
将OD485/OD600值最高的14#突变株培养后分别毕赤酵母的OD485/OD600值采用TTC比色法和平板计数法测定细胞存活率,并与毕赤酵母GS115进行比较,结果见图6。

图5TTC比色法测定NTG诱变后的
Fig.5OD485/OD600value ofPichiapastorismutated by NTGviaTTC colorimetric method
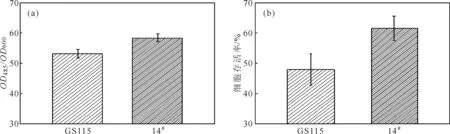
图6 TTC比色法(a)与平板计数法(b)测定的毕赤酵母细胞存活率Fig.6 Cell viability of Pichia pastoris via TTC colorimetric method(a) and plate counting method(b)
由图6可以看出,采用TTC比色法测得GS115菌株和14#NTG诱变菌株的OD485/OD600值分别为53.00、58.23;采用平板计数法测得GS115菌株和14#NTG诱变菌株的存活率分别为48.10%、61.68%。表明TTC比色法能准确描述毕赤酵母细胞的存活率。
2.6讨论
诱变和筛选具有耐受环境或者特殊形状的工业微生物是目前的研究热点。诱变法分为化学法、物理法、空间技术、基因工程等。通过各种诱变手段改变菌体的遗传性状后,从数量庞大的突变菌种库中筛选目标菌种是最关键的步骤,决定能否得到目的突变株,也决定了诱变效率。由于微生物种类和诱变筛选的目的形状的多样性,筛选方法也有所不同,主要有抗性筛选、荧光标记筛选、PCR技术筛选。对筛选菌株活性的测定大多采用稀释涂平板法,该方法非常费时费力。本研究以TTC比色法代替稀释涂平板法,简单省时;利用酶标仪可以同时测定近百个样品,提高了测定效率,但TTC比色法仍需要对每一个菌株进行测定,这也是需要进一步改进的地方。
3 结论
采用TTC比色法筛选高存活率毕赤酵母NTG突变株,探讨了pH值、菌体浓度(OD600)、反应时间、细胞存活率等对TTC显色反应的影响,并与平板计数法进行了比较。结果表明,在pH值为4.0~7.0、菌体浓度(OD600)低于50.00时,pH值、OD600均与1,3,5-三苯基甲臜(TPF)生成量(OD485)呈线性正相关关系;反应时间超过9 h后可以保持稳定的TPF生成量;死细胞对TTC显色反应无干扰,在细胞存活率低于50%时,仍然可以采用TTC比色法测定细胞活性。表明,TTC比色法在一定范围内可以筛选高存活率毕赤酵母突变株,且操作简单省时,为筛选高存活率的微生物菌株提供了可靠技术。
[1]VOGL T,HARTNER F S,GLIEDER A.New opportunities by synthetic biology for biopharmaceutical production inPichiapastoris[J].Current Opinion in Biotechnology,2013,24(6):1094-1101.
[2]SILVA V C,PERES M F S,GATTAS E A L.Application of methylotrophic yeastPichiapastorisin the field of food industry:a review[J].Journal of Food Agriculture & Environment,2009,7(2):268-273.
[3]RAMON A,MARIN M.Advances in the production of membrane proteins inPichiapastoris[J].Biotechnology Journal,2011,6(6):700-706.
[4]LI H,SETHURAMAN N,STADHEIM T A,et al.Optimization of humanized IgGs in glycoengineeredPichiapastoris[J].Nature Biotechnology,2006,24(2):210-215.
[5]SINGH S,GRAS A,FIEZ-VANDAL C,et al.Large-scale functional expression of WT and truncated human adenosine A2A receptor inPichiapastorisbioreactor cultures[J].Microbial Cell Factories,2008,7(1):28.
[6]LIM H K,CHOI S J,KIM K Y,et al.Dissolved-oxygen-stat controlling two variables for methanol induction of rGuamerin inPichiapastorisand its application to repeated fed-batch[J].Applied Microbiology and Biotechnology,2003,62(4):342-348.
[7]CHUNG J D.Design of metabolic feed controllers:application to high-density fermentations ofPichiapastoris[J].Biotechnology and Bioengineering,2000,68(3):298-307.
[8]KATAKURA Y,ZHANG W,ZHUANG G,et al.Effect of methanol concentration on the production of humanβ-2-glycoprotein Ⅰ domain Ⅴ by a recombinantPichiapastoris:a simple system for the control of methanol concentration using a semiconductor gas sensor[J].Journal of Fermentation and Bioengineering,1998,86(5):482-487.
[9]ZHANG W,SMITH L A,PLANTZ B A,et al.Design of methanol feed control inPichiapastorisfermentations based upon a growth model[J].Biotechnology Progress,2002,18(6):1392-1399.
[10]STRATTON J,CHIRUVOLU V,MEAGHER M.High cell-de-nsity fermentation[J].Methods in Molecular Biology,1998,103:107-120.
[11]KHATRI N K,HOFFMANN F.Impact of methanol concentration on secreted protein production in oxygen-limited cultures of recombinantPichiapastoris[J].Biotechnology and Bioengineering,2006,93(5):871-879.
[12]HEYLAND J,FU J,BLANK L M,et al.Carbon metabolism limits recombinant protein production inPichiapastoris[J].Biotechnology and Bioengineering,2011,108(8):1942-1953.
[13]HOHENBLUM H,BORTH N,MATTANOVICH D.Assessing viability and cell-associated product of recombinant protein producingPichiapastoriswith flow cytometry[J].Journal of Biotechnology,2003,102(3):281-290.
[14]LO T M,TEO W S,LING H,et al.Microbial engineering strategies to improve cell viability for biochemical production[J].Biotechnology Advances,2013,31(6):903-914.
[15]XIAO A F,ZHOU X S,ZHOU L,et al.Improvement of cell viability and hirudin production by ascorbic acid inPichiapastorisfermentation[J].Applied Microbiology and Biotechnology,2016,72(4):837-844.
[16]ROUTLEDGE S J,HEWITT C J,BORA N,et al.Antifoam addition to shake flask cultures of recombinantPichiapastorisincreases yield[J].Microbial Cell Factories,2011,10(1):1-11.
[17]ALPER H,STEPHANOPOULOS G.Global transcription machinery engineering:a new approach for improving cellular phenotype[J].Metabolic Engineering,2007,9(3):258-267.
[18]HARPER M,LEE C J.Genome-wide analysis of mutagenesis bias and context sensitivity ofN-methyl-N′-nitro-N-nitrosoguanidine(NTG)[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,2012,731(1/2):64-67.
[19]LUO C,WANG X M,LONG J G,et al.An NADH-tetrazolium-coupled sensitive assay for malate dehydrogenase in mitochondria and crude tissue homogenates[J].Journal of Biochemical and Biophysical Methods,2006,68(2):101-111.
[20]徐俊,雍晓雨,费文斌,等.基于TTC染色法的高活力酵母细胞定量筛选[J].食品与发酵工业,2014,40(7):1-5.
[21]SANCHEZ S,DEMAIN A L.Enrichment of auxotrophic mutants inHansenulapolymorpha[J].Applied Microbiology and Biotechnology,1977,41(1):45-49..
[22]VILLATTE F,HUSSEIN A,BACHMANN T,et al.Expression level of heterologous proteins inPichiapastorisis influenced by flask design[J].Applied Microbiology and Biotechnology,2001,55(4):463-465.
Screening of High Cell ViabilityPichiapastorisMutant by TTC Colorimetric Method
LIU Sheng-nan,ZHANG Yan,LIU Tai-yu,XU Ke,ZHANG Jian-guo
(InstituteofFoodScienceandEngineering,UniversityofShanghaiforScienceandTechnology,Shanghai200093,China)
HighcellviabilityPichia pastorismutantwasscreenedbyTTCcolorimetricmethod.TheeffectsofpHvalue,celldensity(OD600),reactiontime,cellviabilityonTTCcolorimetricreactionwereinvestigated,andcomparedwiththeplatecountingmethod.ResultsindicatedthatOD485of1,3,5-triphenylformazan(TPF)wasproportionalrelatedtothepHvalue(4.0~7.0)orOD600(below50.00).AndtheproductionofTPFremainedstableafterreactionfor9h.Deadcellsdidnotinterferewithcolorimetricreaction.SoTTCcolorimetricmethodcouldbeusedtodetectcellactivityevenwhenthecellviabilitywasbellow50%.TTCcolorimetricmethodcouldbeappliedinscreeningofhighcellviabilityPichia pastorismutantwithinacertainrange,anditwassimpleandtime-saving.Insummary,TTCcolorimetricmethodprovidedareliableapproachforscreeningofhighcellviabilitystrain.
TTCcolorimetricmethod;Pichia pastoris;viability;optimization;NTG;screening
国家自然科学基金资助项目(21306112),上海市自然科学基金资助项目(13ZR1429100),上海高校青年教师培养资助计划项目(slg14037),教育部留学回国人员科研启动基金资助项目,上海理工大学研究生创新基金资助项目,微创励志创新基金资助项目(YS30808007)
10.3969/j.issn.1672-5425.2016.10.004
Q 815
A
1672-5425(2016)10-0018-05
刘胜男,张燕,刘泰瑜,等.TTC比色法筛选高存活率的毕赤酵母突变株[J].化学与生物工程,2016,33(10):18-22.
