电刺激中脑导水管周围灰质对大鼠心脏伤害性感受的下行性抑制调控
2018-04-10刘晓华杜剑青
韩 曼,刘晓华,杜剑青
(1陕西中医药大学生理学教研室,咸阳 712046;2西安交通大学医学部病理生理学与生理学系;*通讯作者,E-mail:dujianq@mail.xjtu.edu.cn)
心源性疾病引起的胸痛越来越受到重视,而心肌缺血是引起心源性胸痛的主要原因之一。现已明确缺血损伤的心肌组织可释放多种致痛物质,如,缓激肽(bradykinin,BK)、腺苷、组织胺、5-羟色胺、钾离子、前列腺素等。这些化学因素具有协同作用,可激活心脏交感神经Aδ和C类纤维末梢引起疼痛。大鼠虽无心源性疼痛,但是存在与心源性疼痛相似的心脏伤害性感受。2001年,Jou等[1]通过心包内注射化学性致痛物质诱发大鼠心脏伤害性感受,表现为心脏-躯体运动反射,该反射以背斜方肌肌电(electromyogram,EMG)为观测指标。本课题组采用心包内注射化学性致痛物质制备大鼠心脏伤害性感受模型对心源性疼痛中枢调控节机制的研究已取得初步进展[2-4]。
在中枢神经系统内有一个以脑干中线结构为中心、由许多脑区组成的痛觉调制的神经网络系统。在这个系统中中脑导水管周围灰质(periaqueductal gray,PAG)处于核心地位,是中枢内源性镇痛系统的关键结构,处在承上启下的重要地位[5,6]。研究表明电刺激大鼠PAG对脊髓背角神经元放电、热辐射痛阈具有抑制作用[7,8],然而,电刺激PAG对心脏伤害性感受是否具有下行性抑制调控作用,尚不清楚。本研究拟通过电刺激激活PAG,观察大鼠心包内注射BK诱发背斜方肌EMG活动及脊髓背角c-Fos表达的变化,探讨PAG对心脏伤害性感受的下行性调控作用。
1 材料与方法
1.1 主要试剂与仪器
BK、戊巴比妥钠(均购于美国Sigma公司),药物均溶解于生理盐水中,配制成所需浓度。BK:1 μg/ml和50 μg/ml;戊巴比妥钠:20 g/L和5 g/L。兔抗大鼠c-Fos多克隆抗体(AB7963;美国Abcam公司);ABC Kit免疫组化试剂盒(PK-6101;美国Vector公司)。蠕动泵(BT100-2J,保定兰格恒流泵有限责任公司);小动物呼吸机(DW3000-B型,淮北正华生物仪器设备有限公司);BL-420A生物信号采集与分析系统及压力换能器(成都泰盟生物科技有限公司);大鼠脑立体定位仪(日本Narishige公司)。
1.2 实验动物分组
实验选用36只雄性10周龄清洁级SD大鼠,体质量280-300 g,由西安交通大学医学院实验动物中心提供(生产许可证:SCXK(陕)2012-003),大鼠在标准清洁级环境中饲养。动物随机分为3组:生理盐水组、BK组、电刺激+BK组,每组12只。其中每组6只大鼠记录背斜方肌肌电,余6只大鼠行免疫组化染色。
1.3 实验动物模型建立
SD大鼠给予2%戊巴比妥钠45-55 mg/kg腹腔麻醉。行气管插管后对动物实施人工呼吸(潮气量5.0-6.0 ml,呼吸频率60-70次/min),左侧颈静脉插管用于补液及维持麻醉[0.05%戊巴比妥钠,15 mg/(kg·h)],右侧颈总动脉插管用于监测动脉血压,维持平均动脉压处于90-100 mmHg,从而保证一个稳定而合适的麻醉状态。暴露左侧背斜方肌,记录EMG。直肠温度计监测大鼠体温,通过温控仪维持大鼠体温在(37.0±0.5)℃。
心包插管术与给药方法:为实现用心包内BK诱发大鼠心脏伤害性感受的目的,对大鼠左侧上胸部第一到第三肋软骨处行开胸术,暴露胸腺和心脏。用玻璃探针在心包膜上开一小孔,将一内径0.051 cm、外径0.094 cm、长12-14 cm远端有数个小洞的硅胶管顺胸腺中线经此孔插入心包约2 cm,依次缝合各层胸壁组织,以固定心包插管。
心脏-躯体运动反射实验给药方法:通过心包插管向心包内注射BK 0.2 ml(1 μg/ml),记录EMG活动60 s后回抽,0.2 ml无菌生理盐水连续冲洗心包5次并回抽,同一只大鼠,心包注射BK每次间隔40 min。整个过程用0.05%戊巴比妥钠维持麻醉。
免疫组化实验给药方法:大鼠实施基础手术后4 h,心包内一次性注射BK溶液0.2 ml(50 μg/ml),保留不回抽。整个过程用0.05%戊巴比妥钠维持麻醉,心包内注射BK 2 h后灌注。
背斜方肌EMG的记录:同芯电极以30°的角度插入背斜方肌约1.5-1.7 mm,通过BL-420A生物信号采集与分析系统记录其EMG活动,每次BK诱发EMG活动总放电单位数(TMUD)通过BL-420A分析软件直接统计得出。由于不同大鼠BK诱发的TMUD有所不同,为了消除个体之间的差异,每只大鼠首次心包内注射BK所诱发的TMUD被标化为100%,作为基础对照,其后续EMG的TMUD均以首次TMUD为分母进行标化,得出百分数,即EMG的变化率。
1.4 PAG电刺激
将动物头部固定于大鼠脑立体定位仪上,行顶骨开颅术。同芯刺激电极(内径0.2 mm)经大鼠脑立体定位仪推进入PAG内,根据Paxinos and Watson大鼠脑图谱[9]对PAG进行脑立体定位,参数如下:前囟后7.5-8.5 mm,脑表面下5.5-6.5 mm,中线向右旁开0.5 mm。电刺激参数:100、150和200 μA,100 Hz,0.1 ms阴极电流。对于电刺激+BK组,PAG电刺激10 s后,再进行心包内注射BK。
实验结束后,通以30 μA、30 s阳极电流进行电损毁,以标记PAG内电刺激位点。对中脑做40 μm的连续冰冻切片后,行尼氏染色,从组织学角度确认电刺激位点,只统计电刺激位点在PAG内的实验数据。将电刺激位点重建和标记在Paxinos and Watson大鼠脑图谱PAG横切面上。
1.5 c-Fos免疫组织化学染色
免疫组化动物经相应处理后,暴露大鼠心脏,经左心室升主动脉插管灌注固定。先用150 ml 0.01 mol/L PBS(pH 7.4)快速灌流,继之以约200 ml含30%饱和苦味酸和4%多聚甲醛的0.1 mol/L PB(pH 7.4)固定溶液快速灌注固定,然后再以同样的固定液250 ml缓慢滴注,持续l.5-2 h。灌注完毕后取脑与T3-T5脊髓,置于上述新鲜固定液中后固定4 h(4 ℃)。继之将上述组织转入含30%蔗糖的0.1 mol/L PB溶液中(4 ℃)沉底后,冰冻切片,片厚30 μm。电刺激组脑片行尼氏染色,在显微镜下进一步确定电刺激位点。T3-T5脊髓按照切片顺序隔3取1,分两组收集于含0.01 mol/L的PBS的洗片盒中备用。免疫组织化学ABC法兔抗鼠c-Fos抗体的工作浓度为1 ∶1 000。对照实验用PBS代替一抗,其余步骤相同。用Olympus光学显微镜(BX51)照相,用软件SPOT对切片进行图像采集,用Imag-Pro-Plus软件计数。
1.6 统计学分析
应用SPSS13.0统计软件进行统计学分析。各处理因素干预大鼠心包内注射BK诱发EMG的变化率以均数±标准差表示,组间比较采用One-way ANOVA并LSD检验进行分析,两组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 心包内注射BK诱发EMG的变化
生理盐水组大鼠背斜方肌均无EMG活动,BK组大鼠均有EMG反应(见图1A)。为了验证心包内注射BK诱发的EMG活动是否具有可靠的重复性,于6只大鼠间隔40 min心包内连续5次注射BK。结果表明第2次至第5次心包内BK所诱发的EMG与第1次BK注射所诱发的EMG活动(标化为:100%)无明显差别,分别为第1次的98.75%±0.75%、97.94%±0.56%、97.11%±0.52%、96.63%±0.68%。原始肌电实例见图1B。
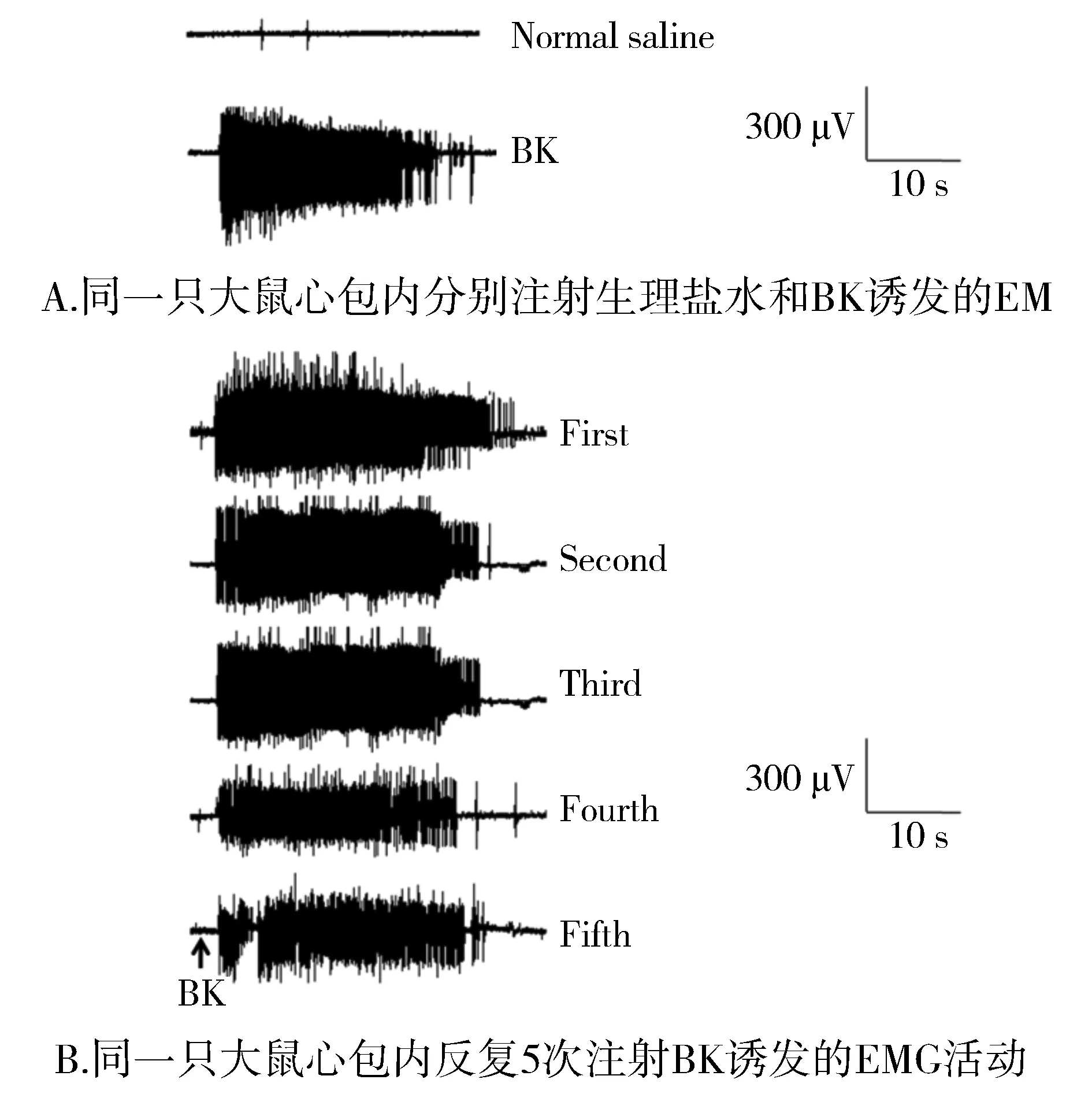
图1 大鼠心包内注射BK诱发的EMG活动Figure 1 EMG responses of rats induced by intrapericardial bradykinin
2.2 电刺激PAG对心包内注射BK诱发EMG活动的影响
电刺激PAG强度依赖性地抑制心包内注射BK诱发的背斜方肌EMG活动(见图2A),EMG分别下降至BK前对照的50.63%±1.52%、43.27%±1.99%和28.88%±0.97%。电刺激PAG的组织再建图见图2B
2.3 电刺激PAG对心包内注射BK诱发脊髓背角c-Fos表达的影响
大鼠心包内注射生理盐水后,T3-T5脊髓背角Ⅰ-Ⅴ层有非常少量的c-Fos阳性表达,数量为21.83±5.08,左右背角表达无明显差别。相反,心包内注射BK诱发了脊髓背角c-Fos的显著表达,数量为205.83±10.07(P<0.05)。然而当150 μA电刺激PAG后,心包内注射BK诱发的脊髓背角c-Fos表达显著减少,数量为93.33%±7.76%(P<0.05,见图3)。
3 讨论
脊髓以上中枢对脊髓背角伤害性信息的传入具有下行性抑制调控作用。PAG是位于中脑顶盖与被盖之间由密度高的神经细胞围绕中脑水管构成的一片环形区域,是中枢下行性抑制调控系统承上启下的关键结构[10,11]。研究表明电刺激或微量注射吗啡于PAG可以引起显著的镇痛效应[7,8,12],然而这些研究主要关注躯体痛觉,对内脏痛觉尤其是心脏痛觉的研究甚少。这部分归因于心脏痛觉模型建立困难。2001年,Jou等[1]建立了心包内注射化学性致痛物制备心脏伤害性感受动物模型,该模型制备简单,利用背斜方肌EMG作为痛反应指标易于检测,为心脏痛觉的研究奠定了基础。本实验采用心包内注射BK制备心脏伤害性感受动物模型,结果表明电刺激PAG能够抑制心包内BK诱发的背斜方肌EMG活动,且呈强度依赖性效应,说明PAG对心脏伤害性感受具有下行性抑制调控作用。
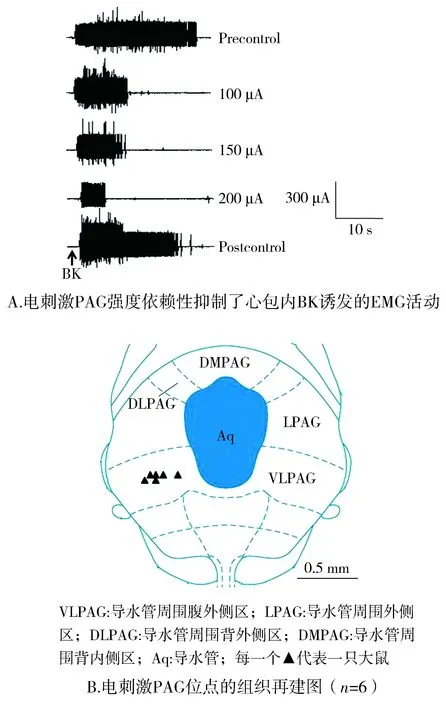
图2 电刺激PAG对心包内注射BK诱发的肌电活动Figure 2 Effects of electrical stimulation in PAG on the EMG response evoked by intrapericardial BK
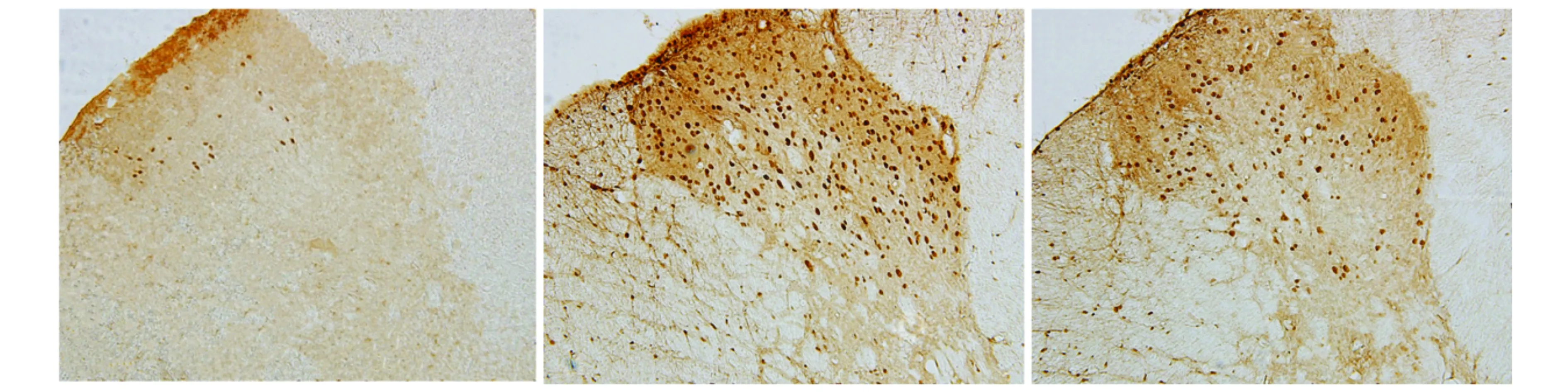
A.生理盐水组 B. 缓激肽组 C. 电刺激+缓激肽组图3 各组大鼠脊髓背角c-Fos的表达 (×200)Figure 3 Expression of c-Fos in the spinal dorsal horn of rats in each group (×200)
c-Fos是原癌基因中的即刻早期基因产物。Hunt等[13]首先将原癌基因用于痛觉研究中,从此,观察c-Fos在中枢神经系统的空间表达状况成为探索伤害性感受神经通路最常用的方法之一。神经解剖学研究表明起源于心脏的交感传入纤维,中枢突进入T1-T4或T5节段后角和中间带外侧核,与脊髓上行通路的神经元形成突触联系[14]。因此,以上区域c-Fos表达的增加代表着该部位参与伤害性信息的传递或整合。本实验结果显示,心包内注射BK激活了心脏初级传入纤维进而导致T3-T5节段Ⅰ-Ⅴ层c-Fos表达增加,而电刺激激活PAG明显抑制了c-Fos免疫样反应,这与电刺激PAG抑制背斜方肌肌电活动的电生理结果相一致。两种结果均支持激活PAG对心脏伤害性感受发挥下行性抑制调控作用。
PAG的细胞和神经化学结构都是异质性的,其内含有多种经典神经递质和神经肽,如阿片肽、5-羟色胺、γ-氨基丁酸、P物质等。韩济生[15]认为PAG主要通过两条下行通路对脊髓背角神经元产生抑制调控作用,一条是PAG-RVM-脊髓背角;另一条是PAG-LRN-脊髓背角。我们前期研究已证实,RVM对心包内BK诱发的心脏伤害性感受产生抑制调控作用[16],同时,电刺激LRN抑制了心包内注射辣椒素诱发的心脏伤害性感受[17]。那么,PAG对心包内注射BK诱发的心脏伤害性感受究竟通过何种下行通路发挥下行性抑制调控作用,有待下一步研究。
参考文献:
[1]Jou CJ,Farber JP,Qin C,etal.Intrapericardial algogenic chemicals evoke cardiac-somatic motor reflexes in rats[J]. Auton Neurosci, 2001, 94(1-2):52-61.
[2]韩曼,刘晓华,杜剑青.脊髓5-羟色胺受体参与延髓外侧网状核对大鼠心脏伤害性感受的下行性抑制调控[J].南方医科大学,2017,37(9):1190-1194.
[3]Liu XH, Zhang Q, Han M,etal. Intrapericardial capsaicin and bradykinin induce different cardiac-somatic and cardiovascular reflexes in rats[J]. Auton Neurosci, 2016, 198:28-32.
[4]韩曼,刘晓华,杜剑青.脊髓NK1受体与非NMDA受体对大鼠心脏-躯体运动反射的调节作用[J].南方医科大学学报,2014,34(12):1728-1732.
[5]韩济生.疼痛学[M].北京:北京大学医学出版社,2012:74-75.
[6]Millan MJ.Descending control of pain[J].Prog Neurobiol,2002,66(6):355-474.
[7]杜剑青,张天祥,程珍凤.PAG电刺激和微注射吗啡对脊髓WDR和NS神经元放电的影响[J].西安医科大学学报,2000,21(1):9-12.
[8]王宁,张婷,苏园林,等.中脑导水管周围灰质电刺激与丘脑电刺激对大鼠伤害感知行为[J].生理学报,2016,68(2):115-125.
[9]Paxinos G, Watson C. The rat brain in stereotaxic coordinates[M]. 4nd edi. San Diego, CA:Academic Press,1998.
[10]Morgan MM. Differences in antinociception evoked from dorsal and ventral regions of the caudal periaquductal gray matter[M]//Depaulis A, Bandler R. The midbrain periaqueductal gray matter: functional, anatomical, and neurochemical organization. New York: Plenum Press, 1991: 139-150.
[11]Chen T, Li J, Feng B,etal. Mechanism underlying the analgesic effect exerted by endomorphin-1 in the rat ventrolateral periaqueductal gray[J]. Mol Neurobiol, 2015, 51(1):1-18.
[12]Lovick TA. Interactions between descending pathways from the dorsal and ventrolateral periaqueductal gray matter in the rat[M]//Depaulis A, Bandler R, editors. The midbrain periaqueductal gray matter: functional, anatomical, and neurochemical organization. New York: Plenum Press, 1991: 101-120.
[13]Hunt SP, Pini A, Evan G. Induction of c-fos-like protein in spinal cord neurons following sensory stimulation[J]. Nature, 1987, 328(6131): 632-634.
[14]柏树令.系统解剖学[M].北京:人民卫生出版社,2008:449-450.
[15]韩济生.神经科学[M].北京:北京大学医学出版社,2009:657-658.
[16]Sun N, Liu XH, Du JQ,etal. Rostroventral medulla-mediated biphasic modulation of the rat cardiosomatic motor reflex[J]. Neuroscience, 2011, 185:174-182.
[17]韩曼,刘晓华,杜剑青.电刺激延髓外侧网状核对大鼠心脏-躯体运动反射的下行性抑制作用及其机制[J].吉林大学学报(医学版),2012,38(3):433-437.
