阿司匹林对匹罗卡品诱导大鼠癫痫持续状态后海马异常神经发生的影响
2018-04-10崔小丽
崔小丽,山 媛,袁 婕,赵 瑞,马 妮,吕 桦
(陕西省人民医院神经内一科,西安 710068;*通讯作者,E-mail:lvh2113@163.com)
癫痫是一组由不同病因引起,脑部神经元高度同步化,且常具自限性的异常放电所致,以发作性、短暂性、重复性及刻板性的中枢神经系统功能失常为特征的综合征。Eriksson和其同事在1998年初次提出人脑内有神经再生。在难治性颞叶癫痫患者病理标本中可以发现神经前体细胞增殖分化为神经元或胶质细胞。癫痫持续状态以后几天就会看到神经发生,几周以后还会保持高水平。动物在正常情况下,其新生神经元接受功能性传入信息,继而将信号传出到突触后神经元。在癫痫哺乳动物脑组织发现新生神经元异位迁移,异位到门区,形成异常的神经环路,提高神经元的兴奋性,导致癫痫的反复发作。癫痫发作后,海马齿状回神经发生水平出现明显改变。这一现象为探讨癫痫后海马结构和功能可塑性的变化提供全新思路,也为癫痫的治疗带来新的曙光。阿司匹林对癫痫发生过程中神经发生有何作用尚不清楚。本实验采用氯化锂-匹罗卡品致癫痫大鼠模型,观察非甾体抗炎药阿司匹林对匹罗卡品诱导大鼠癫痫持续状态后海马异常神经发生的调控研究。
1 材料和方法
1.1 主要试剂
氯化锂(广东西陇化工厂);匹罗卡品(Sigma-Aldrich);溴甲基东莨菪碱(Sigma-Aldrich);水合氯醛(上海山浦化工有限公司);阿司匹林(Sigma-Aldrich);地西泮注射液(西安利君精华药业有限公司);小鼠抗BrdU抗体(Santa Cruz Biotechnology);羊抗DCX抗体(Santa Cruz Biotechnology);生物素标记的羊抗小鼠IgG(Vector laboratories,Burlingame,CA);生物素标记的兔抗羊IgG(Vector laboratories,Burlingame,CA);生物素-卵白素-HRP复合物(Sigma-Aldrich)。
1.2 实验动物及分组
雄性SD大鼠75只,清洁级,体质量200-250 g,购自第四军医大学实验动物中心,饲养于12 h/12 h光暗环境(8:00-20:00),自由饮水,给予标准饮食。所有的动物实验处理严格按照国家健康协会制定的实验动物护理和使用指南。75只大鼠随机等分为正常对照组、模型组、0 h阿司匹林干预组、3 h阿司匹林干预组和24 h阿司匹林干预组(癫痫持续状态持续70 min,地西泮注射液终止发作,终止后的即刻给予阿司匹林干预定为0 h阿司匹林干预组,终止后的3 h、24 h分别开始给药,定为3 h阿司匹林干预组和24 h阿司匹林干预组)。
1.3 氯化锂-匹罗卡品致大鼠癫痫模型
大鼠腹腔注射氯化锂(3 meq/kg,美国Sigma公司),间隔18-20 h腹腔注射匹罗卡品(30 mg/kg,美国Sigma公司),在注射匹罗卡品前15-20 min大鼠给予皮下注射溴甲基东莨菪碱(1 mg/kg)以减少外周胆碱能反应。注射匹罗卡品后约15 min大鼠会出现行为学变化,行为变化的记录和等级依照Racine评分标准[1]:0级,无任何反应;1级,行为固定,面肌抽搐;2级,点头和湿狗样动作;3级,双侧前肢阵挛;4级,前肢阵挛和后肢站立;5级,站立并摔倒。大鼠出现连续的四级以上发作持续70 min,给予地西泮终止发作。建模时对照组腹腔注射给予等量生理盐水。终止发作半小时后,每只大鼠皮下注射生理盐水10 ml,减少大鼠的死亡率,补充建模时的消耗。造模后前2 d,给予大鼠糊状常规鼠粮。
1.4 阿司匹林干预及分组
将大鼠随机分为正常对照组、模型组、0 h阿司匹林(20 mg/kg,腹膜腔内注射1次/d)干预组、3 h阿司匹林干预组、24 h阿司匹林干预组,阿司匹林溶于含5%二甲基亚砜(5%DMSO)的生理盐水,各组都是连续给药20 d,对照组和模型组都是给予等量的含5%DMSO的生理盐水。
1.5 BrdU给药方法
建模癫痫发作后第6天大鼠腹腔注射BrdU 10 mg/ml(50 mg/kg,Sigma公司),每12 h一次,共4次。BrdU末次注射后28 d处死大鼠,观察新生细胞的分化迁移情况。
1.6 标本制备
于实验设计的时间点,将各实验组大鼠用10%水合氯醛(3.5 ml/kg)麻醉,迅速开胸暴露膈肌,小心挑破膈肌显露心脏,剥离心包膜,经左心室进入主动脉,固定针头,剪破右心耳,迅速灌注。首先灌注生理盐水150 ml冲去血液,然后用4%多聚甲醛(4 ℃,pH=7.4)固定,先快速灌注200 ml,再慢速灌注200 ml。开颅取脑,将脑组织入4%多聚甲醛后固定4 h,再入30%蔗糖,放置在4 ℃,直到组织沉底。冰冻切片机恒温,将脑组织中的海马部分冠状位连续切片,片厚30 μm。每只大鼠隔5张脑片取一张组成一套,每套10张脑片,共6套。预做免疫组织化学染色的入0.01 mol/L PBS中,其他的入冻存液(60%丙三醇:40% 0.01 mol/L PBS),-20 ℃保存备用。
1.7 免疫组织化学染色
BrdU染色:切片依次入下列流程:0.01 mol/L PBS漂洗3次,10 min/次;50%甲酰胺/2×标准柠檬酸盐-氯化钠液(standard saline citrate,SSC)=1 ∶1,65 ℃,2 h;2×SSC漂洗2次,10 min/次;37 ℃水浴2 mol/L盐酸30 min;pH=8.5 0.1 mol/L 硼酸10 min;0.01 mol/L PBS漂洗3次,10 min/次;80%甲醇 ∶30%双氧水=1 ∶1 30 min;0.01 mol/L PBS漂洗3次,10 min/次;0.01 mol/L PBS ∶0.3%Triton-X100=100 ∶1 30 min;0.01 mol/L PBS漂洗3次,10 min/次;切片入小鼠抗BrdU单克隆抗体(1 ∶500,Santa Cruz)室温24 h;0.01 mol/L PBS漂洗3次,10 min/次;切片入生物素化的羊抗小鼠IgG(1 ∶500,Vector Laboratories,Burlingame,CA)室温2 h;0.01 mol/L PBS漂洗3次,10 min/次;切片入生物素-卵白素-HRP复合物(1 ∶500,Sigma)室温2 h;0.01 mol/L PBS漂洗3次,10 min/次;葡萄糖氧化酶-DAB显色。显色后依次裱片,晾干后酒精梯度脱水,二甲苯透明,树胶封片。对照组用0.01 mol/L PBS代替抗体稀释液,其余同上,结果均为阴性。抗体稀释液为含1%胎牛血清白蛋白和0.3% Triton-X100的0.01 mol/L PBS。
DCX染色:漂片依次入下列溶液:0.01 mol/L PBS洗涤3次(10 min/次),80%甲醇 ∶双氧水=100 ∶1 30 min;0.01 mol/L PBS洗涤3次(10 min/次),0.01 mol/L PBS ∶30% Triton=100 ∶1 30 min;0.01 mol/L PBS洗涤3次(10 min/次);漂片入含羊抗DCX(1 ∶500,Santa Cruz Biotechnology)的抗体稀释液中,室温孵育24 h,0.01 mol/L PBS洗涤3次(10 min/次);再入生物素化的兔抗羊IgG(1 ∶500,Vector laboratories,Burlingame,CA)中,室温孵育2 h;0.01 mol/L PBS洗涤3次(10 min/次),生物素-卵白素-HRP复合物(1 ∶500,Sigma-Aldrich),室温孵育2 h;0.01 mol/L PBS洗涤3次(10 min/次);葡萄糖氧化酶-DAB法显色。显色后依次裱片,晾干后酒精梯度脱水,二甲苯透明,树胶封片。对照组用0.01 mol/L PBS代替抗体稀释液,其余同上,结果均为阴性。
1.8 统计学分析
BrdU计数采用双盲法,于BX-51,Olympus显微镜200倍下观察并计数门区内BrdU阳性细胞数,结果以均数±标准差表示,各均数之间的比较采用One-way ANOVA,P<0.05为差异有统计学意义。对所有DCX阳性细胞,计数新生神经元门区基数突数量并测量基数突长度。用SPSS 18.0软件进行统计分析。
2 结果
2.1 行为学表现
大鼠在腹腔注射匹罗卡品后5 min内,出现搔抓、流涎、腹泻等外周反应;10-15 min出现面部阵挛,包括眨眼、动须、节律性咀嚼和点头等Ⅱ级以上的表现,约20 min后出现前肢痉挛,后肢站立并摔倒等Ⅳ级以上的发作表现。
2.2 阿司匹林干预后减少了新生细胞向门区的异常迁移
BrdU末次注射28 d处死大鼠行免疫组化,各实验组新生细胞在齿状回内的分布有明显的差异(见图1)。正常组和阿司匹林干预组中,BrdU阳性细胞呈圆形或椭圆形,主要分布于亚颗粒增生带和颗粒细胞层;模型组中BrdU阳性细胞主要分布于门区(见图1)。统计学结果定量分析表示,模型组门区BrdU阳性细胞数量明显增加,与其他组间的差异有统计学意义(P<0.05),而各干预组之间无统计学差异(P>0.05)。该结果表明癫痫发作后新生细胞出现向门区的异常迁移;阿司匹林干预能够明显地减少这种异常迁移。
2.3 阿司匹林干预后显著减少SE后门区内DCX阳性突起的数量和长度
正常情况下DCX主要分布于亚颗粒增生带,突起伸向分子层。BrdU注射28 d后,新生神经元表现出异常迁移模式,形成异位门区基树突和门区异位神经元(见图2)。模型组的突起有一部分伸向了门区;模型组DCX向门区的异位迁移明显的增加,阿司匹林干预后,新生神经元向门区的迁移较模型组减少,突起的数量和突起的长度都较模型组减少,差异有统计学意义(P<0.05,见图3,4),而各干预组之间无统计学差异(P>0.05)。正常对照组、模型组、0 h Asp干预组、3 h Asp干预组、24 h Asp干预组突起的数量分别为10.0±6.45,184.67±19.86,33.33±10.09,28.67±7.53,28.20±8.44(见图3);突起的长度分别为(173.45±3.46)μm,(2 952.9±636.33)μm,(1 206.3±241.87)μm,(868.20±139.03)μm,(948.87±124.26)μm(见图4)。
3 讨论
癫痫严重地危害着人类的生命,其在神经系统中发病率仅次于脑血管病,对个人而言严重地影响其身心发展,对家庭社会而言无疑是一极大的负担。该病的不可预知性,更是让我们难以防范。到目前为止,抗癫痫药种类繁多,但没有任一种药物能够从根源上解决问题,而仍然有30%癫痫患者发作症状不能得到有效的控制[2],所以全人类亟需找到新的抗癫痫方法,从根源上解决问题,也就是抗癫痫发生。目前比较公认的一种说法是,癫痫发生或者说潜伏期是一段时期,指在受到创伤如脑损伤、中风、持续的热性惊厥、癫痫持续状态或脑炎后,出现第一次自发性发作之前的一段时期。癫痫发生的过程中改变了神经元的兴奋性,确立了主要的内部链接,以及结构的改变。这些改变包括神经变性、神经发生等[3]。癫痫发生过程中一个重要改变为新生神经元的异常迁移,大量研究已经证实,海马齿状回颗粒细胞的异常整合,其中包括门区异位颗粒细胞,是颞叶癫痫的重要病理特征[4],在癫痫持续状态后,新生神经元的正常迁移方向受到干扰,这些新生神经元形成的基树突,异常伸向门区,在门区内无序排列,形成门区的异位神经元,有研究发现[5],这些新生神经元在电生理特性及形态上与齿状回的颗粒细胞非常相似,但与成熟的颗粒细胞不同的是,门区异位神经元可以与海马CA3区锥体细胞同步,产生异常爆发点燃,氯化锂-匹罗卡品诱导的癫痫持续状态模型中,给予抗有丝分裂抑制剂,可以抑制海马神经发生,进而减少门区异位神经元的形成,最终降低癫痫发作的频率。也有研究表明癫痫持续状态后齿状回新生颗粒神经元爆发性增加,这些新生神经元同时表现出异常迁移[6],导致形成异常神经网络,兴奋性环路重组,脑的兴奋性与抑制性失平衡,这使得神经细胞过度兴奋及高度同步化,导致癫痫反复发作。
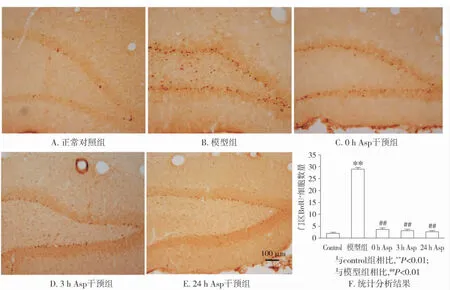
图1 阿司匹林对癫痫大鼠海马齿状回内BrdU标记新生细胞表达的影响Figure 1 Effect of aspirin on BrdU labeling newborn cells in hippocampal dentate gyrus(DG) of epileptic rats
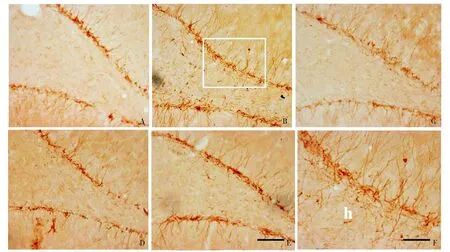
A.正常对照组;B.癫痫模型组; C.0 h Asp干预组;D.3 h Asp干预组;E.24 h Asp干预组(scale bar=100 μm); F.B图方框部位的放大(Scale bar=50 μm)图2 阿司匹林对癫痫大鼠海马齿状回内DCX标记新生神经元迁移表达的影响Figure 2 Effect of aspirin on aberrant migration of DCX-labeled newborn cells in hippocampal dentate gyrus(DG) of epileptic rats
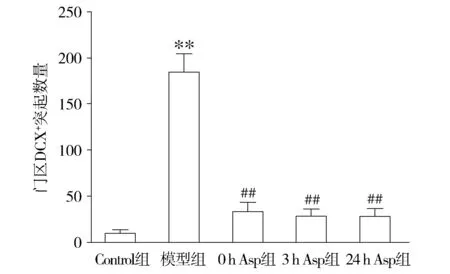
与Control组相比,**P<0.01;与模型组比较,##P<0.01图3 阿司匹林干预对SE后门区内DCX阳性突起的数量的影响Figure 3 Effect of aspirin on DCX-positive dendritic processes reaching into the hilus after SE
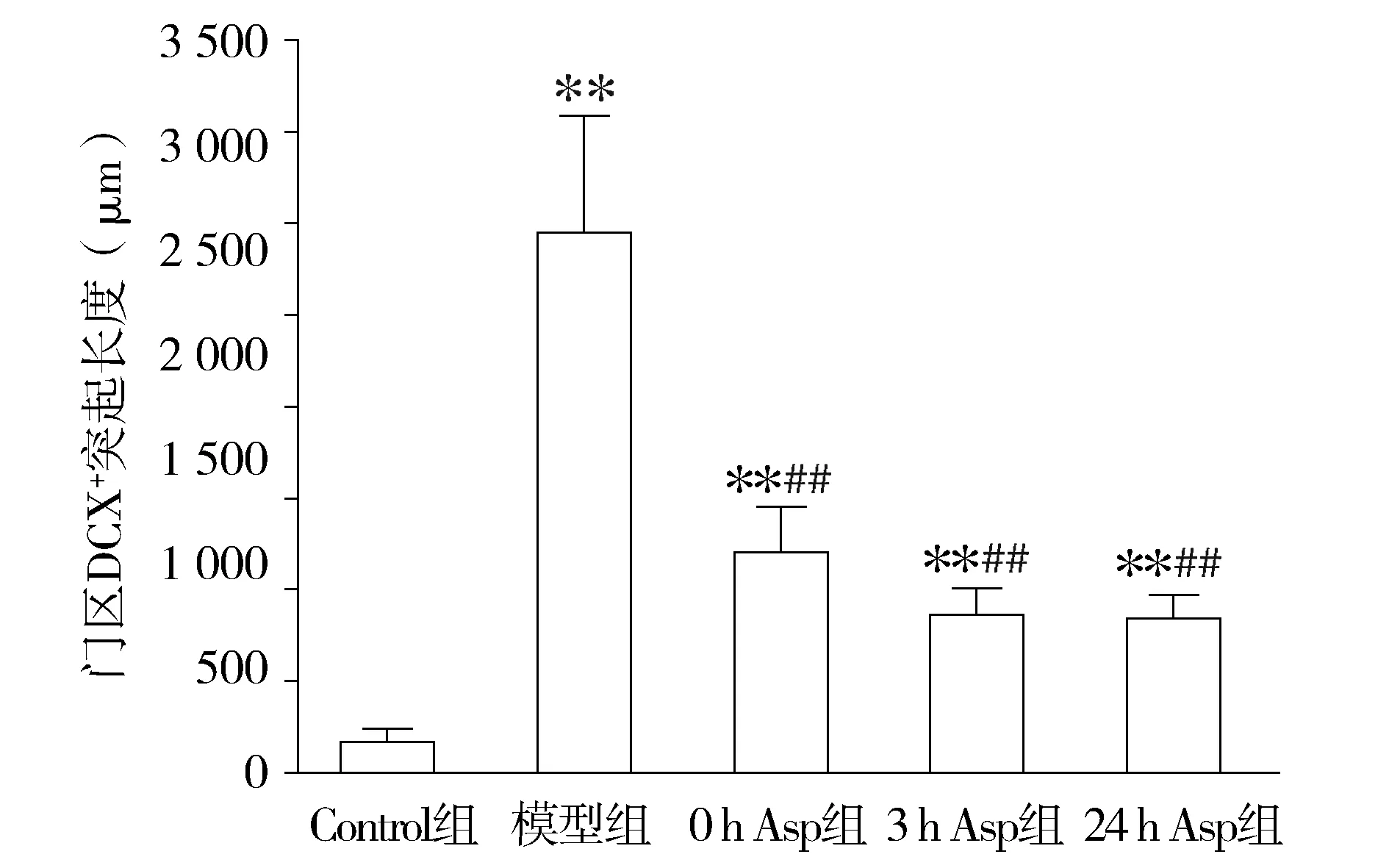
与Control组相比,**P<0.01;与模型组比较,##P<0.01图4 阿司匹林干预对SE后门区内DCX阳性突起长度的影响Figure 4 Effect of aspirin on the length of DCX-positive dendritic processes reaching into the hilus after SE
近期发现癫痫的发生过程中炎性因子起了重要作用[7],在癫痫患者的标本和动物实验中都观察到有炎性分子的大量表达。在炎症存在的情况下癫痫发作的阈值减低。炎症分子在不同程度上影响神经元的兴奋性,机制之一为,IL-1β和TNF通过阻断星型胶质细胞对谷氨酸的再摄取[8],增加了细胞外谷氨酸的浓度,同时也促进了星型胶质细胞释放谷氨酸。此外,细胞因子和前列腺素物质还调节电压门控和受体门的离子通道的功能。如果在癫痫发生的潜伏期进行干预,那么癫痫发生的病理变化将被控制,后期也将可能不会有癫痫自发发作。抗炎药阿司匹林能否改变癫痫发生过程中的病理变化,从根源上控制癫痫还没有详细的被证明。本实验中我们利用氯化锂-匹罗卡品致癫痫大鼠模型,在静默期给予抗炎药阿司匹林干预,观察癫痫形成过程中的结构病理变化。在该部分实验中我们观察到非甾体抗炎药阿司匹林有神经保护作用,这和以往的报道是一致的[9],减少了海马神经元的丢失。减少神经元损伤这一作用对其将来能否应用于临床治疗癫痫起很好的支持作用。难治性癫痫患者大部分为耐药,现有的抗癫痫药物不能控制其临床症状,这些患者脑内大多有一共同的变化,即海马神经元丢失变性。因此在各种伤害性脑损伤诱导脑内级联事件的发生,导致癫痫自发性发作之前给予神经保护性药物或许能够减少后期的自发性发作。与本课题组的既往研究一致[10],在该实验中我们还发现,癫痫组大鼠海马新生神经元出现向门区的异常迁移,这些异位的神经元成为癫痫反复发作的新的靶点。海马区异常的神经发生导致了癫痫发作及认知功能下降[11],本研究的结果表明,抗炎药阿司匹林干预明显地减少了神经元的异常迁移,差异有统计学意义。成年海马部位亚颗粒增生带还可以产生新的细胞,神经前体细胞从亚颗粒细胞层呈放射状迁移至海马颗粒细胞层的基底部,在此神经前体细胞分化为颗粒细胞,进而建立突触联系[12]。癫痫发作后,这些异位入门区的神经元与CA3区的锥体神经元整合成新的网络,可能导致后期癫痫的自发性发作。这些异位的神经元还可和苔藓纤维建立连接[13],进而导致自发爆发动作电位。癫痫发生后,海马新生神经元出现异位迁移的确切机制尚未阐明,近来研究表明细胞外基质蛋白Reelin使神经元朝着正常的方向迁移[14],在匹罗卡品致癫痫大鼠模型中,研究发现Reelin表达下降,因此上调Reelin或许可以减少齿状回神经发生和新生神经元的异常迁移。目前我们课题组发现,癫痫发作后门区激活的小胶质细胞可能指导了新生神经元的异常迁移,给予小胶质细胞的抑制剂米诺环素可以阻断新生神经元向门区的异常迁移[15]。但哪种机制是最重要的,需要下一步实验的进一步证实。
综上本实验表明抗炎药阿司匹林能够减少新生神经元的异常迁移。阿司匹林上述作用可能使得其能够减少癫痫反复自发发作,给临床治疗提供了一定的参考价值。抗炎药是通过什么途径影响了癫痫发生过程中的病理变化也是一个很有意义的课题,在今后的实验中我们将会从分子水平进一步阐述,以期为临床预防与治疗难治性癫痫提供依据。
参考文献:
[1]Racine RJ. Modification of seizure activity by electrical stimulation. II. Motor seizure[J]. Electroencephalogr Clin Neurophysiol, 1972,32(3): 281-294.
[2]Brodie MJ. Pharmacological treatment of drug-resistant epilepsy in adults: a practical guide[J]. Curr Neurol Neurosci Rep,2016,16(9):82-91.
[3]Pitkänen A, Lukasiuk K. Molecular and cellular basis of epileptogenesis in symptomatic epilepsy[J]. Epilepsy Behav, 2009,14 (Suppl 1): 16-25.
[4]Jessberger S,Parent JM.Epilepsy and adult neurogenesis[J].Cold Spring Harb Perspect Biol,2015,7(12):1-10.
[5]Scharfman HE, Goodman JH, Sollas AL.Granule-like neurons at the hilar/CA3 border after status epilepticus and their synchrony with area CA3 pyramidal cells: functional implications of seizure-induced neurogenesis[J].J Neurosci, 2000, 20(15):6144-6158.
[6]Parent JM, Murphy GG.Mechanisms and functional significance of aberrant seizure-induced hippocampal neurogenesis[J].Epilepsia,2008,49(Suppl 5):19-25.
[7]Vezzani A, Friedman A, Dingledine RJ, The role of inflammation in epileptogenesis[J]. Neuropharmacology,2013,69:16-24.
[8]Hu S, Sheng WS, Ehrlich LC,etal. Cytokine effects on glutamate uptake by human astrocytes[J]. Neuroimmunomodulation, 2000, 7(3): 153-159.
[9]Dhir A, Naidu PS, Kulkarni SK. Effect of cyclooxygenase inhibitors on pentylenetetrazol (PTZ)-induced convulsions: Possible mechanism of action[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2006,30(8): 1478-1485.
[10]Yang F, Wang JC, Han JL,etal. Different effects of mild and severe seizures on hippocampal neurogenesis in adult rats[J]. Hippocampus, 2008, 18(5):460-468.
[11]Cho KO, Lybrand ZR, Ito N,etal. Aberrant hippocampal neurogenesis contributes to epilepsy and associated cognitive decline[J]. Nat Commun,2015,6:6606-6619.
[12]Toni N, Teng EM, Bushong EA,etal. Synapse formation on neurons born in the adult hippocampus[J]. Nat Neurosci, 2007,10(6): 727-734.
[13]Arisi GM, Garcia-Cairasco N. Doublecortin-positive newly born granule cells of hippocampus have abnormal apical dendritic morphology in the pilocarpine model of temporal lobe epilepsy[J]. Brain Res, 2007,1165: 126-134.
[14]Gong C, Wang TW, Huang HS,etal. Reelin regulates neuronal progenitor migration in intact and epileptic hippocampus[J]. J Neurosci, 2007,27(8): 1803-1811.
[15]Yang F, Liu ZR, Chen J,etal. Roles of astrocytes and microglia in seizure-induced aberrant neurogenesis in the hippocampus of adult rats[J]. J Neurosci Res, 2010, 88(3): 519-529.
