双歧杆菌三联活菌联合美沙拉嗪治疗中国炎症性肠病患者疗效及安全性的Meta分析
2018-04-10杨天文
廖 煜,杨天文
(重庆医科大学附属永川医院消化内科,永川 402160;*通讯作者,E-mail:ytw2079999@qq.com)
炎症性肠病(inflammatory bowel disease,IBD),是一组慢性复发性非特异性肠道炎症疾病,包括溃疡性结肠炎(ulcerative colitis,UC)及克罗恩病(Crohn’s disease,CD)。其发病受多种因素影响,如感染、免疫、遗传及肠道菌群失调等[1]。炎症性肠病多见于欧美国家,但近年来我国人群发病数量也日趋上升,在临床上主要表现为反复腹痛、腹泻、黏液脓血便、里急后重感以及全身症状,也可有肠外表现。内镜下表现结直肠黏膜血管纹理模糊或消失、充血水肿、出血及溃疡等。其诊断依靠临床、内镜和病理,诊疗困难大,易反复发作,目前尚无有效方法预防及治愈该疾病[2]。
氨基水杨酸制剂常用药物美沙拉嗪是全球公认治疗IBD的一线药物,对轻、中度患者疾病活动期及缓解期均有较好疗效,但长期使用易导致许多不良反应及药物抵抗。益生菌作为辅助疗法尚未作为常规药物使用,曾有关于高加索人群的研究[3-5]显示:益生菌组与对照组对比并未显示其在炎症性肠病诱导缓解期的优越性,亦不能改变患者肠道菌群,但对指导治疗我国炎症性肠病的意义不大。双歧杆菌三联活菌作为常用益生菌对中国IBD患者临床疗效尚无明确循证医学证据。
本研究主要通过Meta分析方法对研究结果综合分析,来讨论在中国人群中双歧杆菌三联活菌联合美沙拉嗪对于IBD的疗效性及安全性,为双歧杆菌三联活菌联合美沙拉嗪在IBD的实际治疗过程中提供理论上的有力证据。
1 资料与方法
1.1 纳入和排除标准
1.1.1研究类型纳入公开发表的双歧杆菌三联活菌联合美沙拉嗪治疗炎症性肠病的随机对照试验(randomized controlled trial,RCT),无论是否采用盲法。语种限制为中、英文。
1.1.2研究对象①根据《2007对我国炎症性肠病诊断治疗规范的共识意见》[6]或者《2012我国炎症性肠病诊断与治疗的共识意见》[7]的标准,确诊为炎症性肠病;②年龄≥12岁的青少年和成年人,国籍为中国,性别和民族不限。
1.1.3排除标准①疾病活动程度为重度;②不能获得摘要或全文,无法准确提取数据的研究;③结局指标不一致的研究。
1.1.4干预措施试验组:双歧杆菌三联活菌联合美沙拉嗪;对照组:美沙拉嗪或其他。所有纳入研究的受试者治疗疗程≥4周。
1.1.5结局指标①总有效;②无效;③临床症状评分;④内镜评分(Baron、Rachmilewitz);⑤DAI评分;⑥肿瘤坏死因子-α(TNF-α);⑦红细胞沉降率(ESR);⑧C反应蛋白(CRP);⑨IL-8;⑩IL-10;超氧化物酶(SOD);丙二醛(MDA);不良反应事件。
1.2 文献检索策略
通过计算机检索相关中英文数据库:PubMed、VIP、The Cochrane Library(2017年5期)、WanFang Data,文献来源日期为数据库建库时间到2017年5月。中文检索词为:双歧杆菌三联活菌、美沙拉嗪、炎症性肠病、溃疡性结肠炎、克罗恩病,英文检索词为:Bifidobacterium Triple Live Bacteria;Live Combined Bifidobacterium,Lactobacillus and Enterococcus;Mesalamine;Mesalazine;Inflammatory Bowel Disease;Ulcerative Colitis;Crohn’s Disease。
此外,对其余的相关期刊、会议论文、杂志等进行人工检索,并且联系文献相关作者以获得通过上述检索方法没得到的信息。检索策略以PubMed为例:
#1 Inflammatory Bowel Disease OR Ulcerative Colitis OR Crohn’s Disease
#2 Bifidobacterium triple viable bacteria OR live combined bifidobacterium,lactobacillus and enterococcus
#3 Mesalamine OR Mesalazine
#4 #1 AND #2 AND #3
1.3 文献筛选和资料提取
两位评价者严格依据排除与纳入标准,分别单独筛选获得相关文献并提取相关资料,对于意见不相符的则通过讨论来解决,必要时可通过第三方(项目负责人)进行相关评判。首先通过对文献的摘要和题目内容的初步筛选,发现不符合条件的文献后进行排除,进而对获得的文献通过全文阅读进行复筛,最后决定是否纳入。
提取的资料内容有以下:①纳入文献的基本内容:文献作者、论文标题、期刊发表信息(年、卷、期、页码)等;②研究过程中的使用的干预方法和手段、研究对象的基线特性以及受观察时间;③和质量评价相关的重要因素;④研究所关注的测量数据结果和目的指标。
1.4 纳入研究的偏移风险评价
对于该研究存在的偏倚风险,由2位研究人员分别进行单独评判,并对结果进行交叉校对。利用Cochrane手册5.1.0推荐的工具(RCT偏倚风险评估工具)对提取的资料进行方法学质量的评估。
1.5 统计分析
统计学分析软件利用RevMan5.3,由The Cochrane Library提供。计量资料采用均数差(mean difference,MD)为效应分析统计量,二分类变量采用比值比(odds ratio,OR)为效应分析统计量,各效应量均提供出其95%CI。结合χ2检验(检验水准为α=0.1)及I2值(I2<50%)分析各研究结果之间的异质性,通过固定效应模型合并分析不存在统计学异质性的研究(α≥0.1且I2<50%),通过随机效应模型合并分析存在统计学异质性的研究(α<0.1且I2≥50%)。如果临床异质性显著,可以利用敏感性分析、亚组分析、描述性分析等处理方法。Meta分析的检验水准设为α=0.05。
2 结果
2.1 文献检索结果及偏倚风险评价
对文献检索后初筛获得246篇相关文献,对文献的摘要、题目和全文进行阅读,最终有14个RCT[8-21]被纳入,包括有对照组498例,试验组522例。文献筛选流程及结果见图1。
2.2 纳入研究的基本特征与偏倚风险评价
纳入研究的基本特征见表1,偏倚风险评价结果见表2。
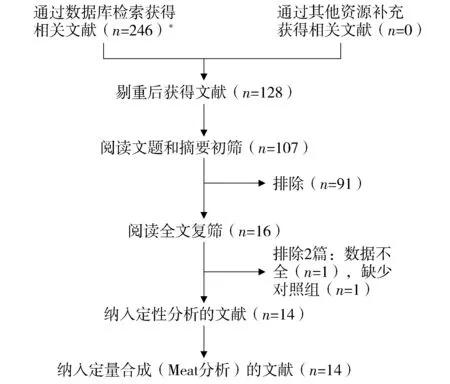
*Cochrane Library(n=2)、PubMed(n=4)、CNKI(n=130)、VIP(n=24)、WanFang Data(n=86)图1 文献筛选流程及结果Figure 1 Process and results of literature screening
表1纳入研究文献的基本特征
Table1Basicfeaturesofincludedstudies
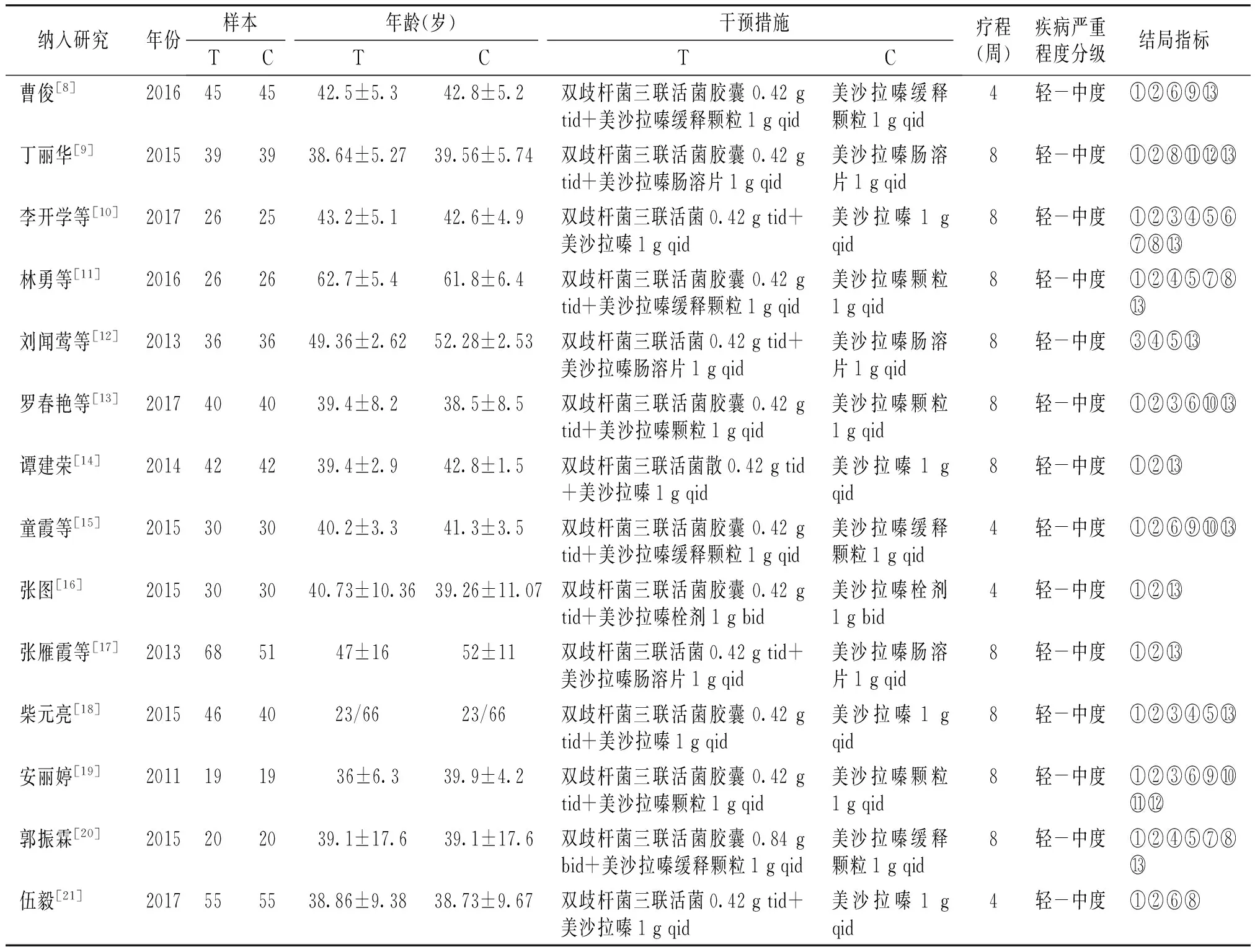
纳入研究年份样本年龄(岁)干预措施TCTCTC疗程(周)疾病严重程度分级结局指标 曹俊[8]2016454542.5±5.342.8±5.2双歧杆菌三联活菌胶囊0.42gtid+美沙拉嗪缓释颗粒1gqid美沙拉嗪缓释颗粒1gqid4轻-中度①②⑥⑨丁丽华[9]2015393938.64±5.2739.56±5.74双歧杆菌三联活菌胶囊0.42gtid+美沙拉嗪肠溶片1gqid美沙拉嗪肠溶片1gqid8轻-中度①②⑧李开学等[10]2017262543.2±5.142.6±4.9双歧杆菌三联活菌0.42gtid+美沙拉嗪1gqid美沙拉嗪1gqid8轻-中度①②③④⑤⑥⑦⑧林勇等[11]2016262662.7±5.461.8±6.4双歧杆菌三联活菌胶囊0.42gtid+美沙拉嗪缓释颗粒1gqid美沙拉嗪颗粒1gqid8轻-中度①②④⑤⑦⑧刘闻莺等[12]2013363649.36±2.6252.28±2.53双歧杆菌三联活菌0.42gtid+美沙拉嗪肠溶片1gqid美沙拉嗪肠溶片1gqid8轻-中度③④⑤罗春艳等[13]2017404039.4±8.238.5±8.5双歧杆菌三联活菌胶囊0.42gtid+美沙拉嗪颗粒1gqid美沙拉嗪颗粒1gqid8轻-中度①②③⑥⑩谭建荣[14]2014424239.4±2.942.8±1.5双歧杆菌三联活菌散0.42gtid+美沙拉嗪1gqid美沙拉嗪1gqid8轻-中度①②童霞等[15]2015303040.2±3.341.3±3.5双歧杆菌三联活菌胶囊0.42gtid+美沙拉嗪缓释颗粒1gqid美沙拉嗪缓释颗粒1gqid4轻-中度①②⑥⑨⑩张图[16]20153030 40.73±10.36 39.26±11.07双歧杆菌三联活菌胶囊0.42gtid+美沙拉嗪栓剂1gbid美沙拉嗪栓剂1gbid4轻-中度①②张雁霞等[17]20136851 47±16 52±11双歧杆菌三联活菌0.42gtid+美沙拉嗪肠溶片1gqid美沙拉嗪肠溶片1gqid8轻-中度①②柴元亮[18]2015464023/6623/66双歧杆菌三联活菌胶囊0.42gtid+美沙拉嗪1gqid美沙拉嗪1gqid8轻-中度①②③④⑤安丽婷[19]20111919 36±6.339.9±4.2双歧杆菌三联活菌胶囊0.42gtid+美沙拉嗪颗粒1gqid美沙拉嗪颗粒1gqid8轻-中度①②③⑥⑨⑩郭振霖[20]20152020 39.1±17.6 39.1±17.6双歧杆菌三联活菌胶囊0.84gbid+美沙拉嗪缓释颗粒1gqid美沙拉嗪缓释颗粒1gqid8轻-中度①②④⑤⑦⑧伍毅[21]2017555538.86±9.3838.73±9.67双歧杆菌三联活菌0.42gtid+美沙拉嗪1gqid美沙拉嗪1gqid4轻-中度①②⑥⑧
T:试验组;C:对照组;tid:每天3次;bid:每天2次;qid:每天4次;结局指标:①总有效;②无效;③临床症状评分;④内镜评分(Baron、Rachmilewitz);⑤DAI评分;⑥TNF-α;⑦ESR;⑧CRP;⑨IL-8;⑩IL-10;SOD;MDA;不良反应事件
表2纳入研究的偏倚风险评估结果
Table2Biasriskassessmentofincludedstudies
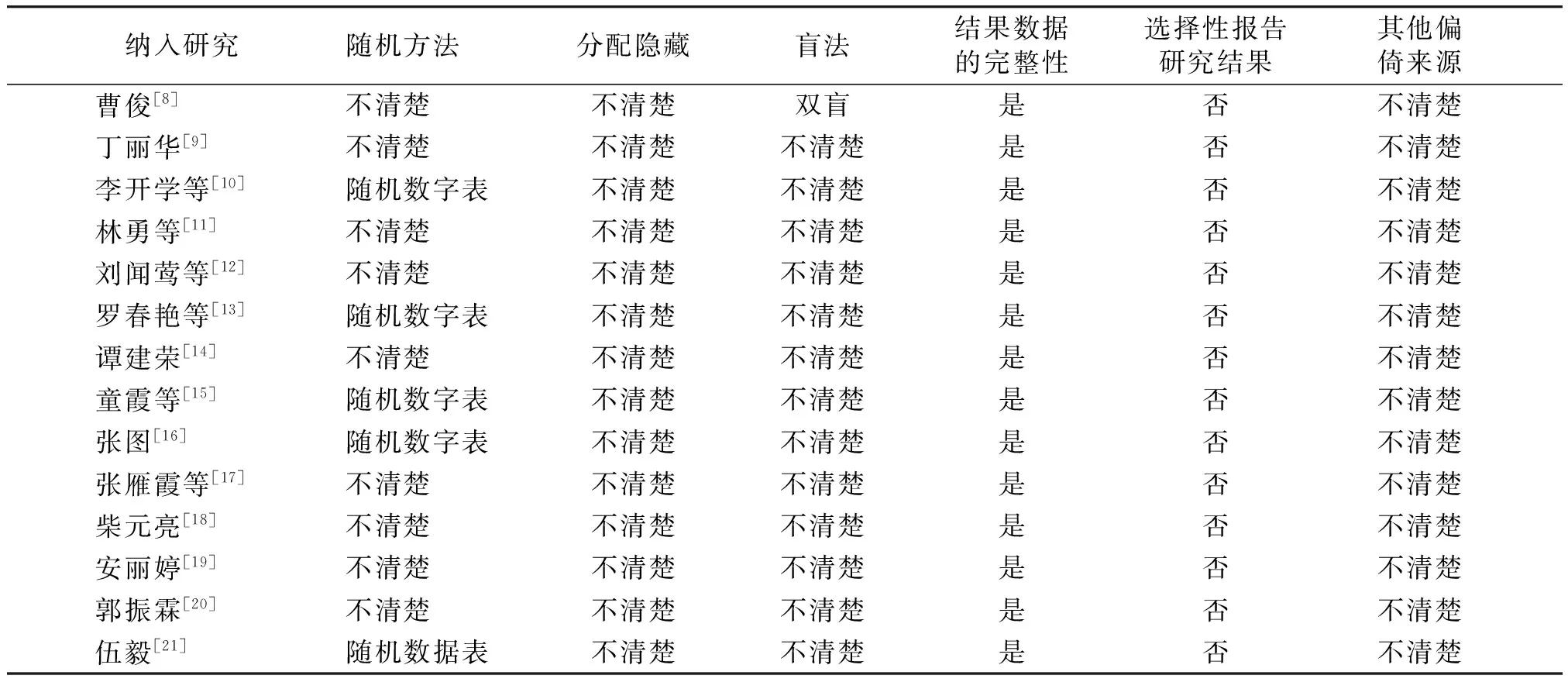
纳入研究随机方法分配隐藏盲法结果数据的完整性选择性报告研究结果其他偏倚来源 曹俊[8]不清楚不清楚双盲是否不清楚 丁丽华[9]不清楚不清楚不清楚是否不清楚 李开学等[10]随机数字表不清楚不清楚是否不清楚 林勇等[11]不清楚不清楚不清楚是否不清楚 刘闻莺等[12]不清楚不清楚不清楚是否不清楚 罗春艳等[13]随机数字表不清楚不清楚是否不清楚 谭建荣[14]不清楚不清楚不清楚是否不清楚 童霞等[15]随机数字表不清楚不清楚是否不清楚 张图[16]随机数字表不清楚不清楚是否不清楚 张雁霞等[17]不清楚不清楚不清楚是否不清楚 柴元亮[18]不清楚不清楚不清楚是否不清楚 安丽婷[19]不清楚不清楚不清楚是否不清楚 郭振霖[20]不清楚不清楚不清楚是否不清楚 伍毅[21]随机数据表不清楚不清楚是否不清楚
2.3 Meta分析结果
2.3.1总有效共纳入11个RCTs[8-10,13-19,21],各研究间不存在统计学异质性(I2=0%,P=1.00),因而通过固定效应模型进行Meta分析。结果显示,试验组的总有效率明显大于对照组,其差异有统计学意义[OR=3.66,95%CI(2.42,5.54),P<0.000 01,见图2]。
2.3.2临床症状评分共纳入5个RCTs[10,12,13,18,19],各研究间不存在统计学异质性(I2=0%,P=0.52),因而通过固定效应模型进行Meta分析。结果显示,试验组的临床症状评分较对照组明显下降,试验组的症状缓解优于对照组,其差异有统计学意义[MD=-1.33,95%CI(-1.66,0.99),P<0.000 01,见图3]。
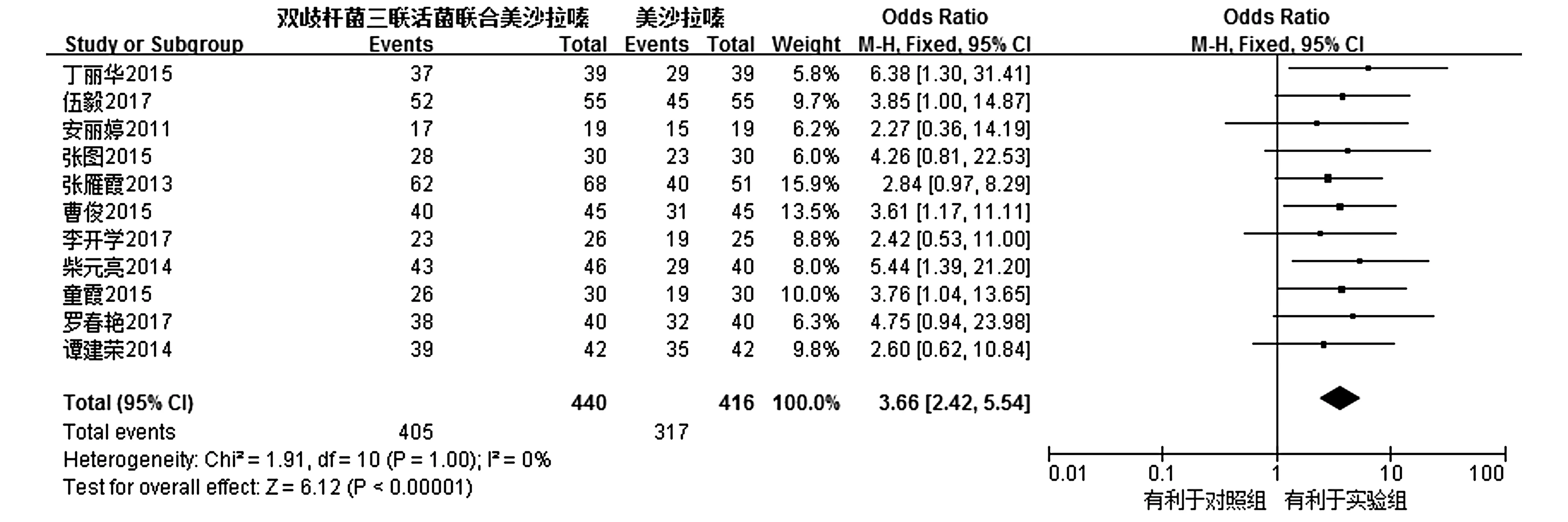
图2 试验组与对照组总有效比较的Meta分析Figure 2 Forest plot of Meta-analysis results of the total effective rate between experimental group and control group
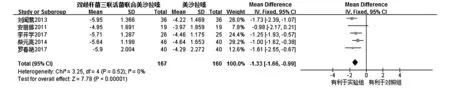
图3 试验组与对照组临床症状评分比较的Meta分析Figure 3 Forest plot of Meta-analysis results of scores of clinical symptoms between experimental group and control group
2.3.3内镜评分该项结局指标共纳入5个RCTs[10-12,18,20],各研究间存在统计学异质性(I2=75%,P=0.003),因此通过随机效应模型进行Meta分析。结果显示,试验组的内镜评分较对照组下降更明显,试验组内镜下黏膜情况优于对照组,两组差异具有统计学意义[MD=-0.70,95%CI(-0.49,-0.91),P<0.000 01]。根据内镜评分的方法不同进行亚组分析,结果显示:Rachmilewitz内镜评分法组共纳入3项RCTs[11,18,20],3项研究之间无统计学异质性(I2=0%,P=0.87),且差异具有统计学意义[MD=-1.46,95%CI(-1.02,-1.90),P<0.000 01]。Baron内镜评分法组共纳入2项RCTs[10,12],2项研究之间无统计学异质性(I2=0%,P=0.40),且差异同样具有统计学意义[MD=-0.48,95%CI(-0.24,-0.72),P<0.000 01]。
2.3.4DAI评分共纳入5个RCTs[10-12,18,20],各研究间存在统计学异质性(I2=64%,P=0.03),因而通过随机效应模型进行Meta分析。结果显示,试验组较对照组的DAI评分明显下降,试验组疾病活动指数小于对照组,两组差异具有统计学意义[MD=-0.61,95%CI(-0.39,-0.82),P<0.000 01]。剔除柴元亮[18]的研究进行敏感性分析,结果显示两组差异仍具有统计学意义[MD=-0.98,95%CI(-0.60,-1.37),P<0.000 01]。
2.3.5TNF-α共纳入4个RCTs[8,10,15,19],各研究间不存在统计学异质性(I2=49%,P=0.12),因而通过固定效应模型进行Meta分析。结果显示,试验组的TNF-α较对照组明显下降,试验组较对照组更能有效降低患者体内TNF-α,其差异有统计学意义[MD=-3.5,95%CI(-4.61,-2.38),P<0.000 01,见图4]。
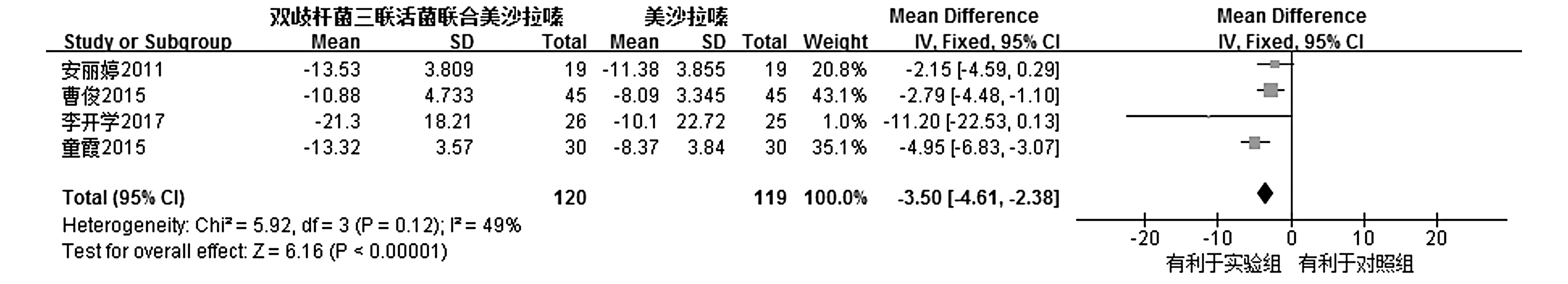
图4 试验组与对照组TNF-α比较的Meta分析Figure 4 Forest plot of Meta-analysis results of TNF-α between experimental group and control group
2.3.6ESR共纳入3个RCTs[10,11,20],各研究间不存在统计学异质性(I2=0%,P=0.48),因此通过固定效应模型进行Meta分析。结果显示,试验组的ESR较对照组明显下降,试验组较对照组更能有效降低患者ESR,其差异有统计学意义[MD=-6.2,95%CI(-8.92,-3.48),P<0.000 01]。
2.3.7CRP该项结局指标共纳入5个RCTs[9-11,20,21],各研究间存在统计学异质性(I2=76%,P=0.002),故通过随机效应模型进行Meta分析。结果显示,试验组的CRP较对照组下降更明显,试验组较对照组更能有效降低患者血中CRP,两组差异具有统计学意义[MD=-3.16,95%CI(-2.71,-3.61),P<0.000 01],根据CRP的血液样本不同进行亚组分析,结果显示:CRP(全血)组共纳入3项RCTs[11,20,21],3项研究之间无统计学异质性(I2=0%,P=0.44),且差异具有统计学意义[MD=-5.39,95%CI(-3.93,-6.85),P<0.000 01]。CRP(血清)组共纳入2项RCTs[9,10],2项研究之间具有统计学异质性(I2=79%,P=0.03),差异同样具有统计学意义[MD=-2.92,95%CI(-2.45,-3.40),P<0.000 01]。
2.3.8IL-8共纳入3个RCTs[8,15,19],各研究间不存在统计学异质性(I2=0%,P=0.60),因而通过固定效应模型进行Meta分析。结果显示,试验组的IL-8较对照组明显下降,试验组较对照组更能降低患者体内IL-8水平,差异有统计学意义[MD=-6.15,95%CI(-7.49,-4.80),P<0.000 01,见图5]。
2.3.9IL-10共纳入3个RCTs[13,14,19],各研究之间有统计学异质性(I2=96%,P<0.000 01),故采用随机效应模型进行Meta分析。结果显示,试验组的IL-10较对照组明显升高,试验组较对照组更能有效提高患者体内IL-10水平,两组差异具有统计学意义[MD=12.62,95%CI(9.61,15.63),P<0.000 01]。剔除罗春艳等[13]的研究,对结果进行敏感性分析,对比两组结果差异仍存在统计学意义[MD=10.00,95%CI(6.91,13.09),P<0.000 01]。
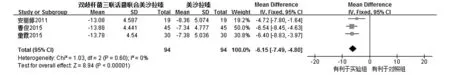
图5 试验组与对照组IL-8比较的Meta分析Figure 5 Forest plot of Meta-analysis results of IL-8 between experimental group and control group
2.3.10SOD共纳入2个RCTs[9,19],各研究之间有统计学异质性(I2=53%,P=0.14),故采用随机效应模型进行Meta分析。结果显示,试验组的SOD较对照组明显升高,试验组较对照组更能提高患者体内SOD水平,其差异存在统计学意义[MD=-0.17,95%CI(0.14,0.19),P<0.000 01]。
2.3.11MDA共纳入2个RCTs[9,19],各研究之间无统计学异质性(I2=0%,P=0.47),故采用固定效应模型进行Meta分析。结果显示,试验组的MDA较对照组明显降低,试验组较对照组更能降低患者体内MDA水平,其差异有统计学意义[MD=-1.25,95%CI(-1.54,-0.95),P<0.000 01]。
2.3.12不良反应事件共纳入12个RCTs[8-18,20],各研究之间无统计学异质性(I2=47%,P=0.06),故采用固定效应模型进行Meta分析。结果显示,试验组的不良反应事件明显少于对照组,试验组较对照组能减少药物不良反应,其差异有统计学意义[OR=0.30,95%CI(0.10,0.47),P<0.000 01,见图6]。
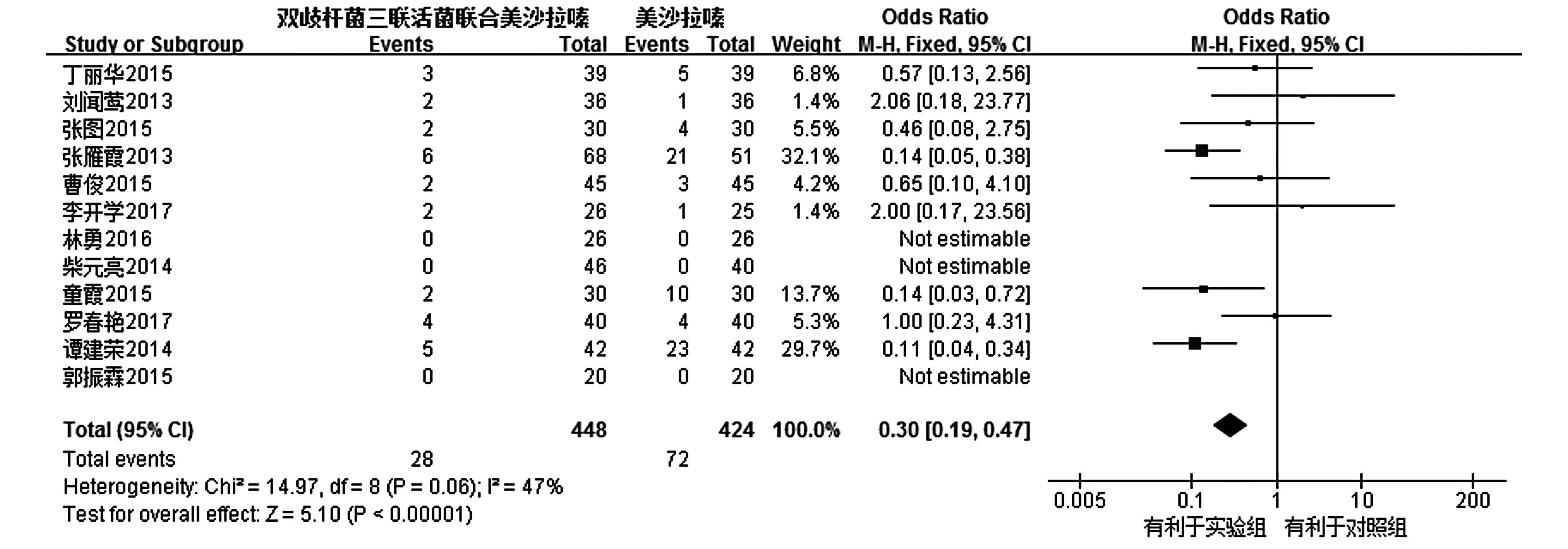
图6 试验组与对照组不良反应事件比较的Meta分析Figure 6 Forest plot of Meta-analysis results of adverse events between experimental group and control group
3 讨论
IBD是一种累及胃肠道的慢性炎症性疾病,在欧洲、北美等高加索人群聚居地区发病率较高,近年来,在亚太地区的发病率也日趋增加[22]。其发病机制尚不明确,可能与环境改变、免疫失衡、遗传易感性及肠道菌群失调有关。目前常用CRP、ESR、IL-8、TNF-α、IL-10、MDA、SOD作为监测IBD活动性的血清学指标[23-26]。2.5%-10.8%IBD患者可能并发结直肠癌,成为IBD患者死亡的主要原因之一[27,28],亦有研究者使用CRP、ESR作为监测IBD癌变指标[29,30]。体内免疫失衡是IBD在亚洲人中最主要的发病原因[31-34],从国内人群中IBD的易感基因和血清标志物与欧美人群的差异性,可以推测在IBD的发病机制上国内人群与西方人群存在差异[35]。故在制定我国IBD患者的诊疗方案上,不能照搬国外指南,应“因人而异”。
我国炎症性肠病目前的治疗目的以缓解临床症状、提高生活质量为主[36]。肠道菌群失衡的现象出现在大多数的IBD病人中,如有害菌的增加、有益菌的减少、细菌类型的多样性遭到破坏等[37],临床上常采用增加益生菌的数量来改善肠道的菌群,从而对已发生病变的肠道的功能和结构进行改善。但是,目前对于不同的菌种的益生菌的治疗效果仍持有不同见解,Lichtenstein等[38]研究报道,单一益生菌制剂对CD临床诱导缓解及维持治疗作用不明显,但复合菌株制剂对CD的缓解与维持作用有益,提示可能复合益生菌制剂较单一益生菌制剂效果更明显,作用更广泛。嗜酸乳杆菌、长型双歧杆菌和粪肠球菌属于双歧杆菌三联活菌中的三种益生菌,它们可以清理并且抑制对肠道产生损伤的有害致病菌,并且同时补充正常肠道中所必需的有益细菌。而且双歧杆菌三联活菌可以在肠道的表面生成保护屏障,保持肠道内部的菌群的平衡,消除肠源性的毒素,使肠道自身的免疫系统被激活,从而有效抵抗有害物质的入侵。其作用迅速而持久,所含的三种有益菌可迅速到达肠道,并能在其中定植。24 h后即可从服用者粪便中检测出目的菌,72-96 h达到高峰[39,40]。临床治疗效果显著的美沙拉嗪属于IBD治疗过程中的一线药物,已经经过多年验证,它主要作用在炎症黏膜表面,抑制炎症介质白三烯的释放以及前列腺素的合成,从而起到对肠壁的抗炎效果。美沙拉嗪在体内也可以起到抗氧化的功能,它主要通过清除体内的氧自由基,以减少由其引发的脂质过氧化反应。同时美沙拉嗪可以缓解IBD病人的高凝状态,改善血液瘀滞,给肠道提供营养从而促进肠道溃疡的修复[41]。美沙拉嗪的效果主要依赖于与患病肠黏膜的接触,有栓剂和口服两种制剂。栓剂直接作用于病变肠黏膜,适用于直肠型UC;口服制剂进入人体后药物迅速通过十二指肠进入各个肠道,并在不同pH环境下均可释放起效。美沙拉嗪和双歧杆菌三联活菌的联合使用可以相互促进、相互协同,对于患者机体的免疫力调节,肠道黏膜的修复都起到重要作用,同时可对肠道内的炎症进行抑制,加速IBD的诱导缓解和优化IBD缓解期的维持疗效。本Meta分析显示使用双歧杆菌三联活菌联合美沙拉嗪治疗轻中度IBD与单用美沙拉嗪相比,总有效明显升高,无效明显降低,且临床症状评分、DAI评分及内镜下评分均较用药前相应评分基数明显下降,提示双歧杆菌三联活菌联合美沙拉嗪更能控制临床症状,修复肠道黏膜,提高生活质量。另外使用双歧杆菌三联活菌联合美沙拉嗪的IBD患者血清炎症介质TNF-α、ESR、CRP、IL-8较单药组明显下降,具有免疫调节功能的IL-10较单药组升高更明显,提示联合用药组较单药组更有利于IBD的炎症控制,降低IBD恶变倾向,加速疾病诱导缓解。并且联合用药组血清中SOD较单药组升高、MDA较单药组减少,提示双歧杆菌三联活菌联合美沙拉嗪可起到抗氧化作用,降低炎性细胞因子的合成与分泌而保护肠黏膜。此外双歧杆菌三联活菌联合美沙拉嗪较单用美沙拉嗪的不良反应事件亦明显减少,安全性良好。
由此可见,双歧杆菌三联活菌与美沙拉嗪的联合使用相比单独使用美沙拉嗪在肠道黏膜的修复、免疫力的调节、炎症的控制上都有更好的效果,并且也可以有效改善患者的生活水平,减少不良反应发生。因此,双歧杆菌三联活菌联合美沙拉嗪的使用是临床上安全有效的治疗炎性肠病的方法,值得推广。
局限性:①本研究纳入文献均为中文,并未纳入其他语言的文献,可能存在潜在语言性偏倚;②虽然5个RCT描述了具体的随机方法,但并未提及隐蔽分组情况,可能存在选择性偏倚;③仅有1个RCT提到双盲,但未具体描述如何实施,因此纳入研究存在实施及测量偏倚的低度可能性;④所有纳入研究均为已发表文献,未能纳入灰色文献,可能存在潜在发表偏倚的低度可能。这些局限性均可能对Meta分析结果产生影响,从而降低本Meta分析结论的可靠性。
参考文献:
[1]Mosli MH,Feagan BG,Sandborn WJ,etal. Histologic evaluation of ulcerative colitis:a systematic review of disease activityindices[J]. Inflamm Bowel Dis,2014,20(3):564-575.
[3]Petersen AM, Mirsepasi H, Halkjr SI,etal. Ciprofloxacin and probiotic Escherichia coli Nissle add-on treatment inactive ulcerative colitis: A double-blind randomized placebo controlled clinical trial[J].J Crohns Colitis,2014, 8 (11): 1498-1505.
[4]贺佳玉,何咏梅.美沙拉嗪联合双歧杆菌三联活菌治疗溃疡性结肠炎及对血清炎症因子的影响[J].四川医学,2015,(6):854-857.
[5]Ahmed J,Reddy BS,Leser TD,etal.Impact of probiotics on colonic microflora in patients with colitis: a prospective double blind randomisedcrossover study[J].Int J Surg,2013,11(10):1131-1136.
[6]Cooperative Group of Inflammatory Bowel Diseases of Digestive Disease of Chinese Medical Association.Chinese consensus on standard management of inflammatory bowel diseases[J].Chin J Dig,2007, 27(8): 545-550.
[7]Group of Inflammatory Bowel Diseases of Digestive Disease of Chinese Medical Association.Consensus on the diagnosis and treatmentof inflammatory bowel disease[J].Chin J Dig, 2012, 32(12): 796-813.
[8]曹俊.美沙拉嗪与双歧三联活菌联合治疗溃疡性结肠炎的疗效分析[J].当代临床医刊,2016,7(2):1981-1982.
[9]丁丽华.美沙拉嗪联合双歧杆菌三联活菌治疗溃疡性结肠炎的临床效果观察[J].社区医学杂志,2015,14(11):42-44.
[10]李开学,曾理,舒晴.益生菌联合美沙拉嗪治疗轻、中度活动期溃疡性结肠炎的效果及安全性[J].中国医学创新,2017,14(8):56-59.
[11]林勇,叶丹,施正超.微生态制剂联合美沙拉嗪治疗轻中度溃疡性结肠炎临床疗效[J].中国微生态学杂志,2016,10(2):185-187.
[12]刘闻莺,邱洪,李英梅,等.益生菌联合美沙拉嗪治疗轻中度溃疡性结肠炎的临床疗效[J].中国临床医学,2013,20(2):150-151.
[13]罗春艳,黄忠.美沙拉嗪联合培菲康对溃疡性结肠炎患者免疫功能及炎性因子的影响[J].国际消化病杂志,2017,29(1):41-44.
[14]谭建荣.美沙拉嗪联合益生菌治疗炎症性肠病临床疗效观察[J].河北医学,2014,20(4):617-620.
[15]童霞,骆成俊,许晓梅,等.美沙拉嗪联合双歧三联活菌对溃疡性结肠炎患者TNF-α、IL-8及IL-10水平的影响[J].现代生物医学进展,2015,23(23):4534-4536.
[16]张图.双歧杆菌三联活菌胶囊联合美沙拉嗪栓剂治疗UC的临床观察[J].当代医学,2015,18(22):135-136.
[17]张雁霞,张秀珍.双歧杆菌三联活菌联合美沙拉嗪治疗轻中度溃疡性结肠炎的疗效观察[J].山西医药杂志(下半月刊),2013,42(4):438-440.
[18]柴元亮.双歧三联活菌联合美沙拉嗪治疗溃疡性结肠炎疗效分析[J].中国现代药物应用,2014,8(1):120-121.
[19]安丽婷.美沙拉嗪颗粒联合培菲康对溃疡性结肠炎患者细胞因子和氧自由基指标的影响[D].太原:山西医科大学,2011:35.
[20]郭振霖.微生态制剂联合美沙拉嗪治疗轻中度溃疡性结肠炎疗效观察[J].江西医药,2015,20(4):338-340.
[21]伍毅.培菲康联合美沙拉嗪对溃疡性结肠炎患者炎症因子、免疫功能的影响[J].医药论坛杂志,2017,16(3):138-140.
[22]Molodecky NA,Shian SI,Rabi DM,etal. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review[J]. Gastroenterology, 2012, 142(1): 46-54.
[23]Sinagra E,Pompei G,Tomasello G,etal.Inflammation in irritable bowel syndrome:Myth or new treatment target? [J].World J Gastroenterol,2016,22(7): 2242-2255.
[24]Sandborn WJ,van Assche G,Reinisch W,etal. Adalimumab induces andmaintains clinical remission in patients with moderate-to-severe ulcerative colitis[J].Gastroenterology,2012,142(2):257-265.
[25]Jess T, Rungoe C, Peyrin-Biroulet L. Risk of colorectal cancer in patients with ulcerative colitis: a Meta-analysis of populationbased cohort studies[J]. Clin Gastroenterol Hepatol, 2012, 10(6):639-645.
[26]FrancesconeR, Hou V, Grivennikov SI. Cytokines, IBD, and colitis-associated cancer[J]. Inflamm Bowel Dis, 2015, 21 (2):409-418.
[27]Tanwar S,Lipman G,Parkes J,etal. Prevalence and pathogenesis of anaemiain inflammatory bowel disease: a cross sectional study in a large tertiarycentre[J]. Gut, 2011,60(Suppl 1):A219-A220.
[28]Ohfuji S, Fukushima W, Watanabe K,etal. Pre-illness isoflavone consumption and disease risk of ulcerative colitis:a multicenter case-control study in Japan[J]. PLoS One, 2014, 9(10): e110270.
[29]Laass MW, Straub S, Chainey S,etal. Effectiveness and safety of ferric carboxymaltose treatment in children and adolescents with inflammatory bowel disease and other gastrointestinal diseases[J].BMC Gastroenterol, 2014, 14(1):1-8.
[30]Saito K,Ito A,Ishikawa K,etal.Pustular psoriasis occurring after total colectomy for ulcerative colitis and relieved by administration of infliximab[J].J Dermatol,2014,41(11):1033-1034.
[31]Prideaux L,Kamm MA,De Cruz PP,etal.Inflammatory bowel disease in Asia:a systematic review[J].J Gastroenterol Hepatol,2012,27(8):1266-1280.
[32]Hua MC,Lai MW,Kuo ML.Decreased interleukin-10 secretion by peripheral blood mononuclear cells in children with irritable bowel syndrome[J]. J Pediatr Gastroenterol Nutr, 2011. 52(4): 376-81.
[33]Olivo-Diaz A,Romero-Valdovinos M,Gudino-Ramirez A,etal.Findings related to IL-8 and IL-10 gene polymorphisms in a Mexican patient population with irritable bowel syndrome infected with Blastocystis[J]. Parasitol Res,2012,111(1): 487-491.
[34]Liu B,Piao X,Guo S,etal.Ursolic acid protects against ulcerative colitis bia anti-inflammatory and antioxidant effects inmice[J].Mol Med Rep,2016,13(6):4779-4785.
[35]钱加明.中国炎症性肠病研究的历史回顾 现状和展望[J].中国实用内科杂志,2015,35(9):727-730.
[36]Whitehead L. The impact of biological interventions for ulcerative colitis on health-related quality of life[J]. Am J Nurs, 2016, 116(11): 21.
[37]Nagalingam NA,Lynch SV.Role of the microbiota in inflammatory bowel diseases [J].Inflamm Bowel Dis, 2012, 18 (5): 968-984.
[38]Lichtenstein L, Avni-Biron I, Ben-Bassat O.Probiotics and prebiotics in Crohn’s disease therapies[J].Best Pract Res Clin Gastroenterol, 2016,30(1): 81-88.
[39]杨桦,杜广胜.炎性肠病肠道微生态改变及益生菌的治疗价值[J].中华胃肠外科杂志,2011,14(3):165-167.
[40]Triantafillidis JK, Malgarinos G, Rentis A,etal. Primary aldosteronism during long-term ulcerative colitis:a diagnostic challenge[J]. Ann Gastroenterol, 2014, 27(4): 432-433.
[41]Bhopal RS, Cezard G, Bansal N,etal. Ethnic variations in five lower gastrointestinal diseases: Scottish Health and Ethnicity Linkage Study [J]. BMJ Open, 2014, 4(10): e006120.
