重金属汞对海洋底栖动物毛蚶和紫贻贝毒性效应研究
2018-03-16魏爱泓矫新明毛成责林明洵黄金鑫楼梦岚廖启智唐磊王长友
魏爱泓,矫新明,毛成责,林明洵,黄金鑫,楼梦岚,廖启智,唐磊,王长友
1. 江苏省海涂研究中心(江苏省海洋环境监测预报中心),南京 210036 2. 南京信息工程大学 海洋科学学院,南京 210044
重金属汞是全球范围内备受关注的持久性环境污染物之一,许多国家及国际机构将其列为污染物排放最优先考虑的控制目标[1]。20世纪80年代以来,每年仅通过径流输入进入我国海洋的汞达40吨以上,造成辽东湾、胶州湾等我国近海部分海域海水汞污染风险较大[2]。进入海洋的汞污染物不能降解,只能通过颗粒沉降进人沉积物才能离开海洋,但这又对底栖生物造成危害。此外,沉积物中有机组分矿化及生物扰动会促使汞释放出来重新进入水体[3],造成汞的二次污染,危害海洋生物。汞危害性极大,不仅引起生物的急性毒性效应,还能在生物体内富集,沿食物链转移,对海洋生态系统造成难以逆转的损害[4-5]。
自20世纪80年代开始我国涉海高等院校和科研机构纷纷开展了针对汞的海洋生态毒理学研究。受试生物包括浮游植物、双壳类、甲壳类和鱼类等多种海洋生物,毒性效应指标(反应终点)涵盖光合作用、生长、滤食、呼吸、行为、发育和繁殖等诸多方面,涉及生物累积与生物排放、生物转移与放大、生物转化与生物降解等诸多生物作用过程[4-16]。另外,也有文献涉及到汞污染物对海洋生物的致畸和致突变现象以及海洋生物致毒和解毒机制的研究[7,13,15]。
为保护海洋生物免受汞的危害,需加强汞污染物入海控制,明确海水汞污染物对海洋生物的毒性效应。目前关于汞污染物对海洋生物尤其底栖生物的毒性效应数据还不是很多。本文以典型近海底栖双壳类生物毛蚶和紫贻贝作为受试生物,研究汞污染物急性和慢性毒性效应,分析计算汞的非效应浓度及半致死浓度。
1 材料与方法(Materials and methods)
1.1 实验材料
毛蚶(Scapharcasubcrenata)、紫贻贝(Mytilusedulis)取自于江苏赣榆近岸养殖水域。采集后立刻带回实验室后用海水冲净其表面的淤泥及附着物,挑选健康、反应灵敏的紫贻贝/毛蚶放入盛有100 L海水的水槽暂养。采用半静水方式暂养3~7 d,连续充气;每24 h更换培养水体的1/2。所有紫贻贝/毛蚶进行3 d饥饿处理,从第4天开始每天投螺旋藻粉(日投饵量为贝类软体部鲜重的0.6%,约0.1%~0.2%湿重)至正式实验开始[17]。实验前1 d停止投饵,选择健康、反应灵敏、大小基本一致的个体随机分组。
在塑料桶(50 L)中放入自来水,添加海水素(益尔牌)并搅拌均匀,配制盐度为20‰的人工海水,放置1 d后作为受试生物培养液。配制1 mg·L-1氯化汞(分析纯,美国Spectrum Chemical公司生产)溶液作为储备液,再稀释成各处理组浓度。
1.2 实验方法
1.2.1 急性暴露实验
在20 L玻璃水槽(内径37 cm×27 cm×20 cm)内放入培养液5 L,随机投放经过24 h饥饿处理、健康活泼紫贻贝/毛蚶15只。毛蚶平均体长2.27 cm(2.16~2.39 cm),平均体质量4.0 g(3.8~4.5 g),紫贻贝平均体长5.19 cm(5.05~5.40 cm),平均体质量14.1 g(13.2~15.4 g),年龄均约10个月。采用半静水方式培养,连续充气。实验期间不投饵。每24 h更换培养水体的1/2。实验浓度梯度取值采用等差或等比方法,并结合预实验结果进行设置,每个污染物设置5个浓度处理组,每组2个平行样,以天然海水为空白对照组,进行96 h急性毒性实验。每24 h观察并记录紫贻贝/毛蚶的死亡率,死亡标准是个体外套膜松弛、长时开口,用玻璃棒轻触外套膜缘5 min内无反应,及时捞出死亡个体。实验开始时测量其体质量和体长。

表1 氯化汞对毛蚶、紫贻贝毒性实验各处理组浓度(HgCl2, μg·L-1)Table 1 Concentrations of HgCl2 prepared for the exposure of Scapharca subcrenata and Mytilus edulis in the toxic effect test (HgCl2, μg·L-1)
1.2.2 慢性暴露实验
在20 L水槽内放入培养液5 L,随机投放经过24 h饥饿处理、健康活泼毛蚶/紫贻贝40只。毛蚶平均体长2.83 cm(2.76~2.91 cm),平均体质量7.2 g(6.8~7.6 g),紫贻贝平均体长5.04 cm(4.86~5.15 cm),平均体质量12.8 g(11.4~13.9 g)。采用半静水式培养,每24 h更换培养水体的1/2后补充污染物至初始浓度。每天固定时间各投喂螺旋藻粉1次(日投饵量为贝类软体部鲜重的0.6%,约0.1%~0.2%湿重)。其他培养条件与急性毒性试验期间相同。参考急性毒性试验的结果优化污染物浓度设置,实验设置5个浓度处理组,1组空白对照组。每实验组设2个平行。实验开始后,于4、8、12、16、20 d取样,每组随机选取2只,用于蛋白质含量及超氧化物歧化酶(SOD)活性的测定。实验期间观察各组有无毛蚶、紫贻贝个体死亡。于实验开始、5、9、13、17、21 d及结束时,应用电子台秤5台(精度0.1 g)测量受试生物湿重,应用游标卡尺(精度0.01 mm)测量受试生物体长。
用大剪刀或螺丝刀在毛蚶/紫贻贝壳上钻孔后并迅速撬开,将伪足上方包裹黑色部位的肌肉分离,黑色部位前半段即为其消化腺,置于称量纸上称量,冰浴暂时保存。取消化腺组织,加入适量冰浴预冷的磷酸缓冲盐溶液(PBS),冰浴进行匀浆1 min(使用玻璃匀浆器)。随后匀浆液10 000 g、4 ℃离心10 min,上清即为待测样品,样品按量分装成4~6份,-80 ℃保存备用。采用碧云天的总SOD活性检测试剂盒(WST-8法),应用可见光分光光度计法测定SOD酶活力。其中PBS缓冲液按实验室常用配制方法配制(NaCl 8 g·L-1; KCl 0.2 g·L-1; Na2HPO41.42 g·L-1; KH2PO40.27 g·L-1),测定波长450 nm。主要原理是通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子自由基,后者氧化羟胺形成亚硝酸盐,在显色剂作用下呈现紫色,利用分光光度计测定吸光度值,然后计算样品中的SOD酶活力。
1.3 数据分析方法
采用Log-logistic模型计算受试生物LC05和LC50及其置信区间[18]。Log-Logistic模型:
(1)
式中,y为效应指标,c为污染物浓度,x为效应百分数,a为c=0时的效应指标,b为模型形状参数。
应用Weibull毒性效应阈值模型计算受试生物急性毒性效应阈值浓度[19-20]。Weibull毒性效应阈值模型:
y=y0e-a(cb-csb)
(2)
式中,y为效应指标,c为污染物浓度,cs为阈值浓度,y0为c=0时的效应指标,a和b为模型形状参数。
对于慢性毒性实验数据,应用单因素方差分析检验各实验组组间方差与组内方差的显著性;应用配对多重比较(Games-Howell和Dunnett’s T3)检验处理组与对照组的均数差异,根据检验结果确定受试生物慢性毒性实验的NOEC(No Observed Effective Concentration)[21-24]。显著性检验P<0.05、P<0.01为差异显著。利用SPSS19.0软件对慢性实验毒性效应测定数据进行统计分析。
2 结果与讨论(Results and discussion)
2.1 毛蚶、紫贻贝急性致死效应
急性毒性实验结果表明,氯化汞对毛蚶、紫贻贝的毒性非常强,浓度高于100 μg·L-1就能造成毛蚶死亡,超过800 μg·L-1在96 h内就能造成半数毛蚶和紫贻贝死亡(图1、2)。
2.2 毛蚶、紫贻贝体长及体质量
尽管慢性毒性实验分别在0、5、9、13、17、21 d测定了毛蚶、紫贻贝的平均体质量、平均体长(图3、4),结果表明同一浓度处理组的组内方差与组间方差并没有显著性差异(P> 0.1),这可能是由于实验周期相对其生长周期来说太短,体质量体长难以有明显变化。这表明对于实验周期小于1个月的毒性效应实验,双壳类底栖动物的体长及体质量不适合作为毒性效应的评价终点。
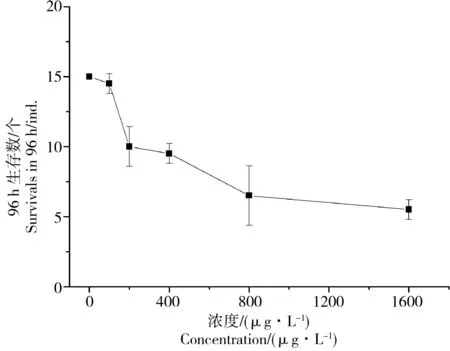
图1 急性毒性实验毛蚶96 h生存数随氯化汞浓度变化曲线Fig. 1 The curve for survivals of Scapharca subcrenata in 96 h with concentrations of HgCl2 in the acute toxic effect test

图2 急性毒性实验贻贝96 h生存数随氯化汞浓度变化曲线Fig. 2 The curve for survivals of Mytilus edulis in 96 h with concentrations of HgCl2 in the acute toxic effect test

图3 慢性毒性实验不同氯化汞浓度处理下毛蚶平均体质量、平均体长变化注:t0、t21表示实验开始时间(0 d)、实验结束时间(21 d)。下同。Fig. 3 The changes of averaged weight and length of Scapharca subcrenata with concentrations of HgCl2 in the chronic toxic effect testNote: t0 and t21 are the beginning time (0 d) and ending time of this test (21 d), respectively. The same below.
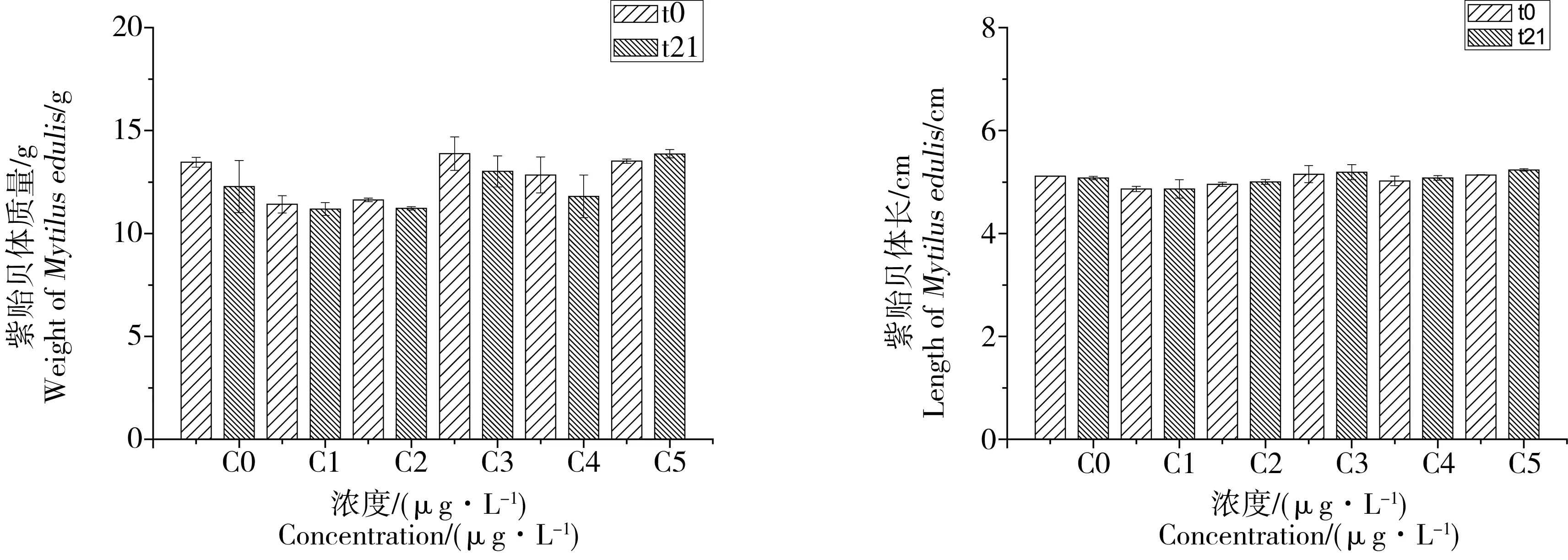
图4 慢性毒性实验不同氯化汞浓度处理下贻贝平均体质量、平均体长变化Fig. 4 The changes of averaged weight and length of Mytilus edulis with concentrations of HgCl2 in the chronic toxic effect test

图5 慢性毒性实验不同氯化汞浓度处理下毛蚶 超氧化物歧化酶(SOD)活性变化Fig. 5 The changes of superoxide dismutase (SOD) in Scapharca subcrenata with concentrations of HgCl2 in the chronic toxic effect test
2.3 毛蚶、紫贻贝SOD活性的变化
氯化汞污染物对毛蚶消化腺中SOD活性的影响如图5所示。整体来看,污染物暴露4、8、12、16、20 d时,各实验组组内方差与组间方差的差异并不显著(P> 0.05),只有暴露12 d时的显著性差异(P= 0.098)接近0.05。但通过配对多重比较可以发现一些实验组的均数也存在差异。当污染物暴露4 d时,C1、C2、C3、C4、C5浓度组(10、20、40、60、100 μg·L-1)SOD活性较对照组均有所降低,分别为对照组的74.8%、89.1%、80.8%、81.9%、71.8%,但只有C1、C3浓度组SOD活性较对照组显著降低(P< 0.05);污染物暴露8 d时,C1、C2、C3、C4、C5浓度组SOD活性仍然低于对照组,分别为对照组的83.1%、84.3%、77.3%、62.4%、94.0%,但差异并不显著(P> 0.1);污染物暴露12 d时,C4浓度组SOD活性低于对照组,为对照组的90.7%,C1、C2、C3、C5浓度组SOD活性较对照组均有所增加,分别为对照组的120.1%、103.4%、130.9%、115.5%,但差异并不显著(P> 0.1);污染物暴露16 d时,仍只有C4浓度组SOD活性低于对照组,为对照组的84.9%,C1、C2、C3、C5浓度组SOD活性高于对照组,分别为对照组的112.1%、123.5%、117.2%、115.51%,但差异并不显著(P> 0.1);污染物暴露20 d时,C1、C2、C3、C4、C5浓度组SOD活性仍然低于对照组,分别为对照组的80.3%、88.1%、87.4%、86.6%、80.3%,但差异并不显著(P> 0.1)。
同一氯化汞污染物浓度作用下,不同时间的毛蚶消化腺SOD活性变化并不一致,C1、C2、C3、C5浓度组SOD活性与对照组的比值整体上呈现先减小再增加然后再减小的波动趋势,只有C4浓度组SOD活性在整个实验过程中都低于对照组,但与对照组的比值整体上也呈现先减小再增加然后再减小的波动趋势。整个实验过程中,C1、C2、C3、C4、C5浓度组SOD活性积分值都低于对照组,但只有C4浓度组SOD活性积分值较对照组显著降低(P< 0.05)。
氯化汞污染物对紫贻贝消化腺中SOD活性的影响如图6所示。整体来看,污染物暴露4、8、12、16、20 d时,各实验组组内方差与组间方差的差异并不显著(P> 0.05),只有暴露12 d时的显著性差异(P= 0.083)接近0.05。但通过配对多重比较可以发现一些实验组的均数也存在差异。当污染物暴露4 d时,C1、C2浓度组(10、20 μg·L-1)SOD活性较对照组均有所增加,分别为对照组的105.4%、109.6%,C3、C4、C5浓度组(40、60、100 μg·L-1)SOD活性较对照组有所降低,分别为对照组的92.2%、99.8%、97.3%,但差异并不显著(P> 0.1);污染物暴露8 d时,C1、C3浓度组SOD活性较对照组均有所增加,分别为对照组的102.3%、120.0%,C2、C4、C5浓度组SOD活性较对照组有所降低,分别为对照组的94.3%、92.7%、86.2%,但差异并不显著(P> 0.1);污染物暴露12 d时,C1、C2、C3、C4、C5浓度组SOD活性均低于对照组,为对照组的83.2%、79.2%、65.5%、81.6%、84.0%,但只有C3浓度组SOD活性较对照组均差异显著(P< 0.05);污染物暴露16 d时,C1、C2、C3、C4、C5浓度组SOD活性仍都低于对照组,为对照组的95.7%、99.0%、68.2%、89.4%、95.5%,且只有C3浓度组SOD活性较对照组均差异显著(P< 0.05);污染物暴露20 d时,C1、C2浓度组SOD活性较对照组均有所增加,分别为对照组的112.0%、120.8%,C3、C4、C5浓度组SOD活性较对照组有所降低,分别为对照组的97.1%、94.7%、96.7%,但差异并不显著(P> 0.1)。已有文献报道重金属汞低浓度、短期暴露下抗氧化酶活性增加,但是随着暴露时间的延长,酶活性降低,甚至被抑制[5],与本文的结果基本一致,但显著性差异大。
同一氯化汞污染物浓度作用下,不同时间的贻贝消化腺SOD活性变化并不一致,C1、C2浓度组SOD活性与对照组的比值整体上呈现先增加再减小然后再增加的波动趋势,C4、C5浓度组SOD活性与对照组的比值在整个实验过程中都低于对照组,只有C3浓度组SOD活性与对照组的比值整体上呈现先减小再增加然后再减小的波动趋势。但整个实验过程中,C1、C2、C3、C4、C5浓度组SOD活性积分值都低于对照组,但差异并不显著(P> 0.1)。

图6 慢性毒性实验不同氯化汞浓度处理下贻贝SOD活性变化Fig. 6 The changes of SOD in Mytilus edulis with concentrations of HgCl2 in the chronic toxic effect test
2.4 毒性效应浓度
利用Matlab软件进行编程,通过模型参数估计方法,应用模型方程公式(1)、(2)分别计算了氯化汞对毛蚶、贻贝的急性毒性效应浓度LC50、LC05、Cs及其bootstrap置信区间,平均拟合优度大于0.9,计算结果如表2。通过配对多重比较检验处理组与对照组的均数差异,根据检验结果确定了受试生物慢性毒性实验的NOEC(P< 0.05)(表2)。
总体来看,Log-logistic模型[18]和Weibull毒性效应阈值模型[19]都能很好地拟合汞污染物浓度与受
试生物之间的毒性效应曲线(反“S”形),并且毒性效应参数(LC50、LC05、Cs)都能在模型拟合过程中直接率定。但由于Weibull毒性效应阈值模型是四参数模型,Log-Logistic模型是三参数模型,Log-Logistic模型收敛性优于Weibull毒性效应阈值模型,计算的LC05均值总体上小于Cs均值,LC05置信区间总体上比Cs置信区间窄。因此,将计算所得的LC05作为汞污染物的非效应浓度[25]。计算结果表明,氯化汞分别高于23.7 μg·L-1、87.8 μg·L-1将会对海洋底栖生物毛蚶、紫贻贝生存产生明显的不利影响。LC50计算结果表明,氯化汞的环境浓度分别高于683.4 μg·L-1、773.2 μg·L-1将会造成海洋底栖生物毛蚶、紫贻贝半数死亡。慢性实验结果表明,氯化汞的环境浓度分别高于10 μg·L-1、20 μg·L-1将会显著影响海洋底栖生物毛蚶、紫贻贝消化腺SOD酶的活性。
结合文献数据资料,可以进行物种敏感度分布(Species Sensitivity Distribution, SSD)分析[23],发现汞污染物对不同门类生物的毒性效应差异很大,半致死浓度(或半效浓度)范围约为0.11~62 688 μg·L-1,对体积较小的单细胞生物(如长毛对虾受精卵、三角褐指藻等)毒性一般更大,对体积较大的生物(如阿匍虾虎鱼、中华绒鳌蟹等)毒性相对较小(图7)。毛蚶、紫贻贝等双壳类海洋底栖生物在汞污染物物种敏感性分布中属于抗性较强的物种(0.80 ≤ Rank)[26],这可能主要是由于毛蚶、紫贻贝体积相对较大,并且受到污染物胁迫时可以闭壳保护自身组织器官免受损伤。
慢性毒性效应实验数据结果表明,实验周期内毛蚶和紫贻贝体质量、体长的组内方差与组间方差并没有显著性差异(P> 0.1),体长及体质量不适合作为毒性效应的评价终点。毛蚶、紫贻贝各实验组SOD酶活力的组内方差与组间方差的差异整体上并不显著(P> 0.05),实验周期内仅在个别时间处理组间存在显著性差异(P< 0.05),毛蚶、紫贻贝NOEC分别为10 μg·L-1、20 μg·L-1。急性毒性效应实验数据结果表明,重金属汞对毛蚶、紫贻贝的非检测毒性效应浓度分别为23.7 μg·L-1、87.8 μg·L-1,半致死浓度分别为683.4 μg·L-1、773.2 μg·L-1。
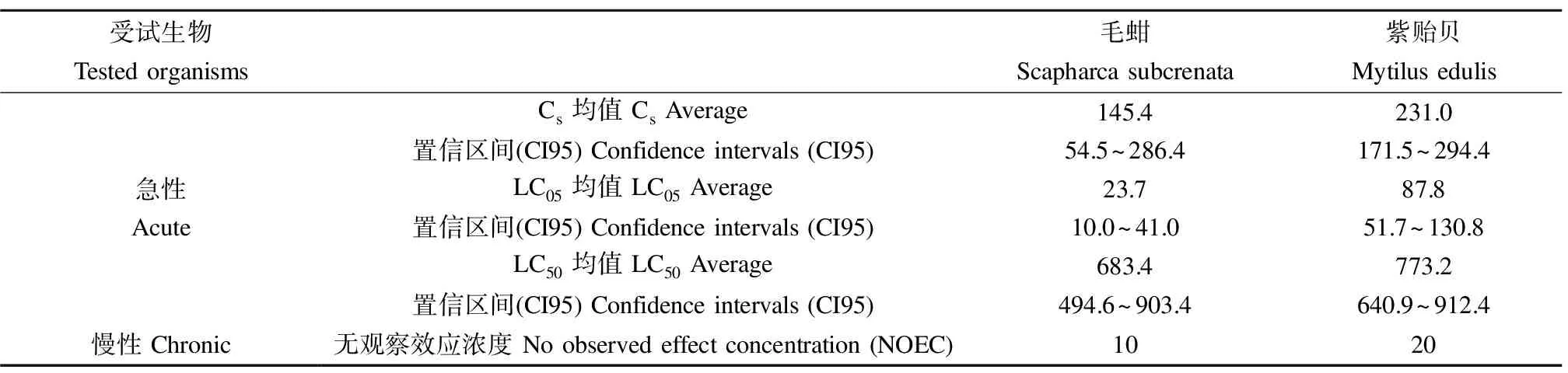
表2 氯化汞对毛蚶和紫贻贝的Cs、LC50、LC05 (μg·L-1)Table 2 The Cs, LC50, and LC05 of Scapharca subcrenata and Mytilus edulis with the exposure to HgCl2(μg·L-1)
注:Cs表示阈值浓度。
Note:Csstands for threshold concentration.
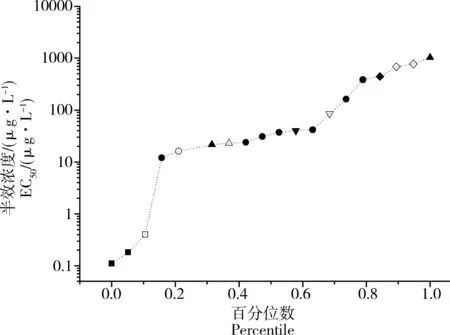
图7 污染物汞半效浓度(EC50)物种敏感性分布注:■斑马鱼胚胎及鱼卵[27];□长毛对虾受精卵及幼体[12]; ●赤潮异弯藻、旋链角毛藻、海洋原甲藻、裸甲藻、中肋骨条藻、 三角褐指藻、青岛大扁藻、亚心型扁藻[6];○斑马鱼胚胎幼体[28];▲阿匍虾虎鱼,黑褐新糠虾[29];△三角褐指藻[7];▼黑鲷胚胎[10];▽栉孔扇贝幼贝[4];◆中华绒鳌蟹幼蟹[30];◇毛蚶成体,紫贻贝成体(本文)。Fig. 7 Species sensitivity distribution for contaminant HgCl2 according to half-effect concentration (EC50) Note:■ Embryos and eggs of zebrafish[27]; □ Fertilized eggs and larvae of Penaeus penicillatus Alcock[12]; ● Heterosigma akashiwo Hada, Chaetoceros curvisetus Cleve, Prorocentrum micans Ehrenberg, Gymnodinium sp., Skeletonema costatum (Greville) Cleve, Phaeodactylum tricornutum Bohlin, Platymonas helgolanidica, Platymonas subcordiformis[6]; ○ Larvae of zebrafish[28]; ▲ Aboma lactipes, Neomysis awatschensis[29]; △ Phaeodactylum tricornutum Bohlin[7]; ▼ Embryos of black porgy[10]; ▽ Juvenile Chlamys farreri [4]; ◆ Young Eriocheir sinensis [30]; ◇ Mature Scapharca subcrenata and mature Mytilus edulis (this study).
