溴氰菊酯对中华绒螯蟹的毒性作用和组织病理研究
2018-03-16张小俊陆宏达田全全贾相相任芳芳
张小俊,陆宏达,田全全,贾相相,任芳芳
上海海洋大学水产动物遗传育种中心上海市协同创新中心,上海海洋大学国家水生动物病原库,上海海洋大学水产科学国家级实验教学示范中心,上海 201306
中华绒螯蟹(Eriocheirsinensis)俗称河蟹,已在我国的江苏、安徽和辽宁等地进行养殖,随着河蟹养殖面积的不断扩大和经济效益的不断提高,目前已成为我国虾蟹类主要养殖品种之一,规模化养殖过程中常出现病毒性、细菌性和寄生虫性等疾病[1],有些疾病可使用化学类药物等进行防治,但部分化学类药物对水产动物具有高毒性,使用不当容易造成中毒死亡等一些不良后果[2]。溴氰菊酯(deltamethrin)又称敌杀死,具有对哺乳动物和鸟类低毒但杀虫活性强的特点,已成为农业和林业中广谱性杀虫剂[3]。其在水产养殖业上的使用较晚,可作为渔药用于治疗鱼类指环虫(Dactylogyrusspp.)、三代虫(Gyrodactylusspp.)、锚头鳋(Lernaeaspp.)和中华鳋(Sinergasilusspp.)等寄生虫病[4-5],还可通过泼洒和浸泡清塘的方法杀灭池塘中的河蟹病原螺原体(Spiroplasmaeriocheiris),达到防控疾病的目的[6-7],在水产养殖业上逐渐得到普遍应用。近几年出现的河蟹水瘪子病,至今病因尚未确定,推测一些药物的使用为其病因或病因之一,王元等[8]在有关河蟹水瘪子病的报道中指出使用菊酯农药清塘后,农药易被土壤吸附长期残留在池底土壤中,底栖生活的河蟹受到土壤释放出的菊酯农药长期作用,受到慢性毒性危害。观察机体组织病理变化是衡量药物毒性作用的方法之一[9],但有关溴氰菊酯毒性作用引起河蟹的组织病理鲜有报道,至今为止只有溴氰菊酯对河蟹肝胰腺的组织病理的简略报道[10]。本文通过毒性试验,较为全面地研究了溴氰菊酯引起河蟹的中毒症状和其主要组织器官鳃、肝胰腺、心脏、肠、肌肉组织和神经团的病理损伤作用,对比较系统地掌握该药对河蟹的毒性、组织病理变化特点和日后采取相应的措施减少对河蟹的损伤作用等方面具有重要的意义。
1 材料与方法(Materials and methods)
1.1 实验河蟹和药品
健康河蟹购于上海某河蟹养殖场,规格为体重(14.58±2.36) g,壳长(2.83±0.19) cm,暂养于室内水族箱中,饲养水体为经曝气后的自来水,待河蟹适应环境并正常摄食后,挑选活力好、四肢健全的河蟹作为实验河蟹。将原产于印度,购于常熟恒耀新材料有限公司的溴氰菊酯原药(纯度98%),溶于丙酮配成母液,现用现配。
1.2 溴氰菊酯对河蟹的急性毒性实验
根据预试验结果,分别配制0.16、0.32、0.64、1.28、2.56、5.12和10.24 μg·L-1溴氰菊酯溶液进行急性毒性实验,探讨溴氰菊酯对河蟹的半致死浓度(median lethal concentrations, LC50)和安全浓度(safe concentrations, SC),并设置与实验组最高浓度组相同量的丙酮溶剂作为溶剂对照组和不加任何药物作为空白对照组,各组河蟹20只,实验在水体为30 L的60 cm×40 cm×30 cm塑料水族箱中进行,自然光照,持续充气,维持水温20~23 ℃,pH 7.2~7.6,每隔24 h各组分别替换与原实验体积相同的水体,实验时间为96 h,实验期间不投食。分别在24 h、48 h、72 h、96 h时统计河蟹死亡数,判断死亡方法为玻璃棒触碰河蟹眼无任何反应,死亡河蟹及时捞出,并从试验开始起对河蟹行为、中毒症状和死亡数进行观察和记录。
1.3 溴氰菊酯慢性毒性作用下河蟹的组织病理研究
根据急性毒性实验结果,分别配制0.005、0.01、0.02、0.04、0.08、0.16和0.32 μg·L-1溴氰菊酯溶液进行慢性毒性实验,探讨溴氰菊酯对河蟹组织病理等的影响,并设置与慢性毒性实验组最高浓度组相同量的丙酮溶剂作为溶剂对照组和不加任何药物作为空白对照组,每组河蟹25只,每天定时投喂适量的河蟹颗粒饲料,每隔24 h各组分别替换与原实验体积相同的水体,同时清除残饵,其他实验条件与急性毒性实验相同。实验第7、14、21天时,分别随机采集各浓度组中5只河蟹,立即取鳃、肝胰腺、心脏、肠、肌肉组织和位于胸腔中央靠近胸甲处的神经团于波恩氏液中固定,24 h后用70%酒精冲洗并保存备用。经酒精梯度脱水,二甲苯透明,石蜡包埋,4~5 μm组织切片,苏木精和伊红(HE)染色,中性树胶封片,在带有NIS-Elements F 4.0软件的Nikon Eclipse 55i显微镜下进行观察和拍照。根据组织病理严重程度的观察结果,将21 d实验期内溴氰菊酯对河蟹组织器官造成的组织病理变化划分为病变前期、中期和后期。实验过程中出现的临死河蟹进行相同的组织病理观察。
1.4 数据处理
运用SPSS 19.0软件对急性毒性实验结果进行Probit回归分析,以溴氰菊酯浓度对数为自变量x,以相应浓度下河蟹死亡百分率的概率值为因变量y建立拟回归方程,分别计算出24 h、48 h、72 h和96 h LC50、95%置信区间和可决系数(R2)。采用公式SC = 96 h-LC50× 0.1[11]计算溴氰菊酯对河蟹的安全浓度。
2 结果(Results)
2.1 溴氰菊酯的毒性作用
2.1.1 急性毒性和慢性毒性作用
溴氰菊酯急性暴露引起河蟹累积死亡见表1,除0.16 μg·L-1组在72 h时才出现死亡外,其他各实验组在24 h时起均出现不同程度的死亡,随着溴氰菊酯浓度和实验时间的增加,河蟹累积死亡数和累积死亡率均出现逐渐上升的趋势,呈现正相关关系,丙酮对照组和空白对照组在实验过程中均无河蟹死亡现象。
溴氰菊酯对河蟹的LC50和SC见表2,由概率单位法分别得到24 h、48 h、72 h和96 h时的y与x的拟回归方程,它们的R2都在0.97以上,溴氰菊酯溴氰菊酯慢性毒性引起河蟹累积死亡见表3。0.04 μg·L-1以下浓度组、丙酮对照组和空白对照组在21 d的实验过程中均没有出现河蟹死亡现象,0.08 μg·L-1组只在实验的第14天时出现1只河蟹死亡,0.16 μg·L-1组和0.32 μg·L-1组在第7、14和21天时均有河蟹死亡,最高累积死亡率达36%。

表1 溴氰菊酯急性毒性作用下的河蟹累积死亡数和死亡率Table 1 Cumulative death and mortality of crab under the acute exposure of deltamethrin
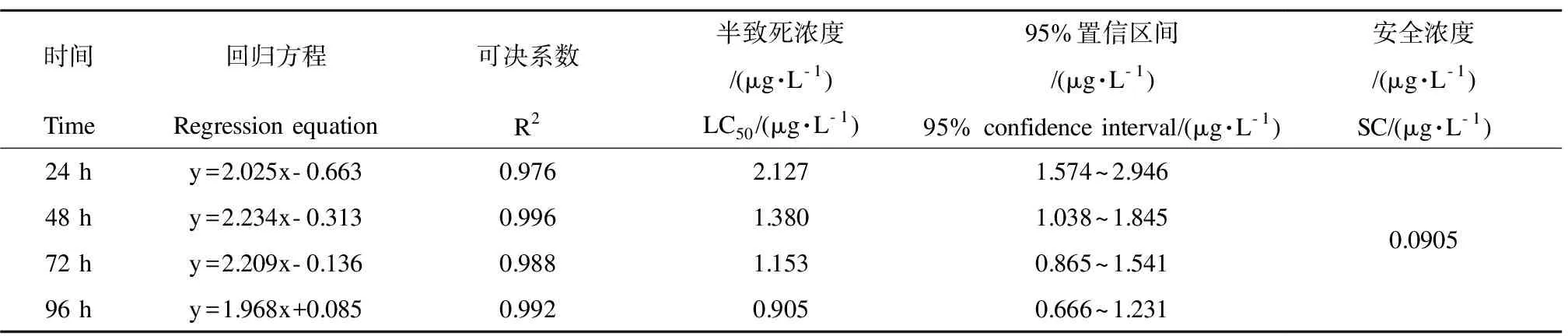
表2 溴氰菊酯对河蟹的半致死浓度和安全浓度Table 2 The median lethal concentrations (LC50) and safe concentrations (SC) of deltamethrin on crab
浓度对数与死亡率概率单位之间高度相关,溴氰菊酯对河蟹的24 h、48 h、72 h和96 h LC50分别为2.127 μg·L-1、1.380 μg·L-1、1.153 μg·L-1和0.905 μg·L-1,它们分别分布在各自的95%置信区间,对河蟹的SC为0.0905 μg·L-1。
2.1.2 急性和慢性中毒症状
急性毒性试验中的河蟹中毒症状主要表现为:开始时河蟹出现不安的状态,爬动加快,有沿水族箱侧壁向上爬动等避开药浴水体的行为,随着药浴时间的延长,部分河蟹四处乱窜,河蟹步足出现微颤现象,进一步发展河蟹出现反应迟钝,爬动能力下降,步足逐渐僵硬僵直,互相团抱等现象(图1-1),临死时所有的步足撑起而静止不动(图1-2),只有眼能微动,死亡河蟹腹脐略张开,用玻璃棒触碰眼无反应。急性毒性试验中0.16 μg·L-1至10.24 μg·L-1各组河蟹都会出现这些不同程度的症状,只是出现相同症状的时间有差异,溴氰菊酯浓度越高,河蟹出现相同症状和死亡越早,同一浓度组中河蟹的死亡时间有一定的差异。最早出现死亡河蟹是在用药后80 min时的10.24 μg·L-1浓度组。
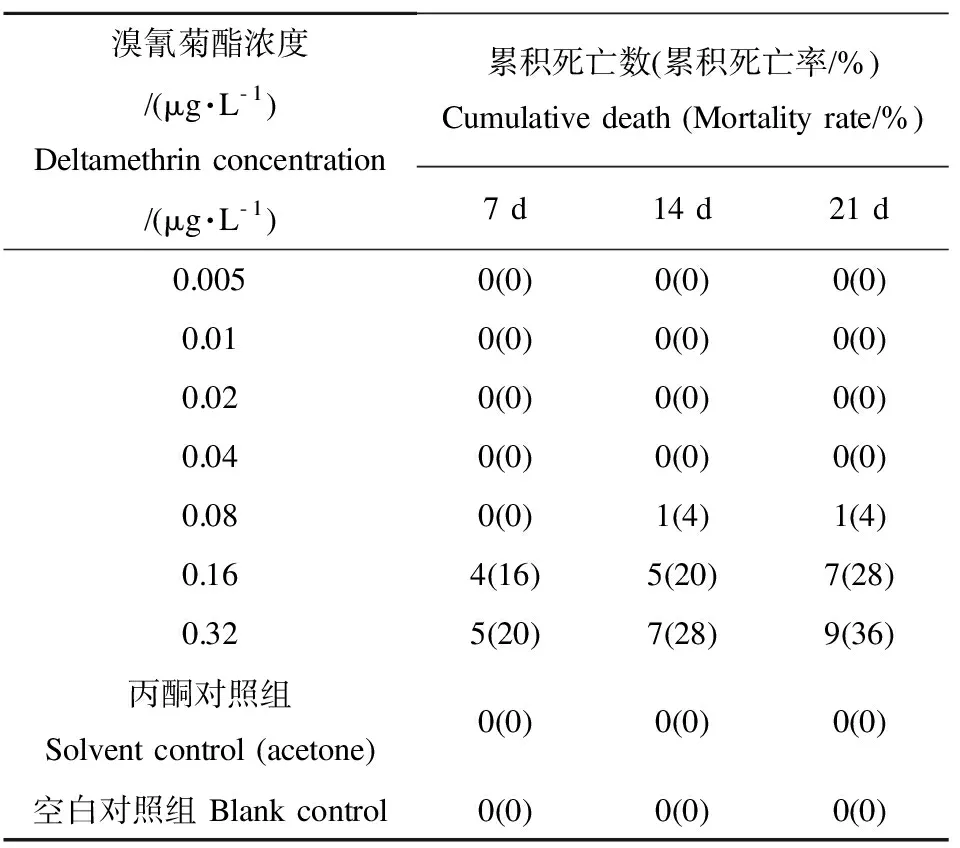
表3 溴氰菊酯慢性毒性作用下的河蟹累积死亡数和死亡率Table 3 Cumulative death and mortality of crab under the chronic exposure of deltamethrin
慢性毒性试验过程中,0.005 μg·L-1组河蟹在整个试验过程中无明显的症状表现,0.01~0.08 μg·L-1各组只出现爬动异常,有避开药浴水体行为等一些轻微中毒症状。0.16 μg·L-1、0.32 μg·L-1两组中毒症状与急性中毒症状相似,少数河蟹出现死亡现象,0.08 μg·L-1、0.16 μg·L-1和0.32 μg·L-1组分别于20 d、13 d、11 d时出现部分河蟹不摄食现象。无论急性毒性试验还是慢性毒性试验,丙酮和空白对照组的河蟹在实验过程中均无异常现象。
2.2 溴氰菊酯对河蟹各组织的病理损伤
经对慢性毒性试验不同浓度组和不同时间点的河蟹各组织器官的组织病理观察,将出现组织病理变化的组织划分为病变前期、中期和后期。
2.2.1 鳃组织病理变化
河蟹每条鳃由鳃轴和向两边发出的层层鳃叶组成,鳃叶最外侧是角质层,内侧是单层上皮细胞,与柱状细胞一起形成血淋巴液循环的鳃腔[12-13]。
鳃病变前期:部分鳃小叶出现肿大,鳃腔膨大,部分区域厚度是健康鳃小叶1倍以上,出现许多从鳃腔中渗出的嗜伊红性渗出物,鳃小叶不同区域渗出物的渗出量不同,分布在鳃小叶之间(图1-3)。病变中期:鳃小叶间渗出物在有些区域进一步增加,肿大的鳃开始出现萎缩现象,鳃腔缩小,鳃小叶厚度小于正常的鳃小叶,但鳃小叶鳃腔两侧的扁平上皮细胞层还没有完全闭合,少量鳃腔内出现嗜伊红性的浓染物质,这些区域扁平上皮细胞及柱状细胞细胞核轻微固缩(图1-4)。病变后期:鳃腔进一步缩小,部分鳃小叶鳃腔两侧的扁平上皮细胞闭合在一起,鳃小叶的鳃腔消失,较为严重的区域大部分鳃腔闭合,已失去鳃小叶的鳃腔结构,这些区域扁平上皮细胞及柱状细胞的细胞核出现浓染固缩等细胞坏死现象,没有闭合的鳃腔内出现嗜伊红性的浓染物质(图1-5)。实验7 d时,0.005 μg·L-1组鳃组织未发生明显病理变化;从0.01 μg·L-1组起鳃出现前期的病理变化,0.01 μg·L-1组只有少量的鳃小叶出现肿大,0.04 μg·L-1组肿大更为严重,鳃小叶之间出现更多的渗出物;0.08 μg·L-1及以上各组均出现中期病理变化,0.08 μg·L-1组部分鳃腔开始出现萎缩,0.32 μg·L-1组更多的鳃腔萎缩并出现嗜伊红物质,但鳃腔尚未出现闭合。14 d时,0.02 μg·L-1及以下各组鳃处于前期的病理变化,鳃腔不同程度地出现肿大现象;从0.04 μg·L-1组至0.16 μg·L-1组鳃出现中期的病理变化,鳃小叶出现萎缩,其中0.08 μg·L-1组鳃腔出现少量嗜伊红物质;0.32 μg·L-1组处于后期的病理变化,部分鳃腔两侧上皮细胞闭合在一起,鳃腔消失。21 d时,0.005 μg·L-1浓度组的鳃小叶处于病变前期,多数鳃小叶鳃腔肿大;0.01 μg·L-1至0.04 μg·L-1各组鳃小叶处于病变中期,鳃小叶鳃腔萎缩程度进一步加大,且鳃腔出现少量强嗜伊红性物质;0.08 μg·L-1及以上各组鳃出现后期的病理变化,但鳃小叶鳃腔萎缩闭合的区域面积不同,浓度越高闭合的区域越大,出现更多的坏死细胞,尚未完全闭合的鳃腔内出现嗜伊红性物质。临死的河蟹鳃病变程度都处于病变后期。
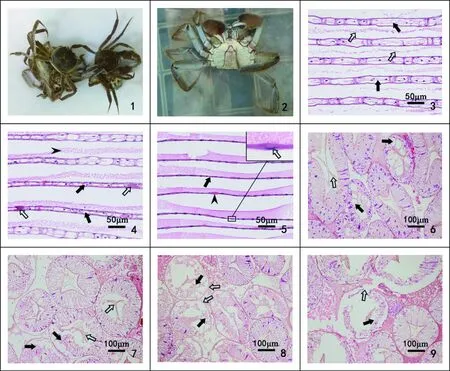
图1 河蟹中毒症状以及鳃和肝胰腺组织病理注:1. 中毒河蟹相互抱团在一起;2. 中毒河蟹步足僵直撑起;3. 病变前期,鳃腔膨大(),鳃小叶之间出现渗出物(),HE;4. 病变中期, 鳃腔萎缩(),腔内出现嗜伊红浓染物质(),渗出物增多(),HE;5. 病变后期,大部分鳃腔完全闭合(),核固缩()和未闭合的鳃腔中出现嗜伊红浓染物质(),HE;6. 病变前期,部分肝胰腺管中肝胰腺细胞出现空泡(),肝胰腺管腔内出现较多的分泌物(),HE;7. 病变中期,部分肝胰腺管中个别肝胰腺细胞开始出现坏死(),管腔内分泌物进一步增加(),HE;8. 病变后期,部分肝胰腺管中较多肝胰腺细胞坏死崩解(),但基膜尚完整(),HE;9. 病变后期,部分肝胰腺管中全部肝胰腺细胞坏死崩解,成一片无细胞结构的物质(),基膜崩解消失(),HE。Fig. 1 Poisoning symptoms and histopathology of gill and hepatopancreasNote: 1.Poisoning crabs gathered together; 2. Pereiopods of crab were spastic; 3. In the early lesion, enlarged gill cavities (), exudation () between secondary lamellae, HE; 4. In the middle lesion, gill cavities atrophied () and eosinophilic materials (), increased excretions (), HE; 5. In the late lesion, gill cavities were completely closed (), karyopyknosis () and eosinophilic materials () in the unclosed gill cavities, HE. 6. In the early lesion, hepatopancreatic cells appeared vacuoles (), and more excretions appeared in hepatopancreatic ducts (), HE; 7. In the middle lesion, necrotic hepatopancreatic cells (), increased excretions in ducts (), HE; 8. In the late lesion, more necrotic hepatopancreatic cells (), intact basement membrane (), HE; 9. In the late lesion, all hepatopancreatic cells were necrosed to be unstructured materials (), and the basement membrane disintegrated and disappeared (), HE.
2.2.2 肝胰腺组织病理变化
肝胰腺由大量排列紧密的肝胰腺管和少量管间的结缔组织组成,肝胰腺管外紧贴着一层基膜,膜内有纤维细胞,核椭圆形或圆形,1~2个核仁;管内有4种肝细胞组成,分别是胚细胞(E细胞)、泡状细胞(B细胞)、纤维细胞(F细胞)和吸收细胞(R细胞)[13]。
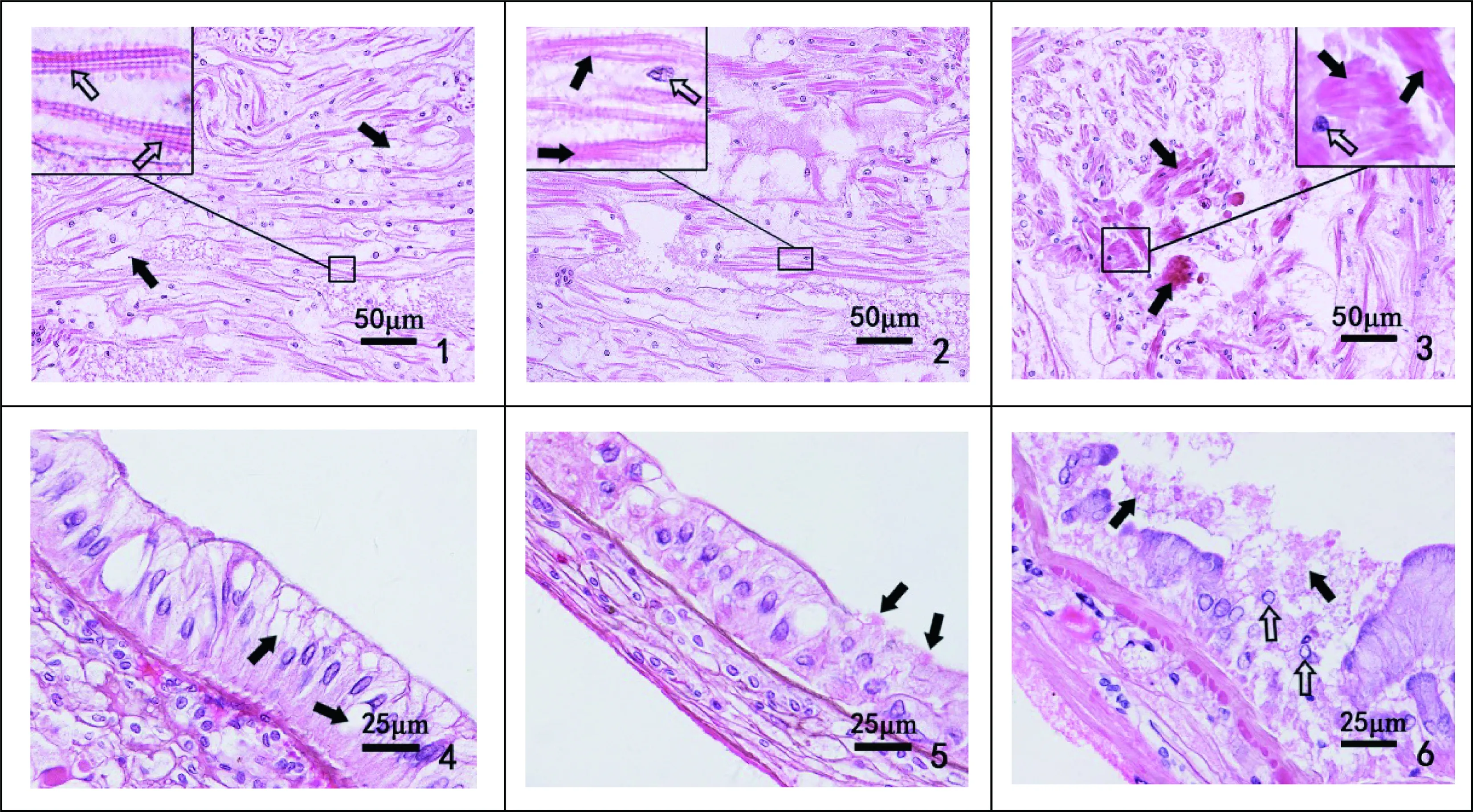
图2 心脏和肠组织病理注:1. 病变前期,心脏出现水肿,心肌纤维之间间隙增大(),但心肌纤维横纹清晰(),HE;2. 病变中期,部分心肌纤维横纹模糊(), 逐渐消失,核轻微固缩(),HE;3. 病变后期,局部坏死的心肌纤维消失成一片无结构物质,呈强嗜伊红性(),核固缩(),HE; 4. 病变前期,肠黏膜层部分柱状上皮细胞出现空泡变性(),HE;5. 病变中期,少量柱状上皮细胞细胞膜破裂消失(), 开始出现坏死现象,HE;6. 病变后期,较多上皮细胞坏死崩解成一片无结构物质(),与残存的细胞核()一起脱落入肠腔,HE。Fig. 2 Histopathology of heart and intestineNote: 1.In the early lesion, heart appeared edema, the gaps between the myocardial fibers increased (), but the transverse lines of the myocardial fibers were clear (), HE; 2. In the middle lesion, some of the myocardial fibers were blurred (), and gradually disappeared, slight karyopyknosis (), HE; 3. In the late lesion, necrotic myocardial fibers became into an unstructured, strongly eosinophilic materials (), karyopyknosis (), HE; 4. In the early lesion, some epithelial cells in the intestinal mucosa showed vacuolar degeneration (), HE; 5. In the middle lesion, membrane of a small amount of necrotic epithelial cells disappeared (), HE; 6. In the late lesion, more necrotic epithelial cells becoming unstructured materials () with the remaining nuclei () that fell into the intestinal duct, HE.
病变前期:部分肝胰腺管中肝胰腺细胞出现不同程度的空泡变性,变性严重的细胞空泡数量和体积都有所增加,肝胰腺管的管腔内分泌物增多(图1-6)。病变中期:部分区域肝胰腺管中的少量肝胰腺细胞出现坏死崩解,坏死的肝胰腺细胞和细胞核脱离基膜,失去应有的细胞结构,肝胰腺管管腔内分泌物进一步增多(图1-7)。病变后期:部分区域肝胰腺管中的肝胰腺细胞坏死进一步加剧,较多的肝胰腺细胞出现坏死崩解现象,但肝胰腺管的基膜还存在,基膜不呈现锯齿状的皱缩现象(图1-8),少量严重病变的肝胰腺管,所有肝胰腺细胞全部崩解坏死,细胞核也崩解消失,成一片无细胞结构的物质,肝胰腺管的基膜崩解消失(图1-9)。实验7 d时,0.005 μg·L-1组肝胰腺组织和健康对照组无差异;0.01 μg·L-1及以上各组均为病变前期,0.01 μg·L-1组少数肝胰腺细胞开始出现空泡变性,随着浓度的增加,空泡增大,数量增多,呈现进一步加剧现象。14 d时,0.005 μg·L-1及以上各组均为中期,少数肝胰腺管内的个别肝胰腺细胞出现崩解坏死现象。21 d时,0.005 μg·L-1组至0.04 μg·L-1组为中期,浓度越高的组,相对病变程度略有加剧;0.08 μg·L-1及以上各组均为后期,随着浓度增加,部分肝胰腺管中坏死崩解的肝胰腺细胞增多,部分病变严重的肝胰腺管中肝胰腺细胞全部坏死崩解,基膜也出现崩解消失现象。临死河蟹的肝胰腺病变程度都处于病变后期。
2.2.3 心脏组织病理变化
心脏分为心外膜、心内膜和心肌层三层结构,心外膜和心内膜主要由结缔组织构成,而较厚的心肌层有结缔组织和大量的心肌纤维,心肌纤维有分支,整齐而松散地排列,为横纹肌,其核椭圆形,位于肌膜边缘[13]。
病变前期:心脏部分区域出现水肿现象,心肌纤维之间间隙增大,但这些水肿部位的心肌纤维横纹清晰,心肌纤维和核无异常现象(图2-1)。病变中期:水肿区域部分心肌纤维横纹逐渐模糊不清,但尚未消失,细胞核有轻微的固缩现象(图2-2)。病变后期:病变进一步发展,部分心肌纤维横纹消失,心肌纤维出现坏死现象,坏死的心肌纤维呈强嗜伊红性,成一片无结构物质,细胞核固缩(图2-3)。实验7 d时,0.005~0.08 μg·L-1各组心脏组织无病理变化;0.16 μg·L-1以上的浓度组心脏处于前期的病理变化,局部心肌纤维出现水肿现象。14 d时,0.005 μg·L-1及以上各组为前期病理变化,浓度越高,水肿现象越严重,但横纹仍清晰。21 d时,0.04 μg·L-1及以下各组为前期病理变化,0.08 μg·L-1组和0.16 μg·L-1组表现为病变中期,部分心肌纤维横纹模糊不清;0.32 μg·L-1浓度组和临死的河蟹心脏病变均为后期病理变化,部分心肌纤维出现横纹消失和坏死。
2.2.4 肠组织病理变化
河蟹肠结构从内到外由黏膜层、黏膜下层、肌层和外膜四部分组成,单层柱状上皮细胞构成黏膜层,胞核位于基部,黏膜下层和肌层不发达,较薄,外膜为浆膜,由疏松结缔组织构成[14]。
肠病理变化主要发生在肠的黏膜层,病变前期:部分肠黏膜层柱状上皮细胞出现空泡变性现象(图2-4)。病变中期:黏膜层少数上皮细胞细胞膜破裂崩解,出现坏死现象(图2-5)。病变后期:黏膜层上皮细胞坏死程度进一步加剧,较多上皮细胞出现坏死,坏死崩解的细胞脱落进入肠腔(图2-6)。实验7 d时,0.005~0.32 μg·L-1各组的肠组织未发生病理变化。14 d时,0.08 μg·L-1以下浓度各组未出现病变;0.16 μg·L-1组和0.32 μg·L-1组肠处于病变前期,黏膜层上皮细胞出现空泡变性。21 d时,0.005 μg·L-1至0.02 μg·L-1各组未见明显病理性变化;0.04 μg·L-1组出现空泡变性的病变前期;0.08 μg·L-1和0.16 μg·L-1组为中期病变,少数上皮细胞出现坏死;0.32 μg·L-1组和临死河蟹的肠均为后期病变,较多的黏膜层上皮细胞出现坏死崩解脱落入肠腔。
2.2.5 肌肉和神经团
不同溴氰菊酯浓度下河蟹的肌肉和神经团均未发生组织病理变化,肌肉组织中的肌纤维横纹清晰,无变性和坏死病理现象,神经团中的神经细胞结构完整,胞浆中尼氏小体未出现异常。
3 讨论(Discussion)
3.1 溴氰菊酯对养殖水生经济动物的急性毒性
养殖的水生经济动物包括高等的脊椎动物鱼类和低等的无脊椎动物虾蟹类,溴氰菊酯对不同种类水生经济动物毒性存在很大的差异,溴氰菊酯对脊椎动物鱼类鲫鱼(Carassiusauratus)的96 h-LC50为15.00 μg·L-1 [15]、罗非鱼(Oreochromisniloticus)为14.50 μg·L-1 [16]、花鳗鲡(Anguillamarmorata)为7.67 μg·L-1 [17]、淡水鲶鱼(Clariasgariepinus)为4.00 μg·L-1 [18]和镜鲤(Cyprinuscarpio)为1.65 μg·L-1 [19],而对无脊椎动物甲壳类远海梭子蟹(Portunuspelagicus)为0.11 μg·L-1、日本囊对虾(Marsupenaeusjaponicus)0.143 μg·L-1 [20]、克氏原螯虾(Procambarusclarkii)为0.0562 μg·L-1 [21],本实验溴氰菊酯对河蟹的96 h-LC50为0.905 μg·L-1,根据农药对鱼类的毒性分级:LC50≤0.1 mg·L-1为剧毒、0.1
3.2 溴氰菊酯对河蟹的组织损伤
溴氰菊酯对河蟹的组织损伤主要表现在鳃、肝胰腺、心脏和肠等组织器官,而对肌肉和神经团没有组织损伤的病理变化现象。组织病理变化是个动态的过程,为了更好地反映损伤程度,根据组织器官的损伤严重程度,分别将出现病理变化的组织器官划分为病变初期、中期和后期,但同一溴氰菊酯浓度组中河蟹病理变化不是完全同步的,其组织器官会出现相邻病变时期的组织病理,相同病变时期内也会存在病变面积等不同的损伤程度。在溴氰菊酯药浴第7天,除无病理变化的溴氰菊酯浓度组外,其他所有溴氰菊酯浓度组的组织病理变化主要是水肿或空泡变性,这些病理变化是可逆的病理过程[27],此时消除溴氰菊酯的药浴作用后,河蟹可以从这样的轻度毒性作用中完全恢复。最早出现坏死的不可逆病理变化是在第14天的0.005 μg·L-1组,肝胰腺细胞坏死,即使此时消除溴氰菊酯的药浴作用,河蟹坏死组织已不能恢复,随着溴氰菊酯药浴浓度和时间的增加,坏死的组织器官增多,坏死细胞数量增加,影响组织器官的功能,最终可导致河蟹死亡。
拟除虫菊酯类具有高亲脂性,鱼鳃对其具有高吸收率,对鱼的毒性作用较为强烈[28],溴氰菊酯属于拟除虫菊酯类,具有类似的特性,溴氰菊酯对食蚊鱼(Gambusiaaffinis)鳃的毒性作用主要为引起鳃小片上皮细胞肥大、增生和鳃小片融合,进一步发展造成坏死,鳃毛细血管扩张成动脉瘤的病理变化[29]。由于河蟹鳃与鱼鳃组织结构等方面不完全相同,溴氰菊酯对河蟹鳃的组织病理存在一定的差异性,河蟹鳃病理变化主要表现为鳃肿大,鳃腔增大,出现大量分泌物后鳃腔萎缩至闭合,上皮细胞坏死。在水环境生活的河蟹,其鳃是水体中外源物的第一靶器官,水体中的溴氰菊酯药物最先接触到的是鳃组织,甲壳类鳃功能之一是进行离子运输调节维持体内渗透压稳定,由鳃表面的上皮组织完成[30],在溴氰菊酯的作用下,河蟹鳃失去调节维持渗透压应有的功能,鳃腔外的水分进入鳃腔,而出现鳃肿大,鳃腔膨大,随着溴氰菊酯浓度和作用时间的增加,上皮细胞进一步受损,鳃腔内的物质渗出,渗出物逐渐增多,使得鳃腔逐渐缩小,腔中物质浓缩而逐渐呈现强嗜伊红性,上皮细胞坏死的病理变化。鳃另一个主要功能是呼吸作用,水流通过鳃小叶上皮细胞进行氧气的交换,河蟹鳃水肿和分泌物增多等轻度病理变化可影响鳃的呼吸,鳃腔闭合和上皮细胞坏死等重度病理变化可导致鳃无法呼吸危及生命。
相对其他拟除虫菊酯类,溴氰菊酯由于在鱼体内不能完全代谢而不能快速解毒,会在鱼体内残留,尤其在脂肪组织中最易积累和残留,因此它对鱼类是高毒性的[31],河蟹肝胰腺由密集排列的肝胰腺管构成,肝胰腺管由单层肝胰腺细胞组成,河蟹肝胰腺是脂类储存器官[32],本实验的溴氰菊酯同样可在河蟹肝胰腺细胞中积累和残留,最终超出其自身机体的保护和解毒能力,从而对肝胰腺细胞产生毒性作用,在溴氰菊酯不同药浴时间和不同浓度作用下,河蟹肝胰腺产生不同程度的病理变化,影响肝胰腺的营养调控等其他代谢功能。溴氰菊酯对食蚊鱼肝脏影响主要为肝细胞肥大,核固缩、脂肪变性,局部坏死的组织病理变化[29],由于鱼肝脏与河蟹肝胰腺在组织结构上的差别,出现的病理变化也存在差异。
溴氰菊酯通过影响心脏的Na+通道,使虹鳟鱼心脏心力衰竭和心律不齐,对心脏产生毒性作用[33],溴氰菊酯作用下河蟹心脏的心肌纤维出现水肿到心肌纤维横纹模糊,最后出现部分心肌纤维横纹消失和坏死,这些不同程度的组织病理变化,可使其心脏心力衰竭,影响河蟹心律调节等功能,可导致河蟹血淋巴液循环障碍。
在21 d的整个实验过程中,一定量的溴氰菊酯可通过河蟹口和胃进入肠道,对河蟹肠道产生损伤作用,病理变化主要出现在由单层柱状上皮细胞组成的黏膜层,上皮细胞出现空泡变性,到少量上皮细胞坏死和较多坏死细胞脱落进入肠腔的过程,这些病理变化与溴氰菊酯引起食蚊鱼肠道的组织病理变化有差别,溴氰菊酯药浴后食蚊鱼肠道主要表现为单核白细胞和嗜酸性粒细胞的浸润,在0.50 μg·L-1溴氰菊酯浓度下药浴30 d时食蚊鱼肠黏膜层才出现上皮细胞坏死现象[29]。河蟹肠的损伤影响其对食物摄入、消化和吸收,这与0.08、0.16、0.32 μg·L-1各浓度组的河蟹在毒性实验过程中出现不摄食的症状相吻合。
近几年,江苏兴化等周边地区养殖的河蟹大面积暴发了水瘪子病,河蟹水瘪子病的组织病理变化[13]与本实验溴氰菊酯引起的河蟹组织病理变化有较大的区别。首先除心脏病变相似外,两者肝胰腺和鳃组织病理变化不同,水瘪子病的肝胰腺以肝胰腺管萎缩和肝胰腺细胞坏死后肝胰腺管基膜出现皱缩呈波浪状为主的病理变化,尤其到疾病后期肝胰腺萎缩和坏死,肝胰腺细胞大量减少,而溴氰菊酯作用下只有少量肝胰腺管坏死,坏死的肝胰腺管无基膜皱缩现象,水瘪子病的河蟹鳃无明显的渗出现象,溴氰菊酯作用下河蟹鳃出现大量渗出物并逐渐增多。其次水瘪子病河蟹肌肉组织有严重坏死的病理变化,无肠的病变,而溴氰菊酯作用下的河蟹相反,无肌肉组织的病变,而肠出现肠黏膜层上皮细胞从变性到坏死的现象。因此水瘪子病的组织病理与溴氰菊酯引起的组织病理有很大不同,具有各自的特点,从组织病理学的角度推测水瘪子病的病因与溴氰菊酯不相关或不完全相关,但水瘪子病病程较长,一般有2~3个月以上[34],而本试验中溴氰菊酯引起的组织病理变化是药物作用21 d的实验结果,更长时间的药物作用是否会出现与水瘪子病相同的病理变化,有待于进一步的研究证实。
