多壁碳纳米管对铜绿微囊藻生长及生理特征的影响
2018-03-16王应军李娜罗潇宇廖鑫
王应军,李娜,罗潇宇,廖鑫
1. 四川农业大学环境学院,成都 611130 2. 四川雅安经济开发区规划建设和安全生产环境保护局,雅安 625000
碳纳米管(carbon nanotubes, CNTs)是一种处于纳米尺度并具有新型结构的晶体碳,是一种外围由数十层的石墨烯片层架构而成的中空碳管[1]。它通常被分为两大类:单壁碳纳米管(single-walled carbon nanotubes, SWCNTs)和多壁碳纳米管(multi-walled carbon nanotubes, MWCNTs)[2]。碳纳米管拥有其他材料所无法达到的特殊性能,比如力学性能、导热性能、导电性能以及化学和电化学性能等。这些卓越的材料性能正是建立在其本身所具有的独特构造,使其具有颇为广阔的研究价值和发展前景。但是,CNTs的生态系统潜在富集效应、生物大分子的复合结合性、多种污染物联合作用的复杂性、迁移和扩散的传播性会使其在更为广阔的生境范围中引起更加显著的环境效应[3]。
单细胞藻类作为水环境中的初级生产者,其生产量与种类的多样性会直接影响到水生生态系统的结构和功能,并对生态系统的平衡和稳定发挥着关键性作用[4]。纳米材料在单细胞藻类体内的积累和毒性,可以间接地影响到整个水生态系统的平衡。CNTs具有十分独特的材料性质,在水体中的生态毒理效应与其本身的环境行为密不可分[5]。但截至目前,CNTs对水生藻类植物的相关研究仍相对匮乏,大量的基础性研究工作亟待开展[6]。已有少量研究报道CNTs可以对水生藻类植物造成毒害作用。多壁碳纳米管在经过适当处理后可以显著抑制和影响杜氏盐藻的生长,干扰胞内光合作用PSII反应进程,影响胞内抗氧化酶的活性状态。这表明CNTs的确可以对藻类植物的生长产生明显的毒性抑制作用,并推测CNTs团聚形成的块体是导致其毒性效应的可能来源[7]。朱小山等[8]在用SWCNTs、MWCNTs和富勒烯处理斜生栅藻时,发现低浓度的碳管可以刺激藻的生长,推断藻的这种应激反应是其对抗环境胁迫和缓解CNTs毒性的可能原因。而Long等[9]和Mou等[10]在用不同浓度CNTs分别处理小球藻和斜生栅藻时同样得出了类似的实验结果,同时发现高浓度的CNTs可以严重干扰藻细胞内的生理生化状态。比如:通过妨碍藻细胞内的活性氧清除代谢平衡,造成严重的细胞氧化损伤;通过对藻细胞的刺穿、割裂以及物理损伤,促使细胞凋亡;CNTs的团聚现象可能影响藻细胞的光和代谢,导致遮光效应,致使光合色素合成受阻;还包括与藻细胞内的生物大分子物质发生作用,使藻细胞中的蛋白质等的合成被抑制等。其他学者报告,SWCNTs可以强烈抑制莱茵衣藻与斜生栅藻的生长[11]。
当前,针对CNTs的相关环境行为以及生物效应的研究已有少量报道,但对水生藻类植物的毒性效应及其致毒机理的研究则非常有限。其次,CNTs在藻体内必将引发生物累积以及生物毒性效应,这将不可避免地对整个水生环境体系产生极为负面的作用和影响[9]。铜绿微囊藻(Microcystisaeruginosa)是我国内陆地区大型水体中的典型水华藻种,也是富营养化水体和水华暴发的典型环境标志物之一[12];相比于其他微藻,铜绿微囊藻更能适应氮磷比失调的水体、更能在实际水体环境中生存,故可做水生环境中初级生物的代表。本文采用标准的96 h短期毒性暴露试验方法,研究和评价MWCNTs单独胁迫条件下对铜绿微囊藻(Microcystisaeruginosa)的生物毒性,深入分析其致毒机理,旨在为评价纳米材料对水生环境中藻类的安全性和评估其对生物体的毒理学效应提供更加科学全面的数据支持,为全面地反映真实水环境中多种纳米材料共存的生态暴露风险提供参考依据,为开展生态环境风险评价及风险管理提供科学的理论指导。
1 材料与方法(Materials and methods)
1.1 实验材料
本实验所使用的MWCNTs购买自中国科学院成都有机化学有限公司,多壁碳纳米管粒径<8 nm,纯度大于95%,长度均为<30 μm。具体性质如表1所示。
取MWCNTs适量,均匀分散于盛有适量稀硝酸的250 mL锥形瓶中,静置48 h,去除制备MWCNTs过程中混进的一些金属离子。将悬浮液在10 000 r·min-1条件下离心10 min,弃上清液,用去离子水反复冲洗沉淀、离心,至上清液pH=7为止。处理后MWCNTs于烘箱内烘干,即得纯化MWCNTs。称取纯化MWCNTs适量于BG-11培养基中,搅拌24 h使其充分分散,制成浓度为5 mg·mL-1的MWCNTs悬浮液母液。待母液灭菌后封口保存,使用前将其超声分散30 min,以使MWCNTs均匀分散。BG11培养基配方如Wu等[13]在其文献中所述。
本实验选用的铜绿微囊藻(Microcystisaeruginosa)株系来自中国科学院水生生物研究所藻种库(FACHB)。严格按照无菌操作的要求,转接时藻液∶培养基体积比为1∶2。放置于光照培养箱中培养,温度为25 ℃,光照强度为2 000~2 500 lx,周期为12 h昼12 h夜,每天定时摇瓶3次。培养2周后观察,如生长较好,再进行转接,比例为1∶5至1∶6,反复接种,使之处于对数生长期。
1.2 实验方法
本文参照OECD 201藻类生长抑制实验方法,将铜绿微囊藻接种在灭菌后的三角锥形瓶中,其初始接种藻密度为10×105cells·mL-1,再分别加入定量MWCNTs母液,使最终实验浓度为0、0.1、0.5、1、5、10、50和100 mg·L-1,在光照度3 000~4 000 lux、光周期12 h Light/12 h Dark的光照培养箱中暴露96 h。每组实验设3平行。
1.2.1 藻细胞生长量的测定
藻细胞生长量的测定依据李娟等[14]的方法并进行改进:取一定量的实验藻液,用分光光度计测定其在680 nm处吸光度值,扣除含有相同浓度的纳米碳管悬浮液在680 nm的吸光度值,通过查阅标准曲线获取实验样品的藻细胞密度。
1.2.2 叶绿素a含量的测定
取3 mL试验样品,8 000 r·min-1离心3 min。倒掉上清液,加入同体积的丙酮(80%)。放入4 ℃冰箱中下静置24 h。离心后取样于663 nm和450 nm处测定吸光度。依据下式进行计算:
Chl-a mg·L-1=12.72×OD663-2.7×OD450
1.2.3 藻细胞组织液的提取
取20 mL藻样,8 000 r·min-1条件下离心10 min收集藻细胞。用等渗缓冲液(PBS,0.1 mol·L-1, pH=7.4)反复离心并收集藻细胞数次。加入缓冲液PBS并使用液氮研磨,使藻细胞充分破碎。之后转入离心管中定容至3 mL,即藻细胞组织液提取完成。该液用于超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、丙二醛(MDA)和蛋白质含量的测定。
1.2.4 组织液指标的测定
SOD、POD、CAT活力,MDA、蛋白质含量均采用试剂盒测定,测试方法依次为黄嘌呤氧化酶法(羟胺法)[15]、比色法[16]、可见光法[17]、硫代巴比妥酸(TBA)法[18]、考马斯亮蓝法[19]。以上试剂盒均购置于南京建成生物工程研究所。
1.2.5 数据处理
本实验结果采用Office Excel 2010软件进行处理和绘图,使用SPSS 20.0软件进行差异显著性分析及t检验,置信水平选取0.95,当P>0.05代表差异不显著,P<0.05代表差异显著。
2 结果(Results)
2.1 MWCNTs对藻生长的影响
在相同的时间内,低浓度(0.1 mg·L-1和0.5 mg·L-1)处理组藻细胞数明显高于空白对照组(0 mg·L-1),且随着时间的延长而明显升高。96 h时,0.1 mg·L-1处理组藻细胞数显著高于72 h处理组(P<0.05),而0.1 mg·L-1和0.5 mg·L-1各处理组在相同时间内藻细胞数差异并不显著(P>0.05)。在前72 h内,各中浓度(1.0 mg·L-1, 5.0 mg·L-1和10 mg·L-1)处理组与空白对照组(0 mg·L-1)生长状况相似,相同时间内并无显著差异(P>0.05)。而96 h后,各处理组藻细胞数开始逐渐下降。在相同的时间内,10 mg·L-1处理组藻细胞数显著低于空白对照组(0 mg·L-1)18.2%(P<0.05),表明此时藻细胞受到了生长抑制,而5.0 mg·L-1处理组却略微升高,比1.0 mg·L-1处理组略高10.1%(P>0.05)。当培养至96 h,大量纳米管悬浮液由于凝聚作用慢慢沉降,培养环境中的碳管浓度逐渐变小,这对铜绿微囊藻的生长自然具有一定的刺激作用。当胁迫浓度为高浓度(50 mg·L-1和100 mg·L-1)时,藻细胞生长全程受到抑制。10 mg·L-1、50 mg·L-1和100 mg·L-1各处理浓度在96 h的抑制率分别是18.18%、35.45%和71.68%。经线型拟合,其规律符合方程y=0.209x-0.424,R2=0.87,拟合效果良好。

表1 多壁碳纳米管性质Table 1 The properties of multi-walled carbon nanotubes
注:CVD表示化学气相沉积法。
Note: CVD stands for chemical vapor deposition; MWCNT stands for multi-walled carbon nanotubes.
2.2 MWCNTs对叶绿素a含量的影响
光合色素是藻类进行光合作用重要的组成部分,是一类能够反应藻类生长过程中利用光能力的重要物质。藻类植物通过光合作用,把二氧化碳和水转化成储存着的能量和有机物,并且在这个化学过程中释放出氧气,供其他生物呼吸。因而,它也是决定藻细胞进行生长和繁殖最重要的生理基础。光合色素含量的高低不仅可以用来指示藻细胞的生长状况,还能够暗示藻体受到环境胁迫的程度。如图2所示,96 h时不同浓度的MWCNTs对铜绿微囊藻叶绿素a含量的影响,与藻细胞生长变化趋势基本表现一致。从图中可以看出,在低浓度(0.1 mg·L-1、0.5 mg·L-1和1.0 mg·L-1)处理组,各处理组内叶绿素a含量差异显著(P<0.05)。与空白对照组相比,MWCNTs处理组各叶绿素a含量基本保持一致,并有略微升高。其中0.5 mg·L-1处理组叶绿素a含量高达52.02 mg·L-1,比对照组升高9.61%,达到最大值。这表明低浓度MWCNTs处理刺激了蓝藻中叶绿素a的合成。随着浓度的进一步升高,在中浓度(1.0 mg·L-1、5.0 mg·L-1和10.0 mg·L-1)处理组范围内,各处理的的叶绿素含量开始大幅下降,明显低于空白对照组。当处理浓度到达50 mg·L-1和100 mg·L-1时,各处理组叶绿素a合成受到严重抑制,其抑制率竟高达85.1%。而相同浓度内,各组含量差异并不显著(P>0.05),并随浓度升高无显著变化(P>0.05)。这表明在高浓度MWCNTs的环境胁迫下,蓝藻生长状况恶劣。胞内生理代谢紊乱,藻细胞内叶绿素a合成严重受阻,藻细胞内光合作用受到严重伤害。
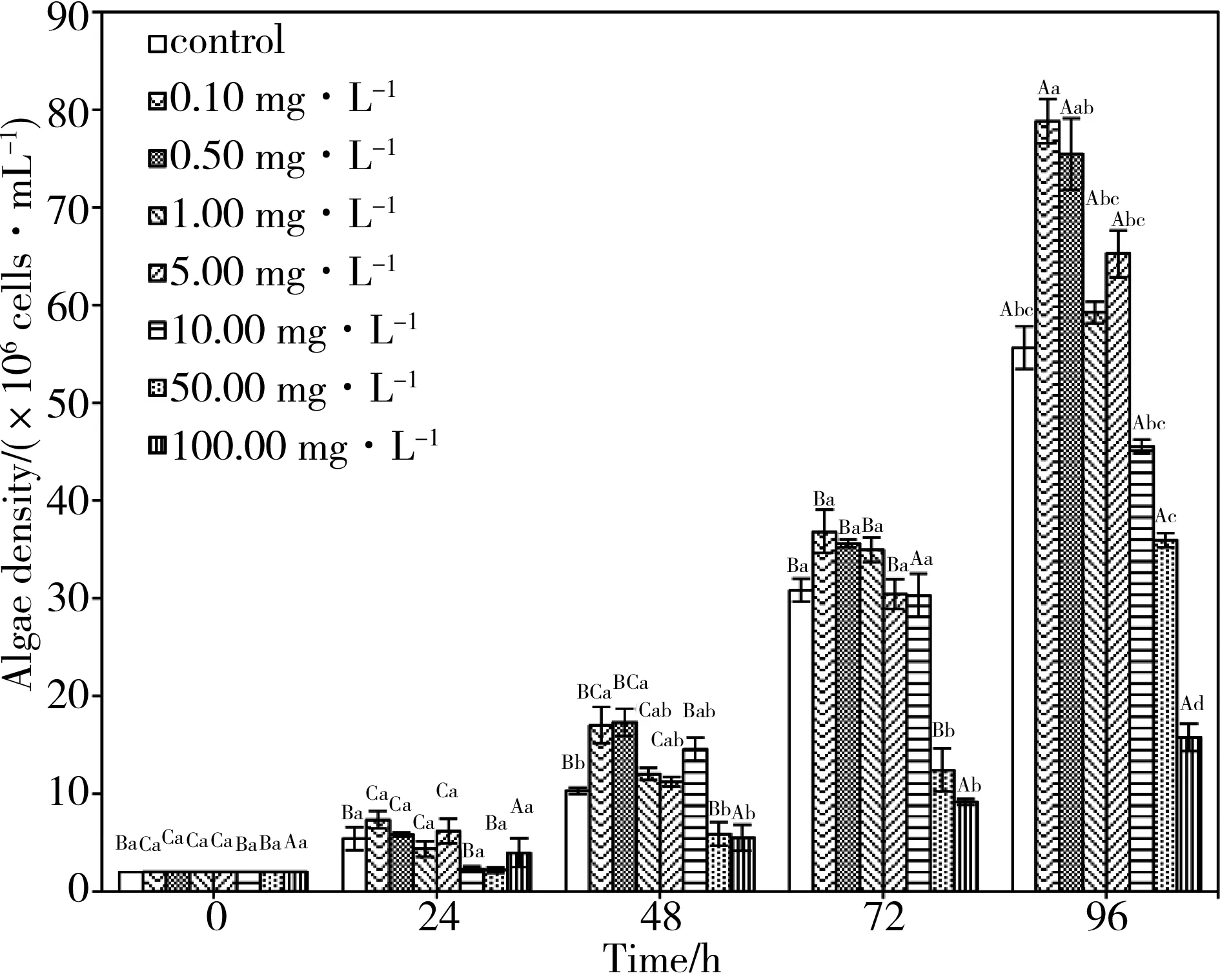
图1 不同浓度的碳纳米管对铜绿微囊藻生长的影响注:小写字母相同,代表相同时间内,数据差异不显著;小写字母不同,代表相同时间内,数据差异显著;大写字母相同, 表示相同浓度条件下,不同时间组间差异不显著;大写字母不同,表示相同浓度条件下,不同时间组间差异显著。Fig. 1 Effects of MWCNTs on the growth of M. aeruginosaNote: The same lowercase letters, representing the data difference is not significant at the same time; different lowercase, representing the data significant differences at the same time; the same capital letters, indicating that significant differences were not observed in different time groups under the same dose level; different capital letters, indicating that significant differences were observed in different time groups under the same dose level.

图2 不同浓度的多壁碳纳米管对铜绿微囊藻 叶绿素a含量的影响注:小写字母相同,表示不同浓度组间差异不显著;小写字母不同, 表示不同浓度组间差异显著。Fig. 2 Effects of MWCNTs on chlorophyll a content of M. aeruginosaNote: The same lowercase letters indicate there is no significant difference among different concentration groups; different lowercase letters indicate there are significant differences among different concentration groups.

图3 不同浓度的多壁碳纳米管对铜绿微囊藻超氧化物歧化酶(SOD)活性的影响注:小写字母相同,表示不同浓度组间差异不显著; 小写字母不同,表示不同浓度组间差异显著。Fig. 3 Effects of MWCNTs on superoxide dismutase (SOD) activity of M. aeruginosaNote: The same lowercase letters indicate there is no significant difference among different concentration groups; different lowercase letters indicate there are significant differences among different concentration groups.

图4 不同浓度的多壁碳纳米管对铜绿微囊藻 过氧化物酶(POD)活性的影响注:小写字母相同,表示不同浓度组间差异不显著; 小写字母不同,表示不同浓度组间差异显著。Fig. 4 Effects of MWCNTs on peroxidase (POD) activity of M. aeruginosaNote: The same lowercase letters indicate there is no significant difference among different concentration groups; different lowercase letters indicate there are significant differences among different concentration groups.
2.3 MWCNTs对超氧化物歧化酶(SOD)活性的影响
藻类组织细胞中含有的活性氧(ROS),比如超氧阴离子等超氧化物,能够对藻细胞产生氧化威胁或氧化损伤,并干扰藻细胞正常的生命活动。而作为发挥关键作用的抗氧化酶类(如SOD)能及时消灭这类有害的自由基,保护藻细胞免受氧化所伤。因而,藻体中的SOD活性的变化情况,可以指示CNTs对铜绿微囊藻造成的氧化压力的程度。如图3可知,低浓度(0.0~0.5 mg·L-1)处理组中,MWCNTs各处理组比对照组都有略微升高,在0.5 mg·L-1处达到最大值17.23 U·(108cells)-1,高于空白对照14.1%,但差异变化并不显著(P>0.05)。这说明,在低浓度范围内,CNTs对铜绿微囊藻产生了氧化胁迫,超氧阴离子等氧自由基开始大量生成。藻细胞为了免受氧化胁迫,诱导合成大量的抗氧化剂以清除超氧化物,这导致SOD合成量上升。而随着处理浓度继续增高,处理组SOD开始明显下降(P<0.05),当处理浓度到达至高浓度时(50 mg·L-1和100 mg·L-1),SOD活性受到严重抑制,各组间并无显著性差异(P>0.05)。这表明高浓度的MWCNTs会严重妨碍抗氧化酶系正常的功能。此时抗氧化体系遭受崩溃,藻细胞受到严重的氧化损伤效应。
2.4 MWCNTs对过氧化物酶(POD)活性的影响
藻细胞中的活性氧自由基除超氧化物外,还包括H2O2等过氧化物。藻细胞中这类自由基累积和代谢失衡,会对藻细胞中的细胞器或细胞膜等发生过氧化反应,造成胞内严重的氧化胁迫和氧化损伤。而POD可以及时清除这类活性氧,维持细胞内正常的代谢平衡。与SOD的作用相类似,藻细胞中POD活性的强弱可以间接反映胞内活性氧的代谢强度。如图4所示,藻细胞POD活性表现为先上升再下降的变化趋势。低浓度(<1.0 mg·L-1)处理时,藻细胞的POD活性都有小幅的升高。在0.10 mg·L-1处藻细胞的POD活性达到最大值,为1.77 U·(108cells)-1,与空白对照组相比差异并不显著(P>0.05)。这表明,在合适的低浓度范围内,MWCNTs可以诱导藻细胞中的过氧化氢等自由基含量上升,也有可能是因为此时大量的SOD参与抗氧化反应,导致超氧化物的歧化产物H2O2大量积累。藻细胞为了抵抗MWCNTs逐渐形成的氧化胁迫,分泌或合成更多的POD以去除过量的过氧化物。伴随着处理浓度继续升高,当超过1.0 mg·L-1时各组的POD活性均开始大幅下降。在中浓度(1.0~5.0 mg·L-1)处理范围内,各组与对照组相比基本一致(P>0.05)。这表明此时的藻细胞自身的生理代谢开始受到CNTs的影响,藻细胞遭受氧化胁迫,过氧化物自由基的清除速率开始降低。
2.5 MWCNTs对过氧化氢酶(CAT)活性的影响
与POD的作用类似,CAT也可以及时清除藻细胞内的H2O2,避免藻细胞遭受过氧化损伤。CAT活性的强弱可以在一定程度上指示藻细胞受到的氧化胁迫水平。如图5所示,MWCNTs浓度高于0.1 mg·L-1,CAT活性均随处理浓度的升高呈现持续降低的变化趋势,表明藻细胞持续受到H2O2的过氧化压力,且氧化胁迫程度随浓度的升高而逐步升高。低浓度时(<0.50 mg·L-1),各组CAT活性与对照组相比无显著性差异(P>0.05)。当处理浓度升高至中浓度范围内时(1.0~10.0 mg·L-1),各组的下降幅度开始加大。而高浓度(50~100 mg·L-1)时,各处理组CAT活性受到严重抑制,与POD活性的变化趋势相吻合,说明藻细胞受到的氧化伤害加剧,胞内抗氧化体系失衡或崩溃。

图5 不同浓度的多壁碳纳米管对铜绿微囊藻 过氧化氢酶(CAT)活性的影响注:小写字母相同,表示不同浓度组间差异不显著; 小写字母不同,表示不同浓度组间差异显著。Fig. 5 Effects of MWCNTs on catalase (CAT) activity of M. aeruginosaNote: The same lowercase letters indicate there is no significant difference among different concentration groups; different lowercase letters indicate there are significant differences among different concentration groups.
2.6 MWCNTs对丙二醛(MDA)含量的影响
当藻细胞中的ROS等物质攻击细胞器膜和细胞质膜,会与其发生脂质过氧化反应,使细胞膜正常功能被破坏。产生的脂质过氧化产物——丙二醛又可与其他生物大分子发生作用,比如和蛋白质发生交联反应使其功能丧失等,严重干扰细胞内的正常生理代谢进程。因而MDA含量的多少可以反映藻细胞受到CNTs的氧化损伤程度。由图6可知,各处理组的MDA含量均随处理浓度的升高而明显上升。在低浓度(0.1 mg·L-1和0.5 mg·L-1)时,各组MDA含量与对照组相比无显著性差异(P>0.05)。这表明低浓度CNTs造成的氧化胁迫比较轻微,藻细胞通过及时清除细胞内的各种活性氧物质,使细胞生理代谢水平运转正常,尚未遭受严重的氧化伤害。当处理浓度超过50.0 mg·L-1时,各组含量基本维持不变,此时MDA含量约为空白对照组含量的4倍左右(P<0.05)。这表明活性氧累积水平如此之高并超过了藻细胞所能承受的范围,通过加剧膜脂质过氧化伤害,藻细胞的正常生理代谢水平崩溃,藻体受到严重氧化损伤。MDA的实验结果意味着CNTs对藻细胞的生物毒性,与通过加剧胞内氧化胁迫伤害具有十分紧密的联系。

图6 不同浓度的多壁碳纳米管对铜绿微囊藻 丙二醛(MDA)含量的影响注:小写字母相同,表示不同浓度组间差异不显著; 小写字母不同,表示不同浓度组间差异显著。Fig. 6 Effects of MWCNTs on malondialdehyde (MDA) content of M. aeruginosa Note: The same lowercase letters indicate there is no significant difference among different concentration groups; different lowercase letters indicate there are significant differences among different concentration groups.
2.7 MWCNTs对可溶性蛋白含量的影响
蛋白质是组成生命有机体的物质基础之一,是维持植物细胞开展正常生命活动的重要生物大分子。藻细胞内蛋白质含量的高低可以揭示其受到纳米碳管的胁迫状况。如下表2所示,MWCNTs实验组铜绿微囊藻细胞内可溶性蛋白的含量,呈现出先上升后下降的变化走向,在低浓度(0.1 mg·L-1和0.5 mg·L-1)时,各处理组与空白对照组相比,蛋白质含量无明显差异(P>0.05)。之后随着处理浓度升高至中浓度(1.0~5.0 mg·L-1)范围,蛋白含量开始显著上升(P<0.05)。当5.0 mg·L-1时,MWCNTs达到最大值55.48 μg·(106cells)-1,并显著高于空白对照组74.1%(P<0.05)。这说明中低浓度范围内,MWCNTs可以促进藻细胞内相关蛋白质的合成,以抵抗纳米碳管带来的环境胁迫。而随着处理浓度的进一步升高,当处理浓度超过10.0 mg·L-1时,蛋白含量均出现急剧下降。
3 讨论(Discussion)
本研究中,铜绿微囊藻在MWCNTs单一胁迫条件下表现出较好的“剂量-效应”关系。低浓度(0.1 mg·L-1和0.5 mg·L-1)的处理并没有对其生长产生抑制效应,相反表现出刺激生长的现象。Mou等[10]在用不同类型不同长度的CNTs处理斜生栅藻(S.obliquus)时,同样发现暴露浓度处于一定的低浓度范围时,CNTs会对斜生栅藻的生长产生刺激作用。这种刺激反应很可能是当藻细胞受到CNTs胁迫时,藻细胞内某些酶活性提高,同时胞内相关代谢加强,为了适应和对抗胁迫环境,藻体促进并提高了自身的繁殖能力和代谢水平[20]。本研究中当处理浓度为高浓度(50 mg·L-1、100 mg·L-1)时,所有藻细胞生长都受到强烈的抑制作用。这很有可能是因为培养基中大量的CNTs团聚沉降,大量藻细胞聚集,使得藻细胞间竞争以及生存环境恶化。同时大量的处于纳米尺度级别的CNTs还可能会刺穿团聚的藻细胞,造成细胞变形、质壁分离、细胞质外流和细胞凋亡等接触物理损伤[21]。这又进一步阻碍和破坏藻细胞内正常的生理生化代等谢过程,最终严重抑制了藻细胞的生长。

表2 多壁碳纳米管对铜绿微囊藻类蛋白质含量的影响Table 2 Effects of MWCNTs on protein content of M. aeruginosa
注:小写字母相同,表示不同浓度组间差异不显著;小写字母不同,表示不同浓度组间差异显著。
Note: The same lowercase letters indicate there is no significant difference among different concentration groups; different lowercase letters indicate there are significant differences among different concentration groups.
光合作用是藻类植物开展生命活动必不可少的生理基础,藻类植物通过光合作用,吸收并转化光能为化学能,从而用于自身的生长和繁殖。叶绿素a可以吸收和转化光能为电能,是最为重要的一种光合色素,叶绿素a的含量多少可以直接衡量藻细胞光合作用的效率,还可以间接指示藻细胞生长和生命活动的状态。有研究表明,CNTs在植物叶绿体内会被吸附、聚集并被转运至质膜表面,在与叶绿体的相互接触过程中,光合活性会被增高数倍[22];牟凤伟[23]在研究CNTs对斜生栅藻(S.obliquus)生理影响时也发现,中浓度CNTs会使藻细胞的光合色素含量有所升高。而本研究同样得出了相似的结果:低浓度CNTs会使叶绿素a的含量有所升高。这很有可能是低浓度污染物胁迫条件下,蓝藻细胞做出的应激反应,通过提高光合作用过程中电子传递阈值,从而积极影响电子转运,并最终促进了电子传递效率的提高,还有可能是藻细胞的抗氧化防御体系受到影响[24],即通过加强藻细胞内的光合作用以及活性氧的清除,来抵御外界环境胁迫。这与之前关于铜绿微囊藻生长量的研究结果一致。高浓度的CNTs会严重抑制3种光合色素的合成,导致藻细胞的光合作用被严重干扰和破坏,这很有可能是由于CNTs本身的不透光性所引起的。当大量的碳纳米颗粒吸附并团聚在藻细胞周围时,藻细胞可利用的光能急剧减弱,即CNTs的遮光效应严重阻碍了藻细胞的光合作用。碳纳米颗粒由于其本身处于纳米尺度的原因,具有相当复杂的结合特性。它也可能会直接进入藻细胞内,割裂诸如叶绿体等细胞器造成机械损伤,细胞被刺穿或分解,进而阻碍了相关光合色素的合成[25]。Long等[9]在用CNTs处理小球藻时同样发现,CNTs的遮光效应所引起的藻细胞的毒性可以高达总毒性的五分之一左右,藻因为不能进行光合作用,导致其无法正常的生长和繁殖。由于CNTs还可以在水中会产生活性氧,当大量的自由基进攻藻细胞以及叶绿体时,膜系统将会受到严重的氧化伤害,这也会导致其藻细胞的生理代谢功能紊乱,藻细胞凋亡机制启动,导致藻体开始程序性死亡,引发叶绿体结构受损严重,甚至解体,最终光合色素被降解[26]。
当藻体遭受外界环境中的毒物胁迫时,藻细胞中会产生各种氧自由基,包括超氧阴离子、过氧化氢、羟自由基等,它们会对藻体产生相当严重的氧化胁迫和损伤。而藻细胞为了维持正常的生理代谢环境,自身具有一套完整的抗氧化防御体系,使得细胞内的各种活性氧自由基的发生与消灭通常处于动态稳定中。藻细胞中的抗氧化系统一般包含酶系和非酶系统等两大类抗氧化物质。而SOD、POD和CAT作为抗氧化酶系中的关键酶类,可以通力协作及时消灭细胞中的O2-、H2O2,在维持细胞自由基代谢平衡,避免遭受氧化损伤等方面发挥着巨大的作用[14]。在本研究中,低浓度的CNTs引起SOD、POD等抗氧化酶的升高,表明藻细胞体内有ROS累积和升高。为了对抗CNTs造成的轻微环境胁迫,细胞内的活性氧清除代谢水平也得以提高,这可以理解成藻体的一种氧化应激反应,与藻的生长刺激效应,光合水平的增高等生理代谢过程具有紧密的联系。与此同时,由于自身独特的光反应特性,CNTs在水体环境中可以直接产生活性氧。当这些ROS裹挟着纳米碳粒,既可以通过与细胞膜的直接物理接触发生作用,也能够在水体直接攻击藻细胞而施加更为严重的氧化压力。当ROS的生成量和攻击程度超过了藻细胞的可以正常处理的阈值范围时,CAT的活性开始明显下降。细胞中原先的超氧化物被SOD陆续催化,并反应生成大量的H2O2。由于抗氧化体系逐渐崩溃,过氧化物无法及时清除而开始大量积累。最终,过量的H2O2致使细胞膜发生脂质过氧化反应,引发膜脂质过氧化产物MDA的含量骤然上升,藻细胞结构严重受损,膜功能运作严重受阻,藻细胞正常的生理代谢活动被严重干扰和破坏。有研究报道,当藻细胞被CNTs穿透、割裂、刺穿,造成物理接触损伤时,同样可能引起氧化损伤[27]。
蛋白质是植物体关键的物质结构基础,是生命体细胞结构重建与细胞间信号沟通的重要的生物大分子,参与藻细胞内各种生理活动。它还作为细胞中各类酶类物质重要组成成分而存在,因而对胞内的生命代谢进程所产生的影响和作用十分巨大。有研究报道,低浓度的CNTs能够引起藻细胞内可溶性蛋白含量应急性升高,而高浓度时则会严重抑制斜生栅藻胞内蛋白的合成[23]。本研究同样得出了类似的结果:当CNTs浓度低于5.0 mg·L-1时,铜绿微囊藻可溶性蛋白含量会随处理浓度的升高而明显升高。并且该现象与藻蓝蛋白含量的变化趋势具有一定的相关性。这很可能是中低浓度的CNTs促进了藻细胞内的各种合成代谢。通过刺激合成光合色素,提高了藻细胞开展光合作用的效率,同时也为分泌蛋白提供了必要的原料和能量。蛋白质含量的上升使藻细胞得以抵抗CNTs所引起的环境胁迫,而随着处理浓度的继续升高,蛋白含量急剧下降。这可能是因为藻体受到的氧化压力在不断增强,藻细胞内大量的活性氧自由基积累,并进攻氨基酸残基,蛋白水解酶被激活,最终导致蛋白质功能失活或者被降解[25]。与此同时,不断进入藻细胞的CNTs可能会与胞内生物大分子发生作用,可能会导致胞内蛋白的变性或水解。当胞内相关蛋白转录翻译的路径被干扰时,胞内蛋白的含量自然会下降,这些最终促使铜绿微囊藻的生长被强烈抑制。联合实验组的蛋白含量表现为不断下降,并未有上升的迹象,这可能与其CNTs的联合作用机制密切相关,但具体原因尚不清楚,仍需进一步的研究和论证。
