丙烯腈诱导大鼠脾的氧化应激和免疫系统响应
2018-03-16魏琳颜高霞魏倩张瑞萍石影郑爱薛红丽
魏琳颜,高霞,魏倩,张瑞萍,石影,郑爱,薛红丽
兰州大学公共卫生学院,兰州 730000
丙烯腈(acrylonitrile, ACN)是一种无色、苦杏仁味、易挥发的有机合成原料,在合成树脂、纤维、橡胶等高分子材料中被广泛使用[1]。ACN能通过消化道、呼吸道和皮肤等多种途径进入机体,引起多个器官的病理改变。单细胞凝胶电泳结果显示25 mg·kg-1ACN亚慢性染毒可使大鼠外周血淋巴细胞DNA损伤,表现为淋巴细胞DNA含量及尾长显著增加[2]。Li等[3]发现ACN可以通过破坏脂筏,引起B细胞淋巴瘤-10蛋白和脂筏分离,并通过抑制Ras-Raf-ERK通路引起免疫毒性。核转录因子κB(nuclear factor κB, NF-κB)是细胞核内重要的转录调节因子,不仅参与机体免疫、炎症、组织损伤修复和胚胎发育等过程,还可调节凋亡相关基因的表达[4]。NF-κB通常与其抑制剂IκB(inhibitor of nuclear factor kappa-B)结合,活性氧(reactive oxygen species, ROS)过量产生时激活IκB激酶复合物IKK(inhibitor of nuclear factor kappa-B kinase),进而降解IκB蛋白[5],然后NF-κB被游离出来而激活,激活后的NF-κB转移至细胞核发挥其生物活性作用[6],其激活程度也可以被抗氧化剂所调节[7]。NF-κB还受IκB的负反馈调节,因此NF-κB被活化后可以上调IκB的表达,这些新生成的IκB,一方面可与游离的NF-κB结合,重新使NF-κB的活性被抑制;另一方面,也可进入细胞核向外输出NF-κB的功能。研究发现,ROS激活的NF-κB信号通路能被N-乙酰半胱氨酸(N-acetylcysteine, NAC)特异性地抑制[8]。脾是人体最大的外周免疫器官,脾脏在机体免疫、抗感染、血液滤过等方面起着重要作用。目前关于ACN对其他脏器毒性和机制的研究较多,而脾的研究资料较为缺乏。故本实验通过对大鼠亚急性染毒ACN,观察大鼠脾损伤的一般毒性表现,测定炎性因子,检测NF-κB(p65)、IκB、p-IκB蛋白和基因表达水平变化,探讨氧化应激激活的NF-κB信号通路与ACN致大鼠脾损伤的关系,为进一步研究ACN的脾脏毒性机制提供依据。
1 材料与方法(Materials and methods)
1.1 主要试剂
ACN购于天津凯信(纯度>99%),NAC购于美国Amersco公司。p65兔抗大鼠一抗,IκB兔抗大鼠一抗,p-IκB兔抗大鼠一抗,HRP标记山羊抗鼠二抗均购于美国CST公司,GAPDH一抗购于美国SAB公司,HRP标记山羊抗兔二抗购于美国SAB公司。超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽(GSH)测试盒均购于南京建成生物工程研究所,BCA(bicinchoninic acid)蛋白定量试剂盒购于美国Thermo公司。白介素6(IL-6)、白介素1-β(IL-1β)、肿瘤坏死因子-α(TNF-α)试剂盒均购于Elabscience公司。
1.2 实验动物及分组
SPF级健康成年SD雄性大鼠60只,体重180~220 g,购于甘肃中医药大学SPF级实验动物中心(实验动物质量合格证编号SCXK(甘)2015-0002)。随机分为5组,每组12只,饲养于兰州大学公共卫生学院实验中心(实验设施合格证编号SYXK(甘)2015-0005),自由进食及饮水,适应性饲养1周后,以11.5(低剂量组)、23.0(中剂量组)、46.0(高剂量组) mg·kg-1ACN、46.0 mg·kg-1ACN + 300 mg·kg-1NAC(NAC干预组)灌胃,NAC干预组NAC灌胃30 min后再灌ACN,对照组大鼠给予玉米油,1次/天,6天/周。染毒剂量主要依据本团队前期研究结果和Abdel Naim[9]的研究设定,连续灌胃4周后处死大鼠。
1.3 脾脏器系数测定
末次染毒结束后,次日称重。乙醚麻醉处死大鼠,分离大鼠脾并置于0.9%生理盐水中,冲洗干净,滤纸拭干后称重并记录。
1.4 氧化还原相关酶及炎性因子的测定
按照脾组织质量(g)∶匀浆介质(mL) =1∶9的质量体积比加入适量预冷的0.9%的生理盐水,冰浴研磨制成10%脾组织匀浆,转速2 500 r·min-1离心10 min,取上清,严格按试剂盒说明书要求检测SOD、MDA、GSH-Px、GSH、过氧化氢酶(CAT)、总抗氧化能力(T-AOC)、BCA、IL-6、IL-1β、TNF-α水平。
1.5 Western Blot检测脾组织NF-κB、IκB、p-IκB蛋白表达水平
每组随机选取6只大鼠脾组织,称取约90 mg,按组织质量(mg)∶RIPA裂解液(mL)=1∶10的质量体积比加入RIPA(radio immunoprecipitation assay)裂解液,再按照PMSF(mL)∶RIPA(mL)=1∶100的体积比加入相应体积的PMSF(phenylmethanesulfonyl fluoride),冰浴研磨,直至组织充分裂解。裂解后的样品4 ℃、12 000 r·min-1,离心15 min,取上清,BCA法测定总蛋白,并按照比例加入RIPA稀释液和5 ×SDS(sodium dodecyl sulfate)上样缓冲液,沸水浴变性5 min,制得蛋白样品。每条泳道加入60 μg蛋白样品进行SDS-PAGE电泳,根据彩虹marker标识的目标蛋白位置将目标条带转移至PVDF(polyvinylidene fluoride)膜,用含5%脱脂奶粉的TBST(Tris-buffered saline containing 0.1% Tween)室温封闭1~2 h,放入GAPDH(1:5 000)、NF-κB (1:1 000)、IκB(1:1 000)、p-IκB(1:1 000)特异性抗体中4 ℃水平摇床过夜,TBST漂洗后室温二抗(1:2 000)孵育2 h。加适量发光液后凝胶成像仪曝光,保存蛋白条带,采用Image J图像分析软件分析蛋白条带灰度值。目的蛋白相对表达量 =目的蛋白条带灰度值/内参蛋白条带灰度值。
1.6 Real Time PCR反应检测脾组织mRNA表达水平
每组随机选取4只大鼠脾组织,取100 mg左右进行Trizol一步法提取组织总RNA,反转录后得cDNA,以cDNA为模板,采用RT-PCR反应检测大鼠脾组织(β-actin、NF-κB、IκB)mRNA相对表达水平。采用25 μL扩增反应体系,进行三步法PCR扩增反应,其中,第一步:预变性,95 ℃、30 s,1个循环;第二步:共50个循环,95 ℃、5 s(变性),55 ℃、30 s(退火),72 ℃、30 s(延伸);第三步:熔解反应,60 ℃、15 s,71个循环。引物设计表见表1。
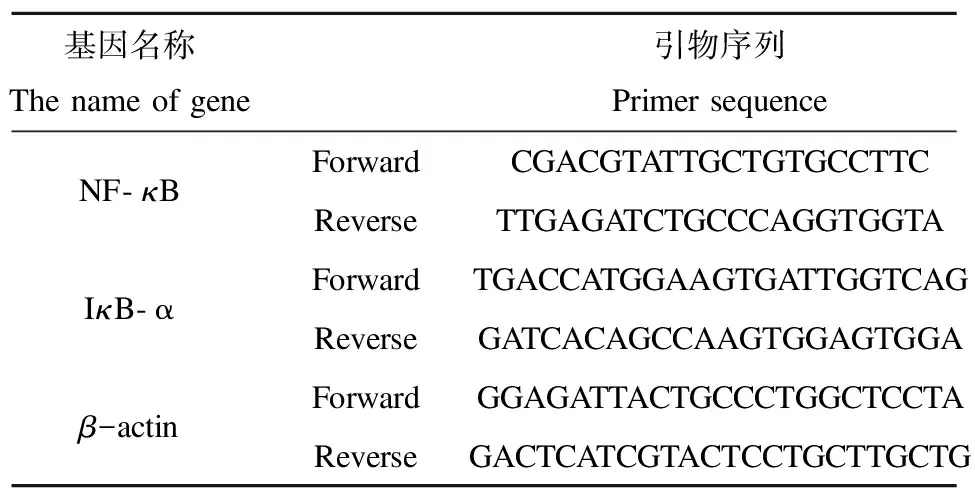
表1 引物序列Table 1 Primer sequence
1.7 统计分析
2 结果(Results)
2.1 大鼠脾湿重及脏器系数变化
单因素方差分析结果显示,与对照组比较,ACN低、中剂量组大鼠脾湿重明显降低(P<0.05);ACN中剂量组大鼠脾脏器系数降低(P<0.05)。与高剂量组比较,NAC组大鼠脾湿重、脏器系数增加,但差异无统计学意义(P>0.05)。
2.2 大鼠脾组织脂质过氧化指标变化
与对照组相比,ACN中、高剂量组大鼠脾组织MDA含量增加(P<0.05);高剂量组大鼠SOD、GSH-Px活力显著增加(P<0.05);低剂量组大鼠CAT活力显著降低,高剂量组大鼠CAT活力显著增加(P<0.05);低剂量组大鼠GSH含量、T-AOC活力显著降低(P<0.05)。与高剂量组比较,NAC组大鼠MDA含量、SOD活性、CAT活性、GSH含量、GSH-Px活性、T-AOC含量显著降低(P<0.05)。
2.3 脾组织炎性因子水平变化
与对照组比较,ACN中、高剂量组大鼠脾组织内IL-1β含量降低(P<0.05),ACN各剂量组大鼠脾组织内TNF-α含量增加(P<0.05)。与高剂量组比较,NAC组大鼠脾TNF-α含量降低(P<0.05)。
2.4 ACN染毒后大鼠脾组织NF-κB(p65)相关蛋白表达变化
Western Blot结果示,ACN中、高剂量组大鼠脾NF-κB、IκB、p-IκB蛋白表达水平与对照组比较均升高(P<0.05)。NAC组大鼠脾IκB、p-IκB蛋白表达水平与ACN高剂量组比较降低(P<0.05)。
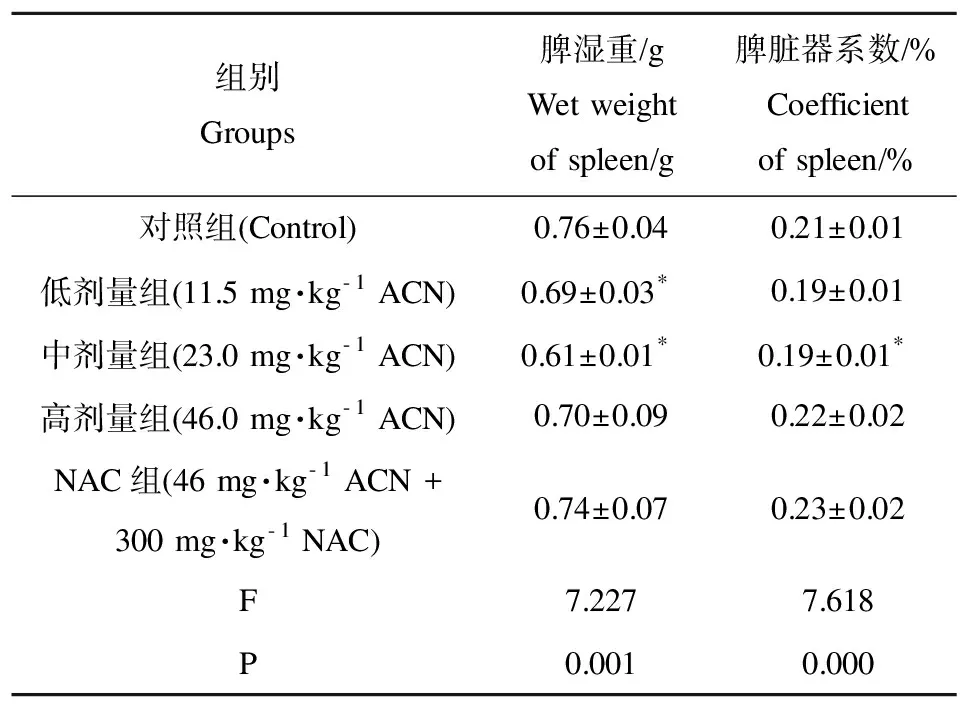
表2 大鼠脾湿重及脏器系数变化Table 2 Changes of the rats spleen wet weight and organ coefficient
注:与对照组比较,*P<0.05;与高剂量组比较,#P<0.05;n=6。脏器系数(%)=脏器湿重(g)/体重(g)×100。ACN表示丙烯腈,NAC表示N-乙酰半胱氨酸。
Note: compared with control,*P<0.05; compared with high dose group,#P<0.05;n=6. organ coefficient (%)=wet weight of organ (g)/weight (g). ACN stands for acrylonitrile; NAC stands for N-acetylcysteine.

表3 大鼠脾组织脂质过氧化指标变化Table 3 Changes of lipid peroxidation index in rat spleen
注:MDA、SOD、CAT、GSH、GSH-Px、T-AOC表示丙二醛、超氧化物歧化酶、过氧化氢酶、谷胱甘肽、谷胱甘肽过氧化物酶和总抗氧化能力。与对照组比较,*P<0.05;与高剂量组比较,#P<0.05;n=6。
Note: MDA, SOD, CAT, GSH, GSH-Px, T-AOC stand for malondialdehyde, superoxide dismutase, catalase, glutathione, glutathione peroxidase and total antioxidant capacity. Compared with control,*P<0.05; compared with high dose group,#P<0.05;n=6.
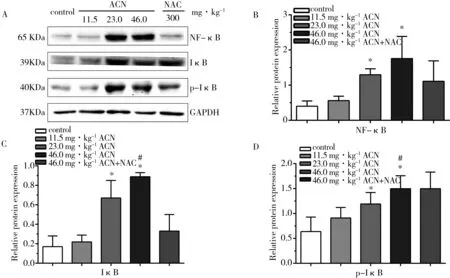
图1 ACN染毒后NF-κB激活的免疫印迹分析注:A,Western Blot NF-κB、IκB、p-IκB蛋白条带。B~D,Western Blot NF-κB、IκB、p-IκB蛋白条带半定量分析。与对照组比较,* P<0.05;与高剂量组比较,# P<0.05;n=6。Fig. 1 Western Blot analysis on activation of NF-κB induced by ACNNote: A, Western Blot bands of NF-κB, IκB and p-IκB proteins; B~D, semi-quantitative analysis on Western Blot of NF-κB, IκB and p-IκB. Compared with control, * P<0.05; compared with high dose group, # P<0.05; n=6.
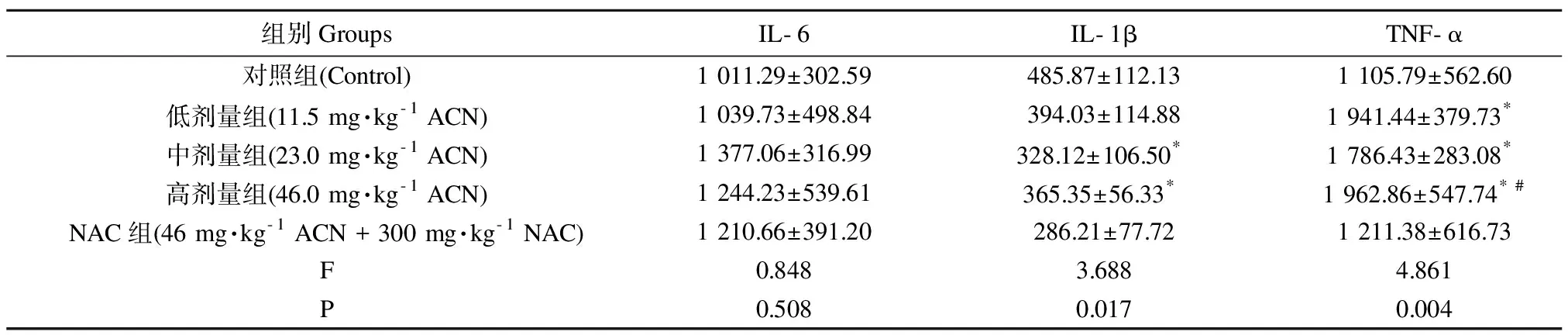
表4 脾组织炎性因子水平变化Table 4 Changes in the level of inflammatory factors in spleen tissue of rats
注:与对照组比较,*P<0.05;与高剂量组比较,#P<0.05;n=6。
Note: Compared with control,*P<0.05; compared with high dose group,#P<0.05;n=6.

表5 ACN染毒后大鼠脾组织NF-κB(p65)相关蛋白表达变化Table 5 Changes of NF-κB (p65) related protein expression in rat spleen after ACN exposure
注:与对照组比较,*P<0.05;与高剂量组比较,#P<0.05;n=6。
Note: Compared with control,*P<0.05; compared with high dose group,#P<0.05;n=6.
2.5 ACN染毒后大鼠脾NF-κB相关基因表达变化
RT-PCR结果显示,ACN各剂量染毒组大鼠脾NF-κBmRNA表达水平均高于对照组(P<0.05);ACN中、高剂量组大鼠脾IκBmRNA表达水平与对照组比较均升高(P<0.05)。NAC组大鼠脾NF-κBmRNA表达水平低于ACN高剂量组(P<0.05)。
3 讨论(Discussion)
脏器系数能敏感地反映脏器受到毒物的毒性反应,其数值大小的改变与脏器的损伤程度有明显的相关关系[10]。正常状态下,动物各脏器的脏器系数比较固定,免疫器官的脏器指数是衡量机体免疫功能的初步观察指标。本研究结果发现ACN染毒后脾脏器系数减小,提示该组织可能出现了萎缩、退行性变化。
氧化应激是由于机体内自由基过量产生导致机体氧化-抗氧化作用失衡的一种病理应激状态。GSH是非酶自由基清除剂,其含量常作为机体抗氧化能力大小的指标之一[11]。本研究发现低剂量染毒组大鼠脾GSH含量显著降低,可能是因为ACN及其代谢产物2-氰环氧乙烷(CEO)与体内GSH结合,使机体内GSH含量下降。GSH-Px是一种含有巯基的重要的抗氧化酶,本研究发现,高剂量组大鼠脾组织GSH-Px活性显著增加,可能是因为ACN染毒后在其代谢过程中产生了过多的自由基,机体为了维持其本身的氧化-抗氧化之间的平衡状态,代偿性增高抗氧化酶GSH-Px。MDA含量多少与体内细胞被破坏程度存在明显的相关关系,本研究发现中、高剂量染毒组大鼠脾MDA含量显著升高,与党瑜慧等[12]结论相似,提示ACN能够引起脾脂质过氧化损伤。SOD是生物体内清除大量自由基的关键物质,一旦SOD活性降低,积累过氧化氢,刺激脂质过氧化反应和氧化反应来破坏细胞[13],本研究结果显示,高剂量组大鼠脾SOD活力升高,可能原因是ACN在体内代谢过程中产生大量·O2-,机体内SOD升高清除·O2-来维持氧化-抗氧化平衡[14]。CAT是过氧化物酶体的标志酶,可减少体内H2O2的积累,一旦CAT受到外源化学物的刺激,其反应性会增加。本研究发现,低剂量组CAT活性显著低于对照组,高剂量组CAT活性显著高于对照组,提示低剂量染毒可使大鼠脾脏组织CAT活力降低,减弱了机体的抗氧化能力。T-AOC是机体防御体系之一,此种机能的降低常常导致各种疾病发生。本研究发现,低剂量组大鼠脾组织T-AOC水平显著降低(P<0.05)。此外,本研究中,与高剂量组相比,NAC组大鼠脾脏MDA、SOD、CAT、GSH、GSH-Px、T-AOC水平显著降低,可能与NAC可以和活性氧直接发生作用,还可能与NAC能抑制ACN向其活性代谢产物CN-转化及抑制ACN持续消耗ATP有关[15]。
IL-6是重要的促炎细胞因子,在炎性刺激下由单核细胞、淋巴细胞等炎症免疫细胞分泌,其分泌水平可反映炎症激烈程度。正常生理状态下IL-6一般不表达,但在炎症、病毒等刺激下分泌水平升高,呈高表达状态。本研究中,与对照组比较,低、中、高剂量组大鼠脾组织内IL-6含量增加,但差异无统计学意义。IL-6有协调IL-1,诱导肝细胞合成急性期反应蛋白,可催化、放大炎性反应及毒性作用,也可与TNF-α产生协同作用,作用于血管内皮细胞,造成微循环障碍[16-17]。本研究发现,中、高剂量组IL-1β分泌水平显著降低。此外,低、中、高剂量组TNF-α分泌水平显著增加,表明ACN引起促炎因子TNF-α异常释放。NAC干预后,大鼠脾TNF-α分泌水平显著降低,说明NAC可使脾组织TNF-α表达降低,从而起到免疫调节作用。

表6 ACN染毒后大鼠脾NF-κB相关基因表达变化Table 6 Changes of NF-κB related gene expression in rat spleen after ACN exposure
注:与对照组比较,*P<0.05;与高剂量组比较,#P<0.05;n=6。
Note: Compared with control,*P<0.05; compared with high dose group,#P<0.05;n=6.
NF-κB信号通路可以调节基因表达,并控制细胞凋亡、病毒复制、肿瘤发生、炎症以及各种自身免疫性疾病[18]。同时,NF-κB信号通路在免疫、炎症和肿瘤形成过程中还能协调、驱动细胞活化和增殖[19]。NF-κB通常与其抑制因子IκB结合,以非活性形式存在于细胞质中,当细胞受到上游刺激因子,如ROS、肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)、细菌脂多糖(LPS)等的作用时而激活[20-22]。NF-κB还可反馈调节,通过迅速合成IκB终止转录,维持细胞自身的稳定性[23]。Dang等[24]研究发现,ACN染毒后大鼠睾丸NF-κB蛋白相对表达量升高,经NAC预处理后,NF-κB的活化受到抑制。本研究结果显示,中、高剂量染毒组大鼠脾NF-κB、IκB、p-IκB蛋白表达水平与对照组比较升高(P<0.05)。RT-PCR结果显示,低、中、高ACN染毒组大鼠脾NF-κBmRNA表达水平与对照组比较均升高(P<0.05);中、高ACN染毒组大鼠脾IκBmRNA表达水平与对照组比较均升高(P<0.05)。可能是因为NF-κB被活化后上调了IκB的表达,而IκB同时又被磷酸化。NAC组大鼠脾IκB、p-IκB蛋白表达水平与高ACN组比较降低(P<0.05),NF-κBmRNA表达水平与高剂量组比较降低(P<0.05),NF-κB的激活显著受到抑制,这是因为NAC作为一种有效的抗氧化剂,可以通过抑制氧化应激,拮抗NF-κB的活化和其在核内的表达[8]。提示ACN染毒后大鼠脾NF-κB信号通路的激活是由氧化应激引起。
综上所述,ACN亚急性染毒可对大鼠脾产生氧化损伤和免疫系统响应,NAC可通过拮抗作用减轻大鼠脾损伤程度。
