外源肠道菌和玉米抗性淀粉对小鼠结肠菌群发酵产酸的影响
2018-03-10杨玥熹俞东宁方建东顾振宇
杨玥熹 俞东宁 方建东 顾振宇
(浙江省食品微生物技术重点实验室;浙江工商大学食品与生物工程学院1,杭州 310018)(国家级食品工程与质量安全实验教学中心2,杭州 310018)
随着生活水平的不断提高,高脂肪、高热量食品的摄入量增大,人类健康正受到肥胖、糖尿病等“富贵病”的威胁。已有研究表明,抗性淀粉(resistant starch,RS)能够抵抗α-淀粉酶分解并且不被小肠吸收[1],具有预防便秘,控制血糖,调节脂类和胆固醇代谢的作用[2]。目前,根据其来源和物理化学性质的不同可将其分为5类:RS1(物理包埋淀粉)、RS2(抗性淀粉颗粒)、RS3(回生淀粉)、RS4(化学改性淀粉)和RS5(淀粉-脂类复合物)[3]。回生淀粉(RS3)是食品中最常见的一类抗性淀粉。淀粉食物经蒸煮后再冷却,会有部分形成回生淀粉,热加工工艺条件对回生淀粉的形成量及其结构有影响,压热法是制备回生淀粉(RS3)的常用方法[4]。国际市场上现有的几种抗性淀粉产品价格昂贵,如美国National starch Chemical Corporation、英国Opta food Ingredients、日本Matsutani Chemical Industry Corporation生产的抗性淀粉产品,皆为RS3型抗性淀粉。
近些年,已有研究初步证明,抗性淀粉可在人体大肠中被微生物发酵所利用,产生短链脂肪酸[6],进而对肠道微环境起到调节作用。Qin等[7]指出2型糖尿病患者均有中等程度的肠道微生态紊乱,且表现为产丁酸细菌种类的缺乏。由此推测,通过抗性淀粉对肠道菌群的调节,从而控制肠道中短链脂肪酸的产量,可对2型糖尿病进行控制。
国内外已经对抗性淀粉的发酵特性进行了一定的研究,包括体外模拟和体内实验[8-9]。谢涛等[10]利用红薯抗性淀粉进行体外发酵,发现抗性淀粉能够选择性的促进人粪便中乳酸杆菌、双歧杆菌群、粪链球菌群等益生菌的增殖。研究发现,抗性淀粉经肠道菌群的发酵产生短链脂肪酸(SCFAs),SCFAs的成分受到抗性淀粉原料种类及发酵菌种的影响[11-13]。在已有的体外模型中,人和动物粪便的悬浊液常被用于模拟肠道环境[14-16],而肠道内容物悬浊液由于取样不易而较少使用;肠道有益菌,尤其是乳酸菌属发酵抗性淀粉的研究较多,而有关来源于不同菌属的混合菌利用抗性淀粉发酵的研究较少。本研究用小鼠结肠内容物悬液模拟结肠环境,研究玉米抗性淀粉体外发酵产酸的特性以及多种外源菌对产酸的影响,进一步推动抗性淀粉与肠道菌群相互调节作用的研究发展,以期为抗性淀粉和益生菌制剂的开发利用提供一定的理论基础。
1 材料和方法
1.1 材料
玉米抗性淀粉(由高直链玉米淀粉制备的RS3型抗性淀粉,抗性淀粉含量≥80%):上海国民淀粉公司。
营养肉汤:青岛海博生物技术有限公司;分析纯的偏磷酸、磷酸二氢钾、磷酸二氢钠、甲酰胺、尿素、冰醋酸、无水乙醇、氢氧化钠、甲醛、氯化钾、氯化钠、甘油、琼脂糖:杭州汇普化学试剂有限公司。
嗜酸乳杆菌(Lactobacillusacidophilus)、大肠埃希氏菌(Escherichiacoli.)、青春双歧杆菌(Bifidobacteriumadolescentis)、粪肠球菌(Enterococcusfaecalis):中国普通微生物菌种保藏管理中心,编号分别为1.1878、1.3344、1.2190、1.2024。
1.2 仪器与设备
WH-1微型漩涡混合器:上海泸西分析仪器厂有限公司;GC-2010气相色谱仪:日本岛津公司;SW-CJ-1FD洁净工作台:苏州安泰空气技术有限公司;LRH智能生化培养箱:上海一恒科技有限公司。
1.3 实验方法
1.3.1 小鼠肠道内容物处理
将24只28日龄健康昆明小鼠进行断颈处理,解剖后将其结肠内容物迅速装入已灭菌的50 mL带盖离心管中并称重,鼓入高纯二氧化碳5 min后密封,置于-20 ℃冰箱内保存。
参照朱翠兰[17]的方法制备小鼠结肠内容物菌悬液,略有修改。首先根据结肠内容物的质量,用无菌生理盐水按1:10比例稀释结肠内容物,旋涡震荡2 min;之后用4层纱布过滤,所得滤液为小鼠结肠内容物菌悬液。依照表1中的条件,分别用LBS琼脂培养基、BBL琼脂培养基、紫红胆盐葡萄糖培养基、肠球菌培养基测定小鼠结肠内容物悬液中乳酸杆菌、双歧杆菌、肠杆菌和肠球菌的数量。
1.3.2 菌种的活化与培养
将保存在甘油中的嗜酸乳杆菌、大肠埃希菌埃希氏菌、青春双歧杆菌、粪肠球菌分别以2%(V/V)的接种量接种到相应的培养基中,培养条件见表1。待菌种活化3次完全恢复活力后,进行活菌计数并用于后续实验。
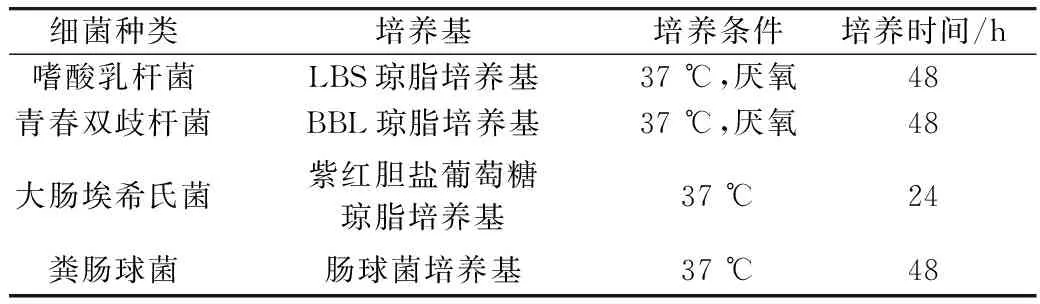
表1 细菌培养基种类及其培养条件
1.3.3 活菌计数
在超净工作台中,吸取0.5 mL经活化后的菌悬液加入到4.5 mL的无菌生理盐水中,摇匀,作10-1~10-7稀释梯度,用移液枪移取100 μL稀释液,分别用无菌的涂布棒均匀地涂布于选择性培养基上,并在相应条件下培养,培养条件如表1所示。取长有20~200个菌落的平板进行计数及统计分析。
1.3.4 体外模拟发酵
根据表2所示实验设计配制含有玉米抗性淀粉的肉汤培养基,分装于250 mL锥形瓶中,每瓶分装量100 mL。灭菌后鼓入高纯CO2气体,20 min后旋紧橡胶塞蜡封。用无菌注射器将1 mL小鼠结肠内容物悬液(处理方法见1.3.1)注入各瓶培养基中,再依表2实验设计用无菌注射器注入外源菌悬液,摇匀后用注射器吸取5 mL的发酵液作为发酵0 min的检测样本,之后放入37 ℃厌氧培养箱中,以80~100 r/min速度振摇,在6、12、18、24、30 h时吸取发酵液5 mL作为检测样本,用于短链脂肪酸(SCFAs)含量的测定。
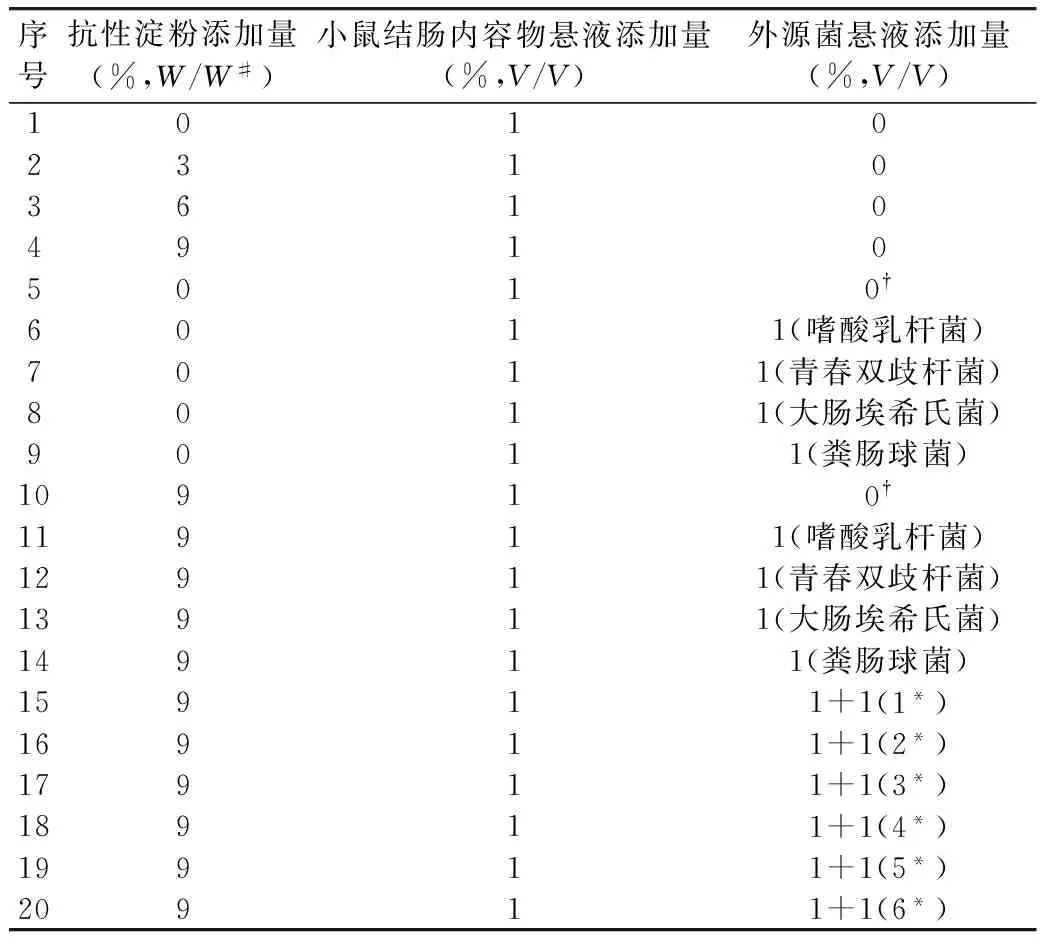
表2 体外模拟发酵实验设计
注:W/W#:玉米抗性淀粉干重/营养肉汤培养基干重;0†:未注入外源菌悬液而注入1 mL无菌蒸馏水;1*:嗜酸乳杆菌+青春双歧杆菌;2*:嗜酸乳杆菌+大肠埃希氏菌;3*:嗜酸乳杆菌+粪肠球菌;4*:青春双歧杆菌+大肠埃希氏菌;5*:青春双歧杆菌+粪肠球菌;6*:粪肠球菌+大肠埃希氏菌。
1.3.5 短链脂肪酸(SFCAs)含量测定
样品预处理:将0.2 g样品和0.2 mL正己酸加入到1.6 mL无菌蒸馏水,混匀后加入0.4 mL的硫酸(质量分数约50%)和2 mL的无水乙醚,并放置于摇床上混匀30 min,接着3 000 r/min离心5 min。加入无水CaCl2除去残留水分,移取上清液用于气相色谱(GC)测定。GC测定参照连晓蔚[18]的方法,略有修改。检测器为氢火焰检测器(FID);色谱柱为DB-FFAP;载气为N2,分流比为10:1,流速为2 mL/min;燃烧炉温度为240 ℃,进样量为2 μL;升温程序:起始温度120 ℃保持5 min,以10 ℃/min升温至250 ℃并保留1 min。采用外标法,乙酸标准曲线为:Y=14.03X-0.405;丙酸标准曲线为:Y=30.37X+0.784;丁酸标准曲线为:Y=45.66X+2.048;上述标准曲线中Y代表峰面积,X代表短链脂肪酸浓度(mmol/L),线性拟合显示R2>0.999。
1.3.6 数据处理
实验数据均是3次平行实验的平均值,采用SPSS 21.0软件对数据进行显著性分析和OriginPro 9.0软件作图。
2 结果与分析
2.1 活菌计数
采用梯度稀释平板涂布法测定的活化后用于培养基注射的外源菌液中的活菌数,平均测定3次,计算平均值,见表3。
小鼠结肠内容物悬液中,乳酸杆菌为(4.36±0.04)×108CFU/mL,双歧杆菌为(1.54±0.02)×109CFU/mL,肠杆菌为(1.62±0.01)×108CFU/mL,肠球菌为(8.12±0.03)×107CFU/mL。4种外源菌液中活菌数都显著高于小鼠结肠内容物悬液中相应的各类细菌的活菌数。

表3 外源菌液的活菌计数
2.2 抗性淀粉含量对小鼠结肠菌群发酵产酸的影响
由图1a、图1b和图1c中可见,添加3%的抗性淀粉后,相比于未添加抗性淀粉的组(实验设计见表2中序号1~4),在发酵的各时间点,乙酸、丙酸和丁酸的含量都有显著性(P<0.05)的增长。随着抗性淀粉含量的增加,短链脂肪酸的产量也提高。在发酵12 h后,添加9%抗性淀粉的组与添加3%、6%抗性淀粉的组相比,乙酸、丙酸和丁酸的含量都有显著性(P<0.05)差异。添加3%和6%抗性淀粉的组在发酵18 h后,乙酸、丙酸和丁酸的含量没有显著性(P>0.05)差异。添加9%抗性淀粉的组,发酵18 h后丁酸仍有显著增长(P<0.05)。相较于3种短链脂肪酸,各取样时间点,乙酸的含量要高于丙酸和丁酸的含量。在12 h前,丙酸的含量要高于丁酸,而在发酵后期丁酸的含量要高于丙酸。说明抗性淀粉能够被肠道微生物利用,发酵产短链脂肪酸,与汪婕等[19]探究结果相似。Haenen等[20]给公猪喂养抗性淀粉后,发现公猪的肠道微生物变化具有显著性差异,其中丁酸的产生菌增殖率有明显的增加,因而肠道中丁酸的含量增加。
2.3 单一外源菌对小鼠结肠菌群发酵产酸的影响
由图2a、图2b和图2c中可见,在肉汤培养中添加各实验外源菌后(实验设计见表2中序号5-9,序号5为空白组),在各取样时间点与空白组相比,丙酸的含量没有显著性变化(P>0.05);添加大肠埃希氏菌组的乙酸含量在6、12 h显著下降(P<0.05),添加粪肠球菌组的乙酸含量在6 h显著下降(P<0.05);添加大肠埃希氏菌组的丁酸含量在各测试时间点都有显著下降(P<0.05),添加嗜酸乳杆菌组的丁酸含量在6、12、18、30 h也有显著下降(P<0.05)。
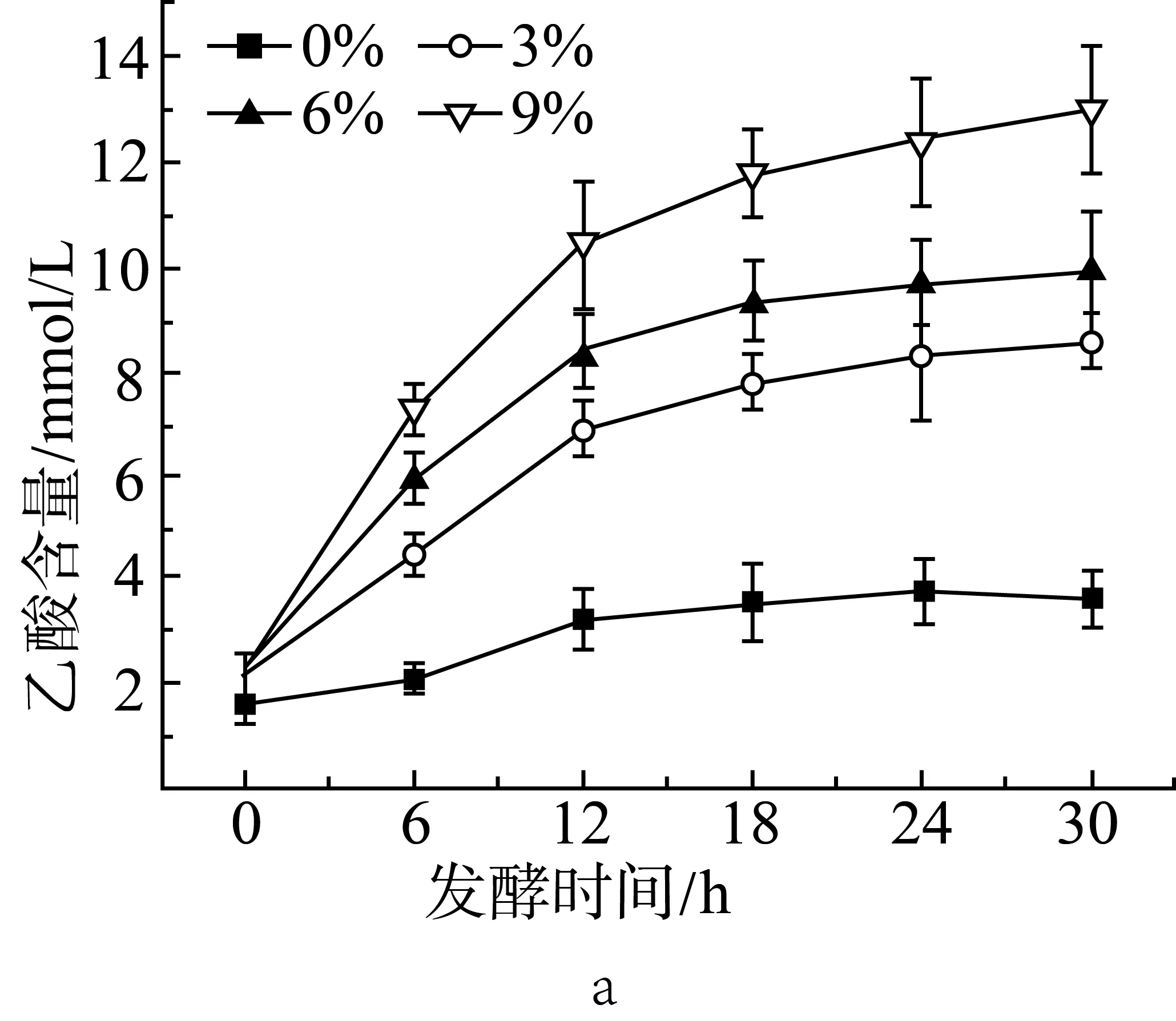
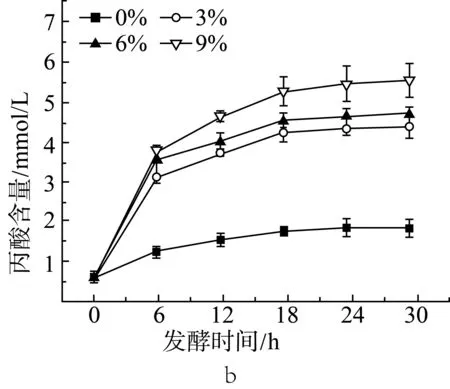

图1 抗性淀粉添加量对小鼠结肠菌群发酵产乙酸(a)、丙酸(b)和丁酸(c)的影响
由此可见,单独添加本实验中的某一种外源菌并不能显著提升发酵产物中短链脂肪酸的含量,甚至产生反效果。
2.4单一外源菌对小鼠结肠菌群利用抗性淀粉发酵产酸的影响
为了研究外源菌对于小鼠结肠菌群利用抗性淀粉发酵产酸的影响,在含抗性淀粉的培养基中加入小鼠结肠悬浊液后,再加入不同的单一外源菌种(实验设计见表2中序号10-14)。如图3a所示,未添加外源菌的抗性淀粉在模拟结肠环境中单独发酵,产生的乙酸含量最高可达12.96 mmol/L,但是当发酵体系中添加嗜酸乳杆菌后,乙酸的含量显著增加,最高时为24.26 mmol/L。与未添加外源菌组相比,在添加青春双歧杆菌、大肠埃希氏菌和粪肠球菌后,发酵产物中的乙酸含量变化不大。朱翠兰[17]也研究发现通过外援乳酸菌和人体的粪便共同体外模拟肠道发酵也有相同影响产生短链脂肪酸的情况,添加乳酸杆菌能够促进乙酸含量的增加。
如图3b所示,未添加外源菌的抗性淀粉在模拟结肠环境中单独发酵,产生的丙酸含量最高可达5.19 mmol/L。与未添加外源菌组相比,当发酵体系中添加双歧杆菌或粪肠球菌后,丙酸的含量显著增加(P<0.05),最高时分别达可9.57和9.14 mmol/L;在添加嗜酸乳杆菌时,发酵产物中的丙酸含量在6、12 h没有显著性变化;18 h及以后有显著性的增长。在添加大肠埃希氏菌的发酵体系中,产生的丙酸含量与未添加外源菌组相比,没有显著性差异(P>0.05)。综上可知,青春双歧杆菌和粪肠球菌能够协同肠道微生物发酵玉米抗性淀粉产生丙酸,而其他的外源菌不具有此种发酵特性。
如图3c所示,未添加外源菌的抗性淀粉在模拟结肠环境中单独发酵,产生的丁酸含量最高可达6.44 mmol/L。但是当发酵体系中添加双歧杆菌和粪肠球菌后,丁酸的含量增加,最高时分别为9.81 mmol/L和7.89 mmol/L。与未添加外源菌组相比,添加嗜酸乳杆菌后,发酵产物中的丁酸含量在发酵6 h后显著增加,在12 h后减少,且在12、18 h时有显著性差异(P<0.05)。添加大肠埃希氏菌的发酵体系中产生的丙酸含量显著低于未添加外源菌组,在18 h后其含量约外源菌组的50%。因此,可以得知青春双歧杆菌和粪肠球菌能够协同肠道微生物发酵玉米抗性淀粉产生丁酸,而其他的外源菌不具有此种发酵特性。但是其中大肠埃希氏菌作为发酵优势菌时会抑制肠道微生物发酵抗性淀粉产丁酸。
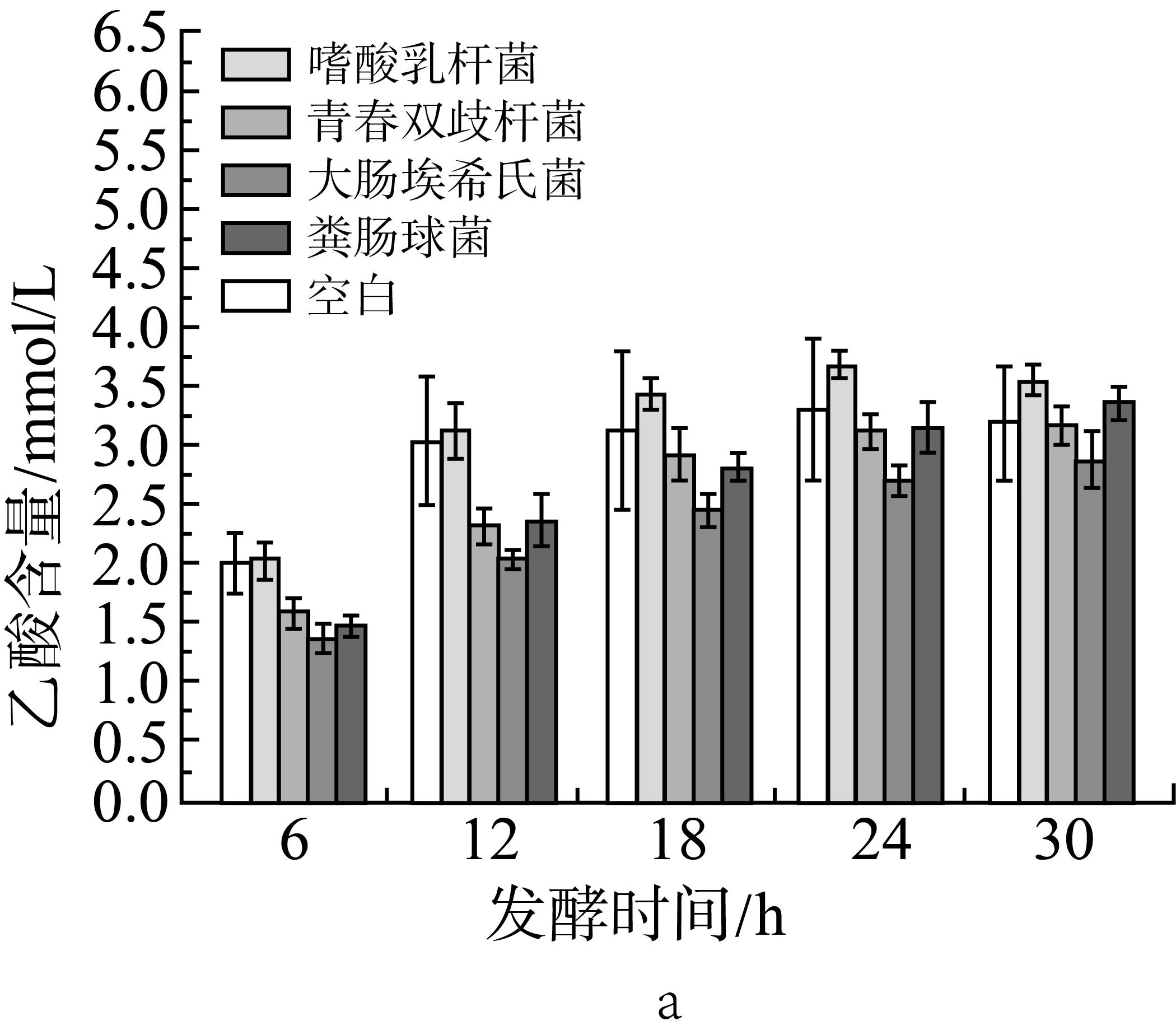

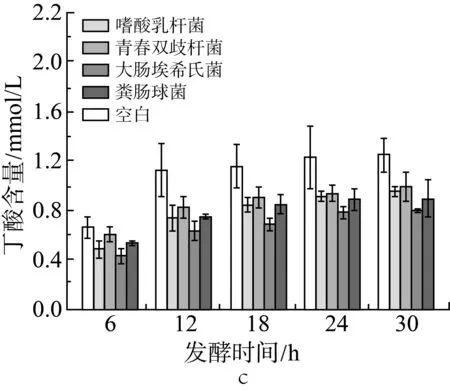
图2 单一外源菌对小鼠结肠菌群发酵产乙酸(a)、丙酸(b)和丁酸(c)的影响
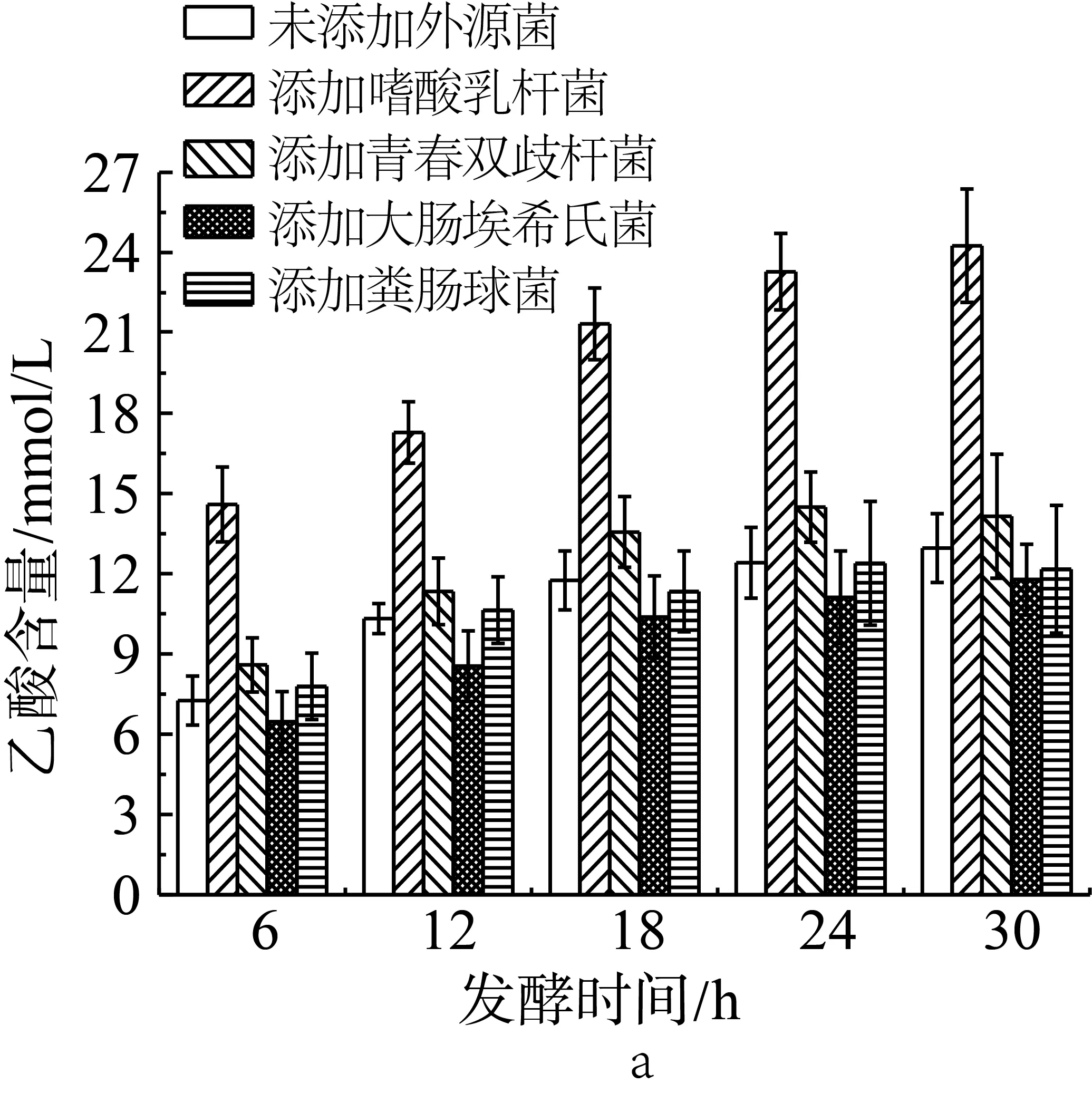
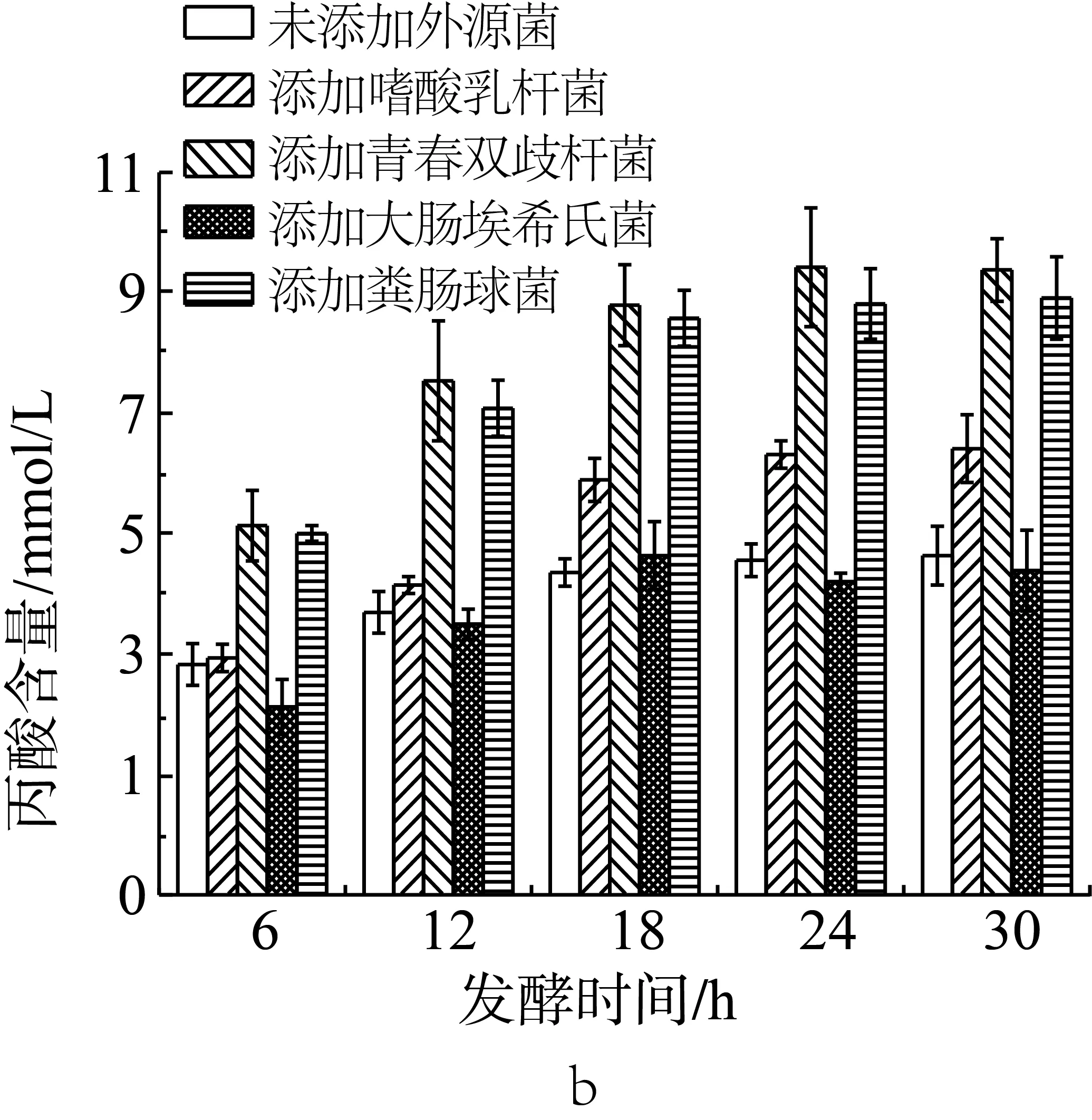
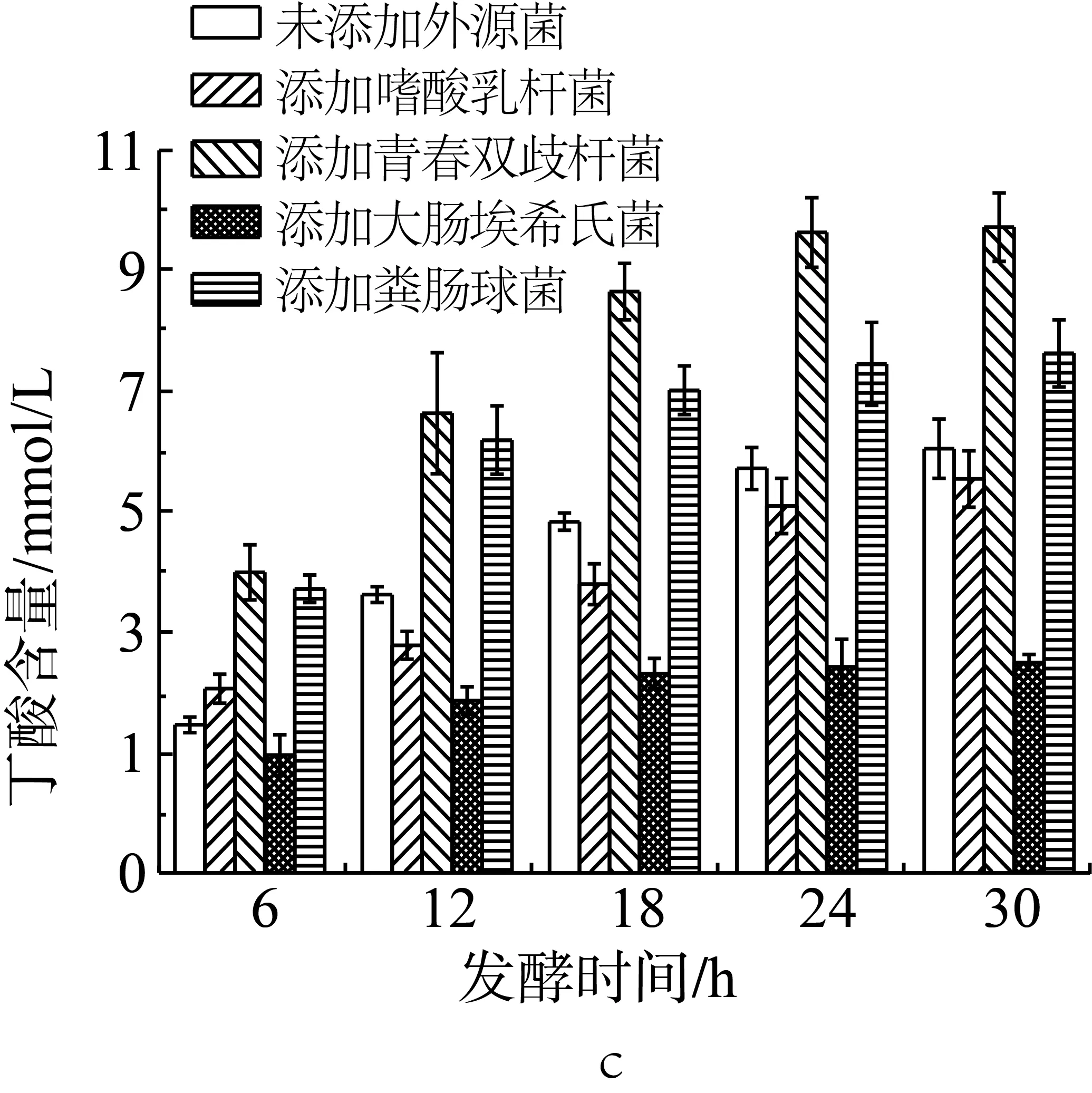
图3 单一外源菌对小鼠结肠菌群利用抗性淀粉发酵产乙酸(a)、丙酸(b)和丁酸(c)的影响
2.5混合外源菌对小鼠结肠菌群利用抗性淀粉发酵产酸的影响
肠道微生物是一个包含种类繁多的微生物的复杂生态系统,不同菌种之间相互制约,相互依存或是相互促进,对于相同的发酵底物,通过不同的菌群发酵,发酵产物组成将会发生变化。因此,本研究尝试将两种不同的外源菌混合添加到抗性淀粉发酵体系中,检测发酵产物中短链脂肪酸(乙酸、丙酸、丁酸)的变化(实验设计见表2中序号15-20)。如图4a所示,在发酵体系中嗜酸乳杆菌和青春双歧杆菌混合添加时,其发酵产物乙酸含量最高为29.86 mmol/L,对比图2a可得,明显高于嗜酸乳杆菌单一发酵时乙酸的产量;嗜酸乳杆菌与大肠埃希氏菌,或是嗜酸乳杆菌和粪肠球菌混合添加时,乙酸含量相比于嗜酸乳杆菌单一发酵时略有下降,但差异不显著;相比于大肠埃希氏菌或粪肠球菌单独发酵时有显著提高(P<0.05)。其他混合菌群相对于各自单独添加时,乙酸产量没有显著的变化。因此可以推断,青春双歧杆菌与嗜酸乳杆菌在发酵抗性淀粉产乙酸时有一定的协同作用。
由图4b和图4c可知,在体外发酵体系中添加青春双歧杆菌和嗜酸乳杆菌,或是青春双歧杆菌和粪肠球菌时,其发酵产物丙酸含量最高值分别为13.45 mmol/L和12.12 mmol/L,显著高于青春双歧杆菌单一发酵时丙酸含量的最高值(P<0.05),增加了大约40.5%和26.6%;青春双歧杆菌和嗜酸乳杆菌混合后其发酵产物丁酸含量也显著性高于青春双歧杆菌单一发酵时产生的量(P<0.05),青春双歧杆菌和粪肠球菌混合后丁酸的含量高青春双歧杆菌单一发酵时产生的量,但增幅有限。嗜酸乳杆菌和粪肠球菌组合发酵时丙酸和丁酸含量比嗜酸乳杆菌单独发酵时高,比粪肠球菌单独发酵时低。相较于嗜酸乳杆菌、青春双歧杆菌单一菌种发酵,当嗜酸乳杆菌、青春双歧杆菌分别与大肠埃希氏菌组合后,在各时间点的丙酸和丁酸的产量都呈现显著性下降(P<0.05),下降最明显的是嗜酸乳杆菌和大肠埃希氏菌组合,其丁酸产量低至大肠杆菌单独发酵产酸的水平;青春双歧杆菌与大肠埃希氏菌组合后丁酸含量的下降幅度大于丙酸含量的下降幅度。粪肠球菌与大肠埃希氏菌组合后,在各测试时间点较未粪肠球菌发酵时的丙酸产量有显著性下降(P<0.05),丁酸含量有也有下降但并不显著(P>0.05)。由此可以推断,青春双歧杆菌与嗜酸乳杆菌或粪肠球菌发酵在产丙酸、丁酸能力上有一定的协同作用,而大肠埃希氏菌会抑制其他菌种发酵产丙酸和丁酸,抑制效果依其他菌种不同而不同,对嗜酸乳杆菌的抑制效果最强。
3 结论
在通过营养肉汤和小鼠结肠菌悬液构建的模拟结肠环境中,添加玉米抗性可以显著提升乙酸、丙酸和丁酸的生成量。抗性淀粉体外发酵产酸模式与肠道菌群种类相关,嗜酸乳杆菌、青春双歧杆菌和粪肠球菌在一定程度上能够促进发酵体系中短链脂肪酸的产生,而大肠埃希氏菌则会抑制发酵体系中乙酸、丙酸和丁酸的产生。上述菌种在两两组合后,又显示出不同的作用效果。嗜酸乳杆菌、青春双歧杆菌产乙酸、丙酸和丁酸的协同增效作用最为明显;大肠埃希氏菌显示出较强的抑制产酸作用,尤其在和嗜酸乳杆菌组合时。
综上可见,通过调节肠道菌群可以调控抗性淀粉发酵产短链脂肪酸,嗜酸乳杆菌和青春双歧杆菌组合在发酵玉米抗性淀粉产乙酸、丙酸和丁酸显示出较好地协同作用。进一步还需要还需通过研究菌群结构动态变化、菌群来源性差异等,解释不同菌种或菌种组合间发酵抗性淀粉产生短链脂肪酸差异的原因,以推动抗性淀粉和益生菌类功能食品的开发及效用的提升。

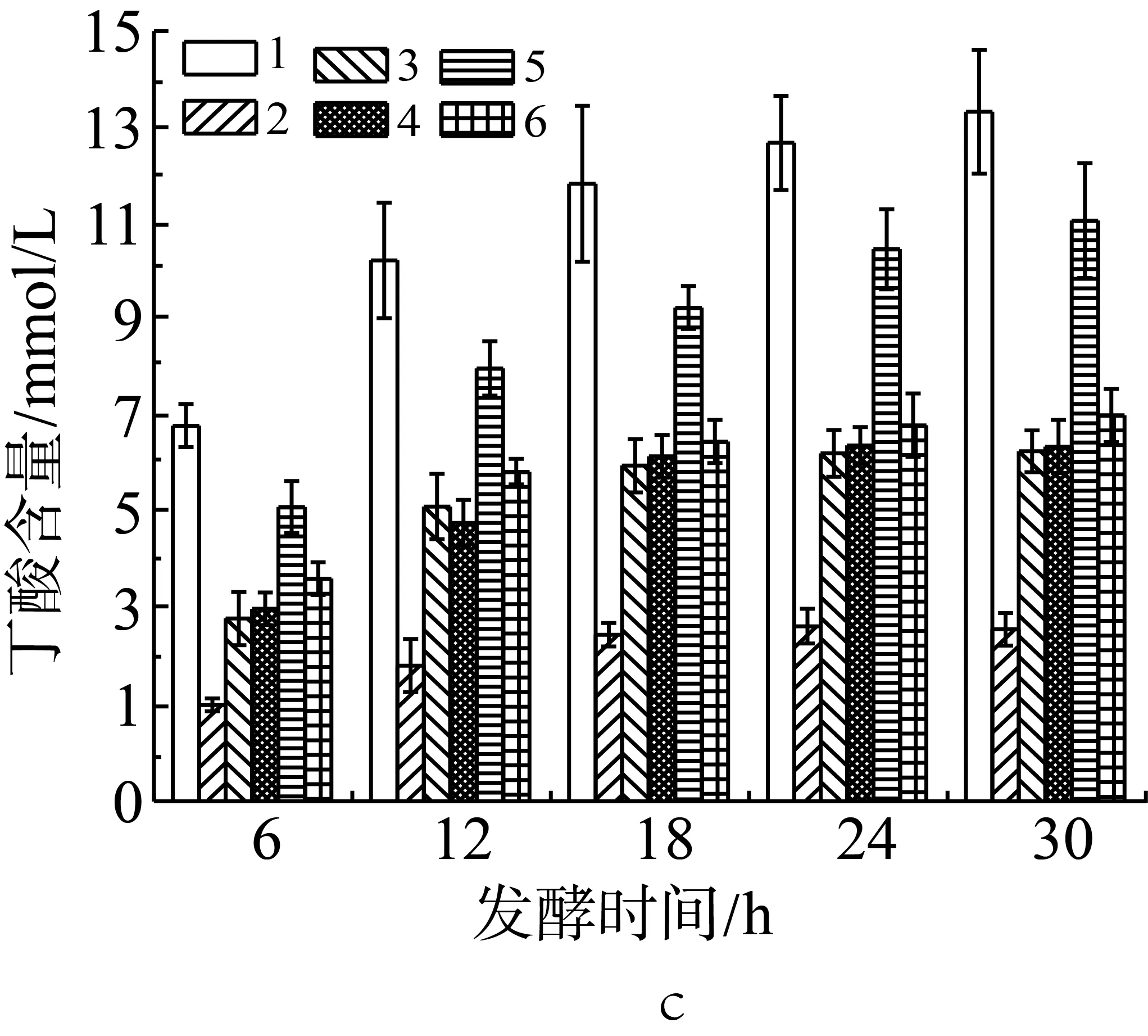
注:1:嗜酸乳杆菌+青春双歧杆菌;2:嗜酸乳杆菌+大肠埃希氏菌;3:嗜酸乳杆菌+粪肠球菌;4:青春双歧杆菌+大肠埃希氏菌;5:青春双歧杆菌+粪肠球菌;6:粪肠球菌+大肠埃希氏菌。
图4 混合外源菌对小鼠结肠菌群利用抗性淀粉发酵产乙酸(a)、丙酸(b)和丁酸(c)的影响
[1]ENGLYST H N,CUMMINGS J H.Digestion of the polysaccharides of some cereal foods in the human small intestine[J].American Journal of Clinical Nutrition,1985,42(5):778-87
[2]FUENTES-ZARAGOZA E,RIQUELME-NAVARRETE M J,SáNCHEZ-ZAPATA E,et al.Resistant starch as functional ingredient:a review[J].Food Research International,2010,43(4):931-942
[3]朱平,孔祥礼,包劲松.抗性淀粉在食品中的应用及功效研究进展[J].核农学报,2015,29(2):327-336
ZHU P,KONG X L,BAO J S.Current progress on the applications and health benefits of resistant starch in foods[J].Acta Agriculturae Nucleatae Sinica,2015,2:327-336
[4]REDDY C K,HARIPRIYA S,MOHAMED A N,et al.Preparation and characterization of resistant starch III from elephant foot yam(Amorphophallus paeonifolius)starch[J].Food Chemistry,2014,155(5):38-44
[5]SANKHON A,YAO W R,WANG H Y,et al.The yield of improvement of resistant starches from Africa Locust(Parkia biglobosa):the influence of heat-moisture,autoclaving-cooling and cross-linking treatments[J].American Journal of Food Technology,2012,7(7):386-397
[6]TAN Z N,ROSMA A,NAPISAH H,et al.Characteristics of metroxylon sagu resistant starch type III as prebiotic substance[J].Journal of Food Science,2015,80(4):H875-H882
[7]CHATELIER E L,NIELSEN T,QIN J,et al.Richness of human gut microbiome correlates with metabolic markers[J].Nature,2013,500(7464):541-546
[8]MAHADEVAMMA S,SHAMALA T R,THARANATHAN R N.Resistant starch derived from processed legumes:in vitro and in vivo fermentation characteristics[J].International Journal of Food Science and Nutrition,2004,55(5):399-405
[9]VINCENT Lebet,EVA Arrigoni,RENATO Amadò.Measurement of fermentation products and substrate disappearance during incubation of dietary fibre sources with human faecal flora[J].Academic Press,1998,31(5):473-479
[10]谢涛,张淑远,王美桂,等.重结晶红薯淀粉体外消化前后益生作用与结构变化[J].农业机械学报,2013,44(8):202-206
XIE T,ZHANG S Y,WANG M G,et al.Probiotic functions and structure changes of recrystallized sweet potato starch before and after in vitro digestion[J].Transactions of the Chinese Society of Agricultural Machinery,2013,44(8):202-206
[11]ZHANG H Z,XU X M,JIN Z Y.Fermentation characteristics of resistant starch from maize prepared by the enzymatic method in vitro[J].International Journal of Biological Macromolecules,2012,51(5):1185-8
[12]HEDEMANN M S,KNUDSEN K E B.Resistant starch for weaning pigs:Effect on concentration of short chain fatty acids in digestion and intestinal morphology[J].Livestock Science,2007,108(1):175-177
[13]庞秋芳,彭喜春,欧仕益,等.直肠菌群对两种抗性淀粉的体外发酵研究[J].食品工业科技,2011(4):148-151
PANG Q F,PENG X C,OU S Y,et al.Study on fermentation of two resistant starch by colon microflora in vitro[J].Science and Technology of Food Industry,2011(04):148-151
[14]王志凡,杨秀琳,陈旺盛,等.抗性淀粉对饮食诱导肥胖大鼠排便状况及肠道菌群的影响[J].动物营养学报,2016,28(5):1626-1632
WANG Z F,YANG X L,CHEN W S,et al.Effects of resistant starch on defecation and intestinal microflora of diet induced obesity rats[J].Chinese Journal of Animal Nutrition,2016,28(5):1626-1632
[15]谢涛,曾红华,汪婕,等.4种抗性淀粉的益生作用及结构变化[J].中国粮油学报,2014,29(10):23-27
XIE T,ZENG H H,WANG J,et al.Probiotic functions and structural changes of 4 resistant starches[J].Journal of the Chinese Cereals and Oils Association,2014,29(10):23-27
[16]彭真福,陈庆发,白永亮,等.双歧杆菌对香蕉抗性淀粉的体外发酵研究[J].食品科技,2015(1):2-5
PENG Z F,CHEN Q F,BAI Y L,et al.Fermentation of banana resistant starch by bifidobacterium in vitro[J].Food Science and Technology,2015(1):2-5
[17]朱翠兰.玉米抗性淀粉的模拟肠道发酵产酸与外源乳酸菌关联性[D].哈尔滨:东北农业大学,2012
ZHU C L.Acid production of crude maize resistant starch in the simulated fermentation in vitro and the Impacts of some exogenous lactic acid bacteria added[D].Haerbin:Northeast Agricultural University,2012
[18]连晓蔚.肠道菌群利用几种膳食纤维体外发酵产短链脂肪酸的研究[D].广州:暨南大学,2011
LIAN X W.Gut microbiota in vitro fermenting destarched dietary fiber to produce SCFA[D].Guangzhou:Jinan University,2011
[19]汪婕,谢涛.锥栗抗性淀粉消化前后的益生作用及结构变化研究[J].食品工业科技,2014,35(13):61-65
WANG J,XIE T.Probiotic functions and structural changes of castanea henryi resistant starch before and after digestion[J].Science and Technology of Food Industry,2014,35(13):61-65
[20]HAENEN D,SOUZAD S C,ZHANG J,et al.Resistant starch induces catabolic but suppresses immune and cell division pathways and changes the microbiome in the proximal colon of male pigs[J].Journal of Nutrition,2013,143(12):1889-1898.
