亚麻籽胶低聚糖的制备及其生物活性评价
2018-03-10韩子晟
梁 珊 张 宁 韩子晟 黄 玉 汪 勇
(广东油脂生物炼制工程技术研究中心;暨南大学食品科学与工程系;暨南大学-萨斯喀彻温大学“油料生物炼制与营养”联合实验室,广州 510632)
亚麻(LinumusitatissimumL.),又称胡麻,是世界范围内重要油料作物之一,其种子亚麻籽中含有10%~15%的亚麻籽胶,主要来源于亚麻籽油加工副产物亚麻籽粕或亚麻籽壳[1],目前常作为增稠剂、凝胶剂、乳化剂等应用于食品、日化及医药行业[2],但关于亚麻籽胶的产品深开发研究还不多见。亚麻籽胶的主要成分亚麻籽多糖是由5~7种单糖通过一系列特异性糖苷键连接而成的聚合物大分子[3],可通过物理、化学或生物的方法降解,从而释放出小分子低聚糖,可作为制备新型低聚糖的良好资源。酶法是目前制备低聚糖最常用方法,但亚麻籽胶由于其多糖结构的复杂性,酶法并不能十分有效的降解[4-5]。双氧水氧化降解法作为一种新型化学降解方法,在温度及压力的共同作用下可表现出很强的降解能力,且其还原产物为水,不会引入其他杂质,绿色安全[6],可用于亚麻籽胶低聚糖的制备。
目前亚麻籽胶(多糖)及其生物活性已见于报道,例如降血糖、降胆固醇、减缓胃肠排空速度、抗氧化等[7-10],但关于亚麻籽胶的降解及其降解产物生物活性则鲜有报道。生物活性评价是天然产物生物活性成分能否应用于功能食品或药物开发的重要依据,在食品、生化及医药领域具有重要意义。本研究针对传统酶法降解亚麻籽胶的局限性,采用双氧水氧化降解法制备亚麻籽胶低聚糖(Flaxseed Gum Oligosaccharides,FGOS),并采用体外抗氧化及乳酸菌增殖实验评价了亚麻籽胶降解产物FGOS的生物活性,旨在为更好地开发和利用油料作物亚麻加工副产物亚麻籽胶提供借鉴。
1 材料与方法
1.1 材料与试剂
1.2 仪器与设备
LC-20AD高效液相色谱仪(配有ELSD检测器):日本岛津公司;Agilent 7820A气相色谱仪:美国安捷伦科技有限公司;4000 QTRAP质谱仪:AB SCIEX公司;722S可见分光光度计:上海菁华科技仪器有限公司;Scientz-10N冷冻干燥机:宁波新芝生物科技有限公司。
1.3 实验方法
1.3.1 氧化降解法制备FGOS
准确称取2.0 g亚麻籽胶(若干份),磁力搅拌状态下加入到100 mL浓度为0.2 mol/L的双氧水溶液中,螺纹口玻璃瓶密封,置于全自动高压蒸汽灭菌锅中,120 ℃反应2.0 h,反应结束后取出冷却,冰水浴10 min停止反应,抽滤,并用蒸馏水反复洗涤滤饼,合并滤液,采用1%的活性炭在50 ℃下反复脱色至糖液变为淡黄色或无色,脱色后的糖液进行超滤(截留分子质量5 000 Da)处理,滤出液稍浓缩后透析(截留分子质量500 Da)除去小分子杂质,透析袋内截留糖液再经浓缩、冷冻干燥后得到FGOS。
1.3.2 FGOS的理化性质表征
观察产品,描述其形态及色、臭、形等信息;并采用HPLC-SEC及ESI-MS、HPLC-ELSD及GC的方法表征FGOS的特性及单糖组成。ESI-MS条件为[11]:电喷雾(ESI)离子源,正离子模式,质量扫描范围0~1 000m/z,毛细管电压40 V,锥孔电压5 500 V,毛细管温度250 ℃;HPLC-ELSD条件为[12]:TSKgel Amide-80 HR色谱柱(4.6 mm ID×25 cm),洗脱液为乙腈/水=55/45,等度洗脱,流速1.0 mL/min,柱温80 ℃,ELSD检测器;GC样品前处理及气相色谱条件参考Chen等[13]的方法进行。
1.3.3 FGOS抗氧化活性评价
针药结合,一直是传统中医的特色,通过经络的刺激可以促进局部的血液循环,改善鼻腔通气,使药物能更好的发挥作用。庞智慧等[5]将90例PVOD患者随机分为3组,分别予以双侧迎香穴、上迎香穴和鼻丘针刺,利多卡因迎香穴注射以及单纯临床观察,结果发现针刺组和穴位注射组的总有效率分别为44.00%、46.70%,明显高于空白对照组,说明针刺及穴位注射均能改善PVOD患者的嗅觉功能。基于“肺开窍于鼻,肺与大肠相表里”的机理,本研究治疗采用手阳明大肠经之合谷、迎香及经外奇穴鼻通共奏宣肺气和通鼻窍之功,取足三里以培补元气、培土生金,取风池、外关疏风解表,配合膀胱经拔罐可起到振奋阳气,祛除外邪的作用。
分别测定FGOS及其对照物质(亚麻籽胶,平行对照、抗坏血酸或EDTA,阳性对照)的Fe3+还原能力(参考韩林等[14]的方法,还原能力记为As700 nm)、抗脂质氧化能力(参考Falkeborg等[15]的方法)、超氧阴离子清除能力(参考敖纯[16]的方法)及Fe2+螯合能力,评价FGOS的抗氧化活性。Fe2+螯合能力采用邻菲罗啉比色法测定:取2.0 mL系列浓度的FGOS溶液(溶于pH 4.5的1.0 mol/L的乙酸-乙酸钠缓冲液中)于试管中,加入150 μL 1 μmol/L的硫酸亚铁溶液(FeSO4·7H2O溶于0.1 mol/L的硫酸溶液中),混匀并放置10 min后加入250 μL 5 mmol/L的1,10-邻菲罗啉溶液,混匀显色10 min后测510 nm处吸光度值,记为A1,不加FGOS溶液的处理组吸光度值计为A0,不加硫酸亚铁溶液的处理组吸光度值计为A2,Fe2+螯合率=[A0-(A1-A2)]/A0×100%。
1.3.4 FGOS乳酸菌增殖活性评价
1.3.4.1 菌种活化、培养基配制及灭菌
挑取冻藏的各受试菌株(鼠李糖乳杆菌、发酵乳杆菌、植物乳杆菌、副干酪乳杆菌)接种于MRS培养基中,37 ℃恒温振荡培养24 h,取适量的活化菌悬液用0.85%灭菌生理盐水配制成浓度为107CFU/mL(麦氏比浊法)的备用菌悬液;分别配制MRS(阳性对照)、MRS无糖(阴性对照)、MRS-FGOS、MRS-XOS(阳性对照)以及MRS-亚麻籽胶(平行对照)培养基,调节pH至6.5,控制FGOS、XOS的质量浓度为2%,亚麻籽胶质量浓度为0.5%,按实验需求分装后121 ℃灭菌15 min,冷却备用。
1.3.4.2 菌种扩大培养和生长曲线绘制
采用无菌操作,将备用菌悬液按照5%(V/V)的接种量接种于培养基中,37 ℃恒温摇床培养60 h,分别在培养0、3、6、9、12、18、24、30、36、48、60 h后,以置于4 ℃冰箱中培养的对照组为参比测定600 nm下吸光度值(OD600 nm),绘制生长曲线,并分别测定pH值。
1.3.4.3 短链脂肪酸测定[17]
取2.0 mL发酵结束后的乳酸菌菌悬液于10 mL离心管中,加入0.4 mL 50%的硫酸溶液和2.0 mL二氯甲烷,漩涡混匀5 min后10 000 r/min离心5 min,取下层有机相测定短链脂肪酸含量。采用外标法,以乙酸、丙酸、丁酸、戊酸、己酸5种短链脂肪酸为标准品,气相分析条件为:DB-WAX毛细管柱、氢火焰检测器,载气为氮气,分流比10:1,程序升温,初始温度70 ℃保持1 min,然后以15 ℃/min升到160 ℃并保持6 min,然后以30 ℃/min升温至210 ℃并保持5 min,进样口温度为220 ℃,检测器温度为250 ℃,进样量5 μL。
1.3.4.4 益生指数PI值计算
按公式计算FGOS及其对照样品的益生指数[18]:
PI=[(APP60-APP0)-(APN60-APN0)]/[(APG60-APG0)-(APN60-APN0)]×100%
式中:APP0和APP60分别为添加特定待评价益生成分(FGOS,XOS及亚麻籽胶)培养0 h和60 h后600 nm下的吸光度值;APG0和APG60分别为以MRS培养基培养0 h和60 h后600 nm下的吸光度值;APN0和APN60分别为以MRS无糖培养基培养0 h和60 h后600 nm下的吸光度值。
2 结果与分析
2.1 FGOS的制备及理化性质表征
本实验采用双氧水氧化降解法以亚麻籽胶为原料制备了FGOS。从外观上来看,FGOS是一种淡红棕色半固态黏稠状物质(类似麦芽糖饴),具有特殊香味,水溶性良好,易吸湿,不溶于乙醇及乙醚等有机溶剂,具有低聚糖的一般特性。由图1a知FGOS的离子碎片主要是一些小分子糖的二聚体(m/z302.5、318.4、330.4、346.5、353.6)、三聚体(m/z512.7、540.8、563.8)、四聚体(m/z679.7、692.6、701.7)和五聚体(m/z906.0、927.9)。由图1b可知组成FGOS的共有6种组分,结合ESI-MS图谱可知FGOS是聚合度分别为1~6的低聚物的混合物,根据正相氨基柱的洗脱特性知最先洗脱出来的小峰(峰1)是一些单糖类物质,而第二个未完全分开的峰则可推测为一些二聚体的异构体,其余的峰则分别对应3~6聚体,液相色谱图进一步验证了ESI-MS正离子图谱的结果。由图1c可知,FGOS由鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖半乳糖及7种单糖组成,摩尔百分比分别为8.26%、7.54%、12.85%、7.93%、29.31%、14.28%、19.82%。
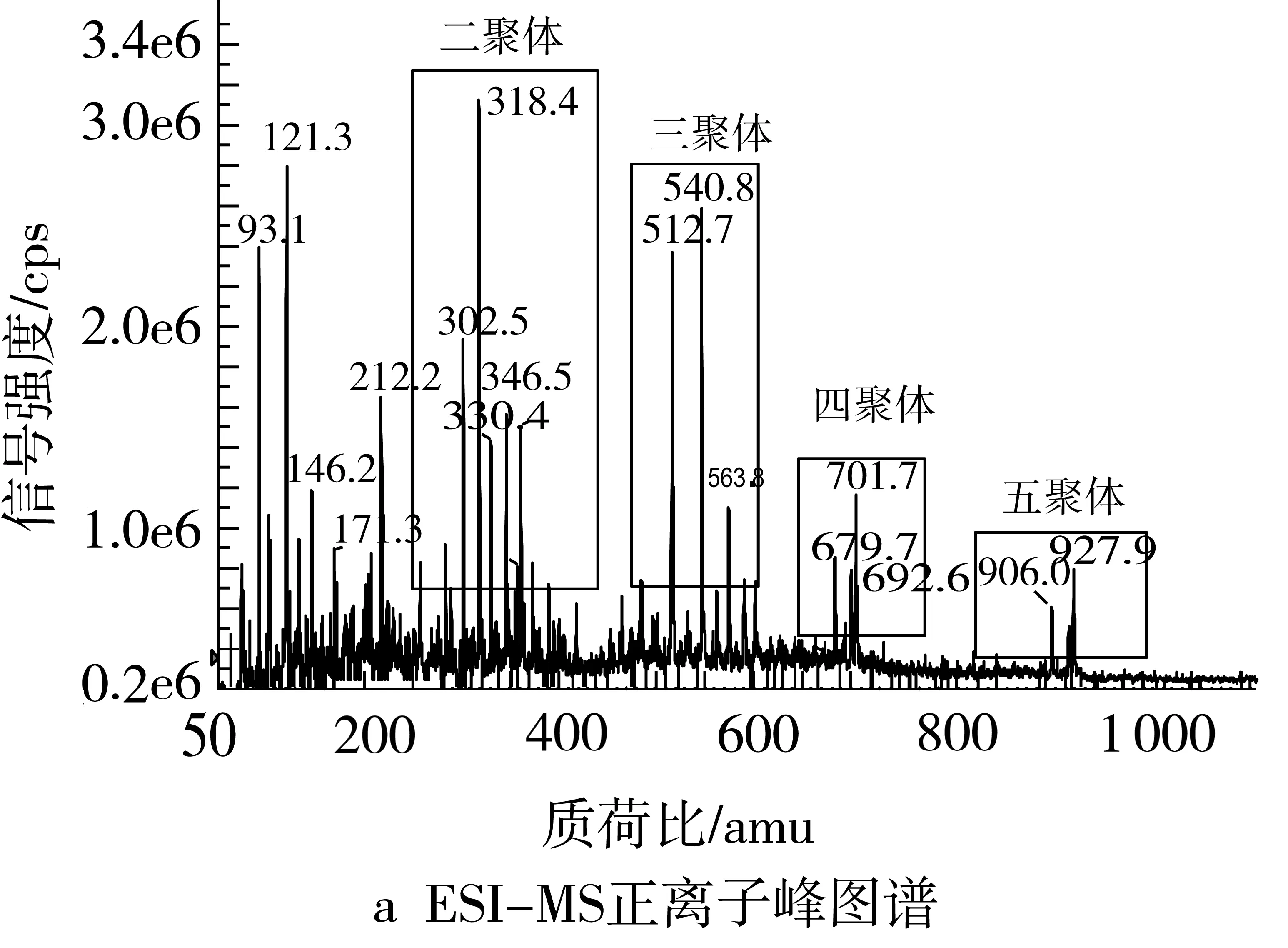

图1 FGOS的表征
2.2 FGOS抗氧化活性评价

由图2可见,抗坏血酸表现出了很强的Fe3+还原、抗脂质氧化及超氧阴离子清除能力,EDTA也表现出了很强的Fe2+螯合能力;亚麻籽胶的Fe3+还原、抗脂质氧化及超氧阴离子清除能力则明显较弱,但亚麻籽胶表现出了一定的的Fe2+螯合能力。多糖(胶)主要是通过分子中的羟基、羧基等基团与金属离子发生络合反应,从而螯合游离的金属离子[20]。整体来看,FGOS表现出了较强的抗氧化活性,而亚麻籽胶的抗氧化活性则较差。
2.3 FGOS乳酸菌增殖活性
2.3.1 FGOS作为碳源对4种乳酸菌OD值的影响
由图3可知,4种乳酸菌在以葡萄糖、XOS及FGOS为碳源的培养基上均能够良好生长,OD值随时间的延长呈规律的“S”型增长,且很显然4种乳酸菌利用葡萄糖及XOS的延滞期和对数期较短,基本在12 h内可达稳定(发酵乳杆菌利用XOS作为碳源较为特殊,延滞期较长),相比之下,4种乳酸菌利用FGOS的速度则较为缓慢,需要24 h甚至更长才能达到稳定。这说明4种乳酸菌均能够利用FGOS进行增殖,但利用效率比葡萄糖和XOS低。另一方面,4种乳酸菌利用亚麻籽胶作为碳源的OD曲线则几乎与MRS无糖培养基无异,说明4种乳酸菌均不能有效利用亚麻籽胶。4种乳酸菌中植物乳杆菌对FGOS的利用情况最好,副干酪乳杆菌和鼠李糖乳杆菌次之,发酵乳杆菌则较差,这种差异与4种乳酸菌产酶系统的不同有关[21],推测植物乳杆菌产生的酶能够较好地降解FGOS而产生可利用的单糖,从而表现出较高的益生活性。
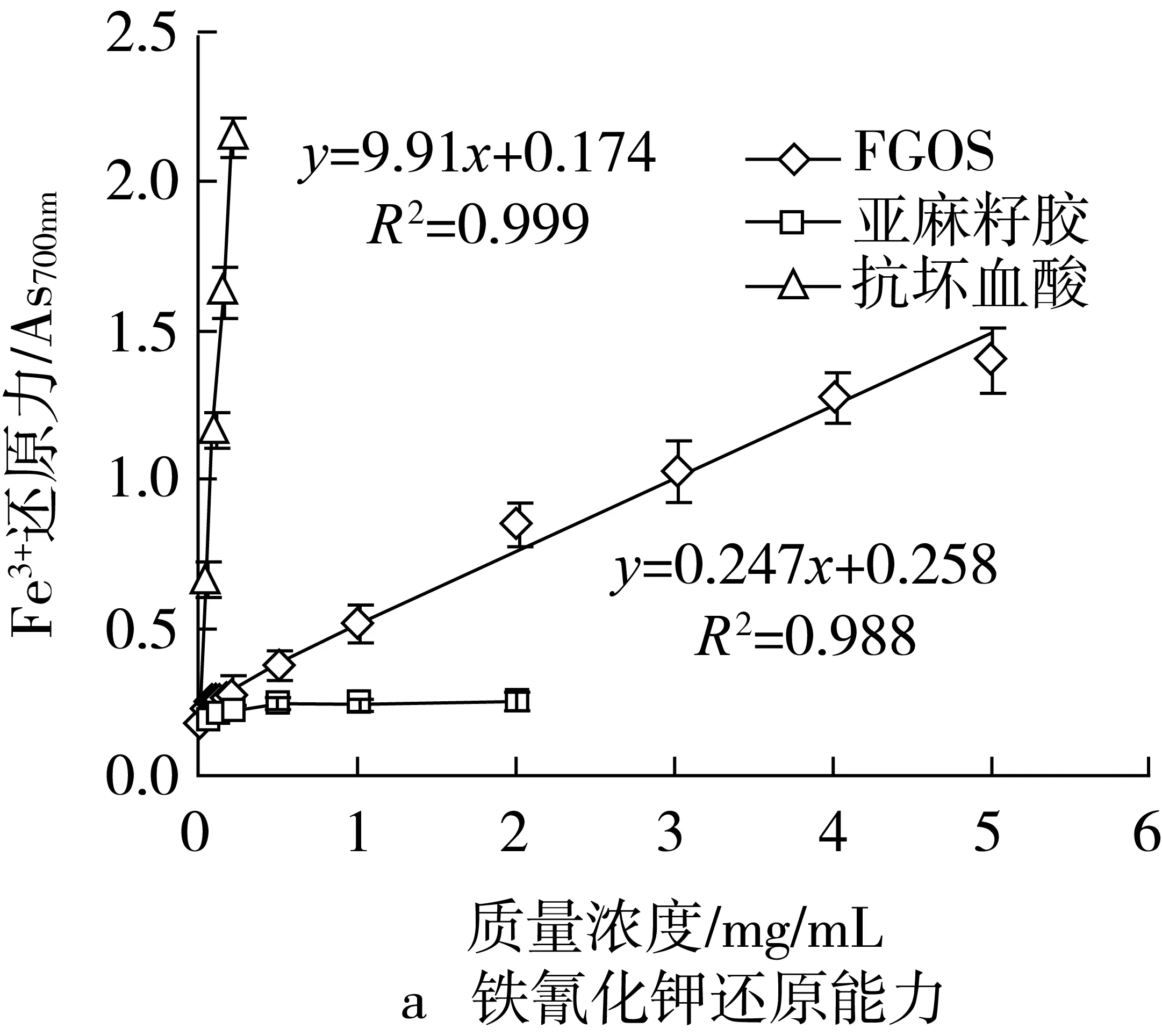
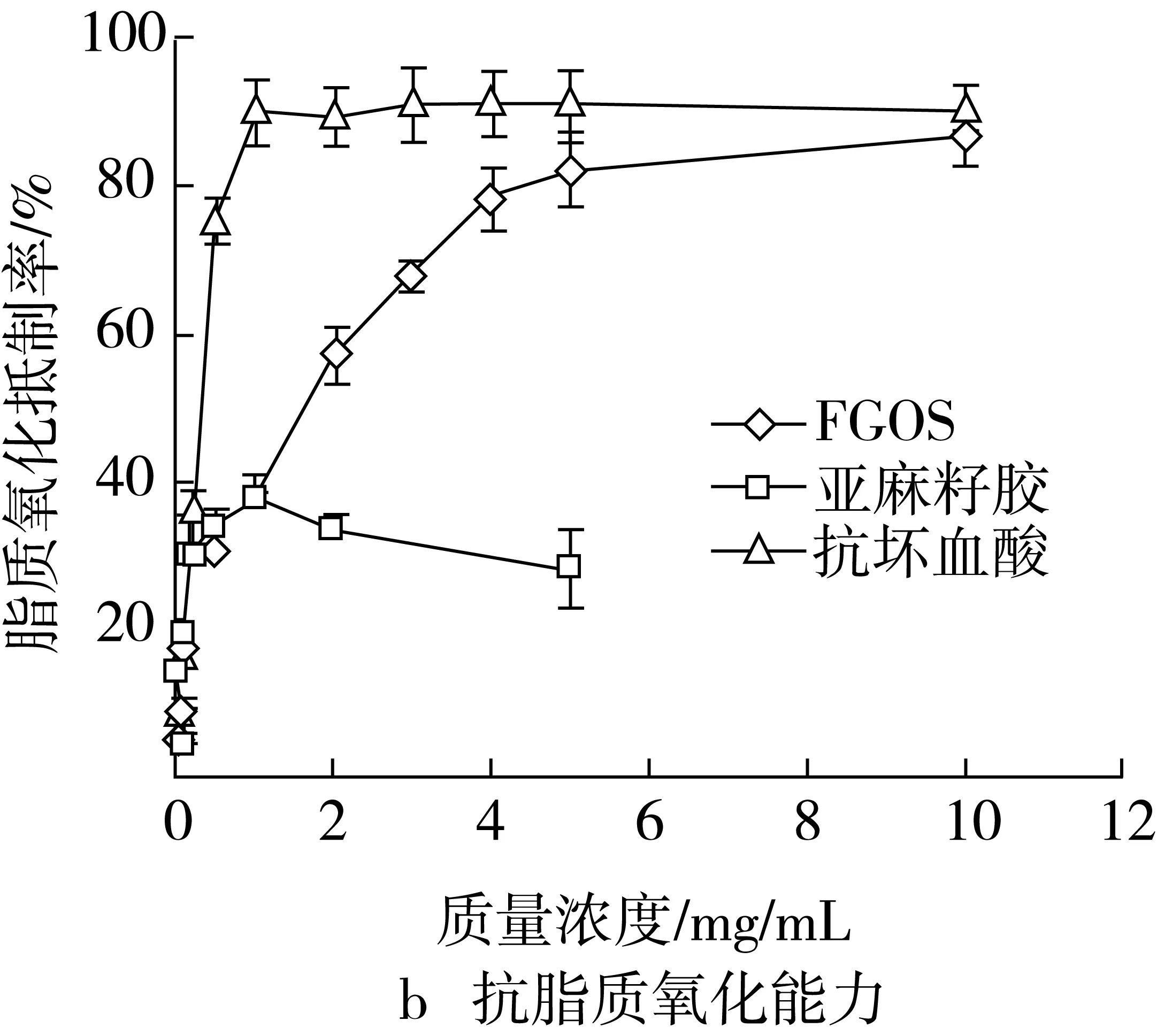


图2 FGOS及其对照物质抗氧化活性


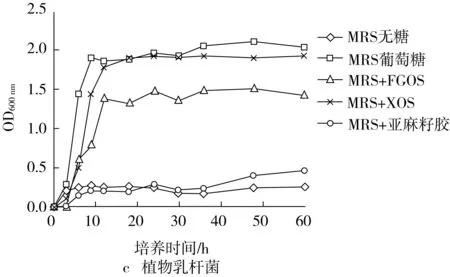

图3 FGOS及其对照物质对4种乳酸菌发酵液OD值的影响
2.3.2 FGOS作为碳源对4种乳酸菌发酵液pH值的影响
由图4可知4种乳酸菌发酵液pH值的变化趋势几乎与OD值相反,除亚麻籽胶和MRS无糖培养基之外,发酵液pH均随着培养时间的延长而降低,其中FGOS为碳源的培养基发酵液pH值下降较快,基本上可在9 h内达到最低值,这与OD值的变化规律稍有差异,说明4种乳酸菌在FGOS培养基上代谢产物积累及平衡速度要快于菌体本身的生长及平衡速度。葡萄糖及XOS为碳源的培养基发酵液pH值下降程度明显优于FGOS培养基,说明4种乳酸菌能够很好地利用葡萄糖及XOS发酵产酸,导致发酵液pH大幅下降,但在12 h之后pH值基本不再变化,即4种乳酸菌在这2种培养基上发酵产酸可在12 h内达到平衡(发酵乳杆菌利用XOS为碳源较为特殊,需36 h以上才达平衡,如图4b所示),这与OD值的变化规律是一致的。4种乳酸菌的亚麻籽胶及MRS无糖培养基发酵液pH值则无明显变化,说明4种乳酸菌不能有效利用亚麻籽胶进行发酵产酸。4种乳酸菌的FGOS培养基发酵液pH由低到高依次为,植物乳杆菌、副干酪乳杆菌、鼠李糖乳杆菌、发酵乳杆菌,这与OD值的规律基本一致。其pH值的差异主要是因为4种乳酸菌的产酸能力不同,这与它们的代谢系统尤其是酶代谢系统有关[21]。




图4 FGOS及其对照物质对4种乳酸菌发酵液pH值的影响
2.3.3 FGOS作为碳源4种乳酸菌的益生指数PI值
益生指数PI值是反映待评价益生物质被目标益生菌利用情况与葡萄糖的接近程度,其值越高说明益生效果越好[18]。由表1可知FGOS对植物乳杆菌的益生效果最好,可达到65.58%,其次是副干酪乳杆菌和鼠李糖乳杆菌,分别为25.51%和24.22%,发酵乳杆菌则相对较差,为18.84%。XOS对4种乳酸菌的益生指数均较高,亚麻籽胶对4种乳酸菌的增殖效果较差,益生指数PI值也相对较低。

表1 FGOS及其对照物质对4种乳酸菌的益生指数PI值/%
2.3.4 FGOS作为碳源对4种乳酸菌产短链脂肪酸的影响
短链脂肪酸(SCFA)是一类含2~8个碳原子的直链烷烃羧酸,是益生菌肠道发酵的重要活性代谢产物[22]。由表2可知4种乳酸菌均可有效利用FGOS为碳源产生SCFA(气相色谱图中SCFA各组分分离效果良好),经60 h发酵后SCFA总产量分别为500.66、295.79、636.32、405.86 μg/mL,整体来说SCFA的总产量为植物乳杆菌>鼠李糖乳杆菌>副干酪乳杆菌>发酵乳杆菌,这与OD及pH值的规律是一致的。从SCFA的组分来看,乙酸含量最高,其次是丁酸和戊酸,丙酸和己酸含量较低。葡萄糖及XOS有很好的SCFA的产生和蓄积能力,亚麻籽胶及MRS无糖培养基也表现出了微量的SCFA的产生能力,具体数据见表2。4种乳酸菌利用FGOS为碳源SCFA的产量低于葡萄糖及XOS,高于亚麻籽胶,这说明双氧水氧化降解亚麻籽胶制备FGOS的过程能够很好地提高亚麻籽胶的益生能力,可为亚麻籽胶产品开发提供一定的依据。

表2 4种乳酸菌在不同碳源MRS培养基上短链脂肪酸产量
注:“—”表示未检出。
3 结论
以亚麻籽胶为原料,采用双氧水氧化降解法制备了聚合度在2~6之间亚麻籽胶低聚糖(FGOS),由鼠李糖、岩藻糖、阿拉伯糖、木糖、甘露糖、葡萄糖及半乳糖7种单糖组成,摩尔比为8.26%、7.54%、12.85%、7.93%、29.31%、14.28%、19.82%;FGOS可线性还原三价铁离子,抗脂质氧化能力、超氧阴离子清除能力最高分别可达82.76%、72.93%,是一种潜在的抗氧化剂;FGOS可有效促进鼠李糖乳杆菌、发酵乳杆菌、植物乳杆菌和副干酪乳杆菌菌体生长及发酵产酸,益生指数良好,并能有效蓄积短链脂肪酸,具有开发成益生性功能食品的潜力。本研究拓展了油料作物亚麻加工副产物亚麻籽胶的应用范围,为其深度利用及其产品开发提供了参考。
[1]李小凤,赵倩竹,滕英来,等.亚麻籽胶微波辅助提取与热水浸提方法比较研究[J].中国粮油学报,2016,31(8):55-61
LI X F,ZHAO Q Z,TENG Y L,et al.Comparison of microwave assisted extraction methods and hot water extraction on flaxseed gum extraction[J].Journal of the Chinese Cereals and Oils Association,2016,31(8):55-61
[2]陈海华.亚麻籽胶的功能性质、结构及其应用[D].无锡:江南大学,2005:8-12
CHEN H H.Functional properties,structure and application of flaxseed gum[D].Wuxi:Jiangnan University,2005:8-12
[3]ELBOUTACHFAITI R,DELATTRE C,QUÉRO A,et al.Fractionation and structural characterization of six purified rhamnogalacturonans type I from flaxseed mucilage[J].Food Hydrocolloids,2017,62:273-279
[4]GUILLOUX K,GAILLARD I,COURTOIS J,et al.Production ofarabinoxylan-oligosaccharides from flaxseed(Linumusitatissimum)[J].Journal of Agricultural and Food Chemistry,2009,57(57):11308-11313
[5]RASMUSSEN L E,MEYER A S.Endogeneousβ-D-xylosidase andα-L-arabinofuranosidase activity in flax seed mucilage[J].Biotechnology Letters,2010,32(12):1883-1891
[6]WU S,CAI R,SUN Y.Degradation of curdlan using hydrogen peroxide[J].Food Chemistry,2012,135(4):2436-2438
[7]BERNACCHIA R,PRETI R,VINCI G.Chemical composition and health benefits of flaxseed[J].Austin Journal Nutrition and Food Sciences,2014,2(8):1045
[8]BOUAZIZ F,KOUBAA M,BARBA F J,et al.Antioxidant Properties of Water-Soluble Gum from Flaxseed Hulls[J].Antioxidants,2016,26(5):1-10
[9]CARDOSO CARRARO J C,DANTAS M I S,ESPESCHIT A C R,et al.Flaxseed and human health:reviewing benefits and adverse effects[J].Food Reviews International,2012,28(2):203-230
[10]THAKUR G,MITRA A,PAL K,et al.Effect of flaxseed gum on reduction of blood glucose and cholesterol in type 2 diabetic patients[J].International Journal of Food Sciencesand Nutrition,2009,60(S6):126-136
[11]万分龙,滕英来,汪勇,等.二聚甘油亚油酸酯的分离纯化及其性质分析[J].现代食品科技,2015(1):59-64
WAN F L,TENG Y L,WANG Y,et al.Separation,purification,and characterization of diglycerol linoleic acid esters[J].Modern Food Science and Technology,2015(1):59-64
[12]使用TSKgel Amide-80高效正相分配色谱填料分离糖类[G].东曹(上海)生物科技有限公司,2014:1-8
Separation of saccharides using TSKgel Amide-80,a packing material for high-performance normal phase partition chromatography[G].Tosoh Bioscience Shanghai Co.,Lid.,2014,1-8
[13]CHEN Y,XIE M Y,NIE S P,et al.Purification,composition analysis and antioxidant activity of a polysaccharide from the fruiting bodies of Ganoderma atrum[J].Food Chemistry,2008,107(1):231-241
[14]韩林,黄玉林,张海德,等.槟榔籽中抗氧化成分的提取及活性研究[J].食品与发酵工业,2009(9):157-159
HAN L,HUANG Y L,ZHANG H D,et al.Study on extraction and activity of antioxidant components in areca seeds[J].Food and Fermentation Industries,2009(9):157-159
[15]FALKEBORG M,CHEONG L Z,GIANFICO C,et al.Alginate oligosaccharides:enzymatic preparation and antioxidant property evaluation.[J].Food Chemistry,2014,164(20):185-194
[16]敖纯.虫茶醇提取物对超氧阴离子和羟基自由基的清除作用[J].肉类研究,2010(4):60-64
AO C.Scavenging effects of sandy-tea ethanol extract on super oxide anion and hydroxyl radical[J].Meat Research,2010(4):60-64
[17]罗剑鸣,饶洁,冯嘉韵,等.3种不溶性复合膳食纤维对小鼠肠道内短链脂肪酸产生的影响[J].食品科学,2012(3):225-227
LUO J M,RAO J,FENG J Y,et al.Effects of insoluble compound dietary fibers on Short-Chain Fatty Acid production in the intestinal tract of rats[J].Food Science,2012(3):225-227
[18]魏华琳,刘宾,胡长鹰,等.大蒜果聚糖对乳杆菌的体外增殖作用研究[J].食品工业科技,2010,31(10):182-185
WEI H L,LIU B,HU C Y,et al.Study on evaluation of prebiotic effects of three garlic fructans in vitro[J].Science and Technology of Food Industry,2010,31(10):182-185
[19]TSAO R.Chemistry and Biochemistry of Dietary Polyphenols[J].Nutrients,2010,2(12):1231-1246
[20]SALEHIZADEH H,SHOJAOSADATI S A.Removal of metal ions from aqueous solution by polysaccharide produced fromBacillusfirmus[J].Water Research,2003,37(17):4231-4235
[21]DENKOVA R S,YANAKIEVA V B,DENKOVA Z R.Enzymatic profile of strains of Lactobacillus fermentum isolated from different sources.[C]//International Scientific-Practical Conference,Food,Technologies and Health 2013,Plovdiv,Bulgaria,7-8 November.2013:70-75
[22]BANEL A,JAKIMSKA A,WASIELEWSKA M,et al.Determination of SCFAs in water using GC-FID.Selection of the separation system[J].Analytica Chimica Acta,2012,716:24-27.
