芝麻素通过PKCα/NF-κB信号途径抑制肥大细胞活化①
2018-03-07赵洪伟崔银锋姜京植王重阳李良昌
赵洪伟 崔银锋 姜京植 车 楠 叶 晶 王重阳 李良昌
(延边大学医学院,延吉 133002)
肥大细胞是哮喘、变应性鼻炎、类风湿关节炎等变态反应性疾病的主要效应细胞,来源于骨髓造血干细胞并能迁移到皮肤和呼吸道等内脏黏膜下微小血管的周围完成分化和成熟。抗原和免疫球蛋白E(Immunoglobulin E,IgE)交联激活肥大细胞表面的IgE高亲和力受体(High-affinity immunoglobulin E receptor Fc epsilon RI),导致细胞内Src家族酪氨酸激酶活化,激活蛋白激酶C(Protein kinase C,PKC),丝裂原活化蛋白激酶和核转录因子κB(Nuclear transcription factor kappa B,NF-κB),最终导致肥大细胞活化释放组胺、TNF-α、IL-6等炎症介质,在免疫性疾病发病过程中发挥重要的作用[1]。芝麻素是从芝麻油中提取出来的一种木脂素类化合物。近年来研究表明芝麻素可以抑制人单核细胞趋化因子的表达,减轻抗原诱导的小鼠气道炎症,同时也可以通过抑制TLR4信号减轻LPS诱导的急性肺损伤[2-4]。芝麻素表现出明显的抗炎作用,但其对肥大细胞FcεRI受体信号转导的影响缺少相关研究。本实验体外培养人肥大细胞系HMC-1细胞,利用anti-dinitrophenyl (DNP) IgE诱导肥大细胞活化,观察芝麻素对肥大细胞FcεRI受体信号转导的影响,并对其影响肥大细胞脱颗粒和炎症介质释放的作用机制进行探讨。
1 材料与方法
1.1实验材料、试剂 芝麻素、anti-DNP IgE、DNP-human serum albumin (HSA)、HEPES、β-actin抗体购自Sigma公司;抗Lyn、Syk、PKCα、IκB和磷酸化抗体,NF-κB p65和PARP抗体购自Santa Cruz公司;TNF-α、IL-6和IL-1β的ELISA试剂盒购自R&D公司;IL-8和组胺ELISA试剂盒购置默沙克公司。
1.2实验方法
1.2.1细胞培养及分组 HMC-1细胞购自美国ATCC公司,在含有10%热灭活胎小牛血清,100 U/ml 青霉素钠和100 μg/ml 链霉素的DMEM培养液中,5%CO2和37℃条件下进行培养,取对数生长期细胞用于实验。实验分成5组,对照组(Control)细胞进行正常培养,模型组(Model)细胞用10 μg/ml的 anti-DNP IgE处理6 h后再用100 ng/ml的DNP-HAS孵育10 min诱导HMC-1细胞脱颗粒。芝麻素低(Sesamin 25)、中(Sesamin 50)、高(Sesamin 100)浓度组处理同模型组,但在DNP-HAS处理前给予最终浓度25、50和100 μg/L芝麻素预处理30 min。
1.2.2细胞毒性试验 利用MTT方法检测芝麻素对肥大细胞的细胞毒性作用。将HMC-1细胞稀释浓度为1×106细胞/ml悬液,取悬液200 μl以后,并加入不同浓度芝麻素(最终浓度25、50和100 μg/L),37℃水浴箱中孵育2 h,洗净,然后加MTT 20 μl,在 37℃水浴箱中孵育1 h,形成紫色晶体,用DMSO去除多余的MTT在570 nm测量吸光度。
1.2.3肥大细胞脱颗粒率及炎症介质浓度测定 anti-DNP IgE致敏细胞后,加入25、50和100 μg/L芝麻素预处理30 min,然后DNP-HAS诱导肥大细胞脱颗粒,显微镜下任选10个视野计数脱颗粒肥大细胞数目,肥大细胞脱颗粒率(%)=(脱颗粒肥大细胞数/肥大细胞总数)×100%。脱颗粒的细胞离心取适量上清液,按试剂盒操作步骤分别测定组胺和各细胞因子浓度。
1.2.4核蛋白萃取 参照我们以前方法[5],细胞破碎后放入2倍体积的富含1.3 mol/L蔗糖,1.0 mol/L MgCl2,pH7.2的10 mmol/L PBS缓冲液,4℃,1 000 r/min离心15 min,沉淀再悬浮于富含2.2 mol/L蔗糖,1.0 mmol/L MgCl2,pH7.2的10 mmol/L PBS缓冲液中,100 000 r/min离心1 h,获得的细胞核在0.25 mmol/L蔗糖,0.5 mmol/L MgCl2和pH7.2,20 mmol/L Tris-HCl缓冲液中清洗,然后1 000 r/min离心10 min,所得沉淀在含有50 mmol/L Tris-HCl (pH7.2),0.3 mmol/L蔗糖,150 mmol/L NaCl,2 mmol/L EDTA,20%甘油,2% Triton X-100,2 mmol/L PMSF和蛋白酶抑制剂混合物中裂解,冰浴1 h后12 000 r/min离心30 min,收集上清液作为可溶性核蛋白进行分析。
1.2.5免疫印迹 收集细胞进行裂解获取蛋白,BCA方法测定蛋白浓度,每个泳道加样30 μg总蛋白,10%SDS-PAGE胶120 V,90 min进行蛋白分离,分离的蛋白250 mA,90 min电转移至PVDF膜上,5%脱脂奶粉TBS-T缓冲液孵育1 h封闭膜上非特异性位点,分别加入相应的稀释抗体4℃ 过夜。第2天,洗膜后再用HRP标记的二抗杂交,37℃ 孵育1 h。洗膜后加ECL发光试剂,利用Gel Doc进行图像采集。

2 结果
2.1MTT检测结果 给予25、50和100 μg/L的芝麻素处理HMC-1细胞,MTT结果显示实验浓度的芝麻素对HMC-1的活性无影响,见表1。
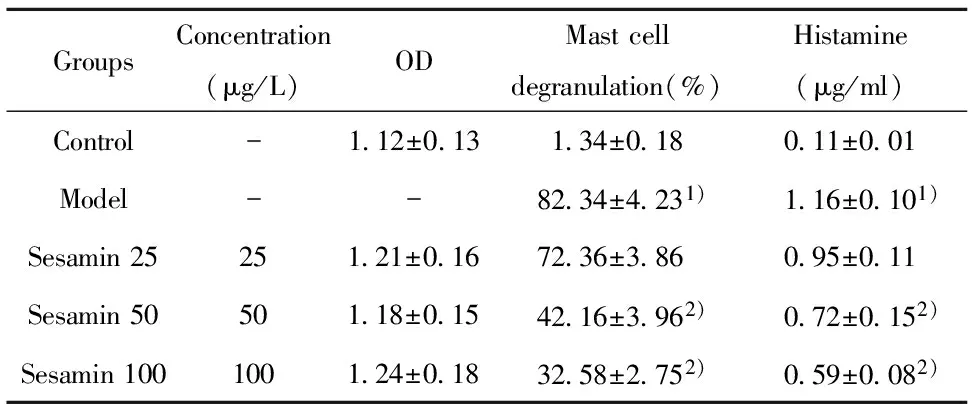
GroupsConcentration(μg/L)ODMastcelldegranulation(%)Histamine(μg/ml)Control-1 12±0 131 34±0 180 11±0 01Model--82 34±4 231)1 16±0 101)Sesamin25251 21±0 1672 36±3 860 95±0 11Sesamin50501 18±0 1542 16±3 962)0 72±0 152)Sesamin1001001 24±0 1832 58±2 752)0 59±0 082)
Note:Vs control group,1)P<0.05;vs model group,2)P<0.05.
2.2芝麻素对肥大细胞脱颗粒率和组胺释放的影响 模型组肥大细胞脱颗粒和组胺释放明显升高,与正常组比较差异有统计学意义(P<0.05)。芝麻素能明显降低肥大细胞脱颗粒率和组胺的释放,中、高 (50、100 μg/L)浓度组与模型组比较,差异具有统计学意义(P<0.05),见表1。
2.3芝麻素对HMC-1细胞因子释放的影响 肥大细胞能分泌TNF-α、IL-6、IL-1β 和IL-8等多种细胞因子,模型组DNP-HSA诱导致敏的肥大细胞活化后能明显提高这些细胞因子的释放,与对照组比较差异有显著统计学意义(P<0.05)。给予不同浓度的芝麻素预处理后能降低细胞因子的释放,芝麻素中、高浓度组与模型组比较,差异具有统计学意义(P<0.05),见表2。
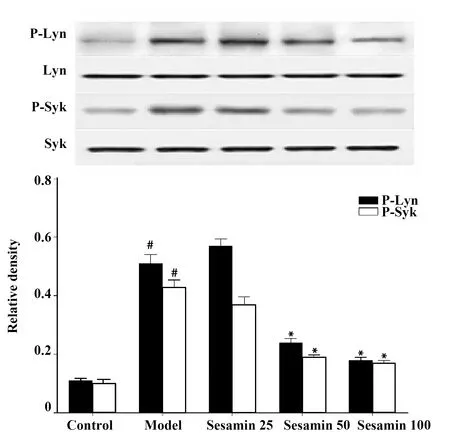
图1 芝麻素对Lyn和Syk活化的影响Fig.1 Effect of sesamin on activation of Lyn and Syk in HMC-1 cellsNote: Vs control group,#.P<0.05;vs model group,*.P<0.05.
2.4芝麻素对Lyn和Syk活化的影响 Lyn和Syk是肥大细胞FcεRI受体的下游信号分子,模型组DNP-HAS与anti-DNP IgE结合后活化FcεRI受体,Lyn和Syk磷酸化水平增高,与对照组比较差异有显著统计学意义(P<0.05)。给予不同浓度的芝麻素预处理后能降低Lyn和Syk磷酸化水平,芝麻素中、高浓度组与模型组比较,差异具有统计学意义(P<0.05),见图1。
2.5芝麻素对PKCα活化的影响 模型组PKCα磷酸化水平明显升高,与对照组比较差异有显著统计学意义(P<0.05)。芝麻素能减低PKCα磷酸化水平,芝麻素中、高浓度组与模型组比较,差异具有统计学意义(P<0.05),见图2。
2.6芝麻素对IκBα磷酸化的影响 模型组IκBα磷酸化明显升高,磷酸化的IκBα随后降解,总IκBα表现为下降,与对照组比较差异有统计学意义(P<0.05)。芝麻素中、高浓度组能明显降低IκBα磷酸化,提高总IκBα,与模型组比较差异有统计学意义(P<0.05),见图3。提示芝麻素能抑制IκBα磷酸化和降解。
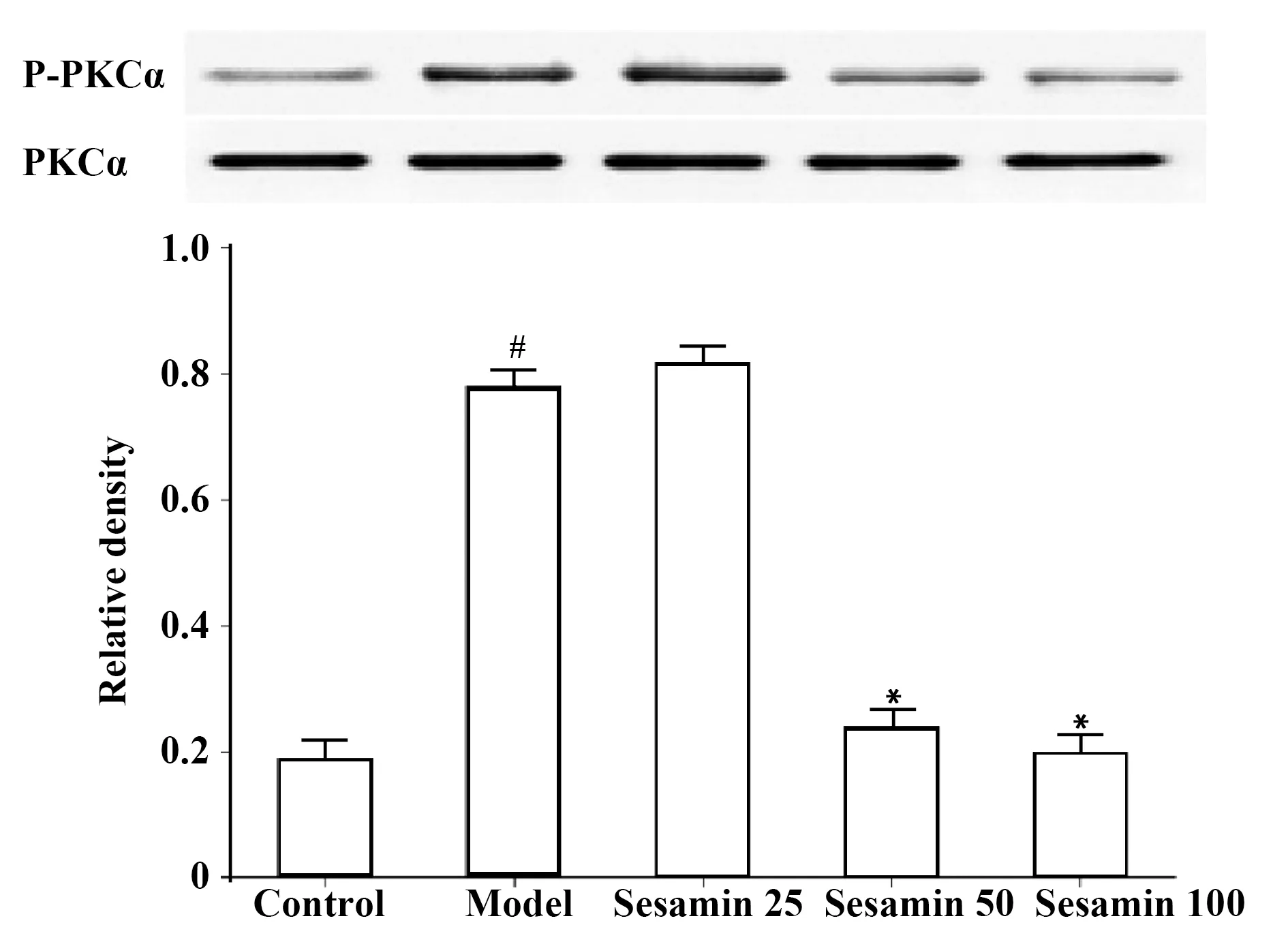
图2 芝麻素对PKCα活化的影响Fig.2 Effect of sesamin on activation of PKCα in HMC-1 cellsNote: Vs control group,#.P<0.05;vs model group,*.P<0.05.
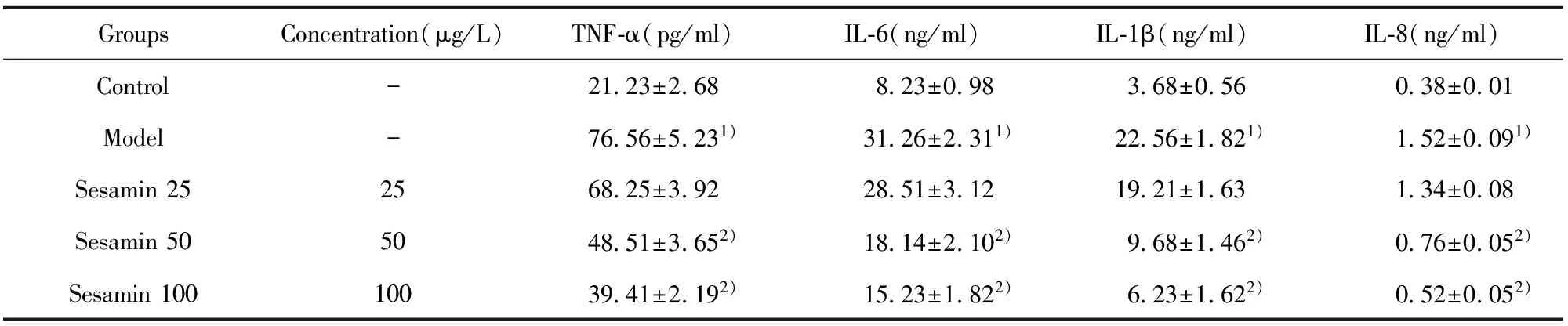
GroupsConcentration(μg/L)TNF⁃α(pg/ml)IL⁃6(ng/ml)IL⁃1β(ng/ml)IL⁃8(ng/ml)Control-21 23±2 688 23±0 983 68±0 560 38±0 01Model-76 56±5 231)31 26±2 311)22 56±1 821)1 52±0 091)Sesamin252568 25±3 9228 51±3 1219 21±1 631 34±0 08Sesamin505048 51±3 652)18 14±2 102)9 68±1 462)0 76±0 052)Sesamin10010039 41±2 192)15 23±1 822)6 23±1 622)0 52±0 052)
Note:Vs control group,1)P<0.05;vs model group,2)P<0.05.

图3 芝麻素对IκBα磷酸化的影响Fig.3 Effect of sesamin on phosphorylation of IκBα in HMC-1 cellsNote: Vs control group,#.P<0.05;vs model group,*.P<0.05.
2.7芝麻素对NF-κB活化的影响 模型组细胞浆内NF-κB p65明显减少而细胞核内明显增多,与对照组比较差异有统计学意义(P<0.05)。芝麻素中、高浓度组能明显提高细胞浆并减少细胞核内NF-κB p65,与模型组比较差异有统计学意义(P<0.05),见图4。提示芝麻素能减少NF-κB p65从细胞浆进入细胞核,抑制NF-κB p65核转位。
3 讨论
肥大细胞是变态反应的重要效应细胞,进入机体的抗原被免疫系统识别产生相应的IgE抗体,IgE抗体与肥大细胞表面受体FcεRI结合使细胞处于致敏状态,当机体再次接触同一抗原后可以活化肥大细胞,诱导肥大细胞脱颗粒,导致组胺的释放。组胺是肥大细胞释放一种重要炎症介质,能够提高局部血流量,增加血管的通透性,引起组织肿胀和瘙痒,参与变态反应的发生[6]。O′Mahony等[7]报道,组胺的作用效果依赖于组胺受体亚型的表达,降低组胺的释放量将会有效的抑制组胺介导的病理反应的发生。肥大细胞也能合成和释放TNF-α、IL-6、IL-1β和IL-8等多种炎症细胞因子,TNF-α是一种内源性致热源能导致机体体温升高,并能诱导IL-6和IL-1β产生,刺激内皮细胞和白细胞释放一氧化氮和氧自由基等炎症介质。IL-6参与急性炎症反应,IL-1β 和IL-8能够诱导内皮表达黏附因子,促使炎症细胞浸润和活化。近年来针对这些细胞因子的中和抗体,可溶性受体和受体拮抗剂在治疗炎症性疾病取得良好的疗效[8,9]。由此可见,抑制组胺和炎症细胞因子的释放能有效地控制肥大细胞介导的炎症反应。以此为研究中心,国内学者利用药用植物的有效成分如木犀草素和资木瓜中莽草酸抑制肥大细胞活化并有效的控制炎症反应[10,11]。本实验选择具有抗炎作用的芝麻素为研究对象,发现芝麻素对HMC-1细胞无毒性作用,能够抑制抗原抗体反应诱导HMC-1细胞脱颗粒,同时降低组胺和TNF-α、IL-6、IL-1β、IL-8等炎症细胞因子释放。

图4 芝麻素对NF-κB活化的影响Fig.4 Effect of sesamin on activation of NF-κB in HMC-1 cellsNote: Vs control group,#.P<0.05;vs model group,*.P<0.05.
肥大细胞释放炎症细胞因子与FcεRI受体介导的细胞内信号转导有关,FcεRI受体激活后通过Src家族激酶的Lyn磷酸化FcεRI受体的和链的免疫受体酪氨酸激活基序(Immune tyrosine activation motif,ITAM),磷酸化的ITAM暴露Src同源2(Src Homology 2,SH2)区域的锚点部位,随后酪氨酸蛋白激酶Syk被招募到磷酸化的ITAM的SH2锚点部位。本实验观察到anti-DNP IgE致敏肥大细胞后利用抗原DNP-HAS能迅速激活FcεRI受体,导致下游信号Lyn和Syk磷酸化,但两者的磷酸化都被芝麻素明显抑制,暗示芝麻素能够抑制肥大细胞FcεRI受体激活后的信号转导。肥大细胞FcεRI受体激活介导了一个复杂的信号网络转导,其中Syk是一个重要因子。Law等[12]发现磷脂酶Cα(PLCα)可以与Syk的酪氨酸残基连接并成为其作用底物,Lu等[13]等研究发现三白草提取物通过抑制Syk磷酸化和下游PLCα介导的钙离子内流减轻肥大细胞脱颗粒。这可能是芝麻素抑制肥大细胞脱颗粒的原因之一。近年来研究表明激活的Syk能够磷酸化PLCα导致PKC信号通路激活[14,15]。激活的PKC可以选择性控制IκB激酶复合物激活,随后IκBα磷酸化,磷酸化的IκBα通过泛素-蛋白酶体途径进行降解,NF-κB从与其抑制性蛋白IκB形成的复合物中释放进入细胞核,激活NF-κB与DNA上特异性序列结合引起包括TNF-α、IL-6、IL-1β和IL-8等目的基因的转录,PKC信号介导的NF-κB激活在炎症疾病中发挥重要的作用。Kim等[16]研究发现PKC/NF-κB途径激活明显提高气道上皮细胞TNF-α、IL-6、IL-1β等炎症细胞因子的mRNA水平,siRNA干扰PKCα后能明显降低这些因子的表达,Song等[17]研究发现PKCα通过磷酸化IκBα激活NF-κB介导气道变态反应性疾病,随后Zheng等[18]发现PKCα和NF-κB的表达存在着正相关,并且PKCα选择性抑制剂Gö6976能阻断佛波酯诱导的PKCα和NF-κB的激活。本实验结果表明激活的肥大细胞通过PKCα磷酸化IκBα,最终导致NF-κB活化。芝麻素对PKCα NF-κB信号途径有明显的抑制作用,综上所述,我们认为芝麻素有明显的抑制肥大细胞活化作用,它可以作用于肥大细胞表面FcεRI受体信号转导并通过抑制PKCα/NF-κB途径降低炎症介质释放。
[1] 柳 丽,周晓鹰.肥大细胞在自身免疫性疾病中的研究进展[J].中国免疫学杂志,2016,32(9):1387-1390.
Liu L,Zhou XY.Progresses and perspectives of mast cell in antoimmune diseases[J].Chin J Immunol,2016,32(9):1387-1390.
[2] Hsieh CC,Kuo CH,Kuo HF,etal.Sesamin suppresses macrophage-derived chemokine expression in human monocytes via epigenetic regulation [J].Food Funct,2014,5(10):2494-2500.
[3] Li L,Piao H,Zheng M,etal.Sesamin attenuates allergic airway inflammation through the suppression of nuclear factor-kappa B activation [J].Exp Ther Med,2016,12(6):4175-4181.
[4] Qiang L,Yuan J,Shouyin J,etal.Sesamin attenuates lipopolysaccharide-induced acute lung injury by inhibition of TLR4 signaling pathways [J].Inflammation,2016,39(1):467-472.
[5] Li L,Jin G,Jiang J,etal.Cornuside inhibits mast cell-mediated allergic response by down-regulating MAPK and NF-κB signaling pathways [J].Biochem Biophys Res Commun,2016,473(2):408-414.
[6] James C,Bernstein JA.Current and future therapies for the treatment of histamine-induced angioedema [J].Expert Opin Pharmacother,2017,18(3):253-262.
[7] O′ Mahony L,Akdis M,Akdis CA.Regulation of the immuneresponse and inflammation by histamine and hista mine receptors [J].J Allergy Clin Immunol,2011,128(6):1153-1162.
[8] Eng GP,Bouchelouche P,Bartels EM,etal.Anti-drug antibodies,drug levels,interleukin-6 and soluble TNF receptors in rheumatoid arthritis patients during the first 6 months of treatment with adalimumab or infliximab:a descriptive cohort study [J].PLoS One,2016,11(9):e0162316.
[9] Hügle B,Speth F,Haas JP.Inflammatory bowel disease following anti-interleukin-1-treatment in systemic juvenile idiopathic arthritis [J].Pediatr Rheumatol Online J,2017,15(1):16-20.
[10] 郑倩倩,董甜甜,李世刚,等.资木瓜中莽草酸对大鼠腹腔肥大细胞脱颗粒及抗炎作用研究[J].中国免疫学杂志,2017,33(7):1035-1038.
Zheng QQ,Dong TT,Li SG.Degranulation and anti-inflammatory effects of shikimic acid in chaenomeles speciosa on peritoneal mast cells in rats[J].Chin J Immunol,2017,33(7):1035-1038.
[11] 余 洁,骆晓蓉.木犀草素对肥大细胞脱颗粒影响及机制的研究[J].中国免疫学杂志,2016,32(8):1153-1156.
Yu J,LUO XP.Effect of luteolin on mast cell degranulation and its mechanism of action[J].Chin J Immunol,2016,32(8):1153-1156.
[12] Law CL,Chandran KA,Sidorenko SP,etal.Phospholipase C-gamma1 interacts with conserved phosphotyrosyl residues in the linker region of Syk and is a substrate for Syk [J].Mol Cell Biol,1996,16(4):1305-1315.
[13] Lu Y,Li Y,Seo CS,etal.Saucerneol D inhibits eicosanoid generation and degranulation through suppression of Syk kinase in mast cells [J].Food Chem Toxicol,2012,50(12):4382-4388.
[14] Kope A,Panaszek B,Fal AM.Intracellular signaling pathways in IgE-dependent mast cell activation [J].Arch Immunol Ther Exp (Warsz),2006,54(6):393-401.
[15] Yu M,Lowell CA,Neel BG,etal.Scaffolding adapter Grb2-associated binder 2 requires Syk to transmit signals from FcepsilonRI [J].J Immunol,2006,176(4):2421-2429.
[16] Kim H,Zamel R,Bai XH,etal.PKC activation induces inflammatory response and cell death in human bronchial epithelial cells [J].PLoS One,2013,8(5):e64182.
[17] Song T,Zheng YM,Vincent PA,etal.Canonical transient receptor potential 3 channels activate NF-κB to mediate allergic airway disease via PKC-α/IκB-α and calcineurin/IκB-β pathways [J].FASEB J,2016,30(1):214-229.
[18] Zheng J,Kong C,Yang X,etal.Protein kinase C-α (PKCα) modulates cell apoptosis by stimulating nuclear translocation of NF-kappa-B p65 in urothelial cell carcinoma of the bladder[J].BMC Cancer,2017,17(1):432-443.