乳腺癌微环境成纤维细胞对乳腺癌细胞表达TIGAR和Bcl-2的影响①
2018-03-07陈少芬李文林石小玉
刘 赛 陈少芬 李文林 石小玉
(南昌大学医学部基础医学院,南昌 330006)
乳腺癌是女性常见癌症,是导致女性因癌症死亡的最主要原因[1,2]。自2000年以来,女性乳腺癌的发病率持续增长[3,4],在中国,乳腺癌是45岁以下女性癌症死亡的主要原因,其死亡率呈上升趋势[5]。乳腺癌是多因素、多因子参与的疾病,其发病原因和机制较为复杂,需深入研究。TP53诱导型糖酵解和细胞凋亡调节剂(TP53-induced glycolysis and apoptosis regulator,TIGAR)是肿瘤代谢调节因子和凋亡抑制蛋白,TIGAR能降低细胞中的果糖-2,6-二磷酸水平,导致糖酵解的抑制和细胞内活性氧水平的降低,从而保护细胞免受ROS相关凋亡[6]。B-cell lymphoma-2(Bcl-2)是Bcl家族中最主要的凋亡抑制蛋白,参与肿瘤细胞的凋亡调节[7],靶向Bcl-2是肿瘤分子治疗需探索的一条新途径[8,9]。成纤维细胞是肿瘤间质微环境中主要细胞,对肿瘤的发生和发展起着重要的作用[10,11],本文研究了成纤维细胞与乳腺癌细胞共生长条件下,成纤维细胞对乳腺癌细胞TIGAR和Bcl-2的表达及对乳腺癌生长的影响,试图为乳腺癌的发病机制研究提供新资料。
1 材料与方法
1.1主要实验材料 人乳腺癌细胞株MDA-MB-231购于中科院上海细胞资源中心,人皮肤成纤维细胞株CCC-ESF-1(ESF)购自中国医科院基础医学研究所细胞中心,雌性裸鼠购自上海斯莱克实验动物有限责任公司(许可证号SCXK沪2012-0002),胎牛血清(Wisent生物技术中国有限公司),DMEM-H培养基(美国Life Tech-Gibco公司),RevertAid first strand cDNA 试剂盒(美国 Thermo Fisher 公司),qPCR试剂IQSYBRGreen Supermix(美国Bio-Rad 公司),RNA提取试剂盒(上海吉玛生物公司),相关基因引物(上海吉玛生物公司),鼠抗β-actin单克隆抗体 (北京中衫金桥生物技术有限公司),鼠抗人Bcl-2单克隆抗体(美国Bioworld公司),鼠抗人TIGAR单克隆抗体(美国Santa Cruz公司),羊抗鼠Ig(美国Santa Cruz公司),一步法聚合物 PV6002试剂盒(北京中衫金桥生物技术有限公司),孔径0.4 μm Transwell小室(美国Corning公司),Caspase-3活性荧光检测试剂盒和Annexin V凋亡试剂盒(Abcam中国分公司)等。
1.2实验方法
1.2.1细胞培养及共培养 将MDA-MB-231细胞和ESF细胞放入含10%胎牛血清的DMEM-H 培养基中,置于37℃、5%CO2培养箱中培养,维持饱和湿度,待细胞生长至80%~90%汇合时,进行传代培养。实验分为三组:ESF单独培养组、ESF+MDA-MB-231共培养组、MDA-MB-231单独培养组。用6孔板和Transwell小室对ESF细胞和MDA-MB-231细胞进行体外共培养,小室接种细胞量为1.5×105/室,6孔板接种细胞量为2×105/孔。
1.2.2RT-qPCR实验 用Trizol 法提取细胞总RNA,取2 μl 提取的RNA溶液,用分光光度计检测,观察A260/A280、A260/A230 比值及连续波长吸收峰,计算RNA 溶液浓度,判断RNA 提取质量,2.3>A260/A280>2.0时,可用于后续逆转录实验。以β-actin为内参,β-actin引物:上游引物5′-GAGAAAATCTGGCACACC-3′,下游引物5′-GGATAGCACAGCCTGGATAGCAA-3′;Bcl-2引物:上游引物5′-CACCCCCTCGTCCAAGAATG-3′,下游引物 5′-GCCACTCGTAGCCCCTCTGC-3′;TIGAR引物:上游引物5′-CAGCGGTATTCCAGGATTAG-3′,下游引物5′-ACCTTAGCGAGTTTCAGTCAG-3′。逆转录合成cDNA,-20℃保存cDNA。荧光定量PCR 扩增实验,反应条件:50℃ 3 min,95℃ 3 min;95℃ 10 s,55℃20 s(Bcl-2:63.5℃ 20 s),72℃ 30 s,40个循环;溶解曲线温度65~95℃。实验结果由荧光定量PCR软件Bio-Rad CFX Manager自动进行统计和计算分析。
1.2.3Western blot实验 PBS分别洗涤细胞后用蛋白提取试剂盒提取总蛋白,BCA法测定蛋白浓度。10%聚丙烯酰胺凝胶电泳进行蛋白分离,转移至PVDF膜,室温下5%脱脂奶粉摇床封闭3 h,分别加入β-actin一抗、TIGAR一抗和Bcl-2一抗,4℃过夜孵育一抗,加入二抗并于摇床上室温孵育1~2 h,ECL显色曝光,观察并拍照,用Image J软件分析各条带光密度 。
1.2.4Annexin V凋亡实验 收集细胞,每一实验样本细胞数量为1×105,实验组每管加5 μl Annexin V-Biotin ,对照组每管加5 μl 7-amino-actinomycin(7-AAD),用7-AAD以区别凋亡细胞与其他死细胞,室温避光孵育 15 min;再在实验组每管中加入Streptavidin-FITC,室温避光孵育15 min,流式细胞仪检测。
1.2.5Caspase-3活性荧光检测实验 提取细胞总蛋白,BCA法进行蛋白定量,实验设空白对照孔和待测样品孔,均加入含荧光底物AC-DEVD-AMC的Caspase-3反应缓冲液(45 μl /孔),空白每孔加5 μl细胞裂解液(含Cocktail),待测样品每孔加10 μg(5 μl)细胞总蛋白,荧光分光光度计检测AMC释放量,分析荧光强度。
1.2.6人乳腺癌裸鼠移植瘤模型的建立 取6~7周龄雌性裸鼠,随机实验分组:①ESF+MDA-MB-231组;② MDA-MB-231组;③ESF组,分别向每组裸鼠右侧胸壁第二乳腺注入100 μl细胞悬液(MDA-MB-231细胞浓度为2×106、ESF细胞浓度为0.5×106)。每隔1 d用游标卡尺测量瘤体的最长径(a)和最短径(b),以肿瘤长径达5 mm为成瘤(成瘤约在细胞接种后的7 d左右)。 根据公式计算肿瘤体积并绘制肿瘤生长曲线,肿瘤的体积计算公式:V(mm3)=1/6πab2。在裸鼠成瘤30 d后将裸鼠颈椎脱臼处死,取出肿瘤组织放入4%福尔马林溶液中固定,石蜡包埋切片,HE染色和免疫组织化学实验。
1.2.7裸鼠移植瘤组织HE染色 石蜡切片经脱蜡至水后,用苏木素-伊红(HE)常规染色,在光学显微镜下观察并拍照。
1.2.8裸鼠移植瘤组织免疫组织化学实验 石蜡切片脱蜡至水,滴加3%H2O2,37℃孵育10 min,置入0.01 mol/L枸橼酸缓冲液(pH6.0)中,入微波炉修复抗原,正常羊血清工作液封闭37℃正常血清工作液作用30 min,滴加一抗4℃孵育过夜,室温平衡30 min,滴加相应二抗,37℃孵育30 min,DAB显色,苏木素复染,光学显微镜下观察和拍照,Image-Pro Plus软件分析。

2 结果
2.1与成纤维细胞共培养的乳腺癌细胞TIGAR和Bcl-2表达上调 RT-qPCR实验检测乳腺癌细胞MDA-MB-231的TIGAR和Bcl-2 mRNA表达,结果如图1所示,与MDA-MB-231细胞单独培养组比较,MDA-MB-231细胞+ESF细胞共培养组TIGAR mRNA表达显著上调(P<0.05),是单独培养组的1.53倍;共培养组MDA-MB-231细胞Bcl-2 mRNA表达显著上调(P<0.05),是单独培养组的1.44倍。Western blot实验检测MDA-MB-231细胞TIGAR和Bcl-2的蛋白表达,结果如图2所示,与MDA-MB-231细胞单独培养组比较,共培养组MDA-MB-231细胞TIGAR和Bcl-2蛋白表达显著上调(P<0.05),分别是单独培养组的1.49和1.81倍。上述结果说明乳腺癌微环境的成纤维细胞能上调乳腺癌细胞抗凋亡因子TIGAR和Bcl-2 mRNA和蛋白的表达。
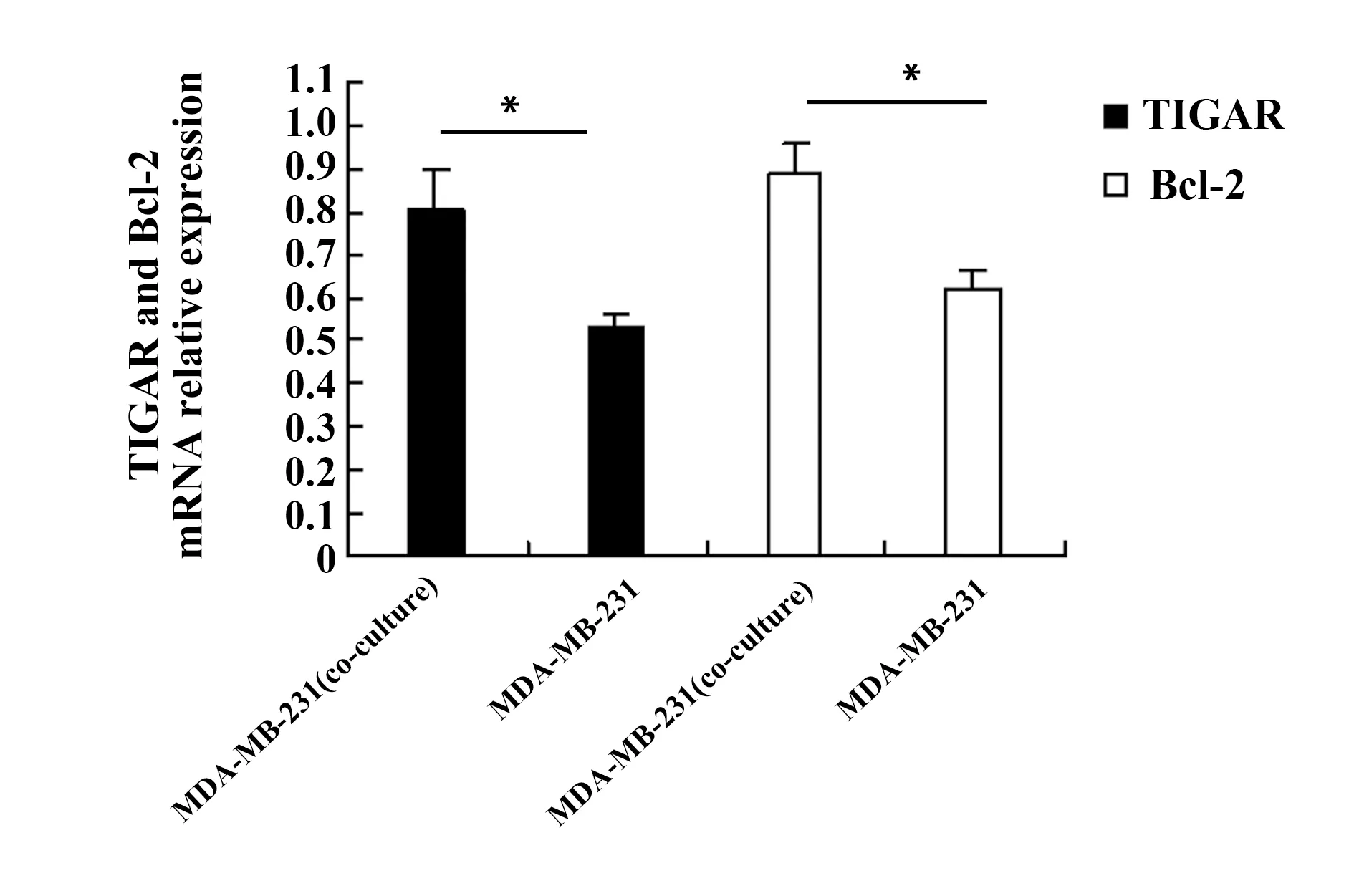
图1 RT-qPCR检测体外培养的MDA-MB-231细胞抗凋亡因子TIGAR和Bcl-2 mRNA的表达Fig.1 mRNA expression of TIGAR and Bcl-2 in MDA-MB-231 cells detected by RT-qPCR in vitro Note: *.P<0.05.
2.2与成纤维细胞共培养的乳腺癌细胞凋亡下降在与成纤维细胞ESF共培养条件下,乳腺癌细胞MDA-MB-231的抗凋亡因子TIGAR和Bcl-2表达上调。MDA-MB-231细胞Caspase-3凋亡蛋白酶活性实验结果显示(图3A),MDA-MB-231细胞+ESF细胞共培养组MDA-MB-231细胞Caspase-3荧光强度显著低于MDA-MB-231细胞单独培养组(P<0.05),表明在ESF细胞共培养的微环境下乳腺癌细胞Caspase-3活性降低,这将有利于乳腺癌细胞生长。Annexin V细胞凋亡实验结果显示(图3B),与单独培养组比较,共培养组早期凋亡的MDA-MB-231细胞下降了2.12倍(4.85/2.29),说明乳腺癌微环境的成纤维细胞通过上调乳腺癌细胞抗凋亡因子TIGAR和Bcl-2的表达从而抑制乳腺癌细胞的凋亡。
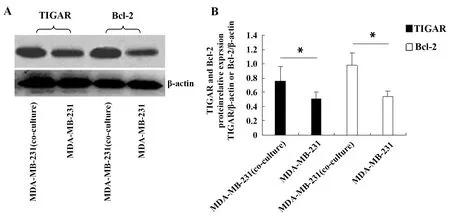
图2 Western blot检测体外培养的MDA-MB-231细胞抗凋亡因子TIGAR和Bcl-2蛋白的表达Fig.2 Protein expression of TIGAR and Bcl-2 in MDA-MB-231 cells detected by Western blot in vitroNote: A.The electrophoretic bands of TIGAR and Bcl-2 proteins in each group detected by Western blot;B.The optical density of electrophoretic bands of TIGAR and Bcl-2 proteins in each group analyzed by Image J; *.P<0.05.
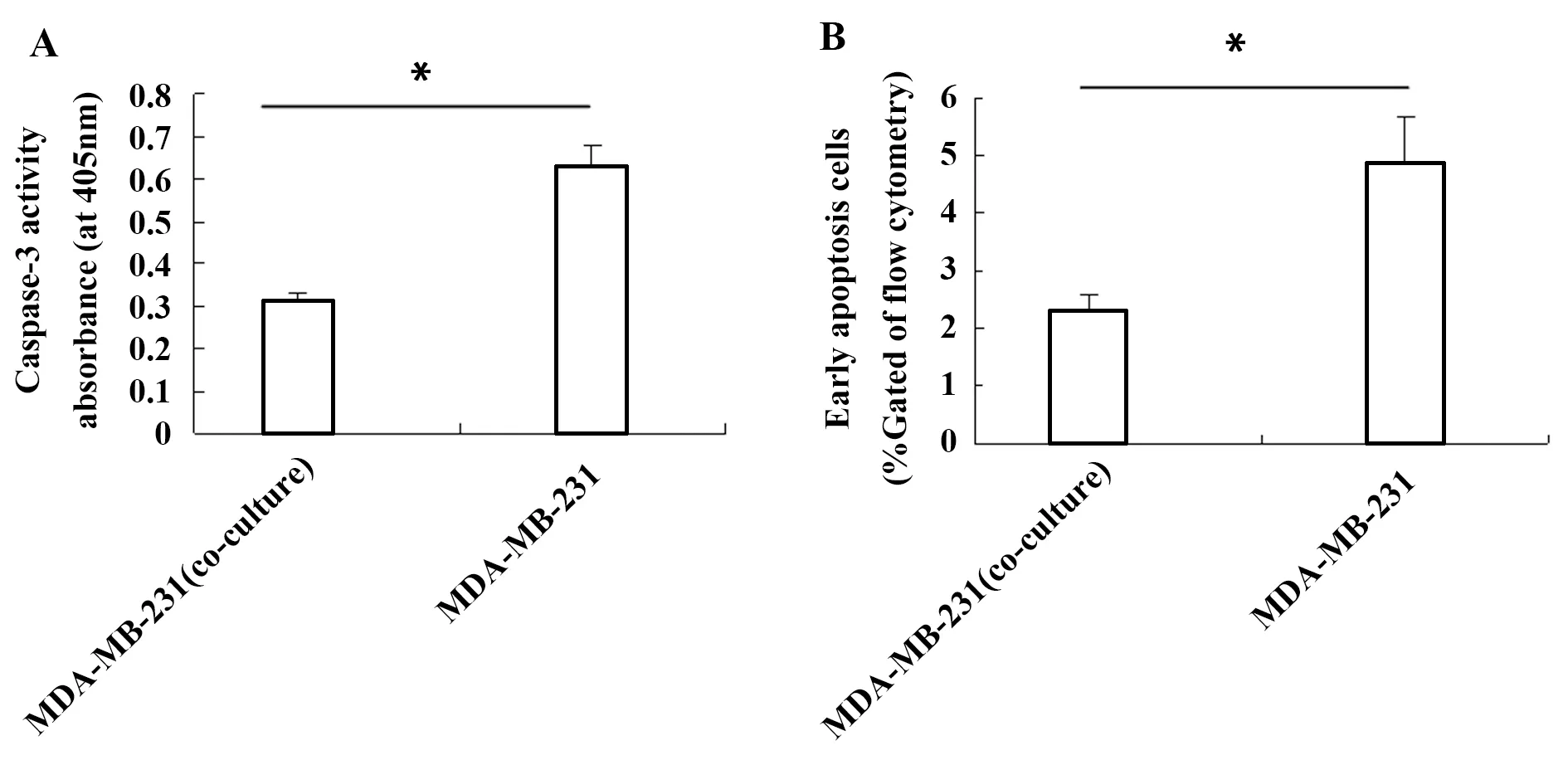
图3 Caspase-3活性和Annexin V检测MDA-MB-231 细胞凋亡Fig.3 MDA-MB-231 cell apoptosis detected by Caspase-3 activity and Annexin VNote: A.Caspase-3 activity in MDA-MB-231 cells detedted by fluorescence;B.MDA-MB-231 cell apoptosis detected by Annexin V and flow cytometry; *.P<0.05.
2.3裸鼠移植瘤微环境的成纤维细胞促进肿瘤生长 将ESF细胞和MDA-MB-231细胞接种于6~7周的雌性裸鼠右侧胸壁第二乳腺,第5天,可在ESF+MDA-MB-231组和MDA-MB-231组的裸鼠乳腺触及肿瘤小结节,7~10 d肿瘤最长径达5 mm,成瘤率为100%,人乳腺癌裸鼠荷瘤模型构建成功(图4A)。第30天,将荷瘤裸鼠颈椎脱臼处死,取瘤组织块,制成石蜡切片,HE染色。400倍显微镜下观察,可见正常乳腺小叶结构消失,细胞聚集成巢,排列紊乱,核大,出现组织结构的异型性,HE染色证实为癌组织(图4B)。在接种后的第1天至第16天ESF+MDA-MB-231组与MDA-MB-231组的肿瘤体积差异无统计学意义(P>0.05),自第18天起ESF+MDA-MB-231组的肿瘤体积较MDA-MB-231组大(图5和表1),表明成纤维细胞与乳腺癌细胞共同移植入雌性裸鼠乳腺内所形成的肿瘤生长快于乳腺癌细胞单独移植,裸鼠移植瘤微环境成纤维细胞具有促进肿瘤生长的作用。
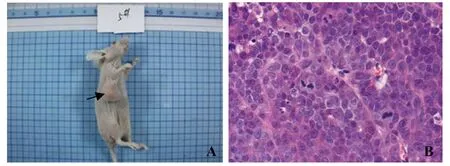
图4 人乳腺癌荷瘤裸鼠移植瘤Fig.4 Human breast cancer-transplanted tumor in nude miceNote: A.The transplanted tumor in nude mice;B.The transplanted tumor tissues stained by HE (×400).
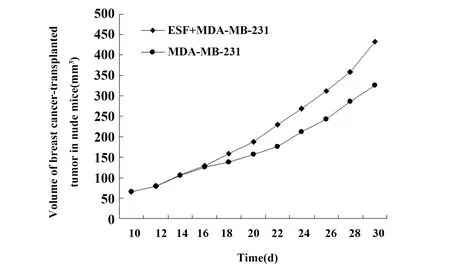
图5 人乳腺癌裸鼠移植瘤生长曲线Fig.5 Growth curve of human breast cancer-transplanted tumor in nude mice
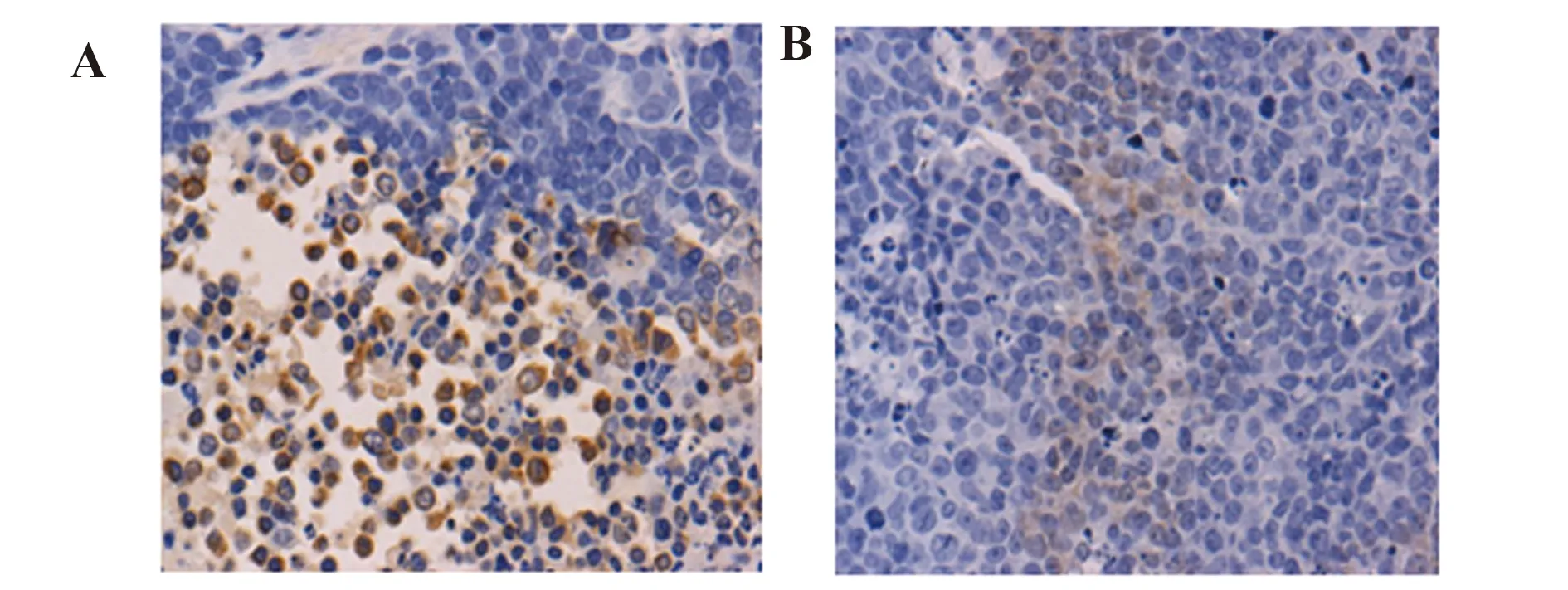

图6人乳腺癌荷瘤裸鼠移植瘤组织TIGAR的表达
Fig.6ExpressionofTIGARofhumanbreastcancer-transplantedtumortissuesinnudemice
Note: A.The immunohistochemical optical micrograph (×400) of TIGAR in the transplanted tumor tissues of ESF+MDA-MB-231 groups;B.The immunohistochemical optical micrograph (×400) of TIGAR in the transplanted tumor tissues of MDA-MB-231 groups;C.The optical density of immunohistochemical staining of TIGAR in the transplanted tumor tissues of ESF+MDA-MB-231 groups and MDA-MB-231 groups analyzed by Image-pro-plus 5.1 software; *.P<0.05.

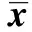

Group10d12d14d16d18d20dESF+MDA⁃MB⁃231(n=16)65 11±10 0979 86±21 65107 51±37 01128 55±41 96159 02±53 891)188 32±68 621)MDA⁃MB⁃231(n=16)64 96±11 1280 07±22 01105 67±38 32125 01±38 32138 22±47 04156 66±58 23Group22d24d26d28d30dESF+MDA⁃MB⁃231(n=16)229 98±87 781)268 83±96 541)312.17±105 691)359 21±116 721)432 09±127 861)MDA⁃MB⁃231(n=16)176 47±61 36211 56±73 35243 85±89 06285 36±99 01325 77±106 54
Note:Compared with MDA-MB-231 group,1)P<0.01.
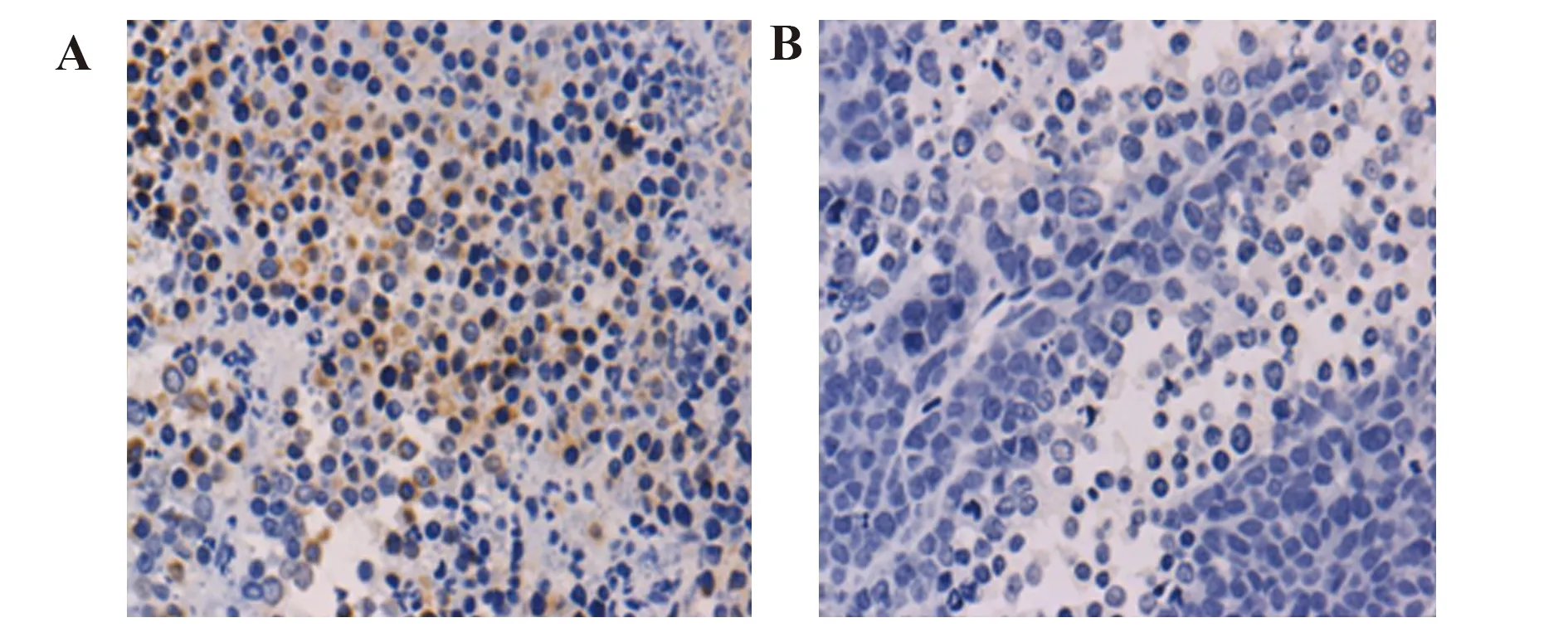
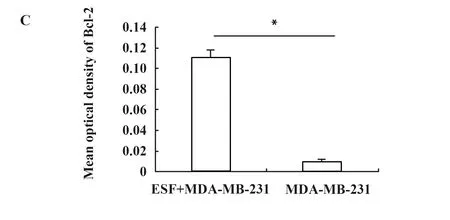
图7人乳腺癌荷瘤裸鼠移植瘤组织Bcl-2的表达
Fig.7ExpressionofBcl-2ofhumanbreastcancer-transplantedtumortissuesinnudemice
Note: A.The immunohistochemical optical micrographs (×400) of Bcl-2 in the transplanted tumor tissues of ESF+MDA-MB-231 groups;B.The immunohistochemical optical micrographs (×400) of Bcl-2 in the transplanted tumor tissues of MDA-MB-231 groups;C.The optical density of immunohistochemical staining of Bcl-2 in the transplanted tumor tissues of ESF+MDA-MB-231 groups and MDA-MB-231 groups analyzed by Image-pro-plus 5.1 software; *.P<0.05.
2.4TIGAR和Bcl-2在人乳腺癌裸鼠移植瘤组织的表达 免疫组化实验检测TIGAR和Bcl-2在裸鼠移植瘤组织中的表达,TIGAR和Bcl-2的阳性结果为细胞质出现棕黄色颗粒 (图6A、B和图7A、B)。每组随机选取5张切片,每张切片选择5个不同视野在×400倍光学显微镜下进行观察拍照,采用Image-pro-plus 5.1软件测量两组移植瘤组织切片TIGAR和Bcl-2的光密度,计算平均光密度,结果显示(图6C和图7C),与MDA-MB-231组比较,ESF+MDA-MB-231组移植瘤组织TIGAR和Bcl-2的平均光密度值大(P<0.05),ESF+MDA-MB-231组荷瘤裸鼠移植瘤组织中TIGAR和Bcl-2的表达显著高于MDA-MB-231组移植瘤组织。表明乳腺癌细胞与成纤维细胞共生长的微环境可促进移植瘤组织TIGAR和Bcl-2的表达。
3 讨论
癌症的发生和发展不仅与肿瘤本身恶性增殖和侵袭等有关,还与它所处的微环境即肿瘤微环境密切相关[12]。肿瘤微环境包括细胞外基质、成纤维细胞(癌相关成纤维细胞,CAFs)、血管、免疫细胞和因子等[13]。其中成纤维细胞占肿瘤微环境的大部分,它通过分泌细胞因子和对细胞外基质的修饰等方式作用肿瘤细胞,对肿瘤的生长起着重要作用[14,15]。为了模拟乳腺肿瘤微环境,我们采用Transwell 方法,将人乳腺癌细胞MDA-MB-231与人成纤维细胞ESF在同一培养液内培养,但细胞不互混,建立了人乳腺癌细胞与人成纤维细胞体外共培养模型;将人乳腺癌细胞MDA-MB-231与人成纤维细胞ESF共同植入裸鼠乳腺内,建立了人乳腺癌细胞与人成纤维细胞体内共生长模型。通过体内体外模拟的乳腺肿瘤微环境模型,研究成纤维细胞对乳腺癌细胞TIGAR和Bcl-2表达的影响及对乳腺癌生长的影响。
在恶性肿瘤发生和发展的过程中,抑制癌细胞凋亡起着重要作用。Bcl家族在细胞凋亡信号转导途径中发挥重要作用,Bcl家族的表达和调控是影响细胞凋亡的关键因素之一[16,17]。Bcl-2是Bcl家族中最主要的凋亡抑制蛋白,与多数肿瘤的发生、发展有关,通过抑制细胞凋亡和抵抗其他形式的细胞死亡导致细胞数增多,对肿瘤的生长具有促进作用[18]。TIGAR是一凋亡抑制因子,可导致细胞内糖酵解下降和糖有氧氧化下降,减少ROS(活性氧族)的产生,保护细胞免于ROS相关的凋亡,在氧化应激下TIGAR可降低自噬水平促进细胞存活,在能量限制下,可以通过增加呼吸率提升能量供给,减少饥饿诱导的细胞死亡[19,20]。
本研究体外实验结果显示,在共培养条件下,成纤维细胞能上调乳腺癌细胞TIGAR和Bcl-2的表达,RT-qPCR和Western blot的实验结果相互印证。随后研究了TIGAR和Bcl-2表达上调对乳腺癌细胞凋亡的影响,采用Annexin V-Biotin流式细胞术和Caspase-3活性荧光检测乳腺癌细胞凋亡,实验结果显示,成纤维细胞+乳腺癌细胞共培养组的乳腺癌细胞凋亡低于乳腺癌细胞单独培养组,表明肿瘤微环境的成纤维细胞通过上调乳腺癌细胞TIGAR和Bcl-2的表达从而抑制乳腺癌细胞凋亡促进肿瘤生长。我们的体内实验结果显示,成纤维细胞+乳腺癌细胞共生长组的荷瘤裸鼠乳腺癌组织TIGAR和Bcl-2的表达上调,成纤维细胞与乳腺癌细胞共同移植入雌性裸鼠乳腺内所形成的肿瘤体积大于乳腺癌细胞单独移植,表明基质成纤维细胞可促进乳腺癌细胞生长,且涉及乳腺癌微环境成纤维细胞上调乳腺癌细胞的抗凋亡因子TIGAR和Bcl-2的表达,TIGAR和Bcl-2的高表达致使荷瘤裸鼠乳腺癌生长加快。
综上所述,乳腺癌微环境成纤维细胞可上调乳腺癌细胞TIGAR和Bcl-2的表达,促进TIGAR和Bcl-2的抗凋亡作用,从而加快乳腺癌的生长。乳腺癌微环境成纤维细胞上调乳腺癌细胞TIGAR和Bcl-2表达的信号转导通路有待进一步研究。
[1] Ferlay J,Soerjomataram I,Dikshit R,etal.Cancer incidence and mortality worldwide:sources,methods and major patterns in globocan 2012[J].Int J Cancer,2015,136(5):E359-E386.
[2] Torre LA,Islami F,Siegel RL,etal.Global cancer in women:burden and trends[J].Cancer Epidemiol Biomarkers Prev,2017,26(4):444-457.
[3] Fitzmaurice C,Dicker D,Pain A,etal.The global burden of cancer 2013[J].JAMA Oncol,2015,1(4):505-527.
[4] Dubey AK,Gupta U,Jain S.Breast cancer statistics and prediction methodology:a systematic review and analysis[J].Asian Pac J Cancer Prev,2015,16(10):4237-4245.
[5] Chen W,Zheng R,Baade PD,etal.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[6] Bensaad K,Tsuruta A,Selak MA,etal.TIGAR,a p53-inducible regulator of glycolysis and apoptosis[J].Cell,2006,126(1):107-120.
[7] Akl H,Vervloessem T,Kiviluoto S,etal.A dual role for the anti-apoptotic Bcl-2 protein in cancer:mitochondria versus endoplasmic reticulum [J].Biochim Biophys Acta,2014,1843(10):2240-2252.
[8] Schenk RL,Strasser A,Dewson G.Bcl-2:Long and winding path from discovery to therapeutic target [J].Biochem Biophys Res Commun,2017,482(3):459-469.
[9] Garner TP,Lopez A,Reyna DE,etal.Progress in targeting the Bcl-2 family of proteins [J].Curr Opin Chem Biol,2017,39:133-142.
[10] Alphonso A,Alahari SK.Stromal Cells and integrins:confor ming to the needs of the tumor microenvironment[J].Neoplasia,2009,11(12):1264-1271.
[11] Xing F,Saidou J,Watabe K.Cancer associated fibroblasts (CAFs) in tumor microenvironment[J].Front Biosci,2010,1(15):166-179.
[12] Allen M,Louise Jones J.Jekyll and Hyde:the role of the microenvironment on the progression of cancer[J].J Pathol,2011,223(2):162-176.
[13] Casey SC,Amedei A,Aquilano K,etal.Cancer prevention and therapy through the modulation of the tumor microenvironment[J].Se min Cancer Biol,2015,35 Suppl:S199-223.
[14] Folgueira MA,Maistro S,Katayama ML,etal.Markers of breast cancer stromal fibroblasts in the primary tumour site associated with lymph node metastasis:a systematic review including our case series[J].Biosci Rep,2013,33(6):921-929.
[15] Soysal SD,Tzankov A,Muenst SE.Role of the tumor microenvironment in breast cancer[J].Pathobiology,2015,82(3-4):142-152.
[16] Guo B,Zhai D,Cabezas E,etal.Humanin peptide suppresses apoptosis by interfering with Bax activation[J].Nature,2003,423(6938):456-461.
[17] 刘 芳,赵世敏,张 威,等.沙棘多糖对急性肝损伤小鼠氧化应激的抑制作用及其对 BCL-2/Bax和PPAR-γ的调控[J].中国免疫学杂志,2016,32(3):358-361.
Liu F,Zhao SM,Zhang W,etal.Inhibitory effects of seabuckthorn polysaccharide on oxidative stress in mice with actue liver injury and modulatory effect on Bcl-2/Bax and PPAR-γ expression[J].Chin J Immunol,2016,32(3):358-361.
[18] Jagani H,Kasinathan N,Meka SR,etal.Antiapoptotic Bcl-2 protein as a potential target for cancer therapy:a mini review[J].Artif Cells Nanomed Biotechnol,2016,44(5):1212-1221.
[19] Wanka C,Steinbach JP,Rieger J.Tp53-induced glycolysis and apoptosis regulator (TIGAR) protects glioma cells from starvation-induced cell death by up-regulating respiration and improving cellular redox homeostasis[J].J Biol Chem,2012,287(40):33436-33446.
[20] Cheung EC,Ludwig RL,Vousden KH.Mitochondrial localization of TIGAR under hypoxia stimulates HK2 and lowers ROS and cell death [J].Proc Natl Acad Sci U S A,2012,109(50):20491-20496.