BCG感染小鼠模型中产IL-35单核细胞的检测及其意义①
2018-03-07张俊爱刘雨晴罗厚龙李瑞曦郑碧英徐军发
陈 晨 张俊爱 刘雨晴 徐 欢 罗厚龙 李瑞曦 郑碧英 徐军发
(广东医科大学检验医学研究所,东莞 523808)
结核病(Tuberculosis,TB)是主要由结核分枝杆菌(Mycobacterium tuberculosis,MTB)通过空气经呼吸道传播后感染而引起的传染性疾病,可严重危害人类健康[1],据WHO发布数据显示2015年全球约140万人死于结核病,我国是结核病高负担国家[2]。结核病患者多潜伏感染,呈慢性迁延又易复发,现有疫苗接种效果欠佳以及耐药性结核菌逃逸机体抗结核免疫机制尚未明确[3-5]。 单核巨噬细胞/巨噬细胞是MTB在体内的主要宿主,也是作为机体抗结核免疫的第一道防线[6],单核细胞极具异质性,可分泌高水平的炎症因子,如TNF-α和IL-12等,促进抗原诱导的T细胞活化[7-9]。结核菌感染后,患者外周血单核细胞可以快速进入组织器官中分化为巨噬细胞和树突状细胞并在炎症周围抑制或清除体内的MTB[10],活化的单核细胞可产生负向免疫调节因子IL-35[11],白介素35(Interleukin-35,IL-35)是一种新发现的起负向调节作用的细胞因子[12-14],主要由P35和EBI3两个亚基组成,属于IL-12家族成员[15]。本课题组前期研究发现活动性肺结核患者外周血IL-35水平显著升高,产IL-35的T细胞增高,且BCG刺激可致患者IL-35表达增加,提示IL-35参与结核免疫应答的调节,但有关产IL-35单核细胞在抗结核免疫中的作用未见报道。本实验选取易建立MTB感染且脏器荷菌量相对较高的C57BL/6小鼠[16],尾静脉注射卡介苗(BCG)建立结核菌感染动物模型,于不同时间点检测外周血和肺组织中产IL-35单核细胞数,分析其于肺组织中载菌量的相关性,探讨产IL-35单核细胞在结核免疫防卫中作用。
1 材料与方法
1.1实验材料
1.1.1主要试剂和仪器 流式抗体为EBI3-APC(R&D,IC18341A),P35-FITC(R&D,IC2191F),小鼠外周血单个核细胞分离液、小鼠组织分离液购自TBDsciences公司,FACS-VerseⅡ流式细胞仪为BD公司产品,其他器材包括倒置荧光显微镜、生物安全柜、切片机、BCG(美国University of Illinois at Chicago陈维政教授提供)、罗氏培养基(贝索)、抗酸染色试剂盒(贝索)、HE染色试剂盒等。
1.1.2实验动物 无特定病原体(SPF)级的C57BL/6J雌性小鼠,6~8周龄,体重16~18 g,购于南方医科大学实验动物中心,具广东省实验动物质量合格证明[许可证号SCXK(粤)2016-0041]。
1.2实验方法
1.2.1小鼠模型制备 将C57BL/6J小鼠平均分为BCG感染实验组和生理盐水对照组,实验组以每只2×106CFU/200 μl剂量经尾静脉途径感染BCG,对照组注射200 μl生理盐水,小鼠感染后分别在2、4、8周摘眼球取血、解剖获取肺脏,进行组织荷菌量、病理及细胞因子流式分析,每个时间点各取6~7只小鼠,各组间注意小鼠周龄、体重、生理状态等相匹配。
1.2.2组织荷菌量 无菌条件下取小鼠左下叶肺组织0.04 g,加1 ml生理盐水于玻璃匀浆器中充分研磨,再用等体积4%NaOH消化30 min后作倍比稀释(10-1和原液),吸取100 μl肺组织匀浆液接种于罗氏固体斜面培养基,37℃孵箱培养4~5周后进行菌落计数。
1.2.3病理学检测 小鼠肺组织用10%甲醛固定,常规梯度酒精脱水,代替二甲苯安全液透明,软蜡硬蜡各浸泡1.5 h后将组织块包埋。切片机调节切片厚度为4~6 μm,烘片后不同浓度酒精脱蜡,进行苏木素伊红染色,另取部分切片抗酸染色,显微镜下观察肺组织病变情况并中性树脂封片。
1.2.4外周血和肺组织单个核细胞的分离 稀释0.05%(w/v)胶原酶和0.01%(w/v)胰蛋白酶抑制剂于RPMI1640液制成酶解液,剪碎小鼠肺组织并加入稀释过的胶原酶,37℃消化30 min,用5 ml组织匀浆液研磨组织后用200目不锈钢滤网过滤到离心管内,500 g离心15 min,弃上清,样本稀释液悬浮沉淀为单细胞悬液。用吸管小心吸取组织单细胞悬液和肝素抗凝外周血于等量的分离液液面上,450 g离心30 min后吸取单个核细胞层。
1.2.5单核细胞P35、EBI3表达的检测 采用流式细胞术胞内细胞因子染色法检测P35与EBI3在单核细胞中的表达,取100 μl含1×106个外周血或肺组织单个核细胞于流式管中,每管加200 μl破膜剂(BD Cytofix/Cytoperm)4℃避光反应20 min,用1 ml清洗液(1×BD Perm/Wash)1 500 r/min,5 min洗涤2次,倒掉上清并控干后加入推荐量荧光标记的抗体(EBI3-APC、P35-FITC)10 μl,振荡混匀,室温避光孵育30 min;再次洗涤2次,弃上清,最后加入200 μl 2%多聚甲醛溶液固定,上流式细胞仪分析,根据前向和侧向散射两个物理参数圈定单核细胞,再根据荧光波长分析P35和EBI3在单核细胞中的表达。

2 结果
2.1肺组织病理学分析和荷菌量检测 小鼠肺组织病理切片主要表现为肺泡结构塌陷破坏,肺泡腔内充满以中性粒细胞为主,伴单个核细胞浸润的炎性病变,红细胞渗出明显;抗酸染色示肺泡周围分枝杆菌为散在细长略带弯曲的红色杆菌。解剖小鼠取肺组织左下叶进行细菌负载量分析,发现小鼠感染后2周肺部荷菌量达到(5.529±0.246 1)log10CFU,在感染后4周下降至(4.911±0.336 9)log10CFU,感染后8周又显著升高到(6.550±0.272 4)log10CFU(P<0.001),见图1。
2.2P35在BCG感染小鼠外周血与肺组织中单核细胞内高表达 对BCG感染小鼠外周血和肺部不同时间点单核细胞中P35表达情况进行分析,结果发现实验组外周血和肺组织中表达P35的单核细胞在2、4、8周的比例均高于相应对照组(P<0.05或P<0.01)。BCG感染后第4周小鼠外周血表达P35的单核细胞明显增加(P<0.05),而在第8周又有所下降(P<0.05)。肺组织中表达P35的单核细胞明显高于对照组,而实验组各时间点差异无统计学意义(P>0.05),见图2。
2.3EBI3在BCG感染小鼠外周血与肺组织中单核细胞内高表达 对BCG感染小鼠外周血和肺组织中单核细胞不同时间点EBI3表达情况分析,发现实验组外周血和肺组织中表达EBI3的单核细胞在2、4周均高于相应对照组(P<0.05或P<0.01),小鼠感染组外周血表达EBI3的单核细胞在第4周明显增加(P<0.05),而第8周又显著下降(P<0.01),肺组织表达EBI3的单核细胞在BCG感染后第4、8周明显增加(P<0.05),见图3。


图1BCG感染后小鼠肺组织病理改变和荷菌量检测
Fig.1AfterBCGinfectioninmicelungtissuepathologychangeandamountofbacteriadetection
Note: A.The experimental group of lung tissue sections HE staining(×20);B.Control group lung tissue sections HE staining(×20);C.Lung tissue sections acid-fast staining(×100);D.Analysis of bacteria at each time point in lung tissue.***.P<0.001.


图2不同感染时间外周血和肺组织中表达P35单核细胞的比较
Fig.2ComparisonofexpressionofP35monocytesinperipheralbloodandlungtissueatdifferenttimeofinfection
Note: A.Peripheral blood and lung tissue monocyte expression P35 flow pattern;B.P35 expression in peripheral blood mononuclear cells;C.P35 expression in lung mononuclear cells.*.P<0.05;**.P<0.01.


图3不同感染时间外周血和肺组织中表达EBI3单核细胞的比较
Fig.3ComparisonofexpressionofEBI3monocytesinperipheralbloodandlungtissueatdifferenttimeofinfection
Note: A.Peripheral blood and lung tissue mononuclear cells expressing EBI3 flow pattern;B.EBI3 expression in peripheral blood mononuclear cells;C.Expression of EBI3 in lung tissue monocytes.*.P<0.05;**.P<0.01.

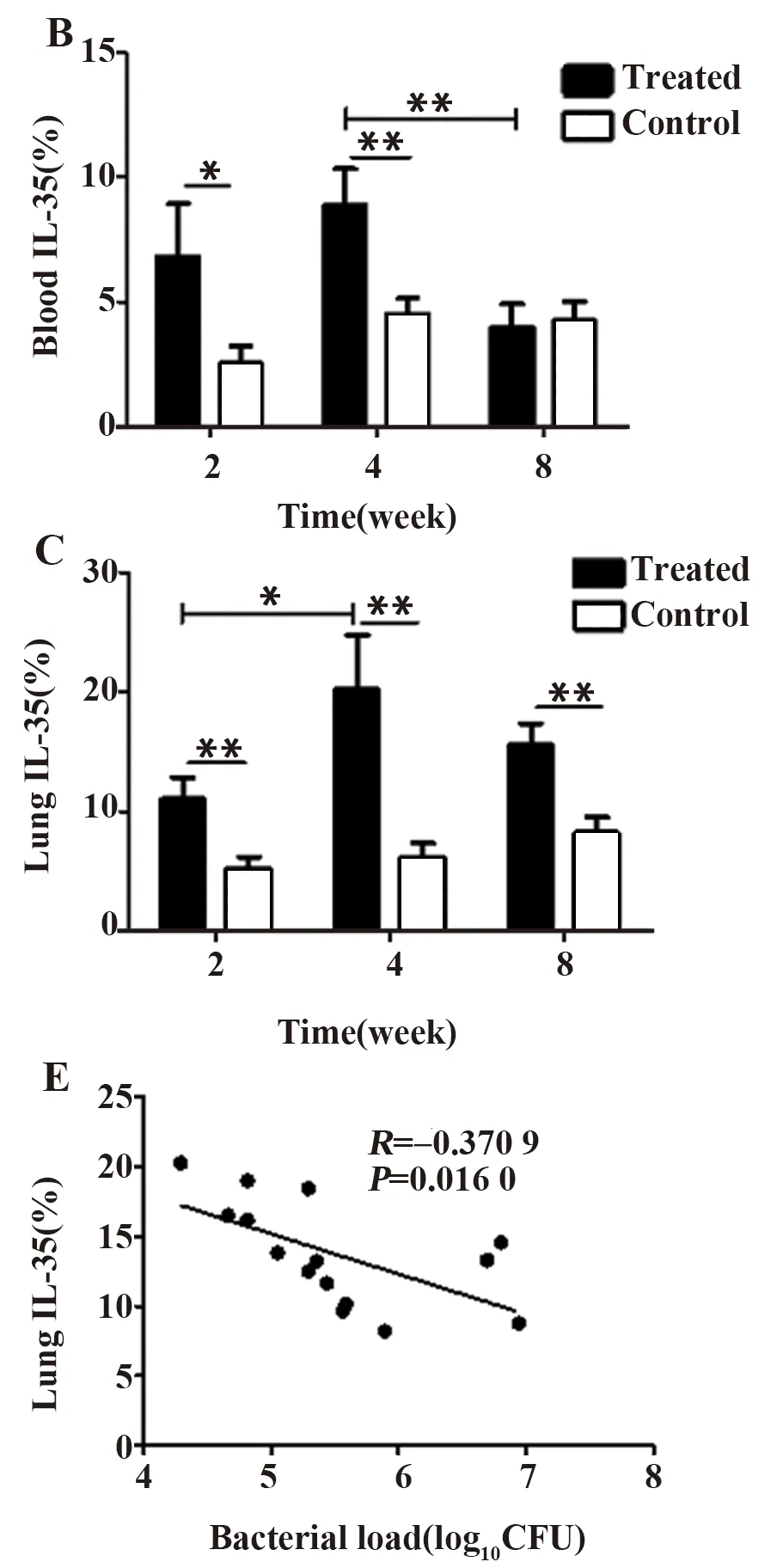
图4不同感染时间外周血和肺组织中产IL-35单核细胞的比较及相关性分析
Fig.4ComparisonandcorrelationanalysisofIL-35mononuclearcellsinperipheralbloodandlungtissueatdifferenttimeofinfection
Note: A.Peripheral blood and lung tissue mononuclear cells express IL-35 flow pattern;B.IL-35 expression in peripheral blood mononuclear cells;C.IL-35 expression in lung mononuclear cells;D.P35 correlation with EBI3(n=19);E.Correlation analysis of lung IL-35 and bacteria(n=15).*.P<0.05;**.P<0.01.
2.4单核细胞IL-35在BCG感染小鼠外周血与肺组织中高表达 对BCG感染小鼠外周血和肺组织不同时间点单核细胞中IL-35表达情况进行分析,发现实验组外周血和肺组织单核细胞中由P35和EBI3双亚基组成的IL-35表达水平显著高于相应对照组(P<0.05或P<0.01)。BCG感染后小鼠外周血产IL-35的单核细胞在第8周明显降低(P<0.01),肺组织中产IL-35的单核细胞在第4周有显著性增加(P<0.01)。单核细胞中P35与EBI3的表达呈显著正相关(P<0.001),肺组织单核细胞中IL-35的表达与载菌量呈负相关(P<0.05),见图4。
3 讨论
本研究发现:①BCG感染小鼠外周血和肺组织不同周期时单核细胞中IL-35及其两个亚基P35及EBI3表达明显高于对照组,且在4周时增加明显,到8周又有所下降;②感染小鼠肺组织各时间点产IL-35单核细胞与荷菌量存在负相关关系。
单核细胞和组织巨噬细胞经抗原刺激活化可生成并释放多种细胞因子以参与机体防卫机制,在抵御及清除病原体入侵的机体天然免疫中非常重要[17-19]。本实验采用流式细胞术分析发现BCG感染小鼠外周血和肺组织单核细胞中P35 和EBI3的表达在感染后2、4、8周均较对照组有显著增加,且实验组表现出感染后4周显著增加而第8周减少的趋势,可见单核细胞中P35 和EBI3的表达在机体抵抗外来抗原刺激的免疫反应时明显增加。关于单核细胞中P35或EBI3单个亚基的表达在免疫性疾病中的比例变化及调节机制的研究已有报道,研究发现EBI3基因缺陷小鼠感染肝炎病毒后死亡率增高,T细胞和单核巨噬细胞增多使免疫应答过激而加重炎症反应[20];本课题组前期研究发现,活动性肺结核患者外周血中不仅单个核细胞高表达P35和EBI3两个亚基的mRNA,而且P35+CD4+T细胞数与EBI3+CD4+T细胞数呈正相关。结合上述研究推测小鼠在感染BCG后诱发宿主单核细胞表达较多的P35和EBI3可增强对抗MTB入侵感染机体的炎症反应,而P35和EBI3的增加又能提高单核细胞清除病原体能力,这或许可为研究单核细胞参与抗结核免疫应答机制提供新的思路。
本实验相关性分析发现P35和EBI3在单核细胞中的表达增高,且呈正相关,感染小鼠外周血单核细胞中IL-35的表达(流式细胞术分析P35和EBI3双阳性)在2、4周比对照组明显升高,而实验组肺组织在2、4、8周较对照组增加均有统计学差异,提示由P35和EBI3双亚基组成的IL-35可能在单核细胞主导的免疫调节中发挥着抑制病情进展的保护性作用,小鼠外周血感染第8周时产IL-35的单核细胞与对照组没有差异,可能是病程后期MTB全部定植到肺组织导致机体局部单核巨噬细胞表达IL-35介导免疫调节。有文献表明重组基因pVAX-IL-35在小鼠哮喘模型中可以产生长效的免疫抑制,有效降低气道的过敏性炎症反应[21];IL-35还可通过减少过量的病原体细胞在靶器官聚集而有效限制疾病的发生发展[22]。另一方面,实验组小鼠肺组织各时间点的荷菌量和单核细胞中IL-35的表达呈负相关,当机体感染第8周时,少数毒性较强的MTB能逃避单核细胞的溶解吞噬作用而大量繁殖增生,单核细胞中IL-35的表达却相应减少,提示免疫炎症抑制因子IL-35的增加也许对调节感染机体免疫状态、增强免疫清除效果和避免病理损伤起重要作用。有研究发现T细胞在与抗原或人鼻病毒激活的DC接触活化后,IL-35的基因水平和蛋白表达均显著升高,且表现出增殖依赖性[23,24]。目前,产IL-35的单核细胞在结核免疫的相关研究机制还未见报道。机体在感染BCG后,单核细胞经MTB刺激活化可分泌包括IL-35在内的多种免疫抗炎因子以介导吞噬降解病原菌的抗结核炎症反应[25],IL-35则可促进抑制性细胞因子分泌和影响多个T细胞亚群的分化及功能,明显降低炎症反应,从而有效减缓结核病程进一步恶化,推测产IL-35的单核细胞升高可能在小鼠针对结核感染疾病中具有抑制性免疫保护作用,因此,单核细胞中IL-35的表达可能对维持机体免疫平衡具有不容忽视的调控作用,有望为结核病的临床诊断、治疗和预后寻求更准确有效的检测指标。
动物模型遗传背景相似,可方便有效研究人类疾病的发生发展规律[26,27],尾静脉注射虽不如气溶胶雾化的方式更能模拟人自然感染,但血液输注较易使组织荷菌量控制在同一水平,本实验选择对BCG感染有较强抵抗能力的C57小鼠[28],小鼠肺组织抗酸染色可见MTB成功侵袭感染肺部,虽不足以引发典型结核结节出现,肺组织依然可见肺泡结构紊乱和炎症细胞聚集等病变表现。
综上所述,本研究发现BCG感染小鼠外周血和肺组织中产IL-35的单核细胞在第4周显著增加,肺组织单核细胞内IL-35的表达和荷菌量呈负相关,提示单核细胞表达IL-35的升高增强了机体抵抗MTB感染的结核免疫反应。然而,产IL-35的单核细胞调节免疫应答的作用机制以及IL-35在人与鼠体内表达方式的差异还有待我们进一步研究探讨和深入了解。
[1] 唐神结,高 文.临床结核病学[M].北京:人民卫生出版社,2011:35.
Tang SJ,Gao W.Clinical Tuberculosis[M].Beijing:People′s Health Press,2011:35.
[2] World Health Organization.Global tuberculosis report 2016[M].Geneva,Switzerland:WHO Press,2016:1-5.
[3] Urdahl KB.Understanding and overco ming the barriers to T cell-mediated immunity against tuberculosis[J].Semin Immunol,2014,26(6):578-587.
[4] Dheda K,Gumbo T,Gandhi NR,etal.Global control of tuberculosis:from extensively drug-resistant to untreatable tuberculosis[J].Lancet Respir Med,2014,2(4):321-338.
[5] Behar SM,Carpenter SM,Booty MG,etal.Orchestration of pulmonary T cell immunity during Mycobacterium tuberculosis infection:Immunity interruptus[J].Semin Immunol,2014,26(6):559-577.
[6] Fine PE.Variation in protection by BCG:implications of and for heterologous immunity[J].Lancet,1995,346(8986):1339-1345.
[7] Zieglerheitbrock L,Ancuta P,Crowe S,etal.Nomenclature of monocytes and dendritic cells in blood[J].Blood,2010,116(16):e74-e80.
[8] Hristov M,Weber C.Differential role of monocyte subsets in atherosclerosis[J].Thromb Haemost,2011,106(5):757-762.
[9] Wong KL,Yeap WH,Tai JJ,etal.The three human monocyte subsets:implications for health and disease[J].Immunologic Res,2012,53(1-3):41-57.
[10] Singh G,Singh B,Trajkovic V,etal.Mycobacterium tuberculosis 6 kDa early secreted antigenic target stimulates activation of J774 macrophages[J].Immunol Lett,2005,98(2):180-188.
[11] Terayama H,Yoshimoto T,Hirai S,etal.Contribution of IL-12/IL-35 common subunit p35 to maintaining the testicular immune privilege[J].PLoS One,2014,9(4):e96120.
[12] Schrader JW.Interleukin is as interleukin does [J].J Immunological Methods,2003,276(1-2):1-3.
[13] Collison LW,Workman CJ,Kuo TT,etal.The inhibitory cytokine IL-35 contributes to regulatory T-cell function[J].Nature,2007,450(7169):566-569.
[14] 马 樱,金伯泉.IL-12家族新成员及其在免疫应答中的重要调节作用[J].细胞与分子免疫学杂志,2008,(11):1129-1132.
Ma Y,Jin BQ.New members of the IL-12 family and their important regulatory roles in the immune response[J]. Chin J Cell Mol Immunol,2008,(11):1129-1132.
[15] Niedbala W,Wei X,Cai B,etal.IL-35 is a novel cytokine with therapeutic effects against collagen-induced arthritis through the expansion of regulatory T cells and suppression of Th17 cells[J].Eur J Immunol,2007,37(11):3021-3029.
[16] 董江涛,张万江.结核分枝杆菌感染小鼠动物模型的建立及研究进展[J].中国病原生物学杂志,2011,6(8):621-623.
Dong JT,Zhang WJ.Establishment of a mouse model of Mycobacterium tuberculosis infection and advances in research[J].J Pathog Biol,2011,6(8):621-623.
[17] Randolph GJ,Jakubzick C,Qu C.Antigen presentation by monocytes and monocyte-derived cells[J].Curr Opinion Immunol,2008,20(1):52-60.
[18] Serbina NV,Jia T,Hohl TM,etal.Monocyte-mediated defense against microbial pathogens[J].Annual Rev Immunol,2008,26(1):421-452.
[19] Chen X,Yang Q,Zhang M,etal.Diagnosis of active tuberculosis in China using an in-house gamma interferon enzyme-linked immunospot assay[J].Clin Vaccine Immunol,2009,16(6):879-884.
[20] Tirotta E,Duncker P,Oak J,etal.Epstein-Barr virus-induced gene 3 negatively regulates neuroinflammation and T cell activation following coronavirus-induced encephalomyelitis[J].J Neuroimmunol,2013,254(1/2):110-116.
[21] Huang CH,Loo EX,Kuo IC,etal.Airway inflammation and IgE production induced by dust mite allergen-specific memory/effector Th2 cell line can be effectively attenuated by IL-35[J].J Immunol,2011,187(1):462-471.
[22] Shen P,Roch T,Lampropoulou V,etal.IL-35-producing B cells are critical regulators of immunity during autoimmune and infectious diseases[J].Nature,2014,507(7492):366-370.
[23] Seyerl M,Kirchberger S,Majdic O,etal.Human rhinoviruses induce IL-35-producing Treg via induction of B7-H1 (CD274) and sialoadhesin (CD169) on DC[J].Eur J Immunol,2010,40(2):321-329.
[24] Guttek K,Reinhold D.Stimulated human peripheral T cells produce high amounts of IL-35 protein in a proliferation-dependent manner[J].Cytokine,2013,64(1):46-50.
[25] Bah A,Lacarrière C,Vergne I.Autophagy-related proteins target ubiquitin-free mycobacterial compartment to promote killing in macrophages[J].Front Cell Infec Microbiol,2016,6(53).
[26] 黎友伦,王国治,罗永艾.结核分枝杆菌潜伏感染动物模型及评价[J].中华结核和呼吸杂志,2005,28(8):552-554.
Li YL,Wang GZ,Luo YA.Animal model of latent infection of Mycobacterium tuberculosis and evaluation[J]. Chin J Tuberc Respir Dis,2005,28(8):552-554.
[27] Gupta UD,Katoch VM.Animal models of tuberculosis[J].Tuberculosis,2005,85(5-6):277-293.
[28] Phyu S,Mustafa T,Hofstad T,etal.A mouse model for latent tuberculosis[J].Scandinavian J Infect Dis,1998,30(1):59-68.