吉西他滨PLGA纳米颗粒对小鼠Lewis肺癌细胞增殖抑制效应的实验研究①
2018-03-07郑源强贾宇臣崔正荣石艳春
乌 兰 郑源强 陈 哲 贾宇臣 丁 枫 崔正荣 石艳春
(内蒙古医科大学自治区分子生物学重点实验室,呼和浩特 010058)
肺癌是患病率极高的肿瘤,其死亡率在所有肿瘤种类中的上升比率最大,是严重危害人类健康的恶性肿瘤之一[1]。目前化疗仍是治疗肺癌的重要措施。吉西他滨为肺癌治疗的一线药物,但它亲水性强,分子量小,血浆半衰期短仅17 min,常规化疗时其在瘤体内难以达到有效的作用浓度,而提高化疗药物的剂量则易导致不良反应增加并产生耐药。聚乙酸-羟基乙酸共聚物(PLGA)是无毒的生物降解性聚合物,该聚合物在体内生物相容性好,可用于药物缓释制剂载体。与传统药物剂型相比,纳米颗粒具有药物缓释和定向释放的优势,可明显增加靶器官病灶部位的药物浓度,提高药物的生物利用度,减轻药物对非靶向部位的毒性,减少全身不良反应的发生。本研究将GemC18-PLGA-NPs应用于LLC细胞并检测其对细胞体外增殖抑制效应和细胞凋亡的影响。
1 材料与方法
1.1材料
1.1.1纳米颗粒和药品 GemC18-PLGA-NPs、PLGA-NPs、GemC18由美国德州大学奥斯汀分校药学院崔正荣教授实验室制备[2,3]。GemC18-PLGA-NPs 纳米粒径为(212±20)nm,Zeta 电位(-42.4±12)mV,多分散指数<0.2。Gemcitabine HCl(GemHCl)购自Biotang公司。
1.1.2细胞株、主要试剂和仪器 小鼠肺癌细胞(LLC)购自中国科学院细胞库,四甲基偶氮蓝(MTT)购自Amresco公司,DMEM、FBS、双抗溶液均为以色列BI公司产品,AnnexinV-FITC/Propidium Iodide(PI)凋亡检测试剂盒购自BD公司,酶标仪为Molecular Devices SpectraMax i3,细胞培养箱为Thermo 371,流式细胞仪BD FACSCalibur。
1.2方法
1.2.1细胞体外生长抑制实验
1.2.1.1共分为4组 GemC18-PLGA-NPs组、GemC18组、GemHCl组和PLGA-NPs组。
1.2.1.2设置6个药物浓度(按所含Gemcitabine计算):0.000 1、0.001、0.01、0.1、1、10 μmol/L。流式细胞术检测的药物浓度为0.1 μmol/L。
1.2.1.3观察时间 MTT法给药后,分别在24、48、72 h进行检验。流式细胞术在给药后48、72 h进行检验。
1.2.1.4细胞培养 将细胞培养在DMEM培养液中(含10%FBS,100 U/ml青霉素和链霉素),置于含5%CO2、37℃饱和湿度培养箱中。
1.2.2MTT法检测给药后各组IC50值和细胞存活率(SR) 细胞经0.25%胰酶消化后,取混悬细胞液,以5×103/孔,按每孔180 μl接种于96孔板,每组药物设置5个复孔,继续培养24 h,待细胞贴壁后给药。给药后继续培养24、48、72 h,每孔于结束培养前加入5 mg/ml的MTT溶液20 μl,继续培养4 h后吸弃上清液,每孔加入二甲基亚砜150 μl,轻轻震荡,10 min后在570 nm波长处用酶标仪检测光密度(OD)值。细胞存活率SR=(给药组OD值-无药组OD值)/(对照组OD值-无药组OD值)×100%。
1.2.3流式细胞仪检测不同给药组对Lewis细胞的凋亡作用 细胞消化后,取混悬细胞液,以2×105/孔,每孔3 ml的浓度接种于6孔板培养,培养板设置4个复孔。在接种6孔板之前,用培养液润湿一下,以免加入细胞不均匀,每加两个孔混匀一下。放入5%CO2,37℃培养箱进行培养,待24 h后细胞贴壁给药,用0.1 μmol/L的药物处理细胞。给药后继续孵育48和72 h,收集细胞,进行检测。取出6孔板,消化,离心弃上清。用预冷的PBS洗涤3次,重悬细胞,调整细胞浓度为1×106ml-1。加入100 μl Annexin Ⅴ Binding Buffer,混匀并重悬细胞,用10 μl AnnexinⅤ FITC和10 μl PI,轻轻混匀。25℃避光染色15 min,漩涡混匀。每管加入400 μl AnnexinⅤ Bingding Buffer,混悬后进行过滤,过滤后1 h内检测。用流式细胞仪检测细胞凋亡率,以百分率表示。
1.3统计学分析 采用Graphpad5.0计算软件,计算IC50值及细胞存活率,进行统计,对组间差异采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1吉西他滨GemC18-PLGA-NPs对Lewis肺癌细胞体外增殖抑制作用 MTT法检测各给药组IC50值及细胞存活率(SR),各组检测结果见图1,在24、48 h时GemC18-PLGA-NPs组的IC50值均高于GemHCl组(P<0.05),GemC18-PLGA-NPs组与GemC18组在24、48 h的IC50值存在差异(P<0.05),在72 h无组间差异。GemC18与Gem-HCl在24 h的IC50值存在差异(P<0.05),在48、72 h无明显差异(P>0.05)。

图1 给药24、48、72 h后各组药物对LLC细胞的增殖抑制作用(IC50值)Fig.1 IC50 values of different groups after 24,48,72 hNote: *.P<0.05,compared to GemHCl;#.P<0.05,compared to GemC18.
给药后24 h,在0.000 1、0.001 μmol/L两个浓度点GemC18-PLGA-NPs组与GemC18和GemHCl组的SR无组间差异 (P>0.05)。 在0.01、 0.1、1、10 μmol/L浓度处GemC18-PLGA-NPs的SR明显高于GemC18和GemHCl组(P<0.05)。GemC18组在0.000 1、0.001、0.01 μmol/L浓度处与GemHCl组无明显组间差异(P>0.05),在0.1、1、10 μmol/L浓度处,两组间存在差异(P<0.05),见图2。
给药48 h后,GemC18-PLGA-NPs在各个浓度的SR均高于GemHCl组,GemC18-PLGA-NPs与GemHCl组均存在显著的组间差异(P<0.05),GemC18-PLGA-NPs与GemC18组在浓度0.000 1、0.001、10 μmol/L处无明显组间差异(P>0.05),在浓度0.01、0.1、1 μmol/L处存在组间差异(P<0.05)。GemC18组与GemHCl组在浓度10 μmol/L无组间差异(P>0.05),GemC18组在浓度0.000 1、0.001、0.01、0.1、1 μmol/L的SR均高于GemHCl组,存在明显组间差异(P<0.05),见图3。
给药72 h后,GemC18-PLGA-NPs组与GemC18组和GemHCl组在0.000 1、0.001、10 μmol/L浓度处的SR无组间差异(P>0.05),在0.01、0.1、1 μmol/L浓度处的SR均高于GemC18组和GemHCl组存在组间差异(P<0.05)。GemC18与GemHCl在0.000 1、0.001、1、10 μmol/L浓度无组间差异(P>0.05),在0.01、0.1 μmol/L浓度处存在组间差异(P<0.05)。PLGA-NPs组的SR在24、48和72 h的每个浓度点均在80%以上,大于其他给药组的SR,见图4。
2.2细胞存活率的浓度和时间依赖性 图2结果提示:(1)给药后24、48、72 h,GemC18-PLGA-NPs、GemC18、GemHCl组的SR与给药浓度均呈负相关,但GemHCl组在1 μmol/L后似已进入平台期,而GemC18-PLGA-NPs组的SR曲线仍下降明显。PLGA-NPs组的存活率并无浓度依赖性。(2)GemC18-PLGA-NPs、GemC18和GemHCl组的SR均具有明显的时间依赖性(P<0.05),PLGA-NPs组的存活率不具有明显的时间依赖性(P>0.05)。实验结果显示GemC18-PLGA-NPs对LLC细胞有一定的时间延续性,表明药物具有一定的缓释作用。
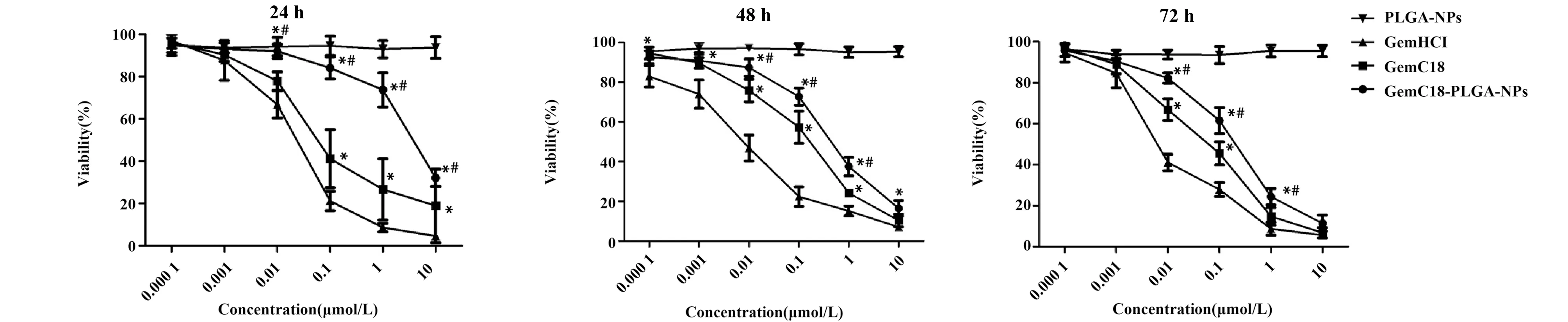
图2 药物作用24、48、72 h后细胞存活率(MTT法)Fig.2 SR of different groups after 24,48,72 h(MTT method)Note: *.P<0.05,compared to GemHCl;#.P<0.05,comared to GemC18.

图3 药物作用48 h和72 h后各组细胞凋亡率(FACS)Fig.3 Apoptosis of different groups after 48 h or 72 h by FACS

Groups48h72hControl29 83±0 9633 86±8 37PLGA⁃NPs31 24±3 5638 88±3 17GemHCl94 44±1 6796 88±1 49GemC1873 00±11 301)87 30±3 311)GemC18⁃PLGA⁃NPs56 92±4 431)2)68 05±2 701)2)
Note:1)P<0.05,compared to GemHCl;2)P<0.05,compared to GemC18.
2.3不同药物组的细胞凋亡率 给药后48、72 h,GemC18组和GemC18-PLGA-NPs组与GemHCl组的细胞凋亡率相比均存在显著统计学差异(P<0.05),72 h,GemC18与GemHCl组相比差异具有统计学意义(P<0.05)。GemC18与GemC18-PLGA-NPs相比差异具有统计学意义(P<0.05)。PLGA-NPs组与Control组相比差异无统计学意义,PLGA-NPs组对细胞的凋亡无明显影响。见图3、表1。
3 讨论
吉西他滨是脱氧胞苷的水溶性类似物,主要通过竞争性抑制DNA合成的相关酶而阻止细胞的分裂和增殖,最终导致肿瘤细胞死亡。被批准用于治疗胰腺癌、非小细胞肺癌、乳腺癌和卵巢癌等恶性肿瘤[2]。然而,吉西他滨存在几个缺点,例如静脉注射后被胞嘧啶脱氨酶快速脱氨基转变为无活性的2′-2′-二氟脱氧尿苷,使其失去了抗肿瘤作用,吉西他滨因核糖核苷酶还原酶M1亚型(RRM1)过表达而产生耐药[3,4],半衰期短、毒性强等。在吉西他滨分子基团的N4位引入硬脂酰基,形成的前药4-(N)-stearoylgemcitabine(GemC18)对血浆脱氨酶不敏感,可以保护吉西他滨免受脱氨酶的脱氨作用,提高了吉西他滨的代谢稳定性[5,6]。GemC18是吉西他滨的脂肪酸酰胺前药,经酰胺酶水解后可释放母体药物吉西他滨,延长了吉西他滨的半衰期。吉西他滨的酰胺衍生物GemC18在肿瘤细胞内释放出吉西他滨,向其他组织扩散减少,减轻了局部毒性,细胞内药物蓄积增加,抗肿瘤活性增加。PLGA是FDA批准的可生物降解和生物相容的聚合物,降解产物乳酸和羟基乙酸可参与人体的新陈代谢,最终生成二氧化碳和水排出体外[7]。PLGA颗粒可用作GemC18载体。在延长体内循环时间,增加在肿瘤组织的药物分布,达到靶向治疗肿瘤的目的等方面有重要作用[8]。PLGA可通过改变形成的颗粒大小而调节由PLGA制备的颗粒的药物释放速率[8-10]。
本实验采用了MTT法检测了GemC18-PLGA-NPs、GemC18和GemHCl对Lewis肺癌细胞株的体外增殖抑制作用,结果显示:(1)GemC18-PLGA-NPs和GemC18在制备过程中并无吉西他滨药效的减损,仍然具有显著的细胞抑制作用;(2)72 h后,GemHCl似在1 μmol/L浓度处已进入平台期,而GemC18-PLGA-NPs的曲线继续下降,说明GemC18-PLGA-NPs可伴随着浓度的加大而增强对肿瘤细胞的抑制作用,并具有时间延续性;(3)PLGA-NPs组没有明显的增殖抑制作用,细胞存活率均在80%以上,也没有明显的时间及浓度相关性,提示PLGA纳米颗粒具有良好的生物相容性,有广泛的临床应用前景。
关于实验结果涉及的几点问题:(1)被吞噬功能:由于GemHCl具有很强的水溶性,其进入细胞依赖细胞膜的核苷转运蛋白[8];而GemC18-PLGA-NPs可以通过先释放出GemC18再释放出GemHCl然后进入细胞的途径,也可通过纳米颗粒被细胞整体吞噬的途径进入;因此在细胞膜的核苷转运蛋白达到饱和以后仍可以进入肿瘤细胞。这可能是GemHCl在1 μmol/L浓度以后药物作用不再随着浓度增加而增大,而GemC18-PLGA-NPs对肿瘤细胞存活率仍然继续下降的主要原因。(2)缓释功能:GemC18-PLGA-NPs在72 h后,10 μmol/L浓度处细胞具有较低的存活率,在1 μmol/L浓度以后具有存活率-浓度负相关,这种现象可能与纳米颗粒的缓释作用有关。GemC18-PLGA-NPs可以通过药物的缓释作用避免细胞膜转运蛋白的过饱和,也可避免因血浆酰胺酶的水解作用而使药物失去活性。GemC18-PLGA-NPs可通过胞吞作用进入肿瘤细胞内遵循先释放GemC18,再释放出GemHCl的迟缓过程,具体表现为给药后72 h的细胞存活率低于给药后24 h和48 h。
由于体内外环境的差异极大,本实验仅初步检测GemC18-PLGA-NPs对LLC细胞的体外增殖抑制作用和对细胞凋亡的影响,尚难以体现其更多的药物缓释优势,后续仍需进行Lewis肺癌细胞的荷瘤小鼠模型等体内实验以进一步证实。
[1] Chun SH,Lee JE,Park MH,etal.Gemcitabine plus platinum combination chemotherapy for elderly patient with advanced non-small cell lung cancer:a retrospective analysis[J].Cancer Res Treat,2011,43(4):217-224.
[2] Sloat BR,Sandoval MA,Li D,etal.In vitro and in vitro anti-tumor activities of a gemcitabine derivative carried by nanoparticles[J].Int J Pharm,2011,409(1-2):278-288.
[3] Wonganan P,Lansakara PDS,Zhu S,etal.Just getting into cells is not enough:mechanisms underlying 4-(N)-stearoyl gemcitabine solid lipid nanoparticle′s ability to overcome gemcitabine resistance caused by RRM1 overespression[J].J Control Release,2013,169(1-2):17-27.
[4] Gong W,Zhang X,Wu J,etal.RRM1 expression and clinical outcome of gemcitabine-containing chemotherapy for advance non-small-cell lung cancer:a meta-analysis[J].Lung Cancer,2012,75(3):374-380.
[5] Arias JL,Reddy LH,Couvreur P.Magnetoresponsive squalenoyl gemcitabine composive nanoparticles for cancer active targeting[J].Langmuir,2008,24(14):7512-7519.
[6] Muthu MS,Rawat MK,Mishra A,etal.PLGA nanoparticle formulations of risperridone:preparation and neuropharmacological evaluation[J].Nano Medicine,2009,5(3):323-333.
[7] Makadia HK,Siegel SJ.Poly lactic-co-glycolic acid(PLGA) as biodegradable controlled drug delivery carrier[J].Polymers(Basel),2011,3(3):1377-1397.
[8] Välimaa T,Laaksovirta S.Degradation behaviour of self-reinforced 80L/20G PLGA devices in vitro[J].Biomaterials,2004,25(7-8):1225-1232.
[9] Mini E,Nobili S,Caciagli B,etal.Cellular pharmacology of gemcitabine[J].Ann Oncol,2006,17(Suppl 5):v7-12.
[10] Zhang X,Sun M,Zheng A,etal.Preparation and characterization of insulin-loaded bioadhesive PLGA nanoparticles for oral administration[J].Eur J Pharml Sci,2012,45(5):632-638.