肥大细胞活化综合征
2019-01-17CemAkinAnnArborMich
Cem Akin, Ann Arbor, Mich
翻译:胡清洁 审校:姚 煦 中国医学科学院 北京协和医学院 皮肤病医院过敏与风湿免疫科
目前有多种以肥大细胞活化异常为表现的疾病,发病情况从常见到罕见不等。肥大细胞活化的机制可由IgE或者非IgE介导。常见的肥大细胞异常活化的特应性疾病,比如过敏性鼻炎和过敏性哮喘,一般人群发病率在10%~30%[1]。与此相反,肥大细胞增生症和单克隆肥大细胞活化综合征(MMAS)发病很罕见,低至1/10 000~20 000[2]。肥大细胞在肥大细胞异常活化所致疾病中不一定是主要的致病因素,也可能是肥大细胞对其他的病理学过程作出应激反应。肥大细胞自身可察觉到内在或外在的压力或危险,并对刺激物作出反应[3]。适度的肥大细胞活化是生理性的,对于维持正常内稳态是必需的。现在的问题是在何种状态下肥大细胞异常活化并发展成为疾病。
有两种情况下肥大细胞活化可导致病理性临床症状。一种是肥大细胞在质量或数量上发生异常。这种情况见于克隆性肥大细胞病的患者,其肥大细胞祖细胞存在肿瘤性的功能性基因突变,最常见的突变基因是KIT,KIT基因编码跨膜受体酪氨酸激酶[4]。当肿瘤性肥大细胞在组织中聚集,干扰组织功能或不适当的释放介质,可引发多种局部或系统症状。
第二种情况是对于察觉到的危险,出于保护机体的需要,肥大细胞发生了过度的活化。这种情况见于机体受到了感染、物理性刺激、毒液或过敏原的威胁。全身性严重过敏反应是肥大细胞过度活化引起的严重反应。
肥大细胞活化可以是局部的或系统性的。组织特异性的肥大细胞活化所致的疾病包括荨麻疹,过敏性鼻炎和哮喘。系统性肥大细胞活化表现出的症状累及两种或更多的器官系统(皮肤:荨麻疹、血管性水肿和潮红;胃肠道:恶心、呕吐、腹泻和腹部绞痛;心血管:低血压性晕厥或接近晕厥以及心动过速;呼吸:哮喘; 鼻-眼:结膜充血、瘙痒和鼻塞)[5]。通常是由特殊部位炎性介质的释放所致,比如皮肤或黏膜组织,或脉管系统中肥大细胞的活化所致。
肥大细胞活化综合征是肥大细胞活化所致的疾病中的一种严重类型[6]。肥大细胞活化综合征的诊断的推荐标准见表1[5-6]。肥大细胞活化没有单一特异性的症状,因此必须满足所有3条标准,才能明确肥大细胞活化所致的疾病。特发性严重过敏反应是肥大细胞活化综合征中一个特殊类型,患者满足严重过敏反应的临床诊断标准[7]。需要注意的是并非所有系统性肥大细胞活化的临床表现都满足严重过敏反应的标准。例如,患者在暴露于一个已知的或可能的过敏原后可以发生荨麻疹和胃肠道症状,此时的临床表现更符合肥大细胞活化综合征而不是特发性严重过敏反应;如果患者出现低血压性晕厥或呼吸系统受累,则倾向于诊断严重过敏反应(图1,表2)。
1 肥大细胞活化标志物
临床可用且经过验证的肥大细胞活化标志物见表3。类胰蛋白酶是肥大细胞负荷和活化最特异性的标志物[8]。在血浆或血清中的正常平均水平约为5 ng/ml,当类胰蛋白酶水平高于11.4 ng/ml被认为升高。尽管嗜碱性粒细胞和早期髓细胞可产生微量类胰蛋白酶,血清或血浆中类胰蛋白酶绝大部分来源于肥大细胞。在正常情况下,血清中可检测到的类胰蛋白酶是被分泌到细胞外的缺乏酶活性的酶原(α-类胰蛋白酶原或β-类胰蛋白酶原)。β-类胰蛋白酶原通过进一步酶促裂解加工为具有蛋白水解活性的成熟的类胰蛋白酶[9]。成熟的类胰蛋白酶储存在肥大细胞颗粒中,并且随肥大细胞脱颗粒而释放,血循环中的浓度在1 h左右达到峰值。

表1 肥大细胞活化综合征的推荐标准(3项必须都满足)
肥大细胞活化后,成熟的类胰蛋白酶释放至血液循环,可导致血清中类胰蛋白酶总水平短暂升高。类胰蛋白酶水平如果增加了基础的20%加上2 ng/ml,则被认为对于提示肥大细胞的活化有意义[6]。因此若一个患者的类胰蛋白酶基础水平是5 ng/ml,在可疑的过敏性事件发生后的4 h内,如果类胰蛋白酶水平升到8 ng/ml或更高,则证实该患者发生了肥大细胞活化。血清类胰蛋白酶水平应该在可疑的肥大细胞活化事件发生后4 h内测定,否则可降回基础水平,难以检测到。
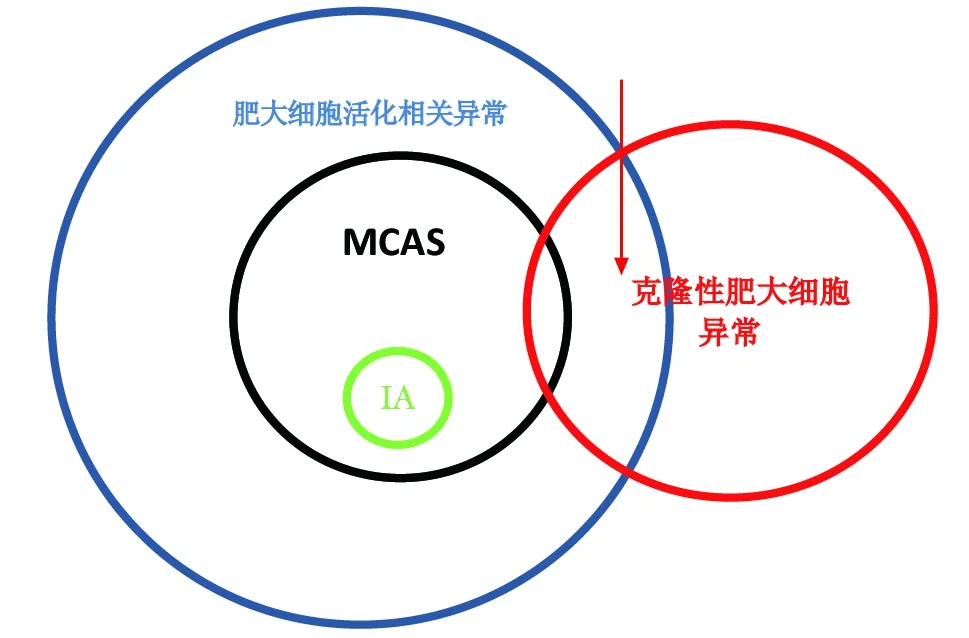
图 1 克隆性肥大细胞病,肥大细胞活化综合征(MCAS)和特发性过敏反应(IA)之间的关系圆圈大小不代表患病率

表2 特发性严重过敏反应和肥大细胞活化综合征比较

表3 肥大细胞活化临床可用且经过验证的标志物
有一项研究在过敏门诊进行了15298位患者的筛查,发现有5.9%的患者血清中类胰蛋白酶水平升高。相对于正常水平的过敏患者而言,类胰蛋白酶水平升高(>11.4ng/ml)的患者更易发生对毒液、药物和放射造影剂的严重过敏反应,并且更多的感到疲劳、腹胀、肌肉/骨骼疼痛、眩晕、心动过速、潮红、心悸、腹泻和水肿[10]。基础类胰蛋白酶水平的升高可见于以下几种疾病:肥大细胞增生症、肥大细胞增生、慢性肾脏疾病、髓系肿瘤、检测干扰所致的假性增生以及家族性高类胰蛋白酶血症。
家族性高类胰蛋白酶血症是一种由于α-类胰蛋白酶基因(TPSAB1)二倍化或三倍化所致的常染色体显性遗传病,一般人群发病率约6%[11],由于基因的倍化,类胰蛋白酶产生过多。患者可有多种表现,包括乳牙滞留、潮红、关节过度活动、毒液反应和功能性胃肠道紊乱,如肠道易激惹综合征。目前并不清楚酶失活的α-类胰蛋白酶是否在这些表现中发挥直接作用。家族性高类胰蛋白血症患者的肥大细胞与正常水平患者的相比,并不表现出内在的高反应性。因此目前没有数据提示由家族性高类胰蛋白酶血症所致的类胰蛋白酶水平升高的患者有活化的肥大细胞表型。
尿中组胺代谢物也被证实与肥大细胞负荷和活化相关[12]。最常测定的代谢物是N-甲基组胺(组胺N-甲基转移酶的产物)和1-甲基-4-咪唑基乙酸(二氨基氧化酶的产物)。尽管较短的采集时间和点分析有一定的意义,但推荐采集24 h样本更为科学。不推荐测定血组胺水平作为肥大细胞活化的标志物,因为在基础状态时组胺来源于嗜碱性粒细胞,并且受多种因素的影响,比如血样本采集和储存。同样的,尿组胺水平也受尿道菌群、储存条件和饮食的影响。
前列腺素D2是一个已知的肥大细胞活化标志物[13]。可通过检测尿中代谢物11-β-前列腺素F2α的水平判断肥大细胞活化[14]。它并不是肥大细胞活化特异性的,多种免疫细胞,包括嗜酸性粒细胞和非免疫细胞均可通过2种结构不同的酶途径产生前列腺素D2。 因此不推荐单纯靠测定前列腺素D2或F2α水平作为肥大细胞活化的标志物,同时还需检测其他标志物。目前判读肥大细胞活化的各种标志物显著升高的临界值尚未确立。对于前列腺素水平升高的良性肥大细胞活化患者,阿司匹林治疗已经取得了一些成功[14]。
白三烯C4是肥大细胞活化过程中产生的脂质介质。在体内首先被代谢成白三烯D4,然后转化成白三烯E4,并在尿中被检测到[15]。尽管目前没有大量的临床数据证实尿中白三烯E4的水平和多种肥大细胞活化症状相关,其测定可以帮助指导白三烯调节药物对症状的治疗。其他肥大细胞活化的标志物包括肝素和纤维蛋白原裂解产物。据报道,在肥大细胞活化综合征患者中,血浆肝素活性增强[16],并且纤维蛋白原的α链被β-类胰蛋白酶裂解[17]。这些检测在通常情况下并不常规使用,并且在严重过敏反应患者中有临床意义的出血很罕见。
2 肥大细胞活化综合征的临床多样性
肥大细胞活化综合征可分为原发性,继发性和特发性[5-6]。原发性肥大细胞活化异常是由于肥大细胞祖细胞的缺陷,导致了肥大细胞质量或数量产生异常。包含2个主要的亚群:肥大细胞增生症和MMAS。
肥大细胞增生症是一种以来源于携带KIT基因功能性突变的克隆性前体肥大细胞的异常增殖和聚集[4,18]为特征的疾病。最常见的KIT基因突变位点是D816V,位于基因的酪氨酸激酶细胞内段[19]。KIT基因参与了肥大细胞的分化、增殖和凋亡保护。尽管体外试验提示KIT信号传导途径和IgE介导的途径协同参与了肥大细胞活化[20],KIT基因功能性突变在这些活化途径中的参与情况仍需要被证实。
在肥大细胞增生症中,病理性肥大细胞的浸润最常见于骨髓和皮肤中。因此,诊断要通过检查皮肤、行骨髓或皮肤活检来确定。目前WHO将肥大细胞增生症分类为7种(表4)[4,6,18],肥大细胞活化的症状见于各亚型中。
皮肤肥大细胞增生症最常见于儿童,不伴内部器官的受累,比如骨髓。90%儿童期发病的肥大细胞增生症到青春期可缓解,不建议常规进行骨髓穿刺等创伤性检查,除外患儿出现全血细胞计数的异常,肝脾肿大或类胰蛋白酶水平持续高于20 ng/ml[21]。皮肤肥大细胞增生症患者可经历肥大细胞活化事件。这些事件可仅以潮红或荨麻疹的形式局限于皮肤,但是也可累及非皮肤部位,比如胃肠道或心血管系统。皮肤肥大细胞活化所释放的介质可在远隔部位发挥作用,故皮肤外症状的出现并不提示系统性的疾病。儿童皮肤肥大细胞增生症患者可携带KIT基因的不典型突变,位于细胞外部分,而不是密码子816[22]。目前尚不清楚在这些患者中,基因突变情况是否与临床表型相关。
约有10%的儿童期发病的皮肤肥大细胞增生症可进展为系统性肥大细胞增生症,以骨髓浸润为主要表现。在有系统疾病的儿童中,可以见到一种罕见的组织病理学变型,称为分化良好的系统性肥大细胞增生症[23-24]。分化良好的系统性肥大细胞增生症患者缺乏CD25的病理性表达,肥大细胞形态正常,可不具有KIT 816的基因突变。骨髓受累及的系统性肥大细胞增生症的患者满足WHO病理诊断标准(表5)。需要满足主要标准和1或3条次要标准才能诊断系统性肥大细胞增生症。也可通过非骨髓的活检标本作出系统性肥大细胞增生症的诊断,同样的标准适用于非骨髓活检。胃肠道活检是一个特殊的挑战,因为胃肠道肥大细胞的类胰蛋白酶表达可能是阴性的,需要做CD117染色[25]。胃肠道中的肥大细胞在许多其他情况下也可增多,如易激惹综合征,如果这些活检标本不能满足其他病理学标准,有可能会导致胃肠道肥大细胞增生症的错误诊断。

表4 肥大细胞增生症的WHO分型*

表5 系统性肥大细胞增生症的诊断标准
MMAS是表现为具有肥大细胞活化症状(常诊断为特发性严重过敏反应),但缺乏皮肤发现,骨髓中有KIT D816V突变或CD25+肥大细胞[6,26]的一种疾病。患者类胰蛋白酶水平低于20 ng/ml,肥大细胞负荷正常或较低,不能完全满足系统性肥大细胞增生症的诊断标准。少部分患者后期可出现系统性肥大细胞增生,但大部分患者最终不会发展为系统性肥大细胞增生症。MMAS或系统性肥大细胞增生症的自发性缓解迄今未有描述。
MMAS的诊断需要有典型的临床表现,和通过骨髓活检确诊。有低血压性严重过敏反应症状的患者需要考虑这一诊断。检测KIT D816V突变可作为筛查的手段。外周血基因检测结果阴性不能排除MMAS,具有KIT D816V突变的患者需要考虑骨髓活检。
原发性肥大细胞异常所致的肥大细胞活化综合征患者的临床表现有皮肤潮红、心动过速、低血压和胃肠道绞痛,恶心、呕吐、腹泻(Box 1)。慢性荨麻疹几乎从不和系统性肥大细胞增生症相关[27]。同样,血管性水肿及上呼吸道症状在肥大细胞增生症患者中高度不典型,但这些症状可在继发性或特发性肥大细胞活化的病例中出现。肥大细胞增生症或单克隆肥大细胞活化的患者更容易对膜翅昆虫的毒液发生超敏反应[28]。这些患者有基于皮肤或血液试验证实的IgE介导的致敏,肥大细胞负荷增加,使其在被膜翅目昆虫叮咬后更易发生危及生命的过敏反应。因此对膜翅目昆虫叮咬有系统性反应的患者,需要常规检测血清基础类胰蛋白酶水平。目前,推荐对毒液有系统性超敏反应,且有相关的原发性肥大细胞异常的患者,开始毒液免疫治疗,并无限期地维持这个治疗。
在继发性肥大细胞活化综合征患者,其骨髓中肥大细胞产生正常,组织中肥大细胞细胞数目通常正常或在对炎性刺激下反应性增加(反应性肥大细胞增生)。肥大细胞活化的刺激物可以是IgE介导的(食物、药物、膜翅目昆虫毒液或吸入剂),可通过过敏检查发现。非IgE介导的肥大细胞活化的刺激物包括药物;物理性刺激,包括锻炼;压力;急性或慢性感染,毒液;或其他炎症性或肿瘤性疾病。通过聚阳离子促泌素受体MRGPRX2,肥大细胞可检测到并对多种刺激物发生反应,包括P物质,药物,和毒液成分[29]。肥大细胞也具有模式识别受体,补体受体,和IgG受体等周围炎症的感受器[30-31]。

Box 1 肥大细胞活化综合征:临床小窍门
特发性肥大细胞活化综合征是指病因不明的肥大细胞异常活化综合征。特发性严重过敏反应是其中的亚型。然而,由于历史原因,笔者对于满足严重过敏反应临床标准的患者更愿意使用特发性严重过敏反应这一术语。这些患者可能有克隆性或继发性的病因,在有更多数据可用的情况下可重新分类。
3 肥大细胞活化综合征的治疗
肥大细胞活化综合征一般治疗原则包括避免激发物,针对肥大细胞介质的药物治疗,治疗相关的症状,对原发性(克隆性)肥大细胞异常的患者考虑肥大细胞减细胞术[32]。
3.1 避免激发物
过敏检查可作为指导用来避免引发肥大细胞活化的食物、药物和吸入性激发物。对毒液系统反应的患者需要无限期地维持毒液免疫治疗。吸入性过敏原的免疫治疗需根据每个患者的风险/受益比的具体情况具体分析。尽管避免特异性激发物的建议不适合所有的患者,情绪应激是所有种类肥大细胞活化综合征的主要激发物,因此需要使用药物或非药物手段进行适当的情绪管理。压力诱发肥大细胞活化的可能机制包括促肾上腺皮质激素释放因子和P物质[3]。低组胺饮食对肥大细胞活化综合征治疗的帮助尚缺乏临床对照试验。
3.2 药物治疗
肥大细胞活化综合征治疗的主要药物是H1和H2受体拮抗剂,白三烯调节剂,色甘酸钠,糖皮质激素和奥马珠单抗。肥大细胞介质的尿中标志物可指导选择合适的抗介质治疗。所有发生过严重全身性过敏反应的患者均需要常备可自行注射的肾上腺素。同样对于肥大细胞增生症的患者,即使未发生过严重全身性过敏反应也要考虑备有。酮替芬是一种抗组胺药,已经证实可有效治疗特发性严重过敏反应[33]。色甘酸钠被用于治疗伴胃肠道症状的肥大细胞增生症患者,但吸收很差,限制了其作为系统用药的效果[34]。治疗启始方案可选择每日一次或两次使用非镇静作用的H1受体拮抗剂,若患者有胃肠道症状可同时使用H2受体拮抗剂。需要补充说明的是根据需要选用短效或长效抗组胺药。有严重难治症状的患者可从糖皮质激素治疗中获益,需要寻找能够维持症状控制的糖皮质激素的最低剂量。白三烯拮抗剂,比如孟鲁司特或齐留通,可作为二线用药和辅助用药;然而,这些药物的副作用,包括精神方面的不良反应,在使用之前需要和患者进行讨论。已有研究表明奥马珠单抗对原发性、继发性和特发性肥大细胞活化患者有益,并且可增加患者对毒液免疫治疗的耐受性[35-37]。奥马珠单抗用于治疗非IgE介导的肥大细胞活化的机制并不清楚,但是可能提示有未发现的内源性IgE靶点的存在,或通过下调非特异性IgE受体来降低肥大细胞的敏感性。
3.3 肥大细胞减细胞术
传统用来减少肥大细胞数量的药物IFN-α和克拉屈滨也可以控制肥大细胞增生症患者中肥大细胞的活化[38-41]。这些药物通常用于治疗肥大细胞增生症中的快速进展型,比如表现为相关的血液学异常,侵袭性系统性肥大细胞增生症或肥大细胞白血病。在极少的情况下,这些药物可用于治疗发生过威胁生命的肥大细胞活化且对抗介质治疗无效的惰性肥大细胞增生症患者。
米哚妥林,一种具有抗D816V KIT活性的多重酪氨酸激酶抑制剂,已经被美国FDA批准用于治疗进展型肥大细胞增生症。接受米哚妥林治疗的患者,除肥大细胞数降低外,肥大细胞活化的症状也随之减轻,并提高了生活质量[42]。米哚妥林也可降低IgE介导的肥大细胞活化[43]。常见的药物不良反应有恶心、呕吐,血细胞减少时要监测全血细胞计数。该药目前不用于治疗惰性肥大细胞增生症或非克隆性的肥大细胞病。
3.4 其他信号传导抑制剂
典型酪氨酸激酶抑制剂伊马替尼具有抗野生型KIT和血小板源性生长因子受体的活性。在近期的一个临床试验中,伊马替尼已经被证实可增加严重哮喘患者的FEV1,并降低气道的高反应性[44]。在肺部活检标本中发现它也可以降低类胰蛋白酶的水平和肥大细胞的数目。然而,缺乏将肺功能增加和肥大细胞活性降低因果关系联系起来的结论性证据。体外试验中,伊马替尼不能降低肥大细胞的活性。鉴于耐药的考虑,不推荐用于治疗非克隆性肥大细胞活化综合征或携带D816V KIT突变的肥大细胞增生症患者。
马赛替尼,野生型(非D816V突变型)KIT和LYN的抑制剂,在一个Ⅲ期临床试验中被报道可改善惰性系统性或冒烟型肥大细胞增生症患者的症状(累积反应率18.7%比对照组7.4%)[45]。腹泻、皮疹和无力是较常见的不良反应,发病率分别为11%,6%和6%。
依鲁替尼是Bruton酪氨酸激酶抑制剂,被美国FDA批准用于治疗套细胞淋巴瘤、慢性淋巴细胞白血病和巨球蛋白血症。近期的临床研究发现,使用依鲁替尼治疗淋巴增殖性疾病的患者出现了过敏原皮肤试验和嗜碱性粒细胞活性试验反应性降低[46]。该药物对非特异性非IgE介导的肥大细胞活化没有作用。这与Bruton酪氨酸激酶抑制剂对IgE介导的肥大细胞活化的体内作用的描述是一致的[47];然而,在考虑用于治疗IgE介导的疾病之前,还需要更多的尤其是抗体介导的免疫功能不良反应的相关数据。
4 未确定区域和研究机会
在临床实践中,一些患者有多种多系统的症状,但是并没有发现主要的病因,此时可考虑检查是否有肥大细胞活化综合征。这些症状包括慢性疲劳,对环境多种因素、食物和药物的不耐受性;还有神经精神症状,比如记忆问题和头痛。这些症状可以是慢性的,没有明确的肥大细胞活化的发作。目前,没有证据表明这些症状是由异常的肥大细胞表型导致的慢性介质的释放引起的。这些患者中的一部分可以有基础类胰蛋白酶水平的轻度升高,这有可能导致肥大细胞活化的诊断。在这些患者中,要考虑到家族性高胰蛋白酶血症的可能,毕竟一般人群的发病率高达6%。在过度活动型Ehlers-Danlos综合征和体位性直立性低血压患者中,临床上也发现了多种肥大细胞活化的症状,比如潮红和胃肠道绞痛[48-49]。有报道高肾上腺素体位性直立性低血压患者中,有一小部分尿中组胺代谢物增加,并且更容易有潮红、呼吸短促、头痛、多尿和胃肠道症状[50]。由于目前仍不清楚这些患者中肥大细胞活化的症状是由于肥大细胞介质的释放引起还是由其他病理过程导致,比如家族性自主神经异常,结缔组织缺陷,或两者都有(表6),故需要进行更多的研究。
参考文献请见原文:
J Allergy ClinImmunol, 2017;140:349-355.
表6肥大细胞活化综合征:哪些是未知的?
1.对于由肥大细胞介质导致的多种非特异性症状的患者,是否存在肥大细胞活化综合征的慢性形式?在这种患者,机体肥大细胞总负荷能否维持肥大细胞的持续活化状态?2.对于特发性肥大细胞活化综合征患者,是否存在尚未发现的克隆性或继发性(如IgE介导的)的病因?对于非IgE介导的肥大细胞活化综合征患者,奥马珠单抗是如何发挥作用的?3.其他另外的临床可用的肥大细胞活化标志物有哪些?4.在关节活动过度和体位性直立性低血压综合征患者,是否有病理性肥大细胞活化?5.家族性高类胰蛋白酶血症患者是否有确证的临床表型?如有,类胰蛋白酶或肥大细胞是否参与其病理过程?
