下调HIF-2α基因对低氧诱导的肝癌细胞体外生物学行为的影响
2018-03-07李伟伟耿晓松申保生杨玉新宋新文
李伟伟 耿晓松 申保生 杨玉新 宋新文
(新乡医学院第一附属医院感染疾病科,卫辉 453100)
肝细胞癌(Hepatocellular carcinoma,HCC)是我国常见的恶性肿瘤,发病率位居所有肿瘤的第五位,死亡率位居第三位[1]。侵袭和转移是导致患者死亡的主要原因[2]。因此,明确肿瘤侵袭及转移的关键调控基因及其相应的信号通路,并进行相应的阻断是肿瘤治疗的重要措施[3]。在肿瘤的发展过程中,因自身血管供应不能满足快速生长的肿瘤细胞的需要,逐渐形成低氧环境,肿瘤细胞能通过一系列自我调节以适应低氧微环境,其中发挥核心调控作用的因子为HIF-2α[4,5],激活后启动下游多种基因和蛋白质的表达,参与细胞增殖、代谢、血管生成、肿瘤浸润转移等,加速疾病恶化[6]。因此,本实验应用特异性HIF-2α siRNA下调低氧诱导下人肝癌细胞株HepG2细胞中HIF-2α表达,研究其表达下调对低氧环境下的HepG2细胞体外增殖、凋亡和迁移侵袭等生物学行为的影响,为肝癌的分子靶向治疗提供新的实验依据。
1 材料与方法
1.1材料
1.1.1主要试剂 RT-PCR 试剂盒、LipofectamineTM2000和Trizol Reageat购自美国Invitrogen公司;CoCl2购自美国Sigma公司;HIF-2α引物由上海生工生物工程有限公司合成,特异性siRNA由广州市锐博生物科技有限公司合成,兔抗人HIF-2α单克隆抗体为美国Santa Cruz 公司产品;BCA蛋白定量试剂盒、增强化学发光(ECL)显色液购自中国南京凯基生物公司;Annexin V-FITC/PI凋亡检测试剂盒购自美国Biovision公司;Transwell 小室购自美国Corning 公司。
1.1.2细胞 人肝癌细胞株HepG2由中国科学院上海细胞库提供。
1.2实验方法
1.2.1细胞培养、诱导低氧环境 肝癌HepG2细胞置于含10%胎牛血清的RPMI1640培养液(37℃培养箱、5%CO2)培养,胰酶消化传代。取24孔板接种对数生长期细胞1×104个/孔,继续培养24 h后,培养基分别调换成CoCl2浓度为50、100、200、400 μmol/L的缺氧培养箱,诱导HepG2细胞处于低氧环境,继续培养24 h后收集细胞用于检测。
1.2.2不同低氧浓度诱导下HepG2细胞HIF-2α mRNA表达 收集各组HepG2细胞,按照Trizol RNA试剂盒说明书步骤操作,逆转录成cDNA,然后以cDNA为模板,以荧光定量PCR的方法扩增HIF-2α mRNA,Real-time PCR方法检测各组细胞中HIF-2α mRNA表达。HIF-2α引物序列:上游5′-GGTGAAAGTCTACAACAACTGCC-3′,下游5′-ATGGGTGCTGGATTGGTTC-3′,GAPDH引物序列:上游5′-TGGCACCCAGCACAATGAA-3′,下游5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′。Real-time PCR 扩增条件:95℃预变性5 min、95℃变性30 s、60℃退火30 s 和 72℃延伸30 s,共 40 个循环。所有标本均重复检测3次,计算Ct值,采用2-ΔΔCt法进行计算分析。
1.2.3细胞转染及分组 选择合适低氧浓度(加200 μmol/L CoCl2)诱导细胞后,在RPMI1640培养液中(37℃培养箱、5%CO2)培养,细胞融合度达到85%左右时,在LipofectamineTM2000脂质体介导下转染细胞。实验分为四组,常氧组、低氧组、低氧+Control siRNA组、低氧+HIF-2α siRNA组。
1.2.4转染后HepG2细胞HIF-2α mRNA表达 收集转染后48 h的各组HepG2细胞,按照1.2.2步骤检测HIF-2α mRNA表达。
1.2.5转染后HepG2细胞HIF-2α蛋白表达 收集转染后各组细胞分别进行培养,48 h后提取各组核蛋白,BCA法测定蛋白浓度。10%的聚丙烯酰胺凝胶分离蛋白,电泳后转印至聚偏二氟乙烯膜上,用含5%脱脂奶粉的PBST于常温下封闭1 h,分别加入GAPDH和HIF-2α一抗,4℃孵育过夜。次日洗膜后,加入对应的第二抗体孵育90 min,加入ECL显色液显影。采用Quantity One软件,对图片进行分析并测定灰度值。
1.2.6转染后HepG2细胞增殖变化 取对数生长期HepG2细胞,接种96孔板,接种细胞数量为:1×104个/孔,37℃、5%CO2培养24 h后,在培养基中加入200 μmol/L CoCl2并进行转染,每组设4个复孔,同时设空白对照。继续培养24、48、72、96、120 h后,每孔加入5 mg/ml的MTT溶液 20 μl继续培养4 h,弃去孔内上清液,加入150 μl/孔二甲基亚砜(DMSO),振荡10 min后,以空白孔为对照,在酶联免疫检测仪上测定各孔光吸收值,检测波长为490 nm,实验重复3次。记录结果,根据公式计算:细胞增殖率(%)=实验组OD值/对照组OD值×100%,绘制细胞生长曲线图。
1.2.7转染后HepG2细胞凋亡变化 收集转染48 h 后的各组 HepG2细胞,4℃预冷的PBS洗涤细胞2次,250 μl 1×缓冲液重悬细胞制备单细胞悬液,调节浓度为1×106个/孔。取100 μl细胞悬液5 ml于流式管中,分别加入5 μl Annexin V-FITC和10 μl PI混匀,室温避光孵育20 min,加入400 μl PBS,用流式细胞仪检测各组细胞凋亡率。实验重复3 次,取平均值。
1.2.8转染后HepG2细胞周期变化 细胞转染48 h 后,用不含EDTA的胰蛋白酶收集,磷酸盐缓冲液(PBS)制备成单细胞悬液,800 r/min离心10 min,70%乙醇4℃固定过夜,预冷的PBS洗涤3次,加入200 μl RNase A(1 mg/ml),37℃温育30 min。避光条件下加入PI染色液(100 ng/ml)800 μl 混匀,4℃放置30 min。使用流式细胞仪分析样品,测定细胞周期。
1.2.9转染后HepG2细胞侵袭迁移力变化 Transwell法检测细胞迁移:采用24孔板Transwell迁移系统以无血清的DMEM培养基悬浮各组细胞为单细胞悬液(7.5×105个/ml)。在Transwell小室上层加入200 μl悬液,小室下层加入600 μl DMEM培养液(含10%胎牛血清),常规培养24 h,取出小室,甲醇固定 30 min,苏木素染色 5 min,流水冲洗,棉签擦掉未穿过膜的细胞。光镜下随机选取6个视野计数,实验重复3次。Transwell法检测细胞侵袭:Transwell 小室滤膜上室面均匀涂Matrigel胶,紫外线照射杀菌。余下步骤同 Transwell迁移实验。

2 结果
2.1不同低氧浓度诱导下HepG2细胞HIF-2α mRNA表达 RT-PCR结果显示 HepG2细胞在常氧环境下有少量HIF-2α表达,当CoCl2浓度为50、100、200、400 μmol/L 时,HIF-2α mRNA相对表达量逐渐递增,与常氧组比较,均有显著性差异(P<0.05)。CoCl2浓度为200 μmol/L和 400 μmol/L时,HIF-2α mRNA表达量无显著性差异,因HepG2细胞在200 μmol/L CoCl2浓度时损伤相对轻,故后续实验选择200 μmol/L CoCl2作为低氧环境诱导HepG2细胞,见图1。
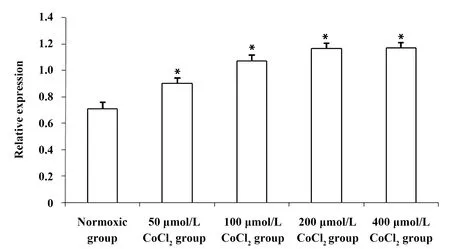
图1 不同浓度CoCl2组HepG2细胞HIF-2α mRNA的表达Fig.1 HIF-2α mRNA expression of HepG2 cells in different concentration of CoCl2 groupNote: Compared with normoxic group,*.P<0.05.
2.2转染48 h后各组HepG2细胞中HIF-2α mRNA表达 低氧诱导下,HIF-2α mRNA表达显著上调,特异性转染HIF-2α siRNA后,HIF-2α mRNA表达显著下调,差异均有统计学意义(P<0.05),低氧组与低氧+Control siRNA组相比,及低氧+HIF-2α siRNA组与常氧组相比,差异无统计学意义(P>0.05),见图2。
2.3转染48 h后各组HepG2细胞中HIF-2α蛋白表达 低氧诱导下,HIF-2α蛋白表达显著上调,特异性转染HIF-2α siRNA后,HIF-2α蛋白表达显著下调,差异均有统计学意义(P<0.05),低氧组与低氧+Control siRNA组相比,及低氧+HIF-2α siRNA组与常氧组相比,差异无统计学意义(P>0.05),见图3。
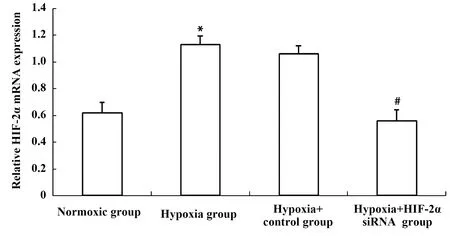
图2 转染48 h后各组细胞中HIF-2α mRNA的表达Fig.2 Expression of HIF-2α mRNA in each group cell after 48 h transfectionNote: Compared with normoxic group,*.P<0.05;compared with hypoxia+control group,#.P<0.05.

图3 转染48 h后各组细胞中HIF-2α蛋白的表达情况Fig.3 Expression of HIF-2α protein in each group cell after 48 h transfectionNote: Compared with normoxic group,*.P<0.05;compared with hypoxia+control group,#.P<0.05.1.Normoxic group;2.Hypoxia group;3.Hypoxia+control group;4.Hypoxia+HIF-2α siRNA group.
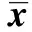
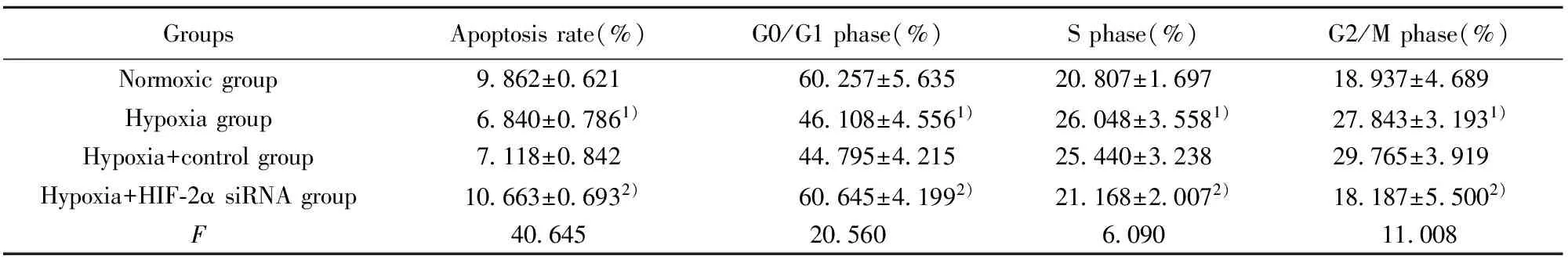
GroupsApoptosisrate(%)G0/G1phase(%)Sphase(%)G2/Mphase(%)Normoxicgroup9 862±0 62160 257±5 63520 807±1 69718 937±4 689Hypoxiagroup6 840±0 7861)46 108±4 5561)26 048±3 5581)27 843±3 1931)Hypoxia+controlgroup7 118±0 84244 795±4 21525 440±3 23829 765±3 919Hypoxia+HIF⁃2αsiRNAgroup10 663±0 6932)60 645±4 1992)21 168±2 0072)18 187±5 5002)F40 64520 5606 09011 008
Note:Compared with normoxic group,1)P<0.05;compared with hypoxia+control group,2)P<0.05.

图4 各组HepG2细胞生长曲线图Fig.4 HepG2 cell growth curve drawn by MTT methodNote: Compared with normoxic group,*.P<0.05;compared with hypoxia+control group,#.P<0.05.

图5 转染48 h后各组细胞凋亡率Fig.5 Apoptosis rate in each group cell after 48 h transfection
2.4MTT结果 低氧诱导下,HepG2细胞在24、48、72、96、120 h光密度值均显著升高,特异性转染HIF-2α siRNA后,HepG2细胞在对应时间点的光密度值均显著降低(P<0.05),低氧组与低氧+Control siRNA组相比,及低氧+HIF-2α siRNA组与常氧组相比,差异无统计学意义(P>0.05),见图4。

图6 Transwell小室检测各组HepG2细胞的迁移、侵袭结果Fig.6 Migration and invasion of HepG2 cells were detected by Transwell cellsNote: Compared with normoxic group,*.P<0.05;compared with hypoxia+control group,#.P<0.05.
2.5细胞凋亡及细胞周期分布 低氧诱导下,HepG2细胞凋亡率减少,特异性转染HIF-2α siRNA后,HepG2细胞凋亡率升高(P<0.05),分布于G0/G1期细胞比率显著升高,S期及G2/M期细胞比率显著降低,差异均有统计学意义(P<0.05),低氧组与低氧+Control siRNA组相比,及低氧+HIF-2α siRNA组与常氧组相比,差异无统计学意义(P>0.05),见图5、表1。
2.6细胞侵袭迁移力 低氧诱导下,HepG2细胞侵袭迁移数目增多,特异性转染HIF-2α siRNA后,HepG2细胞迁移力降低,穿过侵袭膜的细胞总数减少(P<0.05),低氧组与低氧+Control siRNA组相比,及低氧+HIF-2α siRNA组与常氧组相比,差异无统计学意义(均P>0.05),见图6。
3 讨论
由于恶性肿瘤生长过快,同时微血管结构异常不能提供充足的氧,导致肿瘤组织存在缺血缺氧区[7]。在肿瘤的长期慢性缺氧过程中,发挥主要作用的调控因子为HIF-2α,通过启动其下游靶基因,增加肿瘤的恶性生物学行为[8-10]。因此,本实验应用特异性HIF-2α siRNA转染低氧环境下HepG2细胞,探讨下调HIF-2α基因对人肝癌细胞株HepG2低氧状态下增殖、凋亡、细胞周期分布和迁移侵袭力的影响。
目前国内实验室多采用在培养基中加入不同浓度CoCl2的方法来诱导肿瘤细胞体外低氧。通过实验,我们发现200 μmol/L的CoCl2作用细胞,可达到理想的低氧状态,同时对细胞的损伤也较轻。RNA 干扰(RNA interference,RNAi)是近年来在基因治疗研究领域兴起的一项新技术,与传统的反义寡核苷酸和核酶等基因沉默手段相比,稳定性更好,抑制效果更优越[11]。实验中,我们发现低氧环境下HepG2细胞HIF-2α mRNA和蛋白表达水平均显著升高,特异性HIF-2α siRNA转染细胞48 h后,HIF-2α在mRNA及蛋白水平表达均显著下调,说明细胞转染成功。
肿瘤的进展离不开肿瘤细胞的过度增殖和凋亡减弱[12],并与细胞周期的调控异常有密切关系。细胞周期遵循G1-S-G2-M的发展规律,细胞一旦从G1期跨入S期则不再依靠外来信息刺激而自动完成分裂过程[13,14]。低氧环境下,肝癌HepG2细胞生长速度加快,处于合成后期的细胞比率明显增多,细胞凋亡减少,特异性HIF-2α siRNA转染后,HepG2细胞生长速度减慢,增殖能力下降,处于合成前期(G0/G1期)的细胞比率升高,细胞凋亡增加。这表明特异性HIF-2α siRNA 很可能通过调控其细胞周期来控制肿瘤细胞生长,促进细胞凋亡。侵袭和转移是影响肿瘤预后的一个重要因素[2],我们发现,低氧环境下,肝癌HepG2细胞侵袭迁移能力增强,特异性HIF-2α siRNA转染后,HepG2细胞侵袭迁移能力受到显著抑制,从而减缓了肝癌的恶性生物学行为,改善患者预后。
综上所述,特异性HIF-2α siRNA转染低氧环境下肝癌HepG2细胞后,HIF-2α表达下调,从而抑制细胞增殖、侵袭迁移,促进细胞凋亡,减缓肝癌的恶性生物学行为。阻断HIF-2α是靶向治疗缺氧肿瘤细胞的关键,有望成为肝癌治疗的新靶点,但其中具体的分子机制仍需要进一步研究探索。
[1] Cervello M,McCubrey JA,Cusimano A,etal.Targeted therapy for hepatocellular carcinoma:novel agents on the horizon[J].Oncotarget,2012,3(3):236-260.
[2] 李 娜,王洪兴,张 洁,等.siRNA干扰缺氧诱导因子2α对乳腺癌细胞侵袭能力的影响及相关机制[J].中国老年学杂志,2015,35(8):2171-2173.
Li N,Wang HX,Zhang J,etal.Effect of siRNA interfering with hypoxia inducible factor 2 alpha on invasive ability of breast cancer cells and its related mechanism[J].Chin J Gerontol,2015,35(8):2171-2173.
[3] 曾楷峰,施瑞华,朱 宏,等.RNA 干扰沉默缺氧诱导因子-1α对胃癌细胞生物学行为的影响[J].南京医科大学学报(自然科学版),2010,30(2):144-149.
Zeng KF,Shi RH,Zhu H,etal.Effects of RNA interference targeting HIF-1α gene on the biological behavior of gastric cancer cells[J].Acta Universitatis Medicinalis Nanjing(Natural Science,2010,30(2):144-149.
[4] 余小庆,蔡 璨,杜 轩,等.低氧诱导因子-2α-酰基辅酶A去饱和酶-1通路对低氧诱导的肝癌细胞生物学行为的影响[J].中华肝脏病杂志,2016,24(7):506-512.
Yu XQ,Cai C,Du X,etal.Effect of hypoxia-inducible factor-2α/stearoyl-CoA desaturase-1 pathway on biological behaviors of hepatoma cells induced by hypoxia[J].Chin J Hepatol,2016,24(7):506-512.
[5] Xue X,Taylor M,Anderson E,etal.Hypoxia-inducible factor-2α activation promotes colorectal cancer progression by dysregulating iron homeostasis[J].Cancer Res,2012,72(9):2285-2293.
[6] Cannito S,Turato C,Paternostro C,etal.Hypoxia up-regulates SERPINB3 through HIF-2α in human liver cancer cells[J].Oncotarget,2015,6(4):2206-2221.
[7] Yang SL,Liu LP,Niu L,etal.Downregulation and pro-apoptotic effect of hypoxia-inducible factor 2 alpha in hepatocellular carcinoma[J].Oncotarget,2016,7(23):34571-34581.
[8] Mohlin S,Hamidian A,Phlman S.HIF2A and IGF2 expression correlates in human neuroblastoma cells and normal immature sympathetic neuroblasts[J].Neoplasia,2013,15(3):328-334.
[9] Yao J,Li J,Geng P,etal.Knockdown of a HIF-2α promoter upstream long noncoding RNA impairs colorectal cancer stem cell properties in vitro through HIF-2α downregulation[J].Onco Targets Ther,2015,8:3467-3474.
[10] 王 旎,董超然,唐 萃,等.HIF-1α、HIF-2α 和 MT 在人甲状腺乳头状癌中的表达及其意义[J].中国免疫学杂志,2014,30(5):662-665.
Wang N,Dong CR,Tang C,etal.Expression and significance of HIF-1α,HIF-2α and MT in human papillary thyroid carcinoma[J].Chin J Immunol,2014,30(5):662-665.
[11] Varshosaz J,Farzan M.Nanoparticles for targeted delivery of therapeutics and small interfering RNAs in hepatocellular carcinoma[J].World J Gastroenterol,2015,21(42):12022-12041.
[12] Cillo U,Giuliani T,Polacco M,etal.Prediction of hepatocellular carcinoma biological behavior in patient selection for liver transplantation[J].World J Gastroenterol,2016,22(1):232-252.
[13] Madan E,Gogna R,Kuppusamy P,etal.TIGAR induces p53-mediated cell-cycle arrest by regulation of RB-E2F1 complex[J].Br J Cancer,2012,107(3):516-526.
[14] Ruijtenberg S,van den Heuvel S.Coordinating cell proliferation and differentiation:Antagonism between cell cycle regulators and cell type-specific gene expression[J].Cell Cycle,2016,15(2):196-212.