雷帕霉素激活自噬改善嘌呤霉素氨基核苷诱导的足细胞损伤①
2018-03-07詹慧芳刘文娟龚建光
詹慧芳 刘文娟 金 娟 龚建光 赵 黎 何 强
(浙江大学校医院紫金港校区,杭州 310058)
足细胞(Podocyte)是一类位于肾小球毛细血管基底膜外侧的脏层上皮细胞,因其胞浆在基底膜表面形成伪足样突起而得名,足突之间的裂孔膜是肾小球滤过的最后一道屏障,因此足细胞的损伤将导致蛋白尿的出现。肾小球疾病发生过程中的许多因素都可能导致足细胞结构和功能的改变,使得肾小球血液滤过屏障被破坏,进而推动肾小球疾病进展直至终末期肾病。近年来,关于足细胞的研究成为肾小球疾病关注的热点。大量的研究证实,自噬在足细胞损伤中发挥重要作用[1-3]。嘌呤霉素氨基核苷(Puromycin amino nucleoside,PAN)肾病模型是常用的足细胞损伤模型,有研究证实,雷帕霉素可以促进Nephrin蛋白表达显著增加,改善PAN所致的足细胞损伤,雷帕霉素还能减轻PAN肾病小鼠蛋白尿的程度[4,5]。然而足细胞自噬是否在雷帕霉素对PAN足细胞损伤模型的保护中发挥作用还不得而知。因此,本研究拟通过PAN足细胞损伤模型,观察足细胞自噬改变,探寻雷帕霉素对足细胞保护作用的可能机制。
1 材料与方法
1.1材料 雷帕霉素购于美国Selleck,RMPI-1640/DMEM培养基购于美国Hyclone,重组的小鼠 γ-干扰素(IFN-γ)购于美国 Peprotech,AnnexinV/PI Apoptosis Detection Kit APC购于美国eBioscience,CCK-8试剂盒、羊抗兔HRP标记二抗购自上海碧云天生物技术有限公司,兔抗鼠LC3、p62.4EBP1、P70S6K、mTOR购自美国Proteintech,兔抗鼠P-4EBP1、P-P70S6K、P-mTOR购自美国Affinity,BCA蛋白定量试剂盒购于Thermos公司。
1.2方法
1.2.1细胞培养和分组 小鼠永生化足细胞购于中国科学院上海生命科学研究院细胞资源中心,将细胞移入5 ml含10% FBS的RPMI1640培养液中,1 200 r/min离心5 min,倾去含DMSO的上清;加入含10%FBS、100 U/ml青霉素、100 μg/ml链霉素的RPMI1640培养液5 ml,轻柔吹打至细胞呈单个,将其移入培养瓶;加入50 U/ml γ干扰素,放入33℃、5%CO2培养箱中培养,2 d更换一次培养液。待细胞长满70%~80%时,用PBS洗涤,0.25%胰蛋白酶消化后,加入RPMI1640培养液传代培养。将含有50 U/ml γ干扰素的培养基换成不含有干扰素的培养基,置于37℃、5%CO2培养箱中,每2 d更换一次培养液,待10~14 d足细胞即分化成熟,进行后续实验分组和操作。根据不同的处理分成对照组(Control组),PAN组(加入50 μg/ml PAN),雷帕霉素组(RAP组:分别加入100、200、300 ng/ml雷帕霉素),PAN+雷帕霉素组(PAN+RAP组:细胞在用含PAN的培养液培养前1 h,分别用100、200、300 ng/ml雷帕霉素进行预处理1 h)。
1.2.2CCK-8检测足细胞生长 取对数生长期小鼠肾足细胞,胰蛋白酶消化,稀释细胞使其浓度为(1~5)×105个细胞/ml,分别取100 μl至96孔板,33℃、5%CO2饱和湿度培养。按上述分组处理足细胞,给药24 h后,按1∶10体积比混合Cell Counting Kit-8和无血清的RPMI1640,每孔100 μl加入待测孔,33℃、5%CO2培养箱中孵育1 h;酶标仪测定450 nm处吸光度值。
1.2.3Annexin V/PI双染法检测细胞凋亡 细胞培养及分组处理同上,吸取细胞培养液至合适离心管,PBS小心清洗细胞一次,加入适量胰酶消化细胞,室温孵育后小心吸除胰酶,向离心管中加入细胞培养液小心吹散。1 000×g,离心5 min,弃上清,收集细胞,用PBS轻轻重悬细胞并计数;取(5~10)×104个重悬的细胞,1 000×g,离心5 min,弃上清,加入195 μl Annexin V-APC结合液轻轻重悬细胞。加入5 μl Annexin V-APC,轻轻混匀,4℃避光孵育15 min。加入5×PI染色液,轻轻混匀,4℃避光孵育5 min,同时以不加Annexin V-APC及PI的一管为阴性对照。流式细胞仪检测,Annexin V-APC对应BD流式细胞仪FL4检测通道,PI对应BD流式细胞仪FL2检测通道。
1.2.4透射电镜观察自噬小体 各组细胞处理24 h 后,用细胞刮将玻片上的细胞刮下,将培养液离心,制备超薄切片后在透射电镜下观察。
1.2.5Western blot检测LC3、p62、4EBP1、P70S6K、mTOR蛋白表达 收集各组细胞,充分裂解、离心后取上清,BCA法蛋白定量。蛋白样品加入4×SDS loading buffer,沸水煮沸 5~10 min,离心。取 50 μg总蛋白加入SDS-PAGE凝胶上样孔内,电泳结束后,将NC膜在甲醇中浸泡,再使用Transfer Buffer浸泡凝胶、滤纸和NC膜,制备转移三明治。转膜完毕后,封闭,加一抗 4℃孵育过夜,加入稀释好的二抗,室温孵育2 h。ECL 检测样本免疫活性凝胶成像系统分析。

2 结果
2.1CCK-8法检测细胞生长 采用CCK-8试剂盒检测各组小鼠足细胞的增殖情况。结果如图1所示,与对照组比较,PAN组的细胞生长受到显著抑制(P<0.01),100 ng/ml RAP对足细胞生长没有明显的抑制作用(P>0.05),200 ng/ml RAP组的细胞受到显著抑制(P<0.05),300 ng/ml RAP组、PAN+100 ng/ml RAP组、PAN+200 ng/ml RAP组以及PAN+300 ng/ml RAP组的细胞增殖均受到显著抑制(P<0.01)。与PAN组比较,PAN+100 ng/ml RAP组、PAN+200 ng/ml RAP组及PAN+300 ng/ml RAP组的细胞生长抑制作用得到显著改善(P<0.01)。
2.2雷帕霉素抑制PAN诱导的足细胞凋亡 采用Annexin V/PI双染法检测不同处理组小鼠肾足细胞凋亡情况。结果显示,与对照组比较,PAN组、RAP组和PAN+RAP组细胞凋亡率均显著增加(P<0.001)。与PAN组比较,RAP+PAN组细胞凋亡率显著减少(P<0.001)。与RAP组比较,RAP+PAN组细胞凋亡率显著增加(P<0.001)。见图2A、B。
2.3雷帕霉素对PAN诱导的足细胞自噬活性的影响 Western blot检测各组小鼠足细胞自噬标记物LC3和p62的表达。结果显示,与 Control 组比较,PAN 组 LC3Ⅱ蛋白表达显著下调,而p62蛋白表达显著上调;RAP 组 LC3Ⅱ蛋白表达明显上调,而p62蛋白表达显著下调。 与 PAN 组比较,PAN+RAP组LC3Ⅱ蛋白表达上调,p62蛋白表达显著下调,见图3A~C。透射电镜观察各组细胞自噬小体,如图3D所示,Control组胞浆中可见较多自噬小体;PAN组胞浆内可见较多空泡,自噬体明显减少;RAP组胞浆内可见大量空泡和自噬体;与PAN组比较,RAP+PAN组胞浆局部自噬体数量增加。
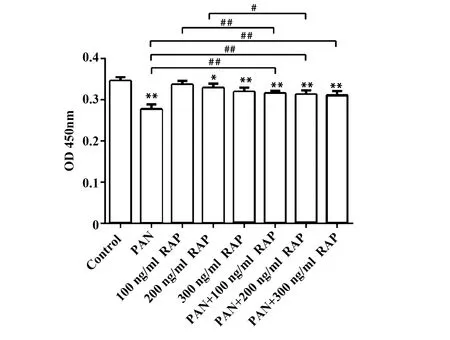
图1 各组细胞增殖情况Fig.1 Proliferation of cells in each groupNote: *.P<0.05,**.P<0.01 vs Control group;#.P<0.05,##.P<0.01.
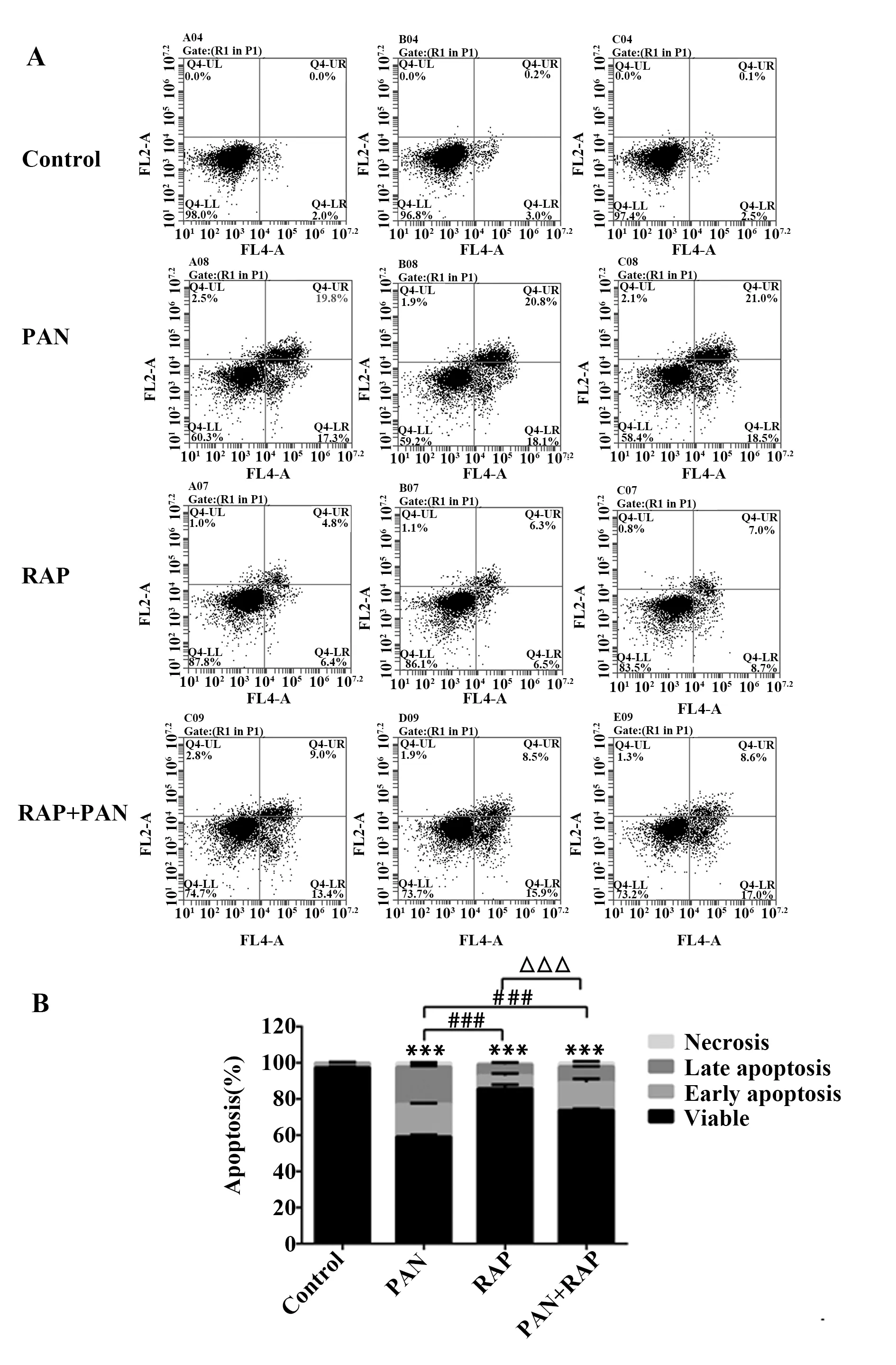
图2 流式细胞术检测细胞凋亡情况Fig.2 Flow cytometric dot plots of Annexin V and propidium iodide(PI) stainingNote: The concentration of puromycin amino nucleoside is 50 μg/ml.The concentration of rapamycin is 100 ng/ml.A.Flow cytometric dot plots of Annexin V and propidium iodide(PI)staining;B.Bar graph showed the percentage of cells apoptosis.***.P<0.001 vs control;###.P<0.001 vs PAN;△△△.P<0.001 vs PAN+RAP.

图3 Western blot检测各组小鼠足细胞自噬标记物LC3和p62的表达及透射电镜观察各组细胞自噬小体(×20 000)Fig.3 Expression of LC3 and p62 protein detected by Western blot and autophagosomes(arrows)detected by transmission electron microscopy in podocytes of individual groups(×20 000)Note: A.Representative band of LC3 and p62 protein in individual groups;B and C.Bar graph showed the relative expression of LC3II and p62 protein;D.Autophagosomes(arrows) detected by transmission electron microscopy in the podocytes of individual groups.
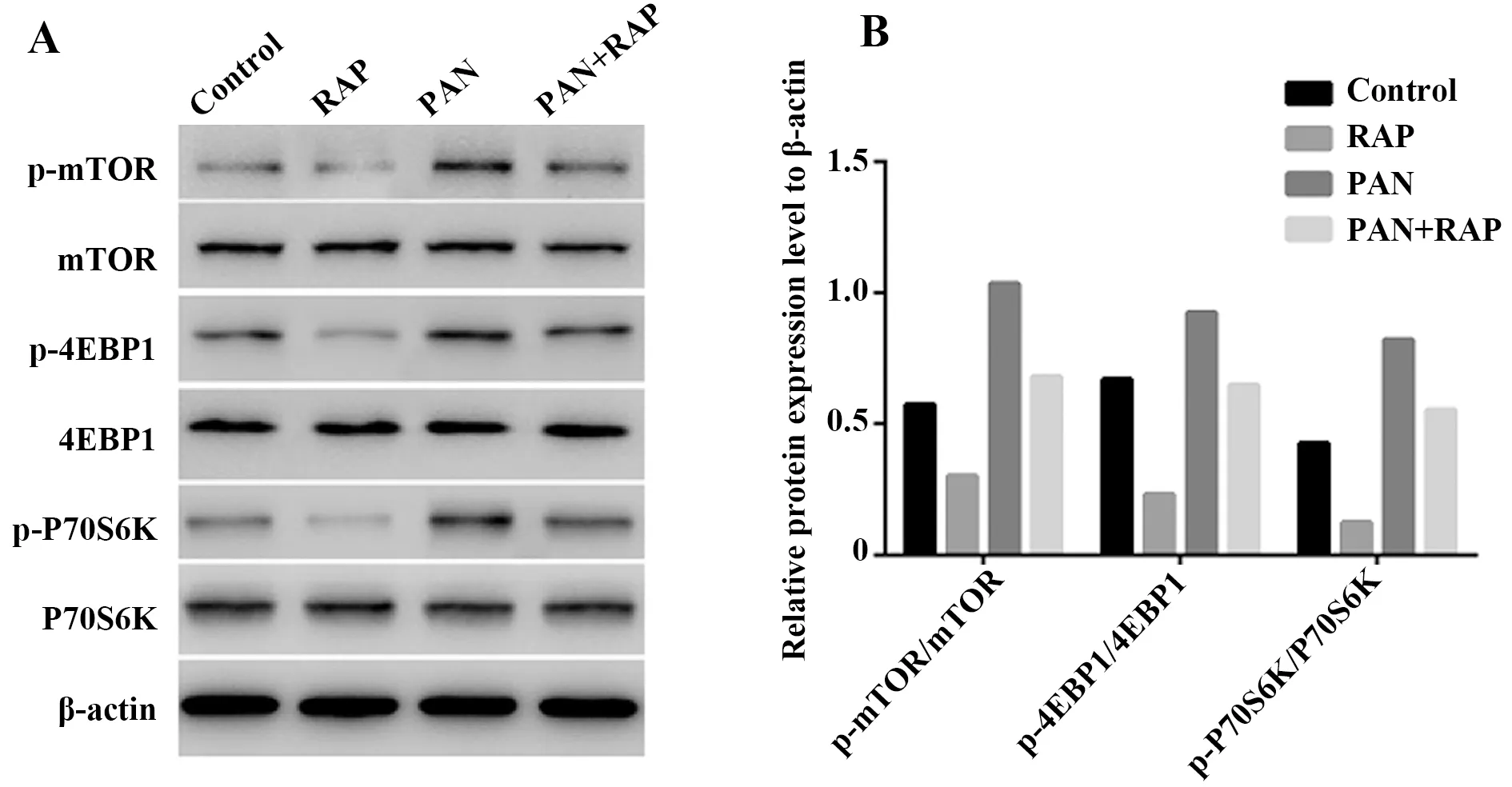
图4 Western blot检测各组细胞mTOR、p-mTOR、4EBP1、p-4EBP1、P70S6K、p-P70S6K蛋白表达Fig.4 Expression of mTOR,p-mTOR,4EBP1,p-4EBP1,P70S6K and p-P70S6K protein detected by Western blotNote: A.Representative band of mTOR,p-mTOR,4EBP1,p-4EBP1,P70S6K and p-P70S6K protein in individual groups;B.Bar graph showed the relative expression of p-mTOR/mTOR,p-4EBP1/4EBP1 and p-P70S6K/P70S6K.
2.4mTOR信号通路在雷帕霉素激活PAN诱导的足细胞自噬活性中的作用 Western blot检测各组细胞mTOR信号通路蛋白,结果如图4A、B所示,与 Control 组比较,PAN 组 mTOR、 4EBP1、 P70S6K 磷酸化水平上调,RAP 组 mTOR、4EBP1、 P70S6K 磷酸化水平下调。 与 PAN 组比较,PAN+RAP 组 mTOR、 4EBP1、 P70S6K磷酸化水平下调。可见,mTOR、 4EBP1、 P70S6K 磷酸化水平与足细胞自噬活性成负相关。
3 讨论
自噬(Autophagy)是一种高度保守的细胞内蛋白再循环机制,它能导致不同于凋亡的不依赖于caspase途径的程序性细胞死亡。自噬广泛存在于正常的生理过程中,维护着细胞的内环境稳定。自噬可使细胞应对各种细胞内外应激,然而过度的自噬或自噬不足,均可对机体造成损害。许多的肾小球疾病如膜性肾病[2]、糖尿病肾病[6]、局灶节段肾小球硬化症[7]等都表现为足细胞自噬活性的下调。我们的结果显示PAN处理足细胞24 h后,自噬标记物LC3Ⅱ明显下调,而p62蛋白出现堆积而上调,表明自噬受到抑制;流式细胞术结果显示细胞凋亡率显著下降,与文献报道的结果一致[8]。
雷帕霉素是一种新型的免疫抑制剂,是哺乳动物雷帕霉素靶蛋白(mammalian target of Rapamycin mTOR)信号通路特异性的负调控因子。mTOR属于磷酸肌醇3激酶超家族成员,是平衡细胞生长和自噬通路中的重要调节因子,起着应对胞内各种生理反应和外部环境压力的作用[9]。我们发现100 ng/ml 的雷帕霉素对正常足细胞不会出现抑制,但可以显著抑制PAN诱导的足细胞凋亡。雷帕霉素预处理后,PAN诱导的足细胞凋亡率由原来的38.5%下降为24.1%。进一步研究发现,与PAN处理相比,雷帕霉素可以显著提升足细胞LC3Ⅱ蛋白的表达,同时降低p62蛋白的水平,可见自噬水平得到激活。同样,透射电镜的结果显示雷帕霉素促进自噬小体的形成,自噬活性得到提升。激活自噬后,细胞将暂停合成功能并降解损伤细胞器及相关蛋白(包括损伤线粒体及 caspase 酶等),为细胞生存及修复提供能量和原料,减轻细胞损伤程度,从而延缓凋亡发生[10]。
另外,起始因子 4E 结合蛋白(eukaryotic initiat-ion factor 4E binding protein 1,4EBP1)和核糖体40S小亚基S6蛋白激酶(70-kD ribosomal protein S6 kinase,p70S6K)是mTOR通路下游的两种靶蛋白,正常生理条件下,mTOR处于活化状态,不仅可以磷酸化下游 Atg 蛋白直接抑制自噬激活,还可以磷酸化真核细胞4EBP1及 p70S6K进而抑制自噬[11,12]。当mTOR的活性被抑制,4EBP1及 p70S6K的磷酸化将受到抑制,4EBPl与eIF4E 亲和力升高,S6K磷酸化水平下降,翻译起始复合物形成被抑制,翻译效率下降和限制细胞增殖[13,14]。我们的研究表明,PAN可以促进mTOR、4EBP1及p70S6K的磷酸化,而雷帕霉素可以抑制mTOR、4EBP1及p70S6K活化,说明雷帕霉素可能通过靶向抑制mTOR信号通路的活化来促进自噬的激活,从而达到足细胞的保护作用。
总之,我们的研究显示,雷帕霉素可通过激活自噬改善PAN诱导的足细胞损伤,mTOR/4EBP1、P70S6K信号通路在自噬活化中可能起到重要作用,这对进一步了解雷帕霉素对足细胞保护作用具有重要意义。
[1] Lenoir O,Tharaux PL,Huber TB.Autophagy in kidney disease and aging:lessons from rodent models[J].Kidney Int,2016,90(5):950-964.
[2] Jin J,Zhan H,Lin B,etal.Association of podocyte autophagosome numbers with idiopathic membranous nephropathy and secondary membranous nephropathy[J].Int Urol Nephrol,2017,49(6):1025-1031.
[3] Bai M,Che R,Zhang Y,etal.Reactive oxygen species-initiated autophagy opposes aldosterone-induced podocyte injury[J].Am J Physiol Renal Physiol,2016,310(7):F669-F678.
[4] 张学凤,李荣山,乔玉峰.雷帕霉素对嘌呤霉素氨基核苷所致足细胞损伤的作用及其对p-P70S6K表达的影响[J].国际移植与血液净化杂志,2014,12(4):42-45.
Zhang XF,Li RS,Qiao YF.Effects of rapamycin on puromycin aminonucleoside induced podocyte injury[J].Int J Transplant Hemopurificati,2014,12(4):42-45.
[5] 王丽华,顾乐怡,梁馨月,等.雷帕霉素对PAN肾病小鼠肾脏病变和VEGF及受体表达的影响[J].上海交通大学学报(医学版),2010,30(4):375-380.
Wang LH,Gu LY,Liang XY,etal.Effects of rapamycin on nephropathy and expression of VEGF and VEGF receptors in PAN nephritic mice[J].J Shanghai Jiaotong Univ(Med Sci),2010,30(4):375-380.
[6] Liu N,Xu L,Shi Y,etal.Podocyte autophagy:a potential therapeutic target to prevent the progression of diabetic nephropathy[J].J Diabetes Res,2017,2017:3560238.
[7] Kawakami T,Gomez IG,Ren S,etal.Deficient autophagy results in mitochondrial dysfunction and FSGS[J].J Am Soc Nephrol,2015,26(5):1040-1052.
[8] Kang YL,Saleem MA,Chan KW,etal.The cytoprotective role of autophagy in puromycin aminonucleoside treated human podocytes[J].Biochem Biophys Res Commun,2014,443(2):628-634.
[9] Inoki K,Huber TB.Mammalian target of rapamycin signaling in the podocyte[J].Curr Opin Nephrol Hypertens,2012,21(3):251-257.
[10] Oral O,Akkoc Y,Bayraktar O,etal.Physiological and pathological significance of the molecular cross-talk between autophagy and apoptosis[J].Histol Histopathol,2016,31(5):479-498.
[11] Wang C,Cigliano A,Jiang L,etal.4EBP1/eIF4E and p70S6K/RPS6 axes play critical and distinct roles in hepatocarcinogenesis driven by AKT and N-Ras proto-oncogenes in mice[J].Hepatology,2015,61(1):200-213.
[12] Wataya-Kaneda M.Mammalian target of rapamycin and tuberous sclerosis complex[J].J Dermatol Sci,2015,79(2):93-100.
[13] Jossé L,Xie J,Proud CG,etal.mTORC1 signalling and eIF4E/4E-BP1 translation initiation factor stoichiometry influence recombinant protein productivity from GS-CHOK1 cells[J].Biochem J,2016,473(24):4651-4664.
[14] Maiese K.Driving neural regeneration through the mammalian target of rapamycin[J].Neural Regen Res,2014,9(15):1413-1417.