树脂改性玻璃离子Vitrebond的光固化时间对细胞毒性的影响
2018-01-18杜若茜周巧珍杨征宇麻健丰
杜若茜,周巧珍,杨征宇,麻健丰
(温州医科大学口腔医学院附属口腔医院 修复科,浙江 温州 325027)
树脂改性玻璃离子在口腔科广泛用于充填、粘结及窝沟封闭等。Vitrebond(美国3M公司)为其中一种,它既保持了传统型玻璃离子的优点,同时还具有树脂粘接强度高、表面特性及美学性能好等特点[1]。但是,很多与其他玻璃离子材料的比较研究显示Vitrebond有细胞毒性[2-4],甚至在ISO 7405:2008《牙科医学医疗器械在牙科医学应用中生物相容性的评估》中被选作阳性对照。固化时间过长或者过短,在树脂聚合时会导致单体转化的不完全,释放宽频谱的残留化合物[2]。根据以上综合因素,本研究选择树脂改性玻璃离子Vitrebond作为实验对象,研究不同光固化时间对其细胞毒性的影响,为临床应用提供实验基础和理论依据;同时比较琼脂扩散法和MTT法的敏感度,以供其他学者进行相关研究时参考。
1 材料和方法
1.1 材料 L929成纤维细胞(CCL 1,美国标准菌库),青霉素G(100 U/mL)、链霉素(100 μg/mL)、两性霉素B(0.25 μg/mL)、MEM盐溶液、左旋谷氨酰胺、碳酸氢钠、中性红试剂、MTT细胞增殖及细胞毒性检测试剂盒、二甲基亚砜(DMSO,美国Sigma公司),棉籽油(比利时Acros Organics公司),6%牛胎儿血清(美国Hyclone Laboratories公司),Vitrebond(美国3M公司)。
1.2 设备 光固化灯1 000 mw/cm2(美国3M公司),辐射表(美国Demetron/Kerr公司),自动化细胞计数器(美国Invitrogen公司),6孔细胞培养板(美国BD公司),96孔细胞培养板(美国Corning Costar公司),无菌滤片(d=6 mm,美国Millipore公司),倒置显微镜(日本Olympus公司),分光光度计(美国Bio-Rad公司)。
1.3 样本制备和分组方法 对照组样本制备和分组:将MEM和棉花籽油(CS Oil)分别作为极性和非极性萃取液,苯酚作为阳性对照,MEM、CS Oil作为阴性对照。实验组样本制备和分组:选用美国3M公司提供的产品Vitrebond,根据说明书以粉液比1.4∶1分别制成2 mm厚,直径为5 mm圆柱形样本。分为4个组,每组样本8个,共计32个样本,在1 000 mw/cm2(3 M/ESPE Elipar Freelight)的光固化强度下(具体时间见表1),将样本称重,加入0.2 g/mL MEM或CS Oil。样本与介质在含5% CO2细胞培养箱中37 ℃保存72 h。

表1 实验分组(n=8)
1.4 细胞培养方法 选用L929成纤维细胞进行体外细胞培养技术培养,6%完全培养基培养,当细胞密度达到1.0×105cell/mL时,用Hank’s平衡盐溶液(HBSS)清洗,0.05% 胰蛋白酶/0.5 mmol/L EDTA处理,在6孔细胞培养板各孔中加入细胞混悬液,在含5% CO2细胞培养箱中37 ℃培养24 h。
1.5 琼脂扩散实验方法 准备3%的琼脂,高压蒸汽消毒,冷却至50~60 ℃。等量10%完全培养基(37 ℃水浴)加入琼脂并混匀。细胞中的旧培养液被新鲜的琼脂、培养基混合物代替。混合物室温下凝固,加入中性红溶液并在暗室中保持15 min,然后去除多余的中性红溶液。制备样本将光照面置于琼脂中心;带有萃取液的滤纸也置于琼脂中心;带有苯酚的滤纸作为阳性对照,带有MEM、棉花籽油的滤纸作为阴性对照。将6孔细胞培养板置于含5%CO2,37 ℃细胞培养箱中。细胞毒性描述分别为无毒性(指数为0)、轻微毒性(指数为1)、中度毒性(指数为2-3)、严重毒性(指数为4-5)。24、48 h分别评估细胞脱色距离和细胞溶解指数。细胞脱色距离=(脱色区直径-样本直径)/2;细胞脱色指数分别为0(无脱色)、1(脱色仅限于样本下方)、2(脱色距样本<5 mm)、3(脱色距样本5~10 mm)、4(脱色距样本>10 mm)、5(完全脱色)。细胞溶解比例在显微镜下计数。细胞溶解指数分别为0(无细胞溶解)、1(<20%细胞溶解)、2(20%~40%细胞溶解)、3(40%~60%细胞溶解)、4(60%~80%细胞溶解)、5(>80%细胞溶解)。
1.6 MTT实验方法 第1天实验组样本分别在1 000 mw/cm2光照强度下光照15、30、45、0 s。1 h以后加入6%完全培养液(0.2 g/mL)作为萃取中介。样本和中介在含5% CO2,37 ℃细胞培养箱中放置72 h。第2天L929细胞用HBSS清洗,0.05%胰蛋白酶/0.5 mmol EDTA处理,调整其细胞密度为5.0×104cell/mL。细胞混悬液加入96孔细胞培养板,在含5% CO2细胞培养箱中37 ℃培养48 h。第4天样本萃取液根据ISO7505生物材料的细胞毒性体外实验检测法稀释至E1=1∶1,E2=1∶2,E3=1∶4,E4=1∶8,E5=1∶16,E6=1∶32。96孔细胞培养板中的旧培养液被样本的萃取稀释液代替,包括空白对照、阳性对照和阴性对照,每个样本6个孔。第5天吸出培养液,停止细胞生长,立即用MTT实验测试细胞活性。每孔中加入100 μL MTT液体,4 h保温,去除上清液,加入100 μL DMSO。分光光度计570 nm波长下测定光学密度。
1.7 统计学处理方法 采用SPSS11.5统计软件进行统计分析。实验1、2、3组间细胞毒性差异分别应用ANOVA及Student-Newman-Keuls(SNK)方法。P<0.05为差异有统计学意义。
2 结果
2.1 琼脂扩散实验检测Vitrebond细胞毒性 琼脂扩散实验琼脂中培养24和48 h后,阴性对照组及光固化的实验组未发现细胞毒性(见表2-3),细胞生长良好,未见细胞脱色及溶解。阳性对照组及未光固化组均有很强的细胞毒性,镜下细胞数量明显减少,出现较严重的细胞溶解(见图1)。
2.2 MTT实验Vitrebond检测细胞毒性 MTT实验中将萃取液稀释到1∶32后,无论光照时间多少,3个实验组均可发现细胞毒性,抑制率组间差异无统计学意义(F=1.452,P>0.05),见表4。MTT实验中从镜下可以观察,阴性对照组细胞生长情况良好,MTT结晶分布均匀,见图2a。苯酚阳性对照组及1∶1和1∶2稀释后呈严重的细胞毒性反应,细胞外形消失、崩解,见图2b-d。将其萃取液稀释到1∶32,Vitrebond显示出很强的细胞毒性,仅见少量细胞生长,见图2e。

表2 24 h后琼脂扩散实验Vitrebond细胞毒性
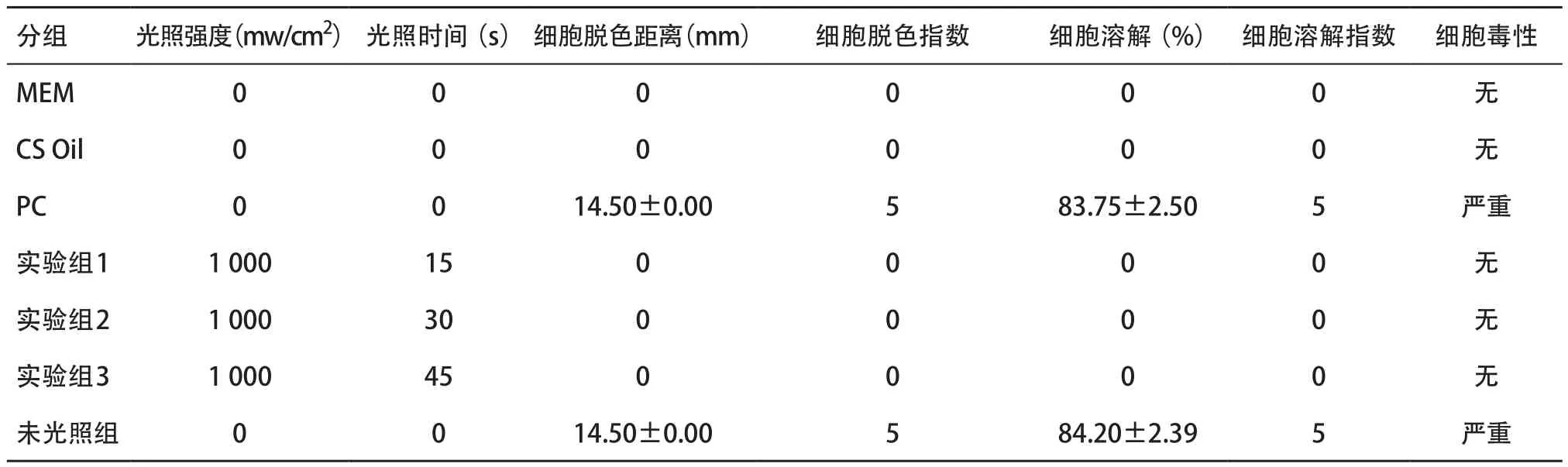
表3 48 h后琼脂扩散实验Vitrebond细胞毒性

图1 琼脂扩散实验中L929细胞电镜下形态(中性红染色,×20)
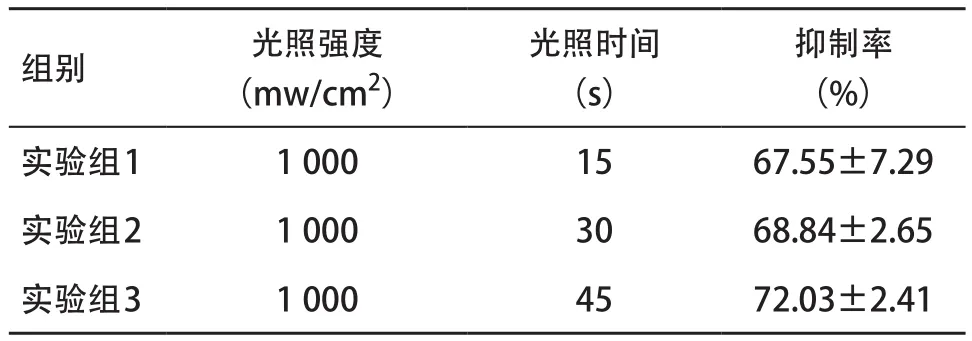
表4 MTT 1∶32稀释不同光照时间下的抑制率( ±s)
3 讨论
树脂改性玻璃离子和传统玻璃离子相比,具有抗压强度高,溶解度小,微渗漏率小,与牙体组织粘结性好等优点[5]。但是树脂改性玻璃离子的液体成分如甲基丙烯酸羟乙酯(2-hydroxyethyl meth-acrylate,HEMA)被认为具有细胞毒性。树脂改性玻璃离子在临床操作中作为粘结剂时,为获得更好的稠度往往选择低粉液比,导致HEMA浓度的升高。剩余甲基丙烯酸酯单体破坏细胞膜的脂双层,从而导致细胞的溶解,产生细胞毒性[6]。ISO 7405:2008(牙科医学-医疗器械在牙科医学应用中生物相容性的评估)明确将树脂改性玻璃离子Vitrebond做为体外实验的阳性对照,但是,我们在实际进行评估操作时发现,光固化时间对Vitrebond的毒性有所影响,并非不表示该材料完全有毒性。PALMER等[7]报道Vitrebond在光刺激下会引起高浓度的HEMA单体聚合,由此减小细胞毒性。STANISLAWSKI等[8]也发现树脂改性玻璃离子释放的单体浓度不足以引起细胞毒性,高浓度Zn2+是唯一可以引起细胞毒性的成分。对于成牙本质细胞(MDPC-23),有研究显示长固化时间(40 s)比短固化时间(20 s)对细胞活性影响小[9],或固化时间对细胞活性的影响没有显著区别[10]。对于L929成纤维细胞,短固化时间(20 s)引起大多数光固化树脂粘结剂材料的细胞毒性比长固化时间(40 s)要高[11]。而本实验研究中发现,在琼脂中培养24和48 h后,阳性对照组及未光固化组均有很强的细胞毒性,而阴性对照组及进行光固化的实验组未发现细胞毒性,未经过光照处理的Vitrebond,可发现细胞代谢明显减少,即细胞毒性的增加。MTT实验中却可以发现,无论光固化时间多少,实验组间均可存在细胞毒性,且抑制率组间无统计学差异。由此可以推测,光固化时间的改变对细胞毒性的影响不大,但经过光固化的Vitrebond比未经光照的毒性有所减少,意味着残留HEMA浓度随着光固化时间降低。即树脂改良玻璃离子的光引发体系中,光线通过修复体已经固化表层所能到达的树脂内部的深度有限,特别是修复体较厚时,极易导致复合树脂的聚合不充分[8,12]。本实验中采取厂商推荐的2 mm深度均发现了细胞毒性,在临床应用中通过减小每次光照的铺层厚度,同时延长光照时间是否可以减小细胞毒性,该设想将在后续实验中进行验证。
也有体外研究表明,树脂改性玻璃离子相比在光固化条件且潮湿的环境中,不进行光照固化会释放更多的残留HEMA[13]。这些研究都指出树脂改性玻璃离子在固化反应过程中,在有水介质存在的情况下,若直接接触牙髓细胞会释放引起细胞毒性的物质。本实验研究中Vitrebond在培养细胞上直接应用,使其没有进一步的防御机制来中和毒性物质对细胞的损伤。由此可以推测在这种类型的实验中获得的结果强化了在临床情况下获得的预期结果。而临床上,口腔材料有时候并不直接与细胞接触,Vitrebond在体内的细胞毒性是否和光固化时间有关需要更多研究来验证。

图2 24 h培养后L929细胞显微镜下观察(MTT染色,×40)
用来评估材料生物相容性的方法有很多。本研究采用琼脂扩散实验及MTT法来检测Vitrebond对L929细胞的毒性作用。MTT法是一种检测细胞存活和生长的方法,其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而死细胞无此功能。DMSO能溶解细胞中的甲瓒,用分光光度计在570 nm波长处测定其光吸收值,可间接反映活细胞数量[14]。琼脂扩散试验为可溶性抗原与相应抗体在含有电解质的半固体凝胶(琼脂或琼脂糖)中进行的一种沉淀试验[15]。通过两者对比,发现MTT实验能更敏感地检测出细胞毒性。琼脂扩散实验的结果与MTT实验结果不符,如果只选用琼脂扩散实验就无法发现材料的细胞毒性,可能跟MTT实验原理有关。因此,大致直观地评估口腔材料的细胞毒性可以直接采用快速简便的琼脂扩散实验,但若需要更敏感且数据精确的结果,则需采用MTT实验。
[1] MUSA A, PEARSON G L, GELBIER M. In vitro investigation of fluorideion release from four resin-modified glass polyalkenoate cements[J]. Biomaterials, 1996, 17(10)∶1019-1023.
[2] LOVELL L G, NEWMAN S M, DONALDSON M M, et al.The effect of light intensity on double bond conversion and flexural strength of a model, unfilled dental resin[J]. Dent Mater, 2003, 19(6): 458-465.
[3] SPAHL W, BUDZIKIEWICZ H, GEURTSEN W. Determination of leachable components from four commercial dental composites by gas and liquid chromatography mass spectrometry[J]. J Dent, 1998, 26(2): 137-145.
[4] ASMUSSEN E. Restorative resins: hardness and strength vs. quantity of remaining double bonds[J]. Scand J Dent Res, 1982, 90(6): 484-489.
[5] MITRA S B, LEE C Y, BUI H T, et al. Long-term adhesion and mechanism of bonding of a paste-liquid resin-modified glass-ionomer[J]. Dent Mater, 2009, 25(4): 459-466.
[6] 郭晓伟, 严敏, 宫海环, 等. 复合树脂细胞毒性检测方法的进展[J]. 口腔医学, 2016, 9(36): 845-848
[7] PALMER G, ANSTICE H M, PEARSON G J. The effect of curing regime on the release of hydroxyethyl methacrylate(HEMA) from resin-modified glass-ionomer cements[J]. J Dent, 1999, 27(4): 303-311.
[8] STANISLAWSKI L, DANIAU X, LAUTI A, et al. Factors responsible for pulp cell cytotoxicity induced by resin-modified glass ionomer cements[J]. J Biomed Mater Res, 1999,48(3): 277-288.
[9] DE SOUZA COSTA C A, HEBLING J, HANKS C T. Effects of light-curing time on the cytotoxicity of a restorative resin composite applied to an immortalized odontoblast-cell line[J]. Oper Dent, 2003, 28(4): 365-370.
[10] ARANHA A M,GIRO E M,SOUZA P P,et al. Effect of curing regime on the cytotoxicity of resin-modified glass-ionomer lining cements applied to an odontoblast-cell line[J].Dent Mater, 2006, 22(9): 864-869.
[11] ERGUN G, EGILMEZ F, YILMAZ S. Effect of reduced exposure times on the cytotoxicity of resin luting cements cured by high-power led[J]. J Appl Oral Sci, 2011, 19(3):286-292.
[12] TRUMPAITE-VANAGIENE R, BUKELSKIENE V, ALEKSEJUNIENE J, et al.Cytotoxicity of commonly used luting cements—An in vitro study[J]. Dent Mater J, 2015, 34(3):294-301.
[13] SALEHI S, GWINNER F, MITCHELL J C, et al. Cytotoxicity of resin composites containing bioactive glass fillers[J].Dent Mater, 2015, 31(2): 195-203.
[14] MOSMANN T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays[J]. J Immunol Methods, 1983, 65(1-2): 55-63.
[15] YY/T 0127.9-2001口腔材料生物学评价, 第2单元: 口腔材料生物试验方法, 细胞毒性试验: 琼脂覆盖法及分子滤过法[S].
