肺原发性单相纤维型滑膜肉瘤1例及文献复习
2018-01-18刘慧唐小万陈莉莉
刘慧,唐小万,陈莉莉
(台州市第一人民医院 血液肿瘤内科,浙江 台州 318020)
滑膜肉瘤是一种较为少见的软组织恶性肿瘤,好发于青少年,大多发生在四肢关节周围软组织。虽被命名为滑膜肉瘤,但肿瘤细胞并非起源于滑膜,而是起源于间叶组织,故也可发生在无滑膜组织的部位,如肝、肾、肺等。肺原发性滑膜肉瘤非常罕见,本院收治1例肺原发性单相纤维型滑膜肉瘤,现对其诊治经过及临床特点进行总结,报告如下。
1 临床资料
患者,男,71岁,因“右侧胸痛伴咯血3个月,咳嗽、咳痰1周”于2017年1月11日入住我科。患者3个月前出现右侧胸痛,伴咯血,体质量明显下降,至本市某医院就诊,查胸部CT示:右上肺团块,周围型肺癌首先考虑;PET/CT示:右肺上叶见一团块状密度增高影,呈分叶状,大小4.0 cm×4.5 cm,CT值约19 Hu,18F-FDG摄取明显增高,最大SUV约14.3,考虑周围型肺癌或转移瘤;两肺内见多发斑片、条索状密度增高影,18F-FDG摄取增高,最大SUV约8.9;右侧肺门、纵隔4区多发淋巴结,糖代谢增高,考虑转移(见图1);其他部位未见明显18F-FDG摄取增高。诊断:周围型肺癌。后患者至上海某医院就诊,诊断“周围型肺癌”,评估无手术指征。近1周因反复咳嗽、咳痰,来我院就诊。既往史:5年前因“结肠癌”行手术治疗,术后未放化疗。个人史:有长期吸烟史。家族史无殊。查体:生命体征平稳,神清,精神软,消瘦貌,左肺呼吸音粗,右上肺呼吸音低。入院后查血沉105 mm/h,明显升高;肿瘤标志物:CEA 6.86 ng/mL,CYFRA21-1 3.69 ng/mL,稍增高。CT平扫:头颅未见明显异常;右肺上叶巨大占位,右肺占位较之前明显增大。为明确占位性质,建议患者行穿刺活检,患者拒绝。
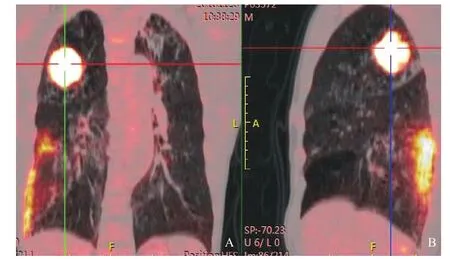
图1 PET/CT提示右肺上叶占位,18F-FDG摄取明显增高,最大SUV约14.3
2017年4月20日,患者因“右侧胸痛加重”再次入院,经劝说后同意行穿刺活检术。术前胸部增强CT示:右肺上叶见巨大类圆形高密度影,边界清,大小9.2 cm×8.2 cm,内见液性密度影,增强扫描见实质明显强化(见图2)。2017年4月26日在CT引导下行右肺占位穿刺活检术。术后病理:HE染色后镜下见梭形瘤细胞,弥漫分布,呈旋涡状或束状排列,局部伴坏死,核深染,核分裂象多见(见图3)。免疫组织化学染色:AE1/AE3(+),CD56(+),CD99(+),Vimentin(+),Fli-1(+),Ki-67(80%+),Cg-A(-),LCA(-),S-100(-),Syn(-),NapsinA(-),TTF-1(-),见图4。形态学结合免疫组织化学染色结果,符合滑膜肉瘤(单向纤维型)。
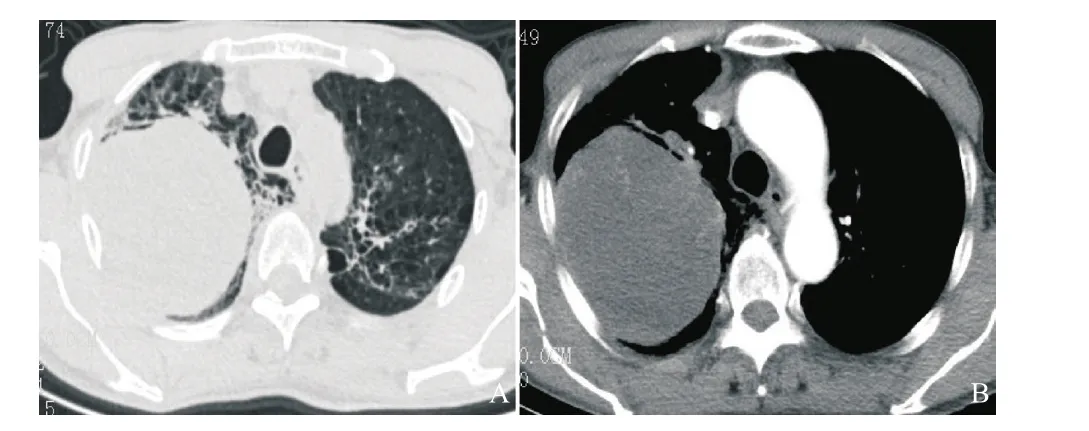
图2 穿刺活检术前胸部增强CT示右上肺巨大占位,边界清,不均匀强化
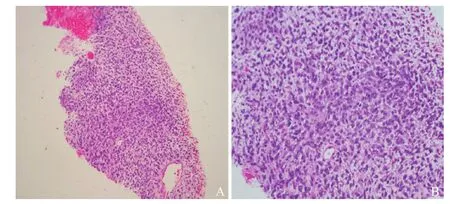
图3 术后病理标本HE染色
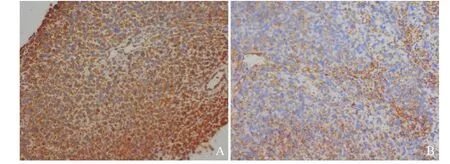
图4 免疫组织化学染色结果(×200)
综合以上资料,诊断右肺原发性滑膜肉瘤(单向纤维型),伴纵隔淋巴结转移。建议行SS18-SSX1/SSX2/SSX4融合基因检查,患者及家属因经济原因拒绝。建议行化疗联合抗血管靶向治疗,患者及家属拒绝。出院后4个月,患者病逝。
2 讨论
滑膜肉瘤是一种少见的间叶组织来源的恶性肿瘤,占软组织肉瘤的5%~10%,最早由Simon在1865年描述,好发年龄20~40岁,男性略多于女性[1],主要发生在四肢大关节周围软组织,尤其是下肢,也可发生在很多无滑膜的部位,如肺、纵隔、肾等。肺原发性滑膜肉瘤很罕见,国内外报道均不多,约占所有原发肺恶性肿瘤的0.5%[2]。有研究[3]报道此病与吸烟关系密切。本例患者有长期吸烟史,可能与肿瘤发生有关。肺原发性滑膜肉瘤常见症状有咳嗽、咳痰、胸痛、咯血等,极少数患者无任何症状,体检时发现[4]。本例患者以胸痛起病,伴咯血,随着病情进展,出现咳嗽、咳痰,与文献报道相符。
本病影像学表现缺乏特异性,CT定性诊断困难,多表现为一侧胸腔圆形或类圆形占位病变,平扫呈高密度,边界一般清,分叶不明显,无毛刺,可有包膜或假包膜[5]。病灶直径多在2~15 cm之间,中间可出现斑片状低密度坏死、出血、钙化等,肿块较大时可伴阻塞性肺炎,侵犯胸膜可引起胸腔积液,肺门及纵隔淋巴结一般无肿大,增强后不均匀强化[6]。本例患者在我院行胸部CT平扫见右上肺巨大高密度占位,最大直径>10 cm,与之前对比明显增大,提示肿瘤进展迅速;增强CT示肿块边界变清,考虑之前合并有阻塞性肺炎,经治疗后边界变清,肿块内有坏死区,增强不均匀强化,与文献报道相符。PET/CT可帮助与肺转移性滑膜肉瘤鉴别。本例患者曾行PET/CT检查,右肺上叶见一团块状病变,18F-FDG摄取明显增高,最大SUV约14.3,其他部位未见糖代谢明显增高区,故可排除转移性肺滑膜肉瘤。
病理形态及免疫组织化学染色对本病的诊断至关重要。根据WHO肺滑膜肉瘤的组织学分型,分为双相型、单相纤维型、单相上皮细胞型和低分化型4型,以单相纤维型最常见[7]。双相型既有梭形细胞成分,又有上皮样细胞成分;单相纤维型镜下特点为由梭形细胞排列成束状或典型的漩涡状排列的梭形成纤维细胞组成;单相上皮型主要由上皮样细胞组成,可形成腺样结构,很难与肺癌区分,此型罕见;低分化型包括3个亚型,分别是由分化差的小圆形细胞、大圆形细胞和高度恶性的胖梭形细胞组成,3种亚型的瘤细胞均具有明显的异型性,核分裂象易见,易误诊为其他各种类型的软组织肉瘤[8]。免疫组织化学染色方面,CK、EMA、Bcl-2、CD99和Vimentin一般阳性,而S-100、CD-34、Desmin、actin、calretinin、NapsinA、TTF-1一般阴性[9]。本例患者CK(AE1/AE3)、CD99和Vimentin阳性,而S-100、NapsinA、TTF-1等阴性,与文献报道相符。本病需要与纤维肉瘤、平滑肌肉瘤、恶性外周神经鞘瘤等相鉴别。对于大多数病例,病理形态结合免疫组织化学染色能明确诊断,少部分患者诊断仍困难。最近研究[10-11]发现,大多数滑膜肉瘤患者肿瘤细胞含特异性的染色体易位t(X;18),18号染色体上的SS18(以往称作SYT)基因与X染色体上的SSX基因(SSX1,SSX2,SSX4)形成融合基因。SS18-SSX1最常见,其次是SS18-SSX2,而SS18-SSX4较少见,SS18-SSX1融合基因与肿瘤的高侵袭性关系密切。通过FISH、RT-PCR可检测以上融合基因,有助于诊断。
肺原发性滑膜肉瘤目前没有最佳的治疗措施,早期局限期的患者,外科手术R0切除是标准的治疗方法,术后予辅助化疗,可明显降低复发率,化疗方案以阿霉素联合异环磷酰胺最常用,对于肿瘤切缘<1 cm,镜下切缘阳性,或肿瘤侵犯骨、大血管或神经等组织的患者,可予术后放疗[12]。对于肿瘤较大,术前新辅助放化疗可降低肿瘤负荷,增加可切除性,降低复发风险。对晚期患者,靶向治疗有一定疗效,如帕唑帕尼,它是一种多靶点TKI,能抑制VEGFR-1等多种受体的酪氨酸激酶活性,改善患者无进展生存期(progression-free survival,PFS)[13]。滑膜肉瘤侵袭性强,容易远处转移,目前5年生存率小于50%,不良预后因素包括肿瘤大小、年龄、男性、肿瘤坏死比例、组织学分级高、有丝分裂率高(>10/HPF)、SS18-SSX1融合基因阳性等。
总之,肺原发性滑膜肉瘤罕见,临床表现缺乏特异性,易误诊为肺癌,确诊依赖病理组织学、免疫组织化学、细胞遗传学检查。本病预后不佳,治疗效果差,未来靶向治疗可能改善预后。
[1] MANKIN H J, HORNICEK F J. Diagnosis, classification,and management of soft tissue sarcomas[J]. Cancer Control,2005, 12: 5-21.
[2] DENNISON S, WEPPLER E, GIACOPPE G. Primary pulmonary synovial sarcoma: a case report and review of current diagnostic and therapeutic standards[J]. 0ncologist,2004, 9(3): 339-342.
[3] NAPPI O, WICK M R. Sarcomatoid neoplasms of the respiratory tract[J]. Semin Diagn Pathol, 1993, 10: 137-147.
[4] ZEREN H, MORAN C A, SUSTER S, et al. Primary pulmonary sarcomas with features of monophasic synovial sarcoma: A clinicopathological, immunohistochemical, and ultrastructure study of 25 cases[J]. Hum Pathol,1995, 26: 474-480.
[5] FRAZIER A A, FRANKS T J, PUGATCH R D, et al. From the archives of the AFIP: Pleuropulmonary synovial sarcoma[J]. Radiographics, 2006, 26(3): 923-940.
[6] POLVEMSI R, MUZZIO P C, PANUNZIO A, et a1. Synovial sarcoma: CT imaging of a rare primary malignant tumour of the thorax[J]. Radiol Med, 2011, 116(6): 868-875.
[7] KOTTU R, PRAYAGA A K. Synovial sarcoma with relevant immunocytochemistry and special emphasis on the monophasic fibrous variant[J]. J Cytol, 2010, 27(2): 47-50.
[8] 王坚, 朱雄增. 软组织肿瘤病理学[M]. 北京: 人民卫生出版社, 2008: 515-525.
[9] KEEL S B, BACHA E, MARK E J, et al. Primary synovial sarcoma: A clinicopathologic study of 26 cases[J]. Mod Pathol, 1999, 12(12): 1124-1131.
[10] DIMITRIADIS E, RONTOGIANNI D, KYRIAZOGLOU A,et al. Novel SYT-SSXfusion transcript variants in synovial sarcoma[J]. Cancer Gen Cytogen, 2009, 195(1): 54-58.
[11] BARCO R, HUNT L B, FRUMP A L, et al. The synovial sarcoma SYT-SSX2 oncogene remodels the cytoskeleton through activation of the ephrin pathway[J]. Mol Biol Cell,2007, 18(10): 4003-4012.
[12] FALKENSTERN-GE R F, KIMMICH M, GRABNER A,et al. Primary pulmonary synovial sarcoma: a rare primary pulmonary tumor[J]. Lung, 2014, 192(1): 211-214.
[13] KASPER B, SLEIJFER S, LITIERE S, et al. Long-term responders and survivors on pazopanib for advanced soft-tissue sarcomas: subanalysis of two European Organisation for Research and Treatment of Cancer (EORTC) clinical trials 62043 and 62072[J]. Ann Oncol, 2014, 25(3): 719-724.
