白酒中8种生物胺的高效液相色谱分析法
2017-11-21王春利赵晓娟王英姿
王春利,赵晓娟,王英姿
(1.江门出入境检验检疫局,广东江门 529000; 2.仲恺农业工程学院,广东广州510225)
白酒中8种生物胺的高效液相色谱分析法
王春利1,赵晓娟2,王英姿1
(1.江门出入境检验检疫局,广东江门 529000; 2.仲恺农业工程学院,广东广州510225)
建立了白酒中8种生物胺残留的高效液相色谱分析方法,样品采用正丁醇-三氯甲烷萃取,丹磺酰氯衍生。实验结果表明,该方法在1~50 mg/L范围内线性关系良好,R2≥0.996;在1~10 mg/L添加水平范围内,平均加标回收率在82.22%~94.11%之间,相对标准偏差RSD<10%;LOD在0.01~0.10 mg/L之间,LOQ在0.03~0.30 mg/L之间,该方法可用于白酒中生物胺的检测。
白酒; 生物胺; 高效液相色谱法; 含量调查
生物胺(biogenic amine,BA)是一类低分子质量的碱性多胺,具有生物活性,普遍存在于生物体的细胞中,是细胞内的正常活性成分。微量的生物胺对人体有益,可以促进人体的生长发育和新陈代谢,提高肠道系统的免疫能力[1]。但是,当人体吸收过量的生物胺后,会出现头痛、血压变化、心悸等严重后果[2]。此外,生物胺还是生成致癌物质亚硝胺的前体物质,如腐胺和尸胺,不仅能增强组胺的毒性,而且还能与亚硝酸盐反应生成亚硝基胺[3-4],严重威胁人体健康和生命安全。
生物胺是由游离氨基酸在微生物产生的脱羧酶作用下而生成,也可以是醛被胺化作用后产生,食品在发酵或腐烂过程中会产生生物胺[5]。生物胺广泛存在于发酵乳制品[6]、酒类[7-8]、水产品[9]、肉类产品[10]、调味液[11-12]等富含蛋白质和氨基酸的食品中。用于食品中生物胺测定的方法主要有电化学法[13]、色谱法[14-17]、酶联免疫法[18]等。目前,酒中生物胺的研究多集中于葡萄酒、啤酒、桑果酒及黄酒,而白酒中生物胺检测方法、生物胺种类和含量的研究报道比较少见。本研究建立的方法简便、快捷、准确,可以用于白酒中8种生物胺的同时测定。
1 材料与方法
1.1 材料、试剂及仪器
标准溶液配制:准确称取适量色胺、β-苯乙胺、腐胺、尸胺、组胺、酪胺、精胺和亚精胺标准品于10 mL容量瓶中,用0.1 mol/L盐酸溶液稀释至刻度,混匀,配制成浓度为1000 mg/L的标准储备液,0~4℃保存。根据需要将标准储备液稀释成相应浓度的标准溶液。
试剂及耗材:正己烷、甲醇和丙酮(均为色谱纯),德国Merk公司;乙醚、正丁醇、三氯甲烷、谷氨酸钠、碳酸氢钠、氢氧化钠、盐酸(均为分析纯),广州试剂厂;色胺、β-苯乙胺、腐胺、尸胺、精胺和亚精胺,美国Sigma公司;酪胺,德国Dr公司;丹磺酰氯(纯度均大于98%)、组胺(纯度>96%),FLUKA公司。
仪器设备:HPLC Waters e2695配Waters e2489紫外检测器,美国Waters公司;3K15冷冻离心机,德国Sigma公司;VORTEX-2旋涡混合器,美国GENE公司;HH-2数显恒温水浴锅,中国晶波;Turbovap lv浓缩氮吹仪,美国caliper公司;TP-214型分析天平,美国DENVER;Orion 868酸度计,美国Orion公司;Milli-Q超纯水器,美国Millipore公司;0.22 μm滤膜针头滤器,上海安谱。Thermo移液枪(200~1000 μL),美国Thermo Fisher公司。
1.2 液相色谱条件
色谱柱:Venusil XBP C18柱(250 mm ×4.6 mm,内径3 μm);检测器波长254 nm,进样量20 μL,柱温30℃,流动相A为甲醇,B为超纯水,流速1.5 mL/min。梯度洗脱程序见表1。
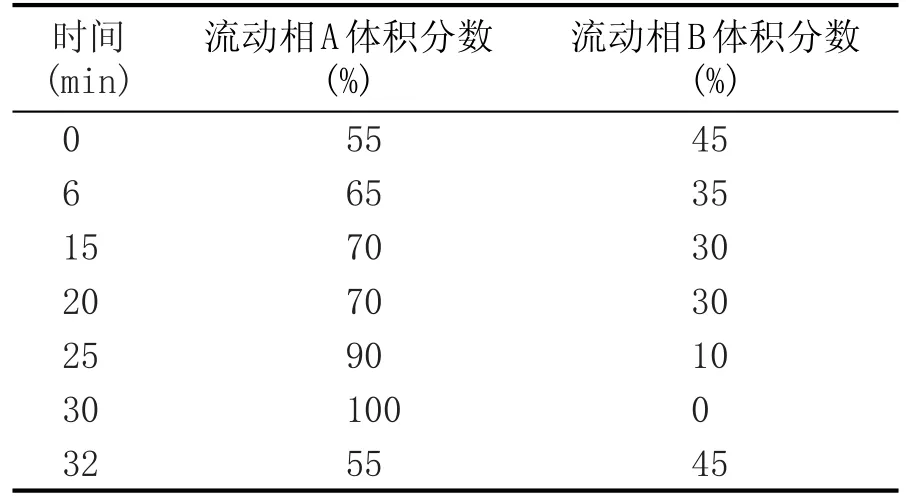
表1 梯度洗脱程序
1.3 样品的萃取和衍生
量取20.00 mL水样,滤纸过滤,滤液加氯化钠至饱和(若水样中含有油脂则加入10 mL正己烷,混匀,弃去上层有机相)。量取5 mL滤液于15 mL离心管中,用0.1 mol/L的氢氧化钠调节pH值到12.0,加入5.0 mL正丁醇和三氯甲烷(1∶1,V/V)混合溶液,漩涡振荡2 min后以5000 r/min离心5 min,保留上层有机相,重复上述萃取2次,合并萃取液。量取3.0 mL萃取液并加入浓度1 mol/L盐酸0.2 mL,60℃氮吹近干,用0.1 mol/L的盐酸定容至1 mL,待衍生。
精确量取1.0 mL待衍生的试样溶液后,加入1.5 mL饱和碳酸氢钠溶液和1.0 mL丹磺酰氯衍生溶液(10 mg/L丙酮溶液),充分混匀。在60℃水浴条件下反应30 min,再加入谷氨酸钠溶液100 μL,充分混匀,60℃保温15 min。取出,加入超纯水l mL,40℃氮吹除去丙酮,之后加入乙醚3 mL,漩涡振荡1 min,静置分层后,吸取乙醚层,重复操作2次,合并乙醚提取液,40℃条件下氮气吹至近干,加入1.0 mL乙腈,溶液用0.22 μm滤膜过滤,滤液待测。
2 结果与讨论
2.1 线性关系和检出限
按照1.1中的方法配制8种生物胺的混合标准溶液进行线性实验,标准质量浓度为1.0 mg/L、2.50mg/L、5.0mg/L、10.0mg/L、15.0mg/L、25.0mg/L、50.0 mg/L。按照1.3中的方法进行衍生,通过HPLC进行测定。以3倍信噪比作为检出限的确定标准,以10倍信噪比作为定量限的确定标准。生物胺分离的液相色谱图见图1,回归方程、相关系数及检出限见表2。
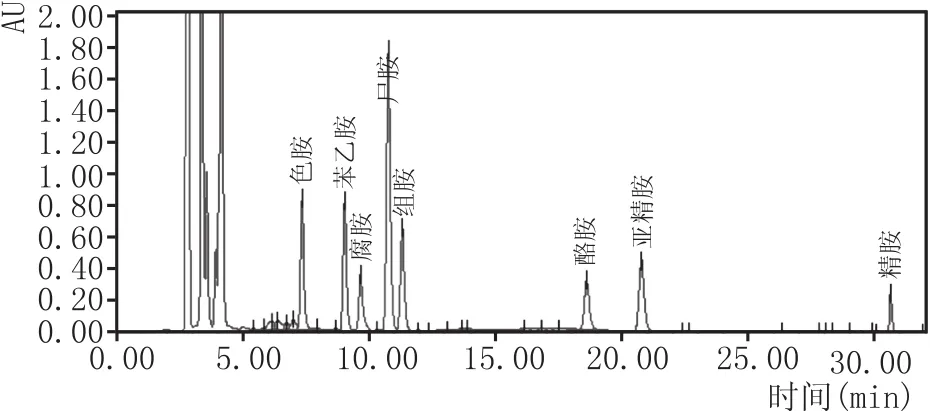
图1 5种生物胺混合标准溶液的液相色谱图 (5.0 mg/L)
由图1可知,8种生物胺色谱峰无重叠,分离较好。由表2可知,8种生物胺在1.0~50.0 mg/L范围内呈现良好的线性关系,相关系数均大于0.996。各组分生物胺的检出限(LOD)为0.01~0.10 mg/L,定量检出限(LOQ)为0.03~0.30 mg/L,满足生物胺检测的要求。
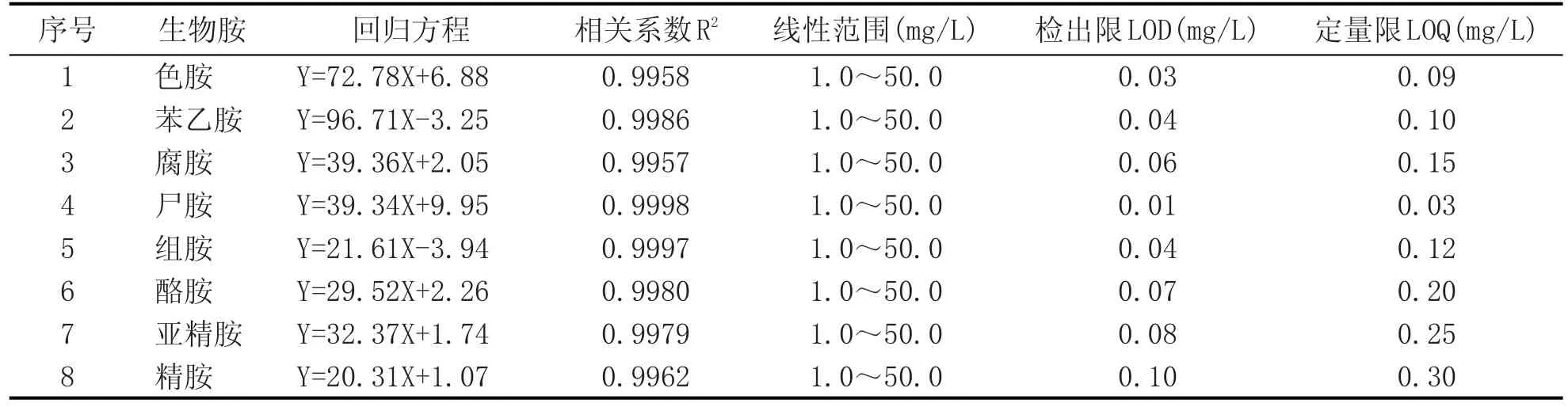
表2 8种生物胺标准的回归方程、相关系数、线性范围、检出限和定量限
2.2 重复性的测定
对8种生物胺混标进行重复测定(n=5),结果见表3。结果显示相对标准偏差RSD≤5.02%,表明重复性较好。
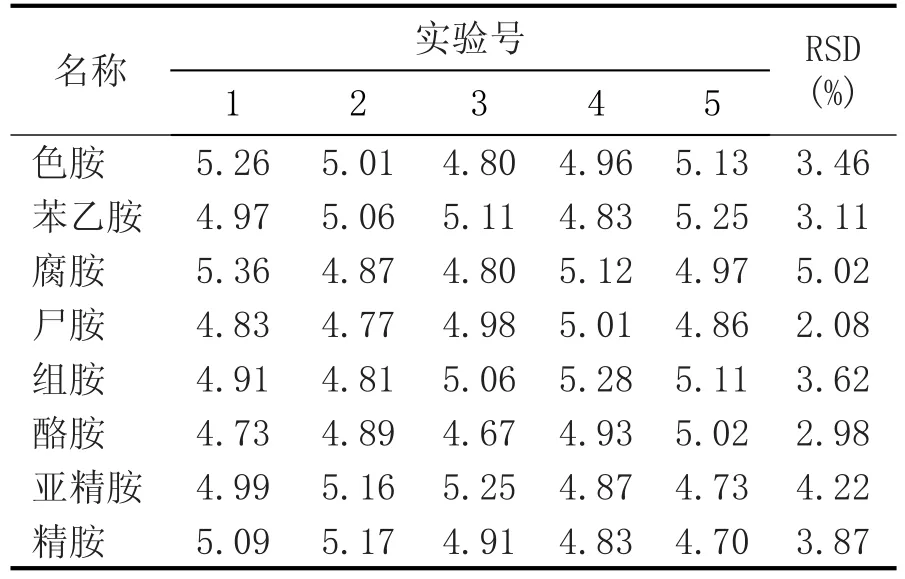
表3 生物胺的重复性实验 (mg/L)
2.3 加标回收率的测定
选取空白样品做1.0 mg/L、5.0 mg/L、10.0 mg/L 3个浓度的加标回收率实验,应用上述方法进行前处理并测定,各加标水平样品平行测定3次,结果见表4。
由表4可知,5种生物胺在1.0~10.0 mg/L添加水平范围内,平均回收率在82.22%~94.11%之间,相对标准偏差RSD在2.36%~7.96%之间,均符合检测要求。
2.4 白酒样品分析
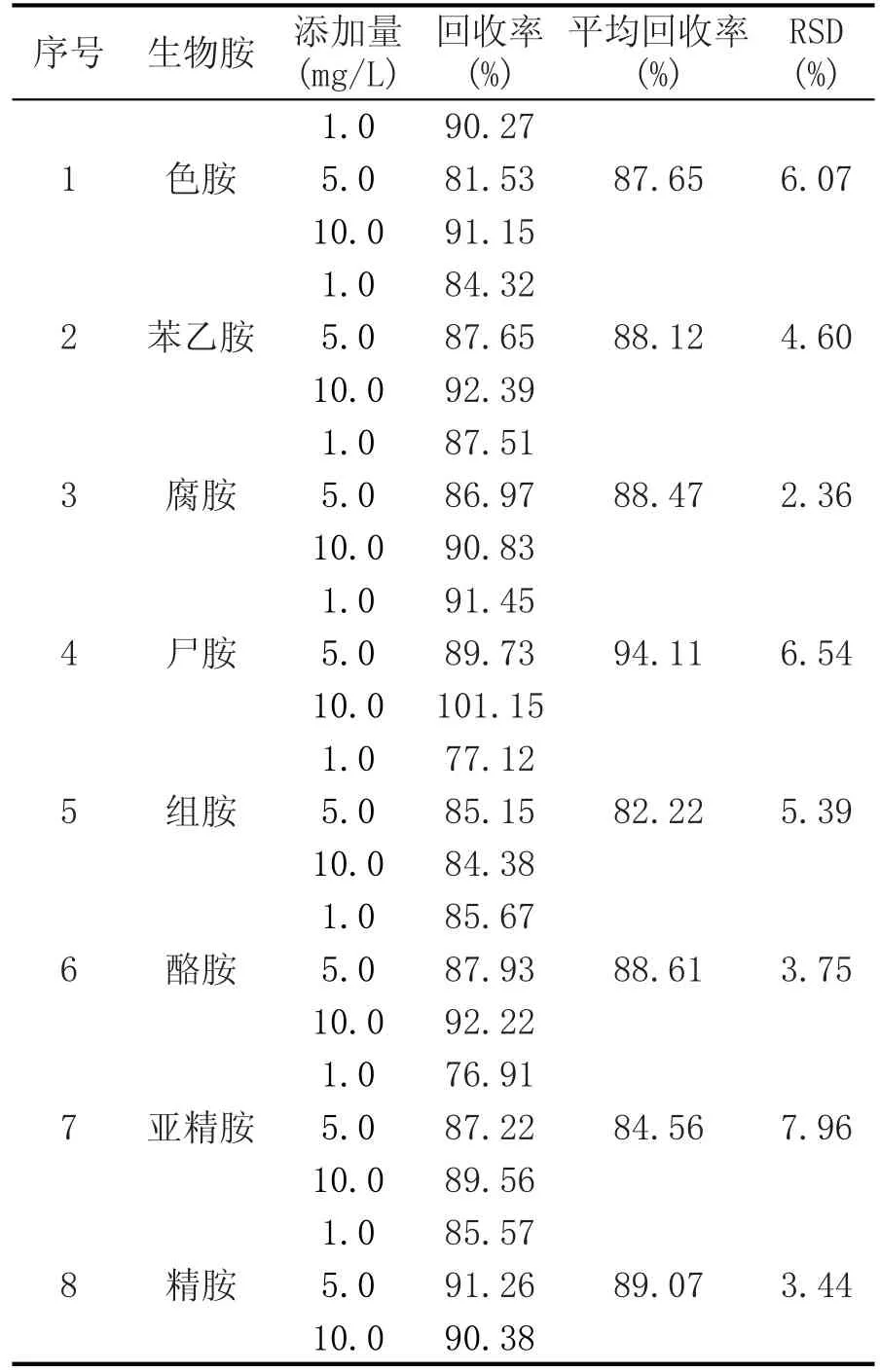
表4 生物胺加标回收率的测定
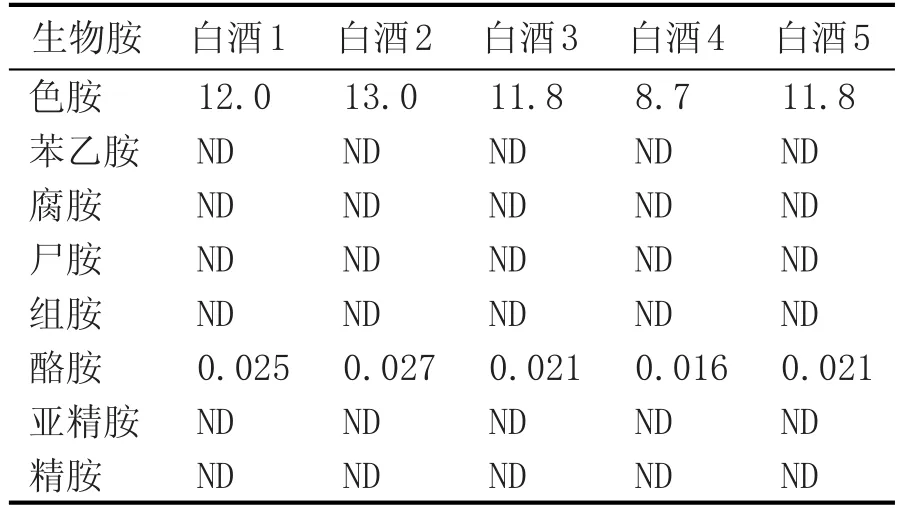
表5 白酒样品中生物胺的测定 (mg/L)
在当地超市随机购买5种酱香型白酒,按照本研究方法进行生物胺检测,检测结果见表5。
由表5可知,5种白酒中均有色胺和酪胺,β-苯乙胺、腐胺、尸胺、组胺、精胺和亚精胺均未检出。其中色胺含量在8.7~13.0 mg/L,酪胺含量在0.016~0.027 mg/L,酪胺含量明显小于色胺,色胺为5种白酒中的主要生物胺。
3 结论
目前,国内外关于酒中生物胺的研究多集中于啤酒、黄酒和红酒,对于白酒中生物胺的检测方法和生物胺分布情况研究较少。本研究所建立的方法,操作简便,灵敏度高,可用于白酒中色胺、腐胺、β-苯乙胺、尸胺、组胺、酪胺、亚精胺和精胺的快速检测,这对于提高白酒产品质量,保障食品安全,帮助政府部门加强酒类市场监管具有重要意义。此外,与欧盟、美国相比,我国在酒中生物胺限量标准制定方面存在较大差距,本文也为相关标准的制订和完善提供参考。
[1] 刘景,任婧,孙克杰.食品中生物胺的安全性研究进展[J].食品科学,2013(5):322-326.
[2] 曹利瑞,朱松,俞剑燊,等.黄酒中9种生物胺的高效液相色谱分析法[J].食品科学,2016(4):103-107.
[3] 孙钦秀,董福家,陈静,等.肉制品中生物胺及其控制技术研究进展[J].食品工业,2015(8):216-219.
[4] 王光强,俞剑燊,胡健,等.食品中生物胺的研究进展[J].食品科学,2016(1):269-278.
[5] 何健,李艳霞.发酵肉制品中生物胺研究进展[J].山东食品发酵,2009(4):30-32.
[6]VALSAMAKI K,MICHAELIDOU A,POLYCHRONIADOR A.Biogenic amine production in Feta cheese[J].Food chemistry,2000,71(2):259-266.
[7] 沈念原,王秀芹.高效液相色谱法测定葡萄酒中生物胺的含量[J].食品工业科技,2011,32(4):394-396.
[8]BORAB B M,ROHRER J S.Determination of biogenic amines in alcoholic beverages by ion chromatography with suppressed conductivity detection and integrated pulsed aerometric detection[J].Journal of chromatography A,2007,1155(1):22-30.
[9]DAPKEVICIUS M L,NOUT M J,ROMBOUTS F M,et al.Biogenic amine formation and degradation by potential fish silage starter microorganisms[J].International journal of food microbiology,2000,57(1/2):107-114.
[10]PARENTE E,MARTUSCELLI M,GARDINI F et al.Evolution of microbial populations and biogenic amine production in dry sausages produced in Southern Italy[J].Journal of applied microbiology,2001,90(6):882-891.
[11] REITER R J,TAN D X,JOU M J,et al.Biogenic amines in the reduction of oxidative stress:melatonin and its metabolites[J].Neuro endocrinology letters,2008,29(4):391-398.
[12] 陈辉,周秋树.鱼露中生物胺的研究进展[J].肉类研究,2016,30(1):40-45.
[13]LANGE J,WITTMANN C.Enzyme sensor arrays for the determination of biogenic amines in food samples[J].Analytical and bioanalytical chemistry,2002,372(2):276-283.
[14]SHAKILA R J,VASUNDHARA T S,KUMUDAVALY K V.A comparison of the TLC-densitometry and HPLC method for the determination of biogenic a mines in fish and fishery products[J].Food chemistry,2001,75(2):255-259.
[15]AWAN M A,FLEET I,THOMAS C L P.Determination of biogenic diamines with a vaporization derivatisation approach using solid-phase microextraction gas chromatography-mass spectrometry[J].Food chemistry,2008,111(2):462-468.
[16]SIMAT V,DALGAARD P.Use of small diameter column particles to enhance HPLC determination of histamine and other biogenic amines in seafood[J].LWT-food science and technology,2011,44(2):399-406.
[17] 乔成栋,宋平顺,严祥,等.5种生物胺的毛细管胶束电动色谱分离[J].分析化学研究,2007,35(1):95-98.
[18] 麻丽丹,巴中华.酶联免疫吸附试验法检测盐渍鳀鱼中的组胺[J].中国酿造,2008,27(14):85-86.
Determination of 8 Biogenic Amines in Baijiu by HPLC
WANG Chunli1,ZHAO Xiaojuan2and WANG Yingzi1
(1.Jiangmen Entry-Exit Inspection and Quarantine Bureau,Jiangmen,Guangdong 529000;2.Zhongkai University of Agriculture and Engineering,Guangzhou,Guangdong 510255,China)
A method for the determination of 8 biogenic amines in Baijiu by high-performance liquid chromatography(HPLC)had been developed.Baijiu samples were extracted with N-butanol and chloroform,and derived by sulfonyl chloride.The experimental results showed that,the proposed method had a good correlation within the range of 1~50 mg/L,and the correlation coefficient was above 0.996,the average recovery was 84.75%to 95.20%in 1~10 mg/L addition level range,RSD(n=3)was less than 10%,LOD was between 0.01~0.10 mg/L,and LOQ ranged within 0.03~0.30 mg/L.This method could be used for the detection of biogenic amines in Baijiu.
Baijiu;biogenic amines;HPLC;content measurement
TS262.3;TS261.4;TS261.7
A
1001-9286(2017)11-0113-04
10.13746/j.njkj.2017171
2016年广东省科技发展专项资金(协同创新与平台环境建设方向)项目;江门市科技项目(江科[2016]191号)。
2017-06-13
王春利 (1980-),男,高级工程师,硕士,E-mail:344159092@qq.com。
优先数字出版时间:2017-08-17;地址:http://kns.cnki.net/kcms/detail/52.1051.TS.20170817.1439.013.html。
