胃肠道间质瘤中Ki-67表达及其与临床病理特征、危险度分级的相关性
2017-11-20王帆荣赵艳红张丽娟
王帆荣,陈 芸,李 梅,赵艳红,张丽娟
胃肠道间质瘤中Ki-67表达及其与临床病理特征、危险度分级的相关性
王帆荣,陈 芸,李 梅,赵艳红,张丽娟
目的探讨Ki-67在胃肠道间质瘤(gastrointestinal stromal tumors, GIST)中的表达及其与临床病理特征、危险度分级的相关性。方法分析77例手术切除的原发性GIST患者的临床病理资料,采用免疫组化SP法检测Ki-67的表达,分析其表达与GIST的临床病理特征及危险度分级的相关性。结果Ki-67表达在肿瘤部位、核分裂象、危险度分级中,差异有统计学意义(P<0.05);在患者年龄、性别、肿瘤大小、组织类型、囊性变、单发或多发、出血、坏死及合并其他肿瘤中,差异无统计学意义(P>0.05);Ki-67增殖指数与肿瘤部位、核分裂象、单发或多发及危险度分级有相关性(P<0.05),其中Ki-67增殖指数与核分裂象及危险度分级呈正相关。结论Ki-67增殖指数可作为判断GIST危险度分级及预后预测的重要参考指标。
胃肠道间质瘤;Ki-67;临床病理;危险度
胃肠道间质瘤(gastrointestinal stromal tumors, GIST)是胃肠道最常见的间叶源性肿瘤,占胃肠道肿瘤的0.1%~3%,发病率为6.5~14.5/100万,可发生于消化道任何部位,分别为胃(40%~60%)、小肠(30%~40%)、结直肠(5%)、食管(<1%);也可以发生于腹腔,如肠系膜、网膜、腹膜后等部位(<5%)[1],其生物学行为复杂,被认为是恶性潜能未定的肿瘤,目前常用危险度分级评估其生物学行为,主要参考2008年美国国立卫生院(national institutes of health, NIH)分级标准[2],依据肿瘤部位、大小、核分裂象及有无破裂进行判断,将其分为极低危、低危、中危、高危组4个等级,该标准虽已被证实对判断GIST术后预后具有显著意义,但即便被归为极低危的GIST患者,也有可能出现转移和复发,故仅根据肿瘤部位、大小、核分裂象及有无破裂来进行危险度分级的生物学行为并不精确。因此,寻找更为准确客观的生物学行为评判指标,对GIST的治疗、预后判断有重要意义。Ki-67作为与细胞增殖相关的核抗原,已被证实与乳腺癌、神经内分泌癌、前列腺癌等的预后、复发、转移有关,但在GIST中的作用还有待进一步分析,本文着重分析GIST的临床病理特征和Ki-67的表达,探讨Ki-67与GIST的临床病理特征及危险度分级的相关性。
1 材料与方法
1.1材料收集云南省肿瘤医院病理科2008年7月~2016年9月经手术切除的原发性GIST标本77例。纳入标准:术后标本根据HE形态和免疫组化指标(CD117、CD34、Dog-1)或基因检测明确诊断为GIST。排除标准:(1)已行分子靶向治疗或放、化疗等抗肿瘤治疗;(2)复发手术切除后诊断为GIST;(3)SDHB阴性的GIST;(4)术后组织不完整或为破碎组织,无法判断肿瘤直径者;(5)临床及病理资料记录不完整者。
1.2免疫组化标本均经10%中性福尔马林固定,常规石蜡包埋,4 μm厚切片,HE染色,由两位病理医师阅片并诊断。采用免疫组化SP法检测Ki-67的表达,并用阳性切片做阳性对照,PBS代替一抗做阴性对照,具体操作步骤按试剂盒说明书进行。
1.3结果判断肿瘤细胞的细胞核呈棕色为阳性,选择热点区域进行计数,计数1 000个细胞,以阳性细胞数的百分数表示Ki-67增殖指数,根据Ki-67增殖指数>5%或≤5%分组。
1.4危险度分级选择肿瘤细胞生长最活跃区,400倍镜下观察并进行核分裂象计数。参照2008年NIH分级[2]、《中国胃肠道间质瘤诊断治疗共识2013版》及《Asian Consensus Guidelines for the Diagnosis and Management of Gastrointestinal Stromal Tumor》[3]标准进行,根据肿瘤部位、大小、核分裂象及肿瘤是否破裂,将肿瘤分为极低危、低危、中危、高危4组(多发肿瘤者,以最大者直径计算)。
1.5统计学分析采用统计学软件SPSS 20.0进行统计学分析,Ki-67表达与临床病理特征的关系,根据资料性质采用χ2检验或Fisher确切概率法,相关性检验采用Spearman等级相关分析,取α=0.05为显著检验水准,P<0.05为差异有统计学意义。
2 结果
2.1GIST的临床病理特征原发性GIST标本77例,其中男性33例,女性44例,男女比为1 ∶1.3,平均年龄55.4岁,中位年龄56岁,食管1例、胃39例、小肠28例、结肠2例、直肠3例、腹膜及其它4例。肿瘤最小者直径为0.3 cm,最大者直径为35 cm,平均直径7.7 cm,肿瘤组织学类型:梭形细胞71例(图1),上皮样细胞0例,混合细胞6例(图2、3),核分裂象数最多为40/50 HPF(图4),Ki-67阳性率83.1%(图5),Ki-67增殖指数最高为50%,发生囊性变18例,未发生囊性变59例,肿瘤为多发12例,合并其它肿瘤11例,出现坏死23例,其中极低危、低危、中危、高危组分别有7、21、10、39例。
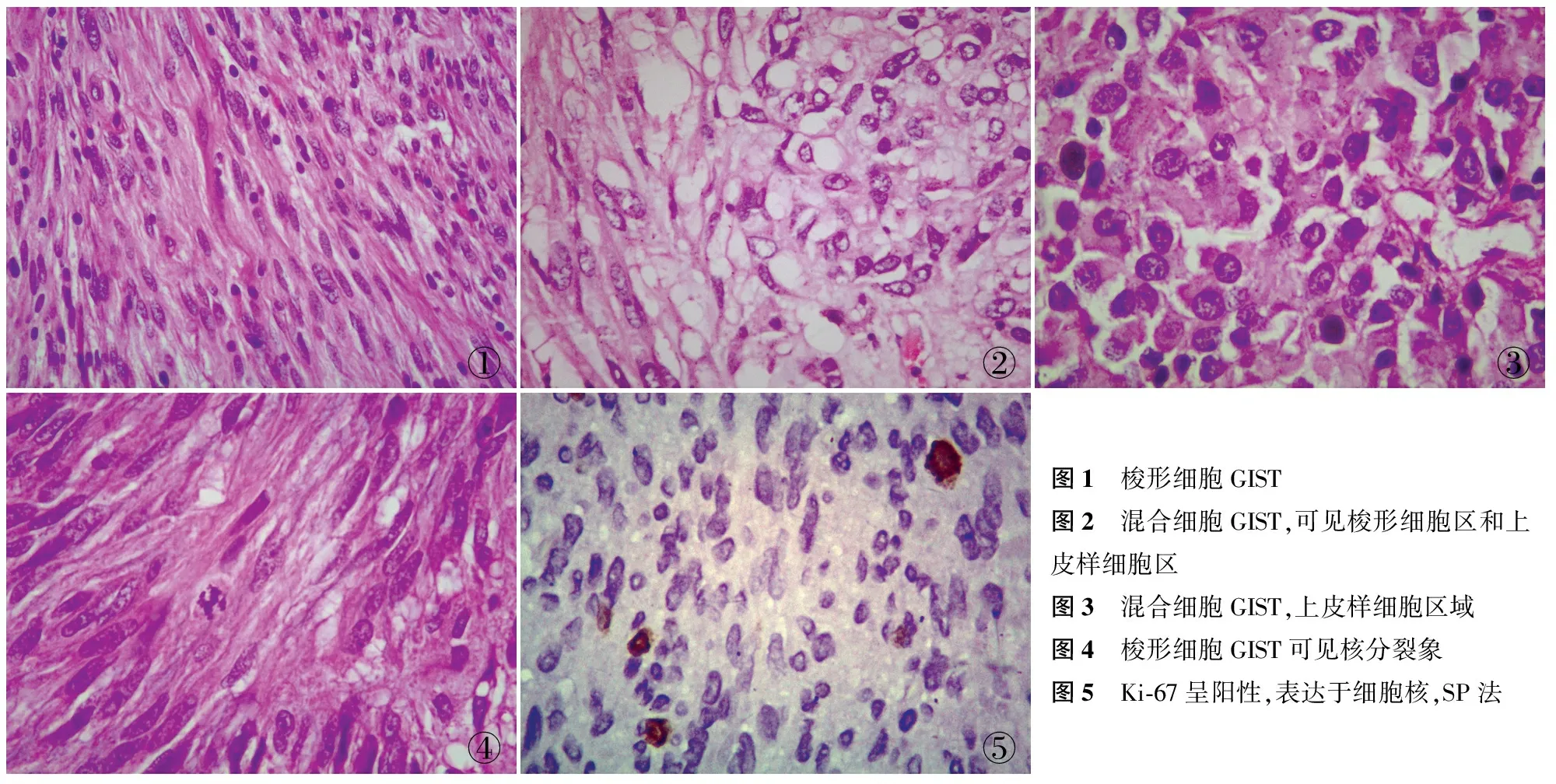
①②③④⑤图1 梭形细胞GIST图2 混合细胞GIST,可见梭形细胞区和上皮样细胞区图3 混合细胞GIST,上皮样细胞区域图4 梭形细胞GIST可见核分裂象图5 Ki⁃67呈阳性,表达于细胞核,SP法
2.2Ki-67表达与GIST临床病理特征的关系采用χ2检验或Fisher确切概率法分析,Ki-67表达在肿瘤部位、核分裂象、危险度分级之间的差异有统计学意义(P<0.05);在患者年龄、性别、肿瘤大小、组织类型、是否囊性变、单发或多发、有无出血坏死、是否合并其他肿瘤之间,差异无统计学意义(P>0.05,表1)。
2.3Ki-67与GIST临床病理特征及危险度分级的相关性采用Spearman等级相关分析,Ki-67增殖指数与肿瘤部位、核分裂象、单发或多发、危险度分级有相关性(P<0.05),其中Ki-67增殖指数与核分裂象、危险度分级呈正相关;与患者年龄、性别、肿瘤大小、组织类型、是否囊性变、有无出血、有无坏死、是否合并其他肿瘤无相关性(P>0.05,表2)。
3 讨论
GIST的生物学行为复杂多样,不能简单以良恶性定义,根据临床和组织学特征较难区分侵袭性与非侵袭性,故GIST均被视为有恶性倾向,且不同部位、不同组织类型、不同基因突变的GIST预后均不相同,有研究发现发生于胃的GIST预后好于发生于小肠的GIST,而发生于十二指肠的GIST则比小肠及其他部位的GIST预后更差[4],上皮样细胞和混合细胞GIST较梭形细胞GIST的生物学行为更具侵袭性[5],出现PDGFR突变的上皮样细胞GIST比不出现突变的预后更好[6]。GIST组织学分为梭形细胞、上皮样细胞、混合细胞,经研究发现上皮样和混合细胞GIST通常危险度分级偏高[7],本组中混合细胞GIST有4例发生于胃、2例发生于肠;高危组有4例(66.7%)、中危组有2例(33.3%),低危和极低危组均为0,与上述文献报道相符。Ki-67抗原与细胞增殖相关,是反映细胞分裂和增殖活性的指标,已在部分肿瘤中显示其预后价值。在GIST的相关研究中,常认为肿瘤部位、肿瘤大小、核分裂象、肿瘤是否破裂与GIST的预后有关,而Ki-67增殖指数在GIST预后中的作用并未明确,有研究认为Ki-67增殖指数与肿瘤部位相关,发生于网膜、腹膜和结直肠的GIST中Ki-67增殖指数常高于发生于小肠和胃的GIST[8]。大部分研究认为,Ki-67增殖指数与核分裂象有关,且两者呈正相关,本组与该结论一致。对于Ki-67增殖指数能否代替核分裂象尚有争议,有学者认为Ki-67增殖指数可代替核分裂象,其仅反映有丝分裂的M期,而Ki-67可表达于细胞分裂的G1/S/G2/M期,故仅用核分裂象代表增殖活性不够全面,而Ki-67则更优,同时Ki-67增殖指数较核分裂象计数的可重复性更好[9]。也有学者认为Ki-67的预后预测作用要劣于核分裂象,其仅在核分裂象计数不够50个高倍镜视野时作为补充参考指标。
Liang等[10]对104例GIST患者进行分析,发现Ki-67<5%时有更高的疾病生存率,提示Ki-67增殖指数可以加强GIST的NIH分级;与Calabuig-Farinas等[11]发现Ki-67和危险度分级与GIST的无进展生存期有关,Ki-67有助于预测GIST的生物学行为结论一致。总之,越来越多研究证明其在预后预测中的作用,但具体的Ki-67临界值还未统一定论,被建议的临界值有0.82%~10%,其中有部分临界值是以复发和转移为阳性的ROC曲线确定,Zhao等[12-13]报道Ki-67增殖指数的临界值为5%,其经ROC曲线证实Ki-67>5%具有较高的特异性和敏感性,且可作为独立的预后因素。本实验发现Ki-67>5%与Ki-67≤5%在极低危、低危、中危、高危组中的表达差异有统计学意义(P<0.05),且两者呈正相关,提示Ki-67增殖指数可能是判断危险度分级的有效参考指标,而5%则有可能作为区分危险度分级的临界值,但仍需要大量研究来进一步证实。
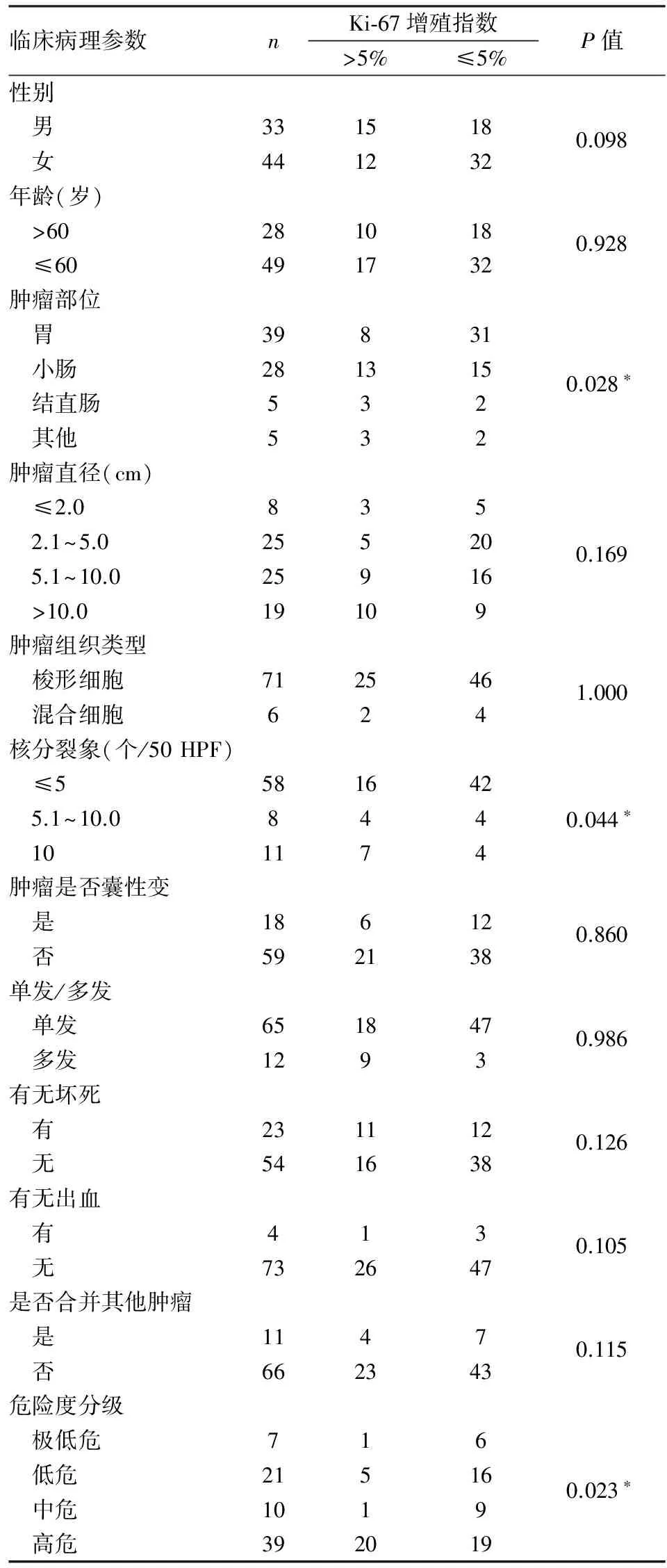
表1 Ki-67表达与GIST临床病理特征的关系
*P<0.05
综上所述,Ki-67增殖指数与GIST的危险度分级相关,可作为GIST生物学行为预测的参考指标。因此,病理医师在评估GIST的危险度分级时可以依据肿瘤部位、大小、核分裂象、肿瘤是否破裂来综合判断,同时可提供Ki-67增殖指数供临床参考,特别是当危险度分级为极低危或低危,但Ki-67增殖指数偏高时,需提醒临床医师加以重视,并密切随访。
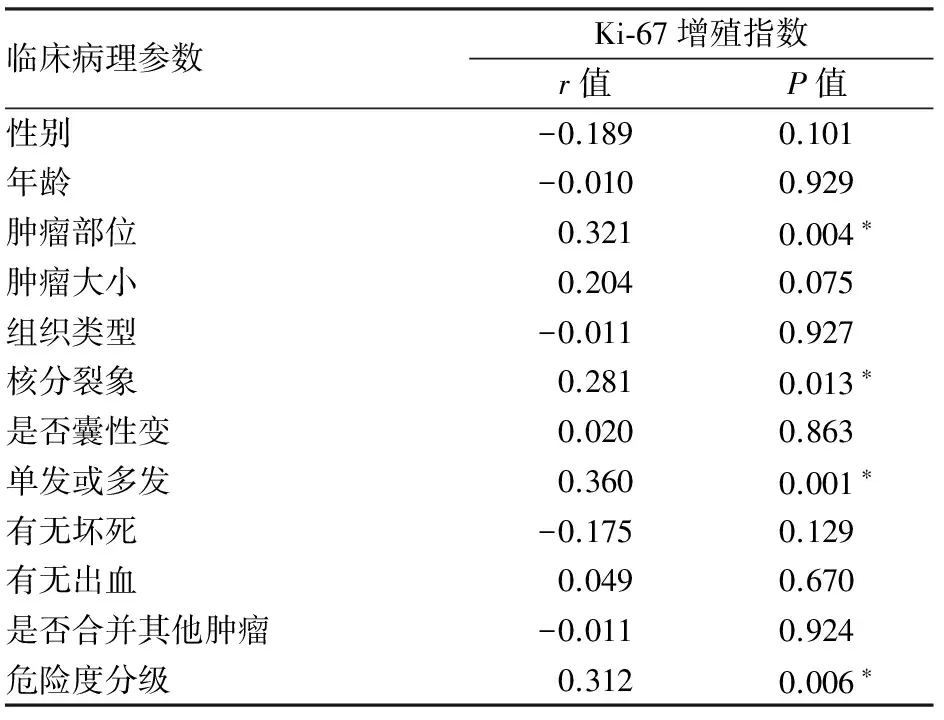
表2 Ki-67与GIST临床病理特征及危险度分级的相关性
*P<0.05
[1] Grover S, Ashley S W, Raut C P. Small intestine gastrointestinal stromal tumors[J]. Curr Opin Gastroenterol, 2012,28(2):113-123.
[2] Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor[J]. Hum Pathol, 2008,39(10):1411-1419.
[3] Koo D H, Ryu M H, Kim K M. Asian consensus guidelines for the diagnosis and management of gastrointestinal stromal tumor[J]. Cancer Res Treat, 2016,48(4):1155-1166.
[4] Han I W, Jang J Y, Lee K B,etal. Clinicopathologic analysis of gastrointestinal stromal tumors in duodenum and small intestine[J]. World J Surg, 2015,39(4):1026-1033.
[5] Wei Y C, Chou F F, Li C F,etal. HuR cytoplasmic expression is associated with increased Cyclin A expression and inferior diseasefree survival in patients with gastrointestinal stromal tumours (GIST)[J]. Histopathology, 2013,63(4):445-454.
[6] Miettinen M, Makhlouf H, Sobin L H,etal. Gastrointestinal stromal tumors of the jejunum and ileum: a clinicopathologic, immunohistochemical, and molecular genetic study of 906 cases before imatinib with long-term follow-up[J]. Am J Surg Pathol, 2006,30(4):477-489.
[7] Haller F, Cortis J, Helfrich J,etal. Epithelioid/mixed phenotype in gastrointestinal stromal tumors with KIT mutation from the stomach is associated with accelerated passage of late phases of the cell cycle and shorter disease-free survival [J]. Mod Pathol, 2011,24(2):248-255.
[8] Bulbul D G. Gastrointestinal stromal tumors: a multicenter study of 1 160 turkish cases[J]. Turk J Gastroenterol, 2012,23(3):203-211.
[9] Jeong S Y, Park W W, Kim Y S,etal. Prognostic significance of
Ki-67 expression in patients undergoing surgical resection for gastrointestinal stromal tumor[J]. Korean J Gastroenterol, 2014,64(2):87-92.
[10] Liang Y M, Li X H, Li W M,etal. Prognostic significance of PTEN, Ki-67 and CD44s expression patterns in gastrointestinal stromal tumors[J]. World J Gastroenterol, 2012,18(14):1664-1671.
[11] Calabuig-Farinas S, Lopez-Guerrero J A, Navarro S,etal. Evaluation of prognostic factors and their capacity to predict biological behavior in gastrointestinal stromal tumors[J]. Int J Surg Pathol, 2011,19(4):448-461.
[12] Zhao W Y, Xu J, Wang M,etal. Prognostic value of Ki-67 index in gastrointestinal stromal tumors[J]. Int J Clin Exp Pathol, 2014,7(5):2298-2304.
[13] Basilio-de-Oliveira R P, Pannain V L. Prognostic angiogenic markers (endoglin, VEGF, CD31) and tumor cell proliferation (Ki67) for gastrointestinal stromal tumors[J]. World J Gastroenterol, 2015,21(22):6924-6930.
时间:2017-9-18 6:23 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170918.0623.019.html
R 735;R 730.26
B
1001-7399(2017)09-1022-04
10.13315/j.cnki.cjcep.2017.09.019
接受日期:2017-06-30
昆明医科大学第三附属医院/云南省肿瘤医院病理科,昆明 650000
王帆荣,女,硕士研究生。E-mail: 659090960@qq.com
张丽娟,女,副教授,硕士生导师,通讯作者。E-mail: 13769171381@163.com
