Beclin1和HLAⅠ、Ⅱ在人卵巢癌SKOV3细胞中的表达及其关系
2017-11-20纪晓坤王学利赵银环吴家宁
纪晓坤,王学利,王 珩,赵银环,吴家宁,王 蕊,吴 娟,杜 芸
Beclin1和HLAⅠ、Ⅱ在人卵巢癌SKOV3细胞中的表达及其关系
纪晓坤,王学利,王 珩,赵银环,吴家宁,王 蕊,吴 娟,杜 芸
目的探讨转染Beclin1质粒的自噬基因Beclin1和免疫应答效应分子HLAⅠ、Ⅱ在人卵巢癌SKOV3细胞中的表达,分析Beclin1在卵巢癌免疫应答中的作用。方法应用基因转染技术、RT-PCR、Western blot法检测Beclin1质粒转染SKOV3细胞前后Beclin1和HLAⅠ、Ⅱ的mRNA和蛋白表达水平的变化。应用免疫荧光显微镜观察Beclin1质粒转染SKOV3细胞后,其自噬小体的变化。用MTT法检测Beclin1质粒转染SKOV3前后细胞的增殖活性。结果SKOV3细胞转染Beclin1质粒后,Beclin1的转录和翻译水平分别是空载体组的5、2倍。荧光显微镜观察,转染Beclin1质粒组卵巢癌细胞MDC标记的自噬小体数量显著增多。RT-PCR和Western blot结果显示,转染Beclin1可诱导HLAⅠ、Ⅱ等位基因的转录和翻译。Beclin1质粒组的HLAⅠ-A、B、C和HLAⅡ-DP、DQ、DR的mRNA分别是空载体组的2、1.6、3倍和2、6、3倍;其HLAⅠ、Ⅱ的蛋白表达分别是空载体组的2、1.6倍。MTT结果显示,Beclin1质粒组与空载体组、空白对照组相比,在转染24、48、72、96 h后,其细胞生长抑制率分别为42.6%、37.8%、24.35%、14.81%。结论在人卵巢癌SKOV3细胞中,转染外源性Beclin1可诱导细胞自噬并使免疫应答效应分子HLAⅠ、Ⅱ的表达增加。HLAⅠ、Ⅱ表达的增加可能使卵巢癌细胞免疫应答增强。转染外源性Beclin1可抑制卵巢癌SKOV3的细胞增殖。
卵巢肿瘤;Beclin1;HLAⅠ、Ⅱ;自噬;免疫应答
卵巢癌是妇科恶性肿瘤中发病率和病死率最高的恶性肿瘤。尽管手术和化疗不断发展,卵巢癌的预后仍然较差,约15%的患者于诊断后1年内死亡,5年生存率仅25%[1],其最主要原因是卵巢癌发现时已属进展期(Ⅲ~Ⅳ期)。尽管考虑肿瘤分级、组织学类型和化疗敏感性等普遍因素,卵巢癌的预后仍然存在较大差异,其主要来自于肿瘤和患者的差异,患者的差异主要体现在对卵巢癌的免疫应答。
接受日期:2017-07-05
目前,已有多项研究证实免疫应答在调节疾病过程中起显著作用[2-3]。
在先天性和后天性肿瘤免疫应答中起关键性作用的人类主要组织相容性复合体HLAⅠ、Ⅱ,其在肿瘤性损伤中的表达会发生改变。据文献报道[4]HLAⅠ、Ⅱ表达的改变在肿瘤免疫逃逸机制中发挥重要作用。近年更多的免疫学家和临床肿瘤医师将注意力转向肿瘤细胞的经典和非经典HLAⅠ、Ⅱ表达的改变[5-8]。
自噬形态学上的特征性变化是细胞内出现大量自噬小体,而自噬在肿瘤的发生、发展和预后中的作用十分复杂。肿瘤细胞自噬增强可使其产生耐药、抵抗放疗并适应缺氧和营养缺乏状态而存活。自噬异常增强可使细胞发生程序性死亡。近年,研究认为自噬的异常调节对卵巢癌的发病机制和耐受放、化疗发挥重要作用[9]。目前,自噬与免疫应答间的关系尚未见报道,本实验旨在探索两者间的关系及其可能的相互作用。
1 材料与方法
1.1细胞株、培养条件及试剂SKOV3细胞株由河北医科大学第四医院科研中心提供,在含10%胎牛血清的RPMI 1640培养液中,于37 ℃、5%CO2环境下培养,当细胞达80%~90%融合时用0.25%胰蛋白酶-EDTA液进行消化以1 ∶4传代,次日换液,每2天传代1次。
1.2方法将SKOV3细胞按每毫升5×105个的密度接种于不含抗生素的RPMI 1640培养基的无菌6孔培养板内,待细胞生长密度达80%~90%时,按转染试剂盒提供的方法进行转染。实验分3组,分别为转染外源性Beclin1质粒组、空载体组、空白对照组。
1.3转染法取OPTI-DMEM 100 μL,加入Lipofectamine 2000DNA转染试剂2 μL,轻轻混匀,室温静置孵育5 min;向上述混合液中加入0.5 μg/μL的质粒DNA 1 μL,轻轻混匀,室温孵育20 min;先在每孔细胞中加入1.5 mL不含牛血清、不含抗生素的RPMI 1640培养基,再将上述混合物分别加入各孔细胞中,轻轻混匀;转染6 h后更换含10%胎牛血清的完全培养基,继续培养至48 h收集细胞,提取细胞总RNA和总蛋白,进行RT-PCR和Western blot实验。
1.4RNA提取和RT-PCR实验采用Trizol法提取细胞中总RNA,紫外分光光度计测其浓度,用Fermentas公司的反转录试剂盒将RNA反转录为cDNA,用美国ABI公司的7500实时定量PCR仪,以合成的cDNA为模板,以美国Promega公司的GoTaq qPCR Master Mix实时定量试剂盒为反应体系,进行目的基因扩增。
1.5细胞总蛋白提取和Westernblot实验细胞转染72 h后,加入细胞裂解液及蛋白酶抑制剂(两者体积比为100 ∶1)提取细胞总蛋白,用BCA蛋白定量试剂盒测定蛋白浓度,定量后的蛋白用于Western blot实验。
Western blot实验:制备5%浓缩胶和12%分离胶,根据蛋白浓度以每孔100 μg上样;SDS-PAGE电泳:5%浓缩胶90 V 40 mA条件电泳到达分离界面后,改换电压120 V 40 mA,1.5~2 h分离样品蛋白;根据蛋白Marker在目的条带区域的凝胶处切胶,置于转膜缓冲液中浸泡,PVDF膜先放入甲醇液中激活3 min,再放入转膜缓冲液中平衡10 min;由负极到正级依次为:3层滤纸、凝胶、PVDF膜、3层滤纸,放入电转仪中,4 ℃条件下进行印迹电泳(恒流180 mA、120 min),将凝胶中的蛋白质转移到PVDF膜上;将PVDF膜用5%脱脂奶粉37 ℃震荡封闭1 h;TTBS洗膜3次,加入Beclin1和GAPDH一抗(稀释比例均为1 ∶1 000),HLA Ⅰ和HLA Ⅱ一抗(稀释比例均为1 ∶100),4 ℃孵育过夜(>6 h);TTBS洗膜3次,加入抗兔荧光二抗(稀释比例为1 ∶5 000),37 ℃避光孵育1 h;TTBS避光洗膜3次,最后用Odyssey成像系统检测结果,采集灰度值,保存图片。
1.6MTT比色法测定细胞增殖收集瞬时转染后对数生长期的3组细胞,以每孔每毫升1×104个细胞分别接种于96孔板,每组设10个复孔,置于37 ℃、5%CO2条件下进行培养。分别在转染后第24、48、72、96 h每孔加入浓度为5 mg/mL的四甲基偶氮唑蓝(MTT)20 μL,温箱培育4 h后小心吸取培养基,每孔加入DMSO 150 μL,震荡混匀10 min,酶标仪测定492 nm处的吸光度(A)值以计算SKOV3细胞的生长抑制率:抑制率(%)=(1-A转染组/A未转染组)×100%。
1.7MDC染色检测自噬小体取对数生长期SKOV3细胞以每孔每毫升1×106个细胞密度接种于放有盖玻片的6孔板中,待细胞贴壁后按外源性Beclin1组、空载体组和空白对照组进行瞬时转染,在转染48 h后,PBS洗2次,换含MDC(0.05 mmol/L)的新鲜培养基于37 ℃培养箱避光孵育60 min后,4%多聚甲醛固定15 min,PBS洗2次,取出细胞爬片,晾干后在荧光显微镜下观察和照相。

2 结果
2.1SKOV3细胞转染Beclin1质粒后Beclin1的表达SKOV3细胞转染Beclin1质粒后,其自噬相关基因Beclin1的转录和翻译水平分别是转染空载体质粒组的5、2倍。转染Beclin1质粒后,各组Beclin1 mRNA表达分别为:转染Beclin1质粒组9.29±0.27、空载体组1.84±0.10、空白对照组1.39±0.01,其数据分析采用单因素方差分析SNK两两比较和非参数检验进行分析,转染Beclin1质粒组与空白对照组比较差异有统计学意义(P<0.01)。Beclin1蛋白表达分别为:转染Beclin1质粒组11.68±2.90、空载体组5.13±0.61、空白对照组5.67±0.85,其数据采用单因素方差分析SNK两两比较,转染Beclin1质粒组与空载体组、空白对照组比较差异均有统计学意义(P<0.01,图1)。

图1Westernblot法检测SKOV3卵巢癌细胞Beclin1的蛋白表达
1.转染外源性Beclin1质粒组;2.空载体组;3.空白对照组
2.2转染Beclin1质粒后SKOV3细胞自噬小体的变化转染Beclin1质粒组卵巢癌细胞MDC标记的自噬小体数量显著增多,提示转染外源性Beclin1可诱导卵巢癌SKOV3细胞自噬增强(图2)。

ABC图2 荧光显微镜观察转染48h后SKOV3细胞中自噬小体的变化:A.转染外源性Beclin1质粒组;B.空载体组;C.空白对照组
2.3转染Beclin1质粒后HLAⅠ、Ⅱ的表达转染外源性Beclin1可诱导HLAⅠ、Ⅱ等位基因即HLAⅠ-A、B、C 和 HLAⅡ-DP、DQ、DR的转录和翻译。Beclin1质粒组的HLAⅠ-A、B、C和HLAⅡ-DP、DQ、DR的转录mRNA(表1)分别是空载体组的2、1.6、3倍和2、6、3倍;其HLAⅠ、Ⅱ的蛋白表达分别是空载体组2、1.6倍(表2,图3)。

表1 RT-PCR检测SKOV3卵巢癌细胞等位基因HLAⅠ-A、B、C和HLAⅡ-DP、DQ、DR的mRNA表达
与空白对照组相比,aP<0.01;与空白对照组,bP<0.05
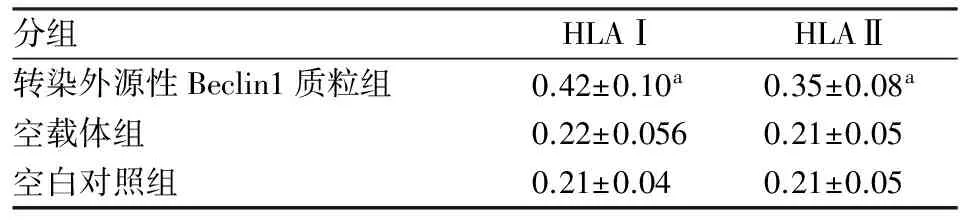
表2 Western blot法检测SKOV3卵巢癌细胞HLA Ⅰ、Ⅱ的蛋白表达
与空载体组、空白对照组相比,aP<0.01
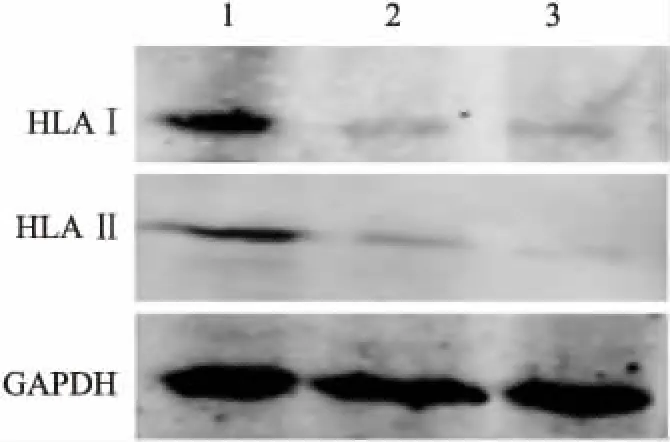
图3Westernblot法检测SKOV3细胞HLAⅠ、Ⅱ的蛋白表达
1.转染外源性Beclin1质粒组;2.空载体组;3.空白对照组
2.4转染Beclin1质粒后SKOV3细胞的生长抑制率转染Beclin1质粒组与空载体组、空白对照组相比,在转染24、48、96 h后,其细胞生长抑制率分别为42.6%、37.8%、24.35%、14.81%(表3)。

表3 MTT比色法测定SKOV3卵巢癌细胞的增殖
与空白对照组相比,aP<0.01
3 讨论
免疫系统能识别并清除肿瘤细胞,以阻止肿瘤的生长和扩散。近年,对肿瘤免疫监视理论的研究突出免疫逃逸机制在肿瘤发生、发展及预后中作用。HLAⅠ、Ⅱ表达的改变在已发现的肿瘤细胞逃避免疫识别及清除机制中发挥重要作用,越来越多的免疫学家及临床肿瘤医师在研究肿瘤免疫逃逸机制中更青睐于分析HLAⅠ、Ⅱ表达改变。在一些肿瘤中[4,10-11],HLAⅠ、Ⅱ的表达与临床预后的关系能反映两者在肿瘤细胞先天性和获得性免疫系统的相互作用中发挥作用。值得注意的是,在大量肿瘤性损伤中已经发现HLAⅠ、Ⅱ的表达改变[4,10]。
Chang等[10]报道除肝癌、白血病及淋巴瘤外的大部分肿瘤中均存在HLAⅠ表达异常,对100多种肿瘤性损伤的研究发现16%~80%的损伤出现HLAⅠ的表达缺失或下降[4]。在非经典型HLAⅠ的抗原中,HLA-G已证实在卵巢癌中表达[10-13]。HLAⅡ抗原不同于HLAⅠ,其通常在恶性肿瘤细胞中高表达[14-15],频率为0~100%。
前期研究显示HLAⅠ在识别并清除肿瘤细胞中发挥重要作用,该作用具有HLAⅠ依赖性,由此可见肿瘤细胞HLAⅠ表达异常使机体免疫系统对肿瘤细胞的免疫应答产生不利影响。作为非经典型HLAⅠ抗原的代表HLA-G,其作用可抑制细胞毒细胞的活性和CTL、CD4+辅助T细胞的增殖,抵抗NK细胞介导的肿瘤杀伤作用[4];HLA-G也可将APC(抗原提呈细胞)细胞膜上的HLA-G转移至活化T细胞,诱导产生新的辅助T细胞亚群。该作用为肿瘤细胞逃避免疫识别和清除提供帮助[16]。值得注意的是NK细胞的肿瘤杀伤作用是由经典型和非经典型HLAⅠ与NK细胞配体激活共同作用的结果。HLAⅡ分子可将抗原肽提呈给辅助T细胞,而HLAⅡ在抗原肽提呈过程中需要HLAⅠ、APM及共刺激分子协同作用[4]。通常CD4+T与HLAⅡ-抗原肽复合物及APC细胞的共刺激分子相互作用,通过CD40-CD40L的作用导致CD8+T细胞和活化的APC细胞的增殖和分化,从而提高抗原提呈作用。HLAⅡ依赖性和肿瘤抗原特异性CD4+T可间接地通过释放IFN的细胞因子活化嗜酸性粒细胞、巨噬细胞及中性粒细胞,杀灭肿瘤细胞[6]。
自噬是细胞吞噬细胞质和细胞器于双层膜结构的自噬小体中,并将自噬小体运送至溶酶体将其降解为氨基酸和能量再利用的动态连续过程。基础水平的自噬有助于通过清除受损伤及衰老的细胞器和更新长寿蛋白维持内环境稳态;而持续大量的自噬可导致细胞程序性死亡[17]。然而,自噬在肿瘤中起截然相反的两种作用:一方面自噬阻止肿瘤形成;另一方面使肿瘤细胞在营养缺乏、代谢性应激、抵抗化疗药物等不利环境中生存。自噬调节异常可能在卵巢癌的发病机制及抵抗放、化疗的治疗中发挥重要作用[9]。Beclin1是第一个被发现的自噬相关基因,也是自噬最重要的效应分子和肿瘤抑制因子,参与自噬的起始、自噬小体的形成和降解等过程。Beclin1在40%~75%的人类散发性乳腺癌、卵巢癌和前列腺癌中存在单等位基因缺失[18]。在Liang等[19]的研究中显示50%散发性卵巢癌中发现Beclin1单等位基因缺失,与卵巢良性肿瘤相比Beclin1在卵巢癌中的表达下调。在体外研究和体内异种移植肿瘤研究中已证实,在乳腺癌MCF-7中Beclin1的异位表达完全可以使乳腺癌MCF-7重建自噬[19]。Peracchio等[9]未公开的数据显示在卵巢癌患者中提高Beclin1和 LC3表达能提高化疗的有效率,该现象有助于探索癌症治疗的新方法。
本实验着重分析提高细胞自噬能否提高卵巢癌的免疫应答,实验显示在卵巢癌SKOV3细胞中提高Beclin1表达能诱导自噬而抑制细胞增殖,同时可以诱导免疫应答效应分子HLAⅠ、Ⅱ的表达。此结果为揭示肿瘤中自噬与免疫系统间未知的关系提供实验数据。
目前,卵巢癌的免疫生物治疗方法取得重大突破。在诸如恶性黑色素瘤和肾细胞癌中免疫生物治疗取得巨大成功;而相似的治疗方针已延伸到卵巢癌的治疗中。但是在卵巢癌取得巨大进展的标准治疗中仍然缺乏重要的肿瘤免疫学知识。另外,在恶性肿瘤中HLAⅠ的表达缺失有助于肿瘤细胞逃避CTL细胞的识别和清除,因此其有望成为潜在性有益的T细胞免疫治疗新方法。本实验显示在卵巢癌SKOV3细胞中提高Beclin1表达可诱导自噬进而提高HLAⅠ、Ⅱ的表达并抑制细胞增殖,为卵巢癌患者提高免疫反应增加抗肿瘤作用改善预后提供实验依据。
[1] Tanner B, Hasenclever D, Stern K,etal. ErbB-3 predicts survival in ovarian cancer[J]. Clin Oncol, 2006,24(26):4317-4323.
[2] Charbonneau B, Goode E L, Kalli K R,etal. Theimmune system in the pathogenesis of ovarian cancer[J]. Crit Rev Immunol, 2013,33(2):137-164.
[3] Preston C C, Goode E L, Hartmann L C,etal. Immunity and immune suppression in human ovarian cancer[J]. Immunotherapy, 2011,3(4):539-556.
[4] Campoli M, Ferrone S. HLA antigen changes in malignant cells: epigenetic mechanisms and biologic significance[J]. Oncogene, 2008,27(45):5869-5885.
[5] Ostrand-Rosenberg S. Animal models of tumor immunity, immunotherapy and cancer vaccines[J]. Curr Opin Immunol, 2004,16(2):143-150.
[6] Knutson K L, Disis M L. Tumor antigen-specific T helper cells in cancer immunity and immunotherapy[J]. Cancer Immunol Immunother, 2005,54(8):721-728.
[7] Marsman M, Jordens I, Griekspoor A,etal. Chaperoning antigen presentation by MHC class II molecules and their role in oncogenesis[J]. Adv Cancer Res, 2005,93:129-158.
[8] Moretta L, Bottino C, Pende D,etal. Human natural killer cells: molecular mechanisms controlling NK cell activation and tumor cell lysis[J]. Immunol Lett, 2005,100(1):7-13.
[9] Peracchio C, Alabiso O, Valente G,etal. Involvement of autophagy in ovarian cancer: a working hypothesis[J], Ovarian Res, 2012,5(1):22.
[10] Chang C C, Campoli M, Ferrone S. Classical and nonclassical HLA class I antigen and NK cell-activating ligand changes in malignant cells: current challenges and future directions[J]. Adv Cancer Res, 2005,93:189-234.
[11] Campoli M, Ferrone S. HLA antigen and NK cell activating ligand expression in malignant cells: a story of loss or acquisition[J]. Semin Immunopathol, 2011,33(4):321-334.
[12] Lin A, Yan W H, Xu H H,etal. HLA-G expression in human ovarian carcinoma counteracts NK cell function[J]. Ann Oncol, 2007,18(11):1804-1809.
[13] Sheu J J, Shih I M. Clinical and biological significance of HLA-G expression in ovarian cancer[J]. Semin Cancer Biol, 2007,17(6):436-443.
[14] Campoli M, Ferrone S. A fresh look at an old story: revisiting HLA class II antigen expression by melanoma cells[J]. Expert Review of Dermat, 2006,1(6):805-823.
[15] Campoli M, Chang C C, Oldford S A,etal. HLA antigen changes in malignant tumors of mammary epithelial origin: molecular mechanisms and clinical implications[J]. Breast Dis, 2004,20:105-125.
[16] Wischhusen J, Waschbisch A, Wiendl H. Immune-refractory cancers and their little helpers-an extended role for immunetolerogenic MHC molecules HLA-G and HLA-E[J]. Semin Cancer Biol, 2007,17(6):459-468.
[17] Chen N, Karantza-Wadsworth V. Role and regulation of autophagy in cancer[J]. Biochim Biophys Acta, 2009,1793(9):1516-1523.
[18] Aita V M, Liang X H, Murty V V,etal. Cloning and genomic organization of beclin-1, a candidate tumor suppres-sor gene on chromosome17q21[J]. Genomics, 1999,59(1):59-65.
[19] Liang X H, Jackson S, Seaman M,etal. Induction of autophagy and inhibition of tumorigenesis by beclin 1[J]. Nature, 1999,402(6762):672-676.
ExpressionofBeclin1andHLAⅠ, ⅡinhumanSKOV3ovariancancercellsandtheircorrelation
JI Xiao-kun, WANG Xue-li, WANG Heng, ZHAO Yin-huan, WU Jia-ning, WANG Rui, WU Juan, DU Yun
(DepartmentofCancerDetection,theForthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China)
PurposeThe aim of this study was to investigate the relationship between autophagy gene Beclin1 and immune response effector classical HLAⅠ, Ⅱ in SKOV3 cells. To explore the role of Beclin1 in immunity in ovarian cancer cells which were transfected with the vector of Beclin1.MethodsRT-PCR and Western blot were used to detect the expression of Beclin1 and HLAⅠ, Ⅱ in SKOV3 cells. Fluorescence microscope was carried out to observe the unique autophagosome in SKOV3 cells. MTT was used to analyze the proliferation of the Beclin1 over-expressed SKOV3 cells.ResultsTransfection SKOV3 cells with Beclin1 vector could induce Beclin1 transcription and translation approximately 5 and 2 times compared with empty vector group respectively. The autophagosome stained by MDC was observed by fluorescence microscope. And much more green fluorescence signal was observed in Beclin1 vector group. RT-PCR and Western blot indicated that HLAⅠ, Ⅱinduced by transfection with extrinsic Beclin1. The allelic transcriptions of HLAⅠ-A, B, C and HLAⅡ-DP, DQ, DR in extrinsic Beclin1 group were approximately 2, 1.6, 3 and 2, 6, 3 times compared with empty vetcor group or untreated group, respectively. The results of Western blot showed that HLAⅠ, Ⅱin Beclin1 vector group induced as much as 2 and 1.6 times compared with empty vetcor group or untreated group, respectively. The results of MTT showed that the proliferation of SKOV3 cells treated with Beclin1 vector was significantly suppressed. The percentage of suppression in Beclin1 vector group at 24 h, 48 h, 72 h and 96 h is 42.6%, 37.8%, 24.35%, 14.81% compared with untreated group or empty vector group respectively.ConclusionThe enhancement of autophagy by over-expression of Beclin1 could induce HLAⅠ, Ⅱ transcription and translation in SKOV3 cells. The expression of HLAⅠ, Ⅱmay be responsible for triggering the immune response in ovarian cancer. Over-expression of Beclin1 could inhibit the proliferation of SKOV3 cells which were transfected with extrinsic Beclin1.
ovarian neoplasm; Beclin1; HLAⅠandⅡ; autophagy; immune response
R 737.31
A
1001-7399(2017)09-0954-05
10.13315/j.cnki.cjcep.2017.09.003
河北医科大学第四医院癌检中心,石家庄 050011
纪晓坤,女,硕士,医师。E-mail: jixiaokun01@163.com
杜 芸,女,博士,主任医师,通讯作者。E-mail: yydd40@126.com
