利用反相高效液相法测定马乳中的乳清蛋白
2017-11-03李敏婧杨洁杨迎春王红娟吕岳文申彤刘军阿里木江阿布都拉
李敏婧,杨洁,杨迎春,王红娟,吕岳文,申彤,刘军,阿里木江·阿布都拉
(新疆大学 生命科与技术学院,新疆 乌鲁木齐,830049)
利用反相高效液相法测定马乳中的乳清蛋白
李敏婧,杨洁*,杨迎春,王红娟,吕岳文,申彤,刘军,阿里木江·阿布都拉
(新疆大学 生命科与技术学院,新疆 乌鲁木齐,830049)
乳清蛋白是马乳中主要的蛋白质,不同物种间蛋白质组成存在差异。该研究利用反相高效液相色谱(RP-HPLC)对马乳清中的蛋白进行分离和定量分析,利用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)对主要分离组分进行鉴定。结果表明,马乳乳清蛋白中主要组分为LYS,α-lg和β-lg。利用建立的色谱分析方法对乳清蛋白定量测定结果显示,LYS,α-lg和β-lg在(0.1~1.0)(R2=0.999 3)、(0.2~0.8)(R2=0.996 9)和(0.2~1.0) g/L(R2=0.990 3)线性关系良好。该方法的稳定性、精密度、重现性的相对标准偏差(RSD)均小于5%,加标回收率分别为:88.05%~96.26%,86.03%~95.70%和91.79%~100.97%,能够满足实际检测的需要。测得马乳乳清中的LYS,α-lg和β-lg,含量为别为(3.38±0.32)、(2.64±0.37)及(0.52±0.06) g/L。
反相高效液相色谱法;马乳;溶菌酶;α-乳白蛋白;β-乳球蛋白
新疆是多民族聚居地区,养马业发达,当地牧民有饮用马奶及酸马奶的传统。马乳含1%脂肪、2%蛋白质、7%的乳糖[1],马乳相对于其他乳制品,有一些结构和功能上的特性使得它更符合人们的营养需要,乳糖含量高于其他乳品,更利于肠道微生物的生长,改善肠道问题等[2]。由于不同哺乳动物幼崽所需要的营养物质不同,因此不同物种乳中蛋白质组成不同,马乳中α-乳白蛋白(α-lactalbumin, α-la),β-乳球蛋白(β-lactoglobulin, β-lg),免疫球蛋白(immunoglobulin, Ig),具有抑菌作用的溶菌酶(lysozyme ,LYS),乳铁蛋白(lactoferrin , Lf),乳凝集素(lactadherin)含量较高,除了乳清酸蛋白以上这些蛋白质的比例在物种之间差异较大:α-la占牛乳乳清蛋白50%,而马乳中α-la所占比例较少,驼乳、马乳中β-lg含量要高于牛乳,且马乳β-lg较牛β-lg易消化[3],马乳、驼乳和牛乳α-la均含123个氨基酸,对马乳,驼乳和牛乳主要蛋白质氨基酸序列利用NCBI进行比对,发现其氨基酸序列有明显差异,差异性为17.34%[4]。从结构上来看,驼乳α-la比牛乳α-la多5个折叠,马乳中β-lg中2个异构体包含162及163个氨基酸,每个异构体中含有2个二硫键,但在牛乳中并未发现二硫键。
由于其独特的品质和功能,马乳在辅助疾病治疗方面以及在食品行业中的应用有巨大的潜力,新疆马乳的生产大部分来自小规模饲养的牧民,难以控制生乳及其制品的质量[5]。目前,对乳蛋白质进行检测的主要方法有高效液相色谱法(HPLC),双向凝胶电泳(2-DE),层析分离(chromatography),非变性聚丙烯酰胺凝胶电泳(polyacrylamide gelelectrophoresis,PAGE),变性聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption-lonization time of flight mass spectrometry,MALDI-TOF-MS)等。国外学者多用蛋白质组学方法——电泳、多维液相色谱与质谱联用技术等,依据不同乳中的特征蛋白鉴别不同来源的乳制品,MIRANDA等[6]使用RP-HPLC,2-DE和MALDI-TOF-MS依据不同蛋白分子质量以及N端序列不同成功鉴别牛乳、马乳、人乳以及山羊乳中LYS,α-lg和β-lg。BESMA S等[4]利用HPLC,MALDI-TOF-MS等蛋白质组学技术识别驼科乳中酪蛋白及乳清蛋白等,并且依据不同物种乳中的乳清蛋白的分子质量及氨基酸序列鉴定驼科乳。YANG等[7]使用2-DE和MALDI-TOF-MS依据α-la,β-lg等不同蛋白质在2-DE胶图中所表现的不同斑点,以其作为分子标志检测牛乳掺伪的驼乳、山羊乳等。
本研究采用反相高效液相色谱法(RP-HPLC),基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)对马乳与牛、驼、酸马乳乳清中差异蛋白乳清蛋白进行检测,为监测新疆特色乳品质量以及优化产品加工方式提供技术理论基础。
1 材料和方法
1.1材料
马乳:选择新疆乌鲁木齐水西沟天然放牧的马匹,现场采集10匹泌乳母马的乳汁,混匀后使用冰盒带回实验室后立即离心,得到马乳乳清于-50 ℃冰箱保存备用。
1.2试剂
标准物质:溶菌酶(LYS)、牛源α-乳白蛋白(α-la)、牛源β-乳球蛋白(β-lg),纯度均≥90%,均购自sigma;乙腈(HPLC级),三氟乙酸(TFA)和其余试剂均为分析纯,α-氰基-4-羟基肉桂酸(CHCA),纯度99%,购自sigma;Mass Standards Kit for the 4700 Proteomics Analyzer(ABI)。
1.3仪器
高效液相色谱仪(LC-10ATvp),日本岛津;低温离心机(3K30) ,德国Sigma;超声波清洗仪(B3200S),美国BRANSON;超纯水仪(NW Ultra-pure Water System),香港heal force;改良砜复合膜(Biomax系列),美国Millipore;电子天平(AL104型),梅特勒-托利多仪器(上海)有限公司;超级恒温水浴锅(DKB-501A型),上海精宏实验设备有限公司;质谱仪4800 Plus MALDI TOF/TOFTM Analyzer ,ABI(Foster City)。
1.4实验条件
1.4.1 色谱条件
色谱柱:Kromasil 5u 100Å C4(150×4.6) mm;流动相:A液0.1% TFA水, B液0.09% TFA乙腈; 流速:1.0 mL/min;检测波长:215 nm;柱温:40 ℃;进样量:20 μL;外标法定量。采用梯度洗脱方式分离检测马乳乳清中的蛋白组分,梯度洗脱程序见表1。
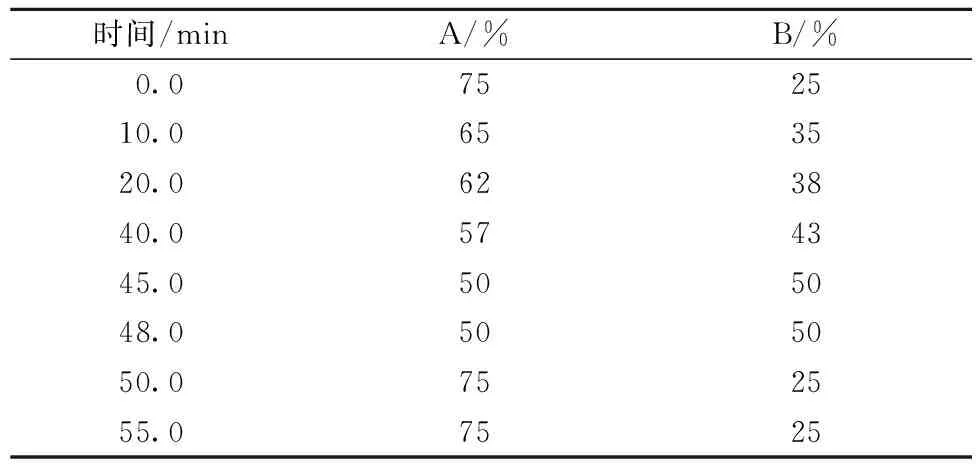
表1 梯度洗脱程序
注:A:A液0.1﹪TFA 水; B:B液0.09﹪TFA 乙腈。
1.4.2 质谱条件
样品靶:384 Opti-TOF 123 mm×81 mmss ,ABI;检测方式:正离子反射检测;基质:CHCA。
1.4.3 标准液制备
溶菌酶标准贮备液:准确称取溶菌酶标准品1.0 mg,用1 mL超纯水溶解。
用同样的方法制得质量浓度为1.0 g/L的α-la和β-lg标准贮备液。
1.4.4 样品处理
取马、牛、驼、酸马乳,4 ℃,12 000 r/min,离心30 min,去除上层乳脂和下层酪蛋白等沉淀,将得到的乳清二次离心,去除残余的少量乳脂和酪蛋白沉淀,取二次离心后的乳清1 mL,用超纯水稀释至2 mL,经0.45 μm微孔滤膜过滤后备用。
1.4.5 样品测定
将经过1.4.3样品处理的马乳乳清样品,按照1.4.1的色谱条件进行分析。
2 结果与讨论
2.1方法学考察
2.1.1 检测波长的选择
选用215 nm和280 nm检测波长对同一样品进行分析[8-9],目标蛋白(1:LYS ; 2:α-la; 3:β-lg) 在215 nm检测波长下有较高的响应(图1),确定215 nm为最佳检测波长。

A-215 nm; B-280 nm; 1-LYS; 2-α-la; 3-β-lg图1 不同检测波长下RP-HPLC测马乳乳清蛋白的色谱图Fig.1 Chromatography proles for mare whey protein by RP-HPLC, detected at 215 nm(A)and 280 nm(B)
2.1.2 梯度洗脱程序的选择
起始梯度洗脱程序为95%的A液,5%的B液,乳清蛋白几乎完全与固定键合相发生疏水作用。随着B液浓度不断提高(图2),逐步破坏蛋白与固定相之间的疏水作用,最终蛋白被一一洗脱下来。当浓度达到30%时开始有较大的峰(β-lg),直到浓度达到45%时不再有峰。可以确定25%~50%的B液可以将乳清蛋白中的组分完全洗脱。
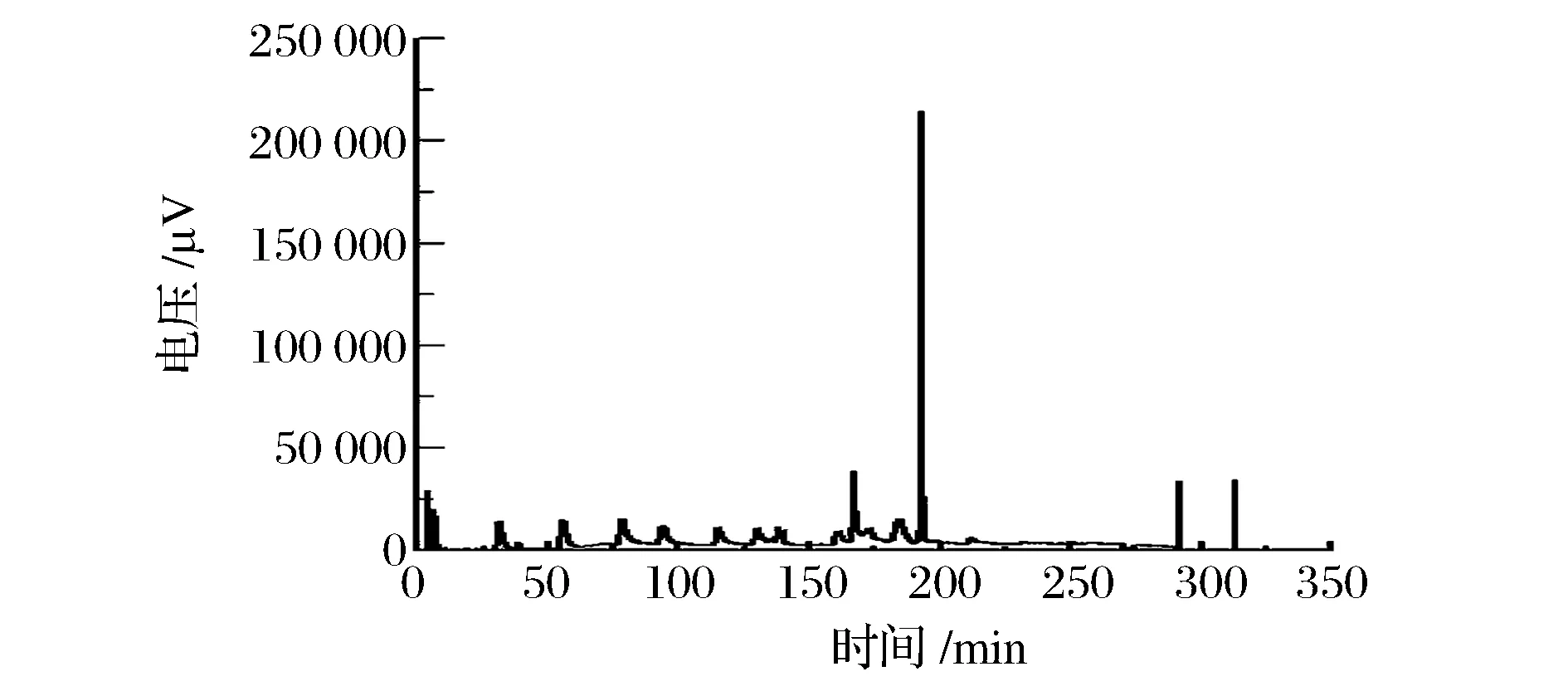
图2 不同B液浓度下马乳的洗脱色谱图Fig.2 RP-HPLC profile of clarified mare’s milk on a Kromasil C4 column
2.1.3 流速的选择
柱温为40 ℃,分别选用0.4、0.5、0.6、0.8、1.0 mL/min五个流速进行洗脱(图3)[10],随着流动相流速的增大,色谱峰的峰形变的尖锐对称,并且保留时间被大大缩短,峰的分离度增大,分离效果明显提高。由于流速对面积百分比的影响较小,因此流速不会影响最终各组分的定量结果。综合考虑,最终选择1.0 mL/min作为洗脱流速。
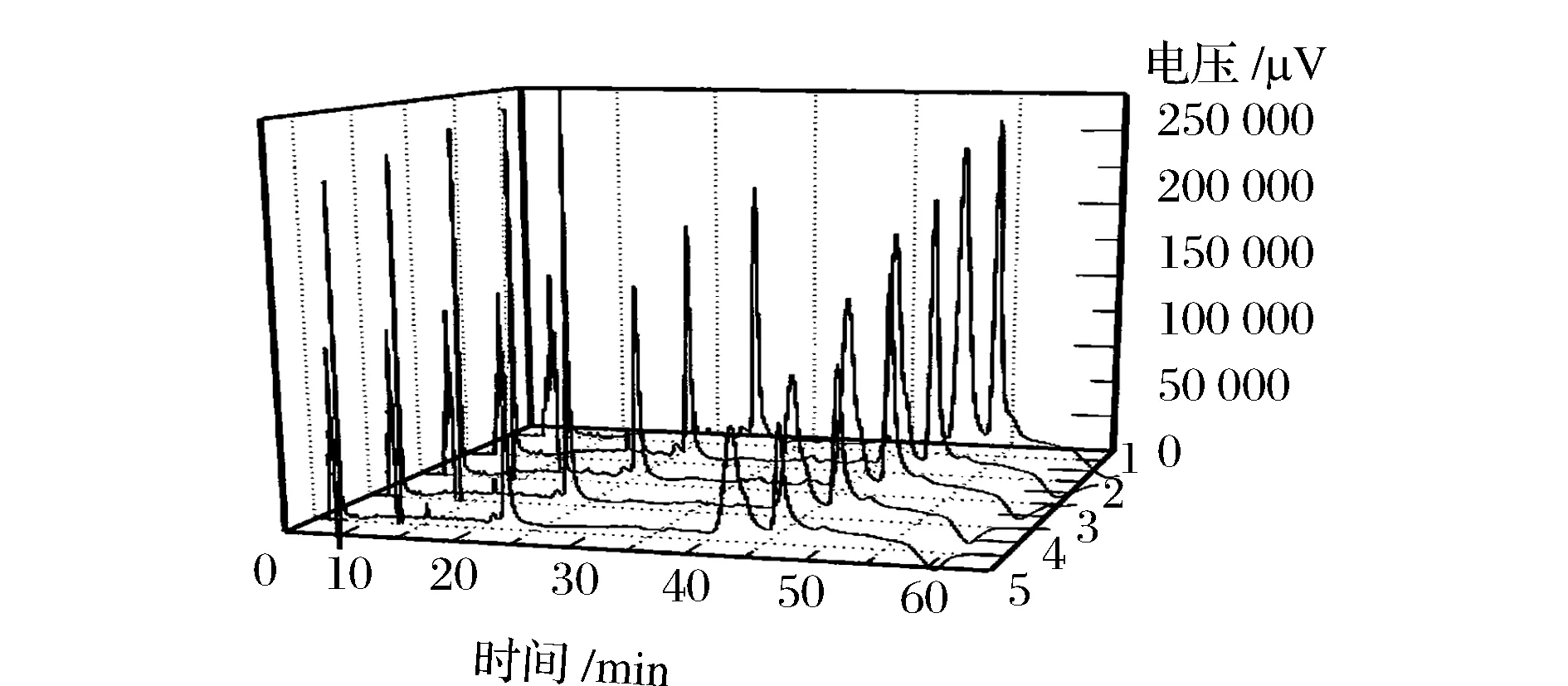
1-0.4 mL/min; 2-0.5 mL/min; 3-0.6 mL/min; 4-0.8 mL/min; 5-1.0 mL/min图3 不同流速对马乳清蛋白分离影响的色谱图Fig.3 Chromatography proles with different flow velocity
2.1.4 色谱柱柱温的选择
固定其他条件不变,选择不同温度进行恒定柱温洗脱(图4)[10],柱温升高,使色谱峰变得尖锐对称,实验结果中温度对3个大的组分峰的保留时间影响不明显,但随着柱温升高,LYS峰面积有减少的趋势,β-lg峰面积有增加的趋势,而α-la峰面积随着柱温的升高几乎不变。综合考虑LYS,α-lg和β-lg三种蛋白的最佳峰面积,选择40 ℃作为最终检测柱温。
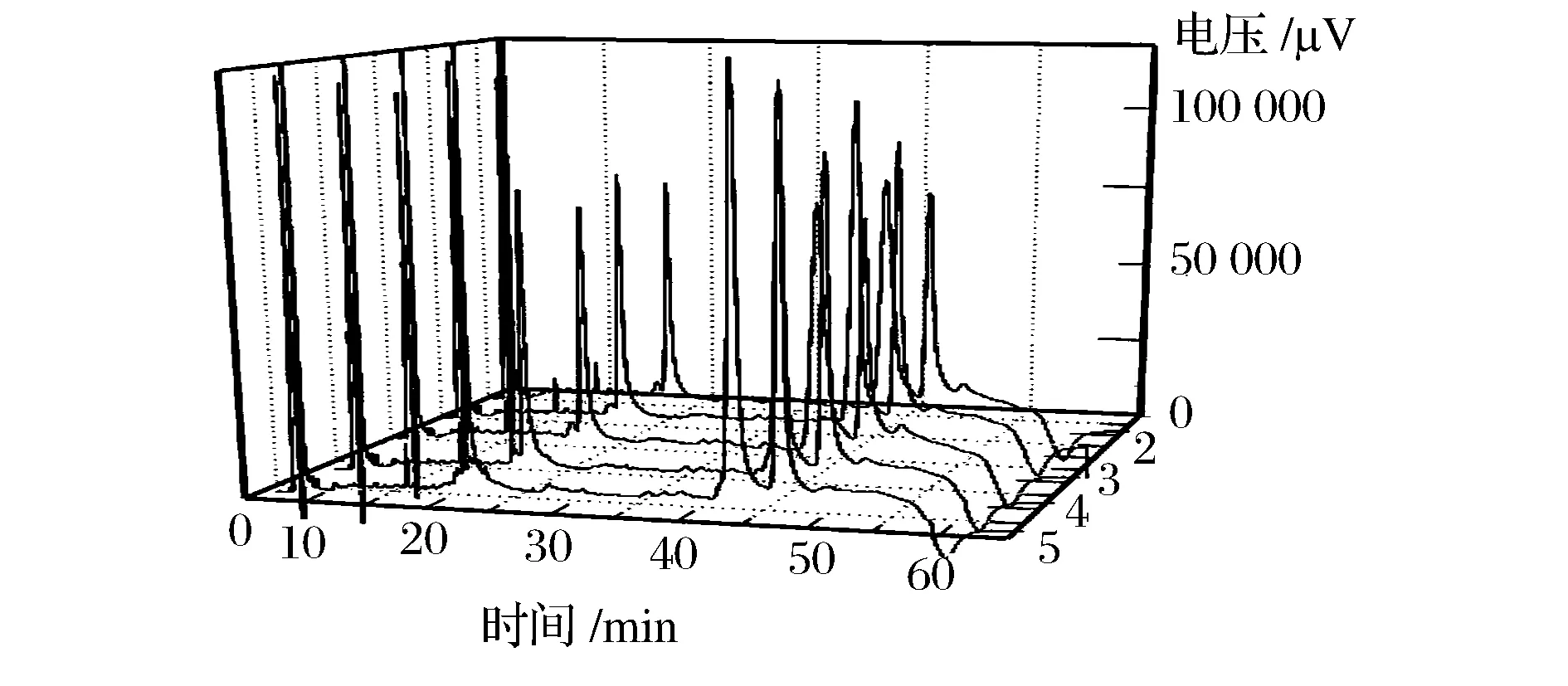
1-30 ℃; 2-35 ℃; 3-40 ℃; 4-45 ℃; 5-50 ℃图4 不同温度对马乳清蛋白分离影响的色谱图Fig.4 Chromatography proles with differentcolumn temperature
2.2分析方法的性能指标
2.2.1 线性范围
取LYS,α-la和β-lg标准贮备液,分别稀释成质量浓度为0.2、0.4、0.6、0.8、1.0 g/L,0.2、0.4、0.5、0.6、0.8 g/L及0.2、0.4、0.6、0.8、1.0 g/L的标准系列溶液。按1.4.1色谱条件分析(图3)。以标准品质量浓度为横坐标(X),标准品峰面积为纵坐标(Y),绘制标准曲线。本方法LYS,α-la和β-lg分别在(0.2~1.0)、(0.2~0.8)和(0.2~1.0) g/L的质量浓度范围内线性关系良好,检出限分别为0.59、7.3和8.7 mg/L,满足检测要求(表2)。
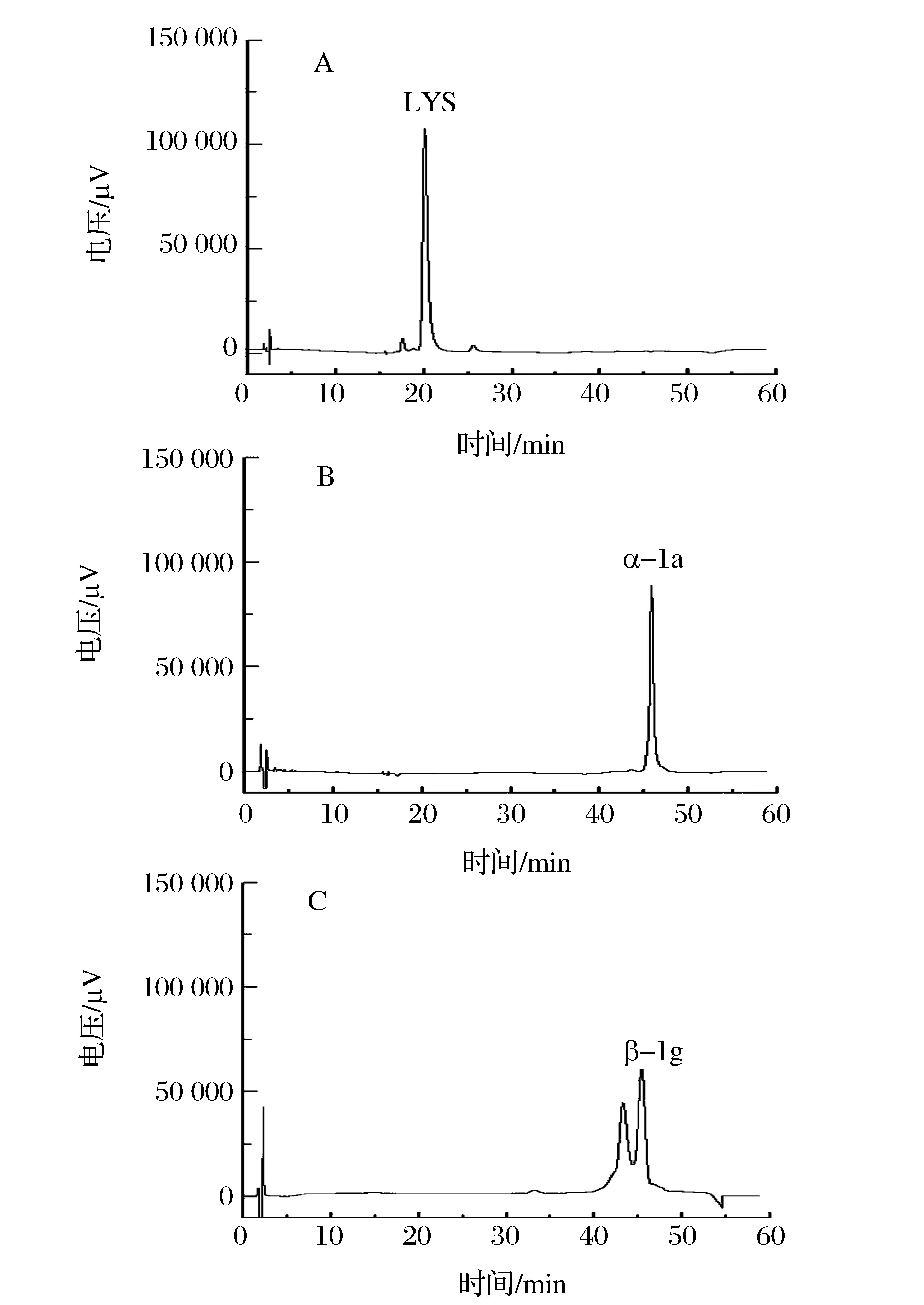
A-LYS标品; B-α-la标品; C-β-lg标品图5 LYS(A),α-la(B) 和β-lg (C)标准品的色谱图Fig.5 Chromatography proles of LYS(A),α-la(B) and β-lg (C) standards

名称线性回归方程相关系数(R2)线性范围/(g·L-1)检出限/(g·L-1)LYSy=17735884.7x-105401.10.99930.2~1.00.00059α-lay=7500107.8x-156482.00.99690.2~0.80.0073β-lgy=6852159.5x-321581.80.99030.2~1.00.0087
2.2.2 精密度实验
取经1.4.3样品处理后的待测样品,按1.4.1的色谱条件,在同1天连续进样3次,分别求得LYS、α-la和β-lg各组分的色谱峰面积的平均值,以相对标准偏差RSD表示精密度(表3)。本法相对标准偏差(RSD)分别为3.26%、0.97%和1.73%<5.00%,可知此实验方法的精密度良好。
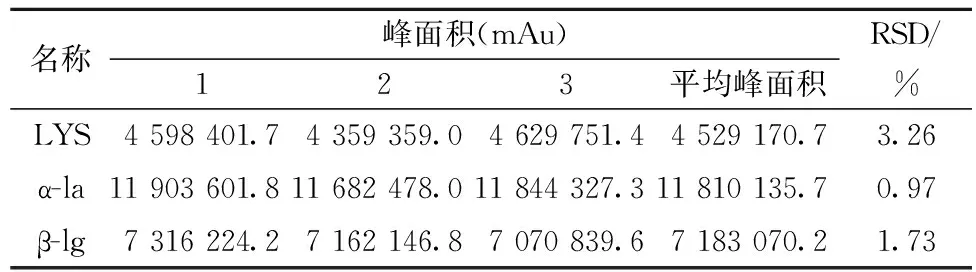
表3 方法精密度
2.2.3 稳定性实验
取同一待测样品,在检测过程中的24 h内分别在0、8、16 h进样1次,得到LYS、α-la和β-lg各组分的色谱峰面积的平均值,以其RSD值表示天内稳定性(表4)。用上述待测样品在第2天、第3天重复进样,得到LYS、α-la和β-lg各组分的色谱峰面积的平均值,以其RSD值表示天间稳定性(表4)。相对标准偏差RSD值均小于5%,可知该方法稳定性良好。
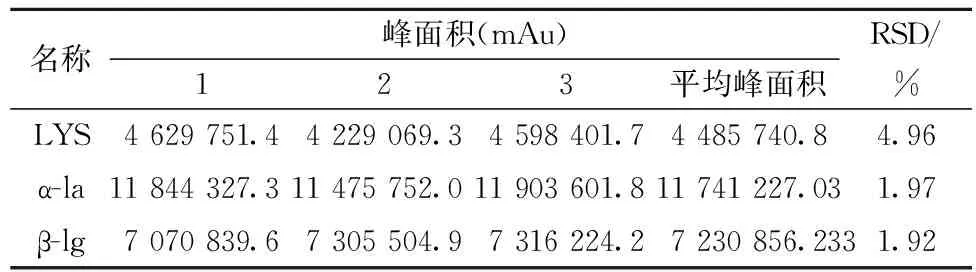
表4 方法稳定性
2.2.4 重现性实验
同一个待测样品分3等份,按照1.4.3的样品处理方法处理,1.4.1的色谱条件,分别进样,得到LYS、α-la和β-lg各组分的色谱峰面积的平均值(表5)。并计算3个组分的相对标准偏差(RSD)分别为2.74%、2.17%和2.37%<5.00%,可知该方法重现性良好。
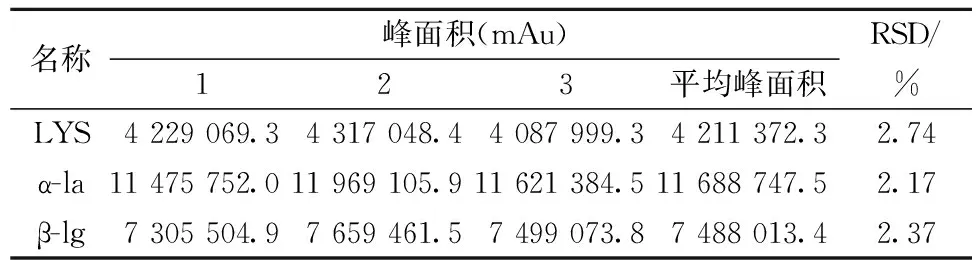
表5 方法重现性
2.2.5 回收率实验
取同一个待测样品共六份,其中3份测本底值,其余3份添加一定量的标准品。由于LYS、α-la和β-lg标准品分别来自蛋清、人乳及牛乳,与马乳中相应组分存在差异,组分保留时间有偏差,因此认为加标测回收率的的样品本底值为0。此方法测得的回收率均在86%以上(表6)。

表6 RP-HPLC法加标回收率实验结果
2.3样品中LYS、α-la和β-lg含量的测定
SILVIA VINCENZETTI等[11]曾指出,马科乳乳清中的高丰度蛋白组分为LYS、α-la和β-lg,且利用反相C4柱对驴乳乳清分析所得的3个大量组分峰分别为LYS、α-la和β-lg。因此结合上述文献记载及标准品的保留时间、出峰前后顺序,最终确定图1-A中马乳乳清在反相C4柱中所表现出的1、2、33个大量组分峰分别为LYS、α-la及β-lg。
选择4个不同待测马乳样品,分别测定LYS、α-la和β-lg的含量,结果见表7。由表7可知,马乳乳清中LYS、α-la和β-lg的平均含量分别为(0.52±0.06)、(3.38±0.32)及(2.64±0.37) g/L。
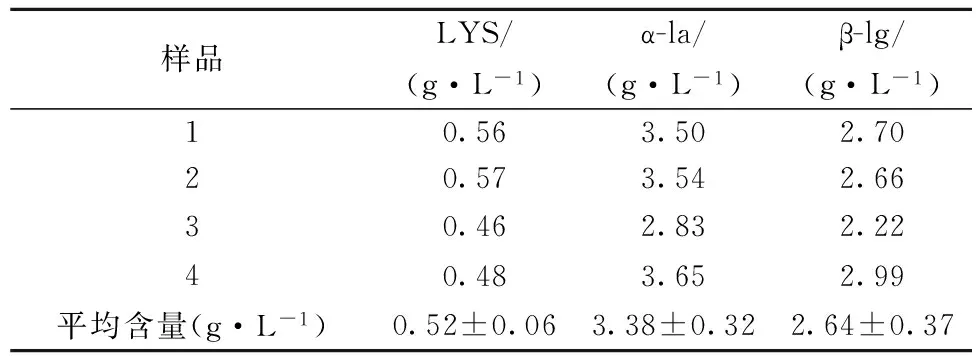
表7 样品乳中LYS、α-la和β-lg的含量
2.4不同家畜乳品乳清蛋白的比较
对马乳与酸马乳、驴乳、驼乳、牛乳中乳清蛋白样品在相同处理条件和色谱条件下进行分析检测,发现不同家畜乳清蛋白在反相C4柱上色谱行为差异显著,表现出蛋白质多态性(见图6)这与乳清蛋白组分的细微结构变化有关。马乳与酸马乳(图6中的1、图6中的2)均存在保留时间为10、17、38及42 min的蛋白峰,驴与马亲缘关系相近,驴乳(图6中的4)含有在马乳中也出现的保留时间为17、38及42 min的蛋白峰,与马乳相比缺少保留时间为10 min的特征峰;驼乳只有一个保留时间为25 min的特征峰(图6中的5),在此保留时间马、驴、牛乳清均无峰出现;牛乳(图6中的3)的2个特征峰保留时间为39与45 min,在45 min处马、驴、驼乳清均无峰出现。这种差异对乳的鉴别具有重要意义。
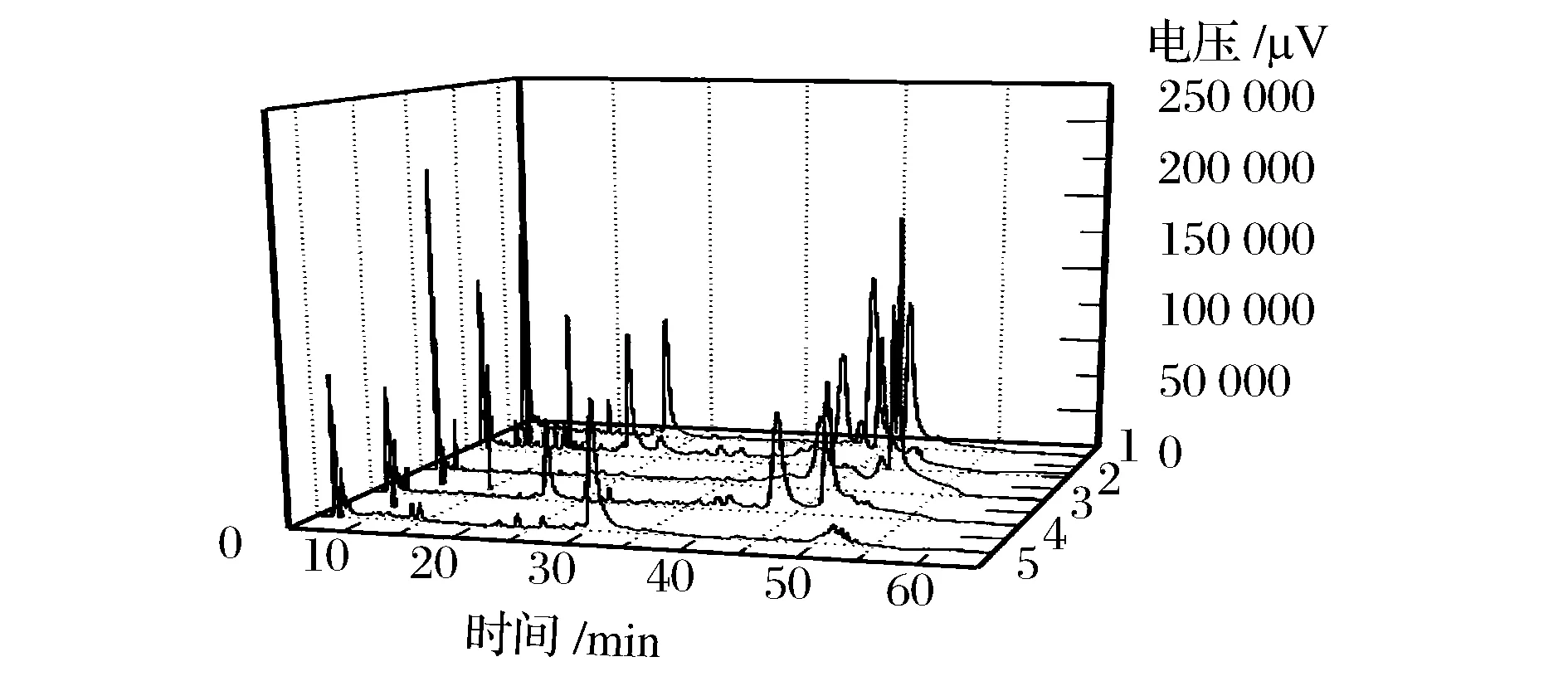
1-马乳;2-酸马乳;3-牛乳;4-驴乳;5-驼乳图6 不同来源乳品乳清蛋白的色谱图Fig.6 Chromatography proles of whey protein from different sources
2.5马乳及驼乳乳清蛋白中差异蛋白的质谱鉴定
由于缺乏马乳及驼乳乳清蛋白组分标准品,所以实验中图5为来源于牛乳的LYS、α-la和β-lg标准品的色谱图,蛋白质的来源不同因此它们在C4色谱柱上所表现出的保留时间有所差异。为更进一步确认马乳乳清蛋白在C4色谱柱分离的3个特征组分分别为LYS、α-la和β-lg,以及探究驼乳乳清蛋白在C4色谱柱分离的蛋白是何组分,对马乳和驼乳乳清蛋白组分进行回收浓缩,并进行MALDI-TOF质谱分析。分析结果经数据库检索和人工比对(表8),马乳乳清蛋白(图6中的1)的3个特异蛋白(17、38、42 min)为前文中推测的LYS、α-la和β-lg,但这3个蛋白组分与来源于蛋清的LYS和牛乳的α-la和β-lg保留时间有所偏差,其中主要原因就是来源于不同物种所致。驼乳乳清蛋白25 min的蛋白被鉴定为α-la,与马乳、牛乳乳清蛋白具有很大的差异,原因可能是驼乳来源的α-la的蛋白结构与来源于马乳、牛乳的差别较大,所以在C4色谱柱上表现出保留时间的差异明显。

表8 质谱鉴定驼乳、马乳WP中蛋白信息
3 结论
通过对RP-HPLC方法的考察,表明应用RP-HPLC法检测马乳乳清中LYS,α-lg和β-lg的方法是可行的。该方法前处理过程简单,3种蛋白在(0.2~1.0) g/L质量浓度范围内线性关系良好、精密度高、准确性好,适合进行较大样本量的样品分析检测。在马乳、酸马乳、驴乳、驼乳、牛乳中乳清蛋白的分析中发现,不同物种来源乳品在反相C4柱上表现蛋白质多态性,可作为乳品掺伪检测的依据。对马乳和驼乳乳清蛋白特征蛋白组分进行回收浓缩,并进行Maldi-TOF-TOF质谱鉴定,分析结果经数据库检索和人工比对,结果表明马乳乳清蛋白的3个蛋白(17、38、42 min)为前文中推测的LYS、α-la和β-lg,这3个蛋白组分与来源于蛋清的LYS和牛乳的α-la和β-lg的保留时间有所偏差。驼乳乳清蛋白25 min的蛋白被鉴定为α-la,这与马乳、牛乳乳清蛋白具有很大的差异,原因可能是驼乳来源的α-la的蛋白结构与来源于马乳、牛乳的差别较大,所以在C4色谱柱上表现出保留时间的差异明显。
[2] STUPARU A A, STRUGARIU C E, OROIAN T.Pharmaceuticals and dietary supplements extracted from mare's milk[J].Bulletin of the University of Agricultural Sciences & Veterinary ,2016,73(1):2-10.
[4] SAADAOUI B, BIANCHI L, HENRY C, et al.Combining proteomic tools to characterize the protein fraction of llama (Lamaglama) milk[J].Electrophoresis, 2014,35(10):1 406-1 418.
[5] 魏晓敏.乳与乳制品掺伪鉴别和检验技术[J].黑龙江科技信息, 2016(6): 124.
[6] MIRANDA G, MAHE M F, LEROUX, et al.Proteomic tools to characterize the protein fraction of Equidae milk[J].Proteomics,2004(4):2 496-2 509.
[7] YANG Y, ZHENG N, YANG J, et al.Animal species milk identification by comparison of two-dimensional gel map profile and mass spectrometry approach[J].International Dairy Journal,2014,35(1):15-20.
[8] WANG J,ZHANG Q H,WANG Z H,et al.Determination of major bovine milk proteins by reversed phase high performance liquid chromatography[J].Chinese Journal of Analytical Chemistry, 2009,37(11):1 667-1 670.
[9] VINCENZETTI S, POLIDORI P,MARIANI P,et al.Donkey’s milk protein fractions characterization[J].Food Chemistry,2008,106(2):640-649.
[10] 师治贤,王俊德.生物大分子的液相色谱分离和制备[M].北京:科学出版社,1992:113-116.
[11] THERESE UNIACKE-LOWE, THOM HUPPERTZ, PATRICK F FOX.Equine milk proteins: Chemistry, structure and nutritional signicance[J].International Dairy Journal, 2010, 20:609-629.
[12] FERREIRA IMPLVO, CAÇOTE H.Detection and quantification of bovine, ovine and caprine milk percentages in protected denomination of origin cheeses by reversed-phase high-performance liquid chromatography of beta-lactoglobulins[J].Journal of Chromatography A, 2003,1015(1/2):111-118.
[13] CZERWENKA C, MÜLLER L, LINDNER W.Detection of the adulteration of water buffalo milk and mozzarella with cow’s milk by liquid chromatography-mass spectrometry analysis of β-lactoglobulin variants[J].Food Chemistry, 2010,122(3):901-908.
[14] ENNE G, ELEZ D, FONDRINI F, et al.High-performance liquid chromatography of governing liquid to detect illegal bovine milk's addition in water buffalo Mozzarella: Comparison with results from raw milk and cheese matrix[J].Journal of Chromatography A ,2005,1 094(1/2):169-174.
[15] FELFOUL I, JARDIN J, GAUCHERON F, et al.Proteomic profiling of camel and cow milk proteins under heat treatment[J].Food Chemistry,2016, 216:161-169.
[16] FARAH Z.Effect of heat treatment on whey proteins of camel milk[J].Milchwissenschaft-milk Science International, 1986, 41(12): 763-765.
[17] HURLEY I P, COLEMAN R C, IRELAND H E, et al.Measurement of bovine IgG by indirect competitive ELISA as a means of detecting milk adulteration[J].Journal of Dairy Science, 2004,87(3):543-549.
[18] ELAGAMY E I.Effect of heat treatment on camel milk proteins with respect to antimicrobial factors: a comparison with cows’ and buffalo milk proteins[J].Food Chemistry, 2000,68(2): 227-232.
Determinationofwheyproteinsinmaremilkbyreversed-phase
high-performanceliquidchromatography
LI Min-jing, YANG Jie*, YANG Ying-chun, WANG Hong-juan, LYU Yue-wen, SHEN Tong, LIU Jun, Alimujiang·ABUDULA
(College of Life Sciences, Xinjiang University,Urumqi 830049,China)
Whey protein are the main protein in mare milk,but are different in protein composition among different species. In this paper, reserved-phase high-performance liquid chromatography (RP-HPLC) was used to isolate and quantify proteins in mare whey, the main components were identified by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry (MALDI-TOF-MS). The result showed that LYS, α-Ig and β-Ig are the primary components in mare whey proteins. The linear relation of LYS , α-Ig and β-Ig are in the range of 0.1-1.0 (R2=0.999 3) 0.2-0.8 (R2=0.996 9) and 0.2-1.0 μg/L(R2=0.990 3), respectively. The relative standard deviations (RSDs) value of precision and reproducibility tests were all less than 5%, and the spike recovery was in the range of 88.05%-96.26%, 86.03%-95.70% and 91.79%-100.97%, respectively. The concentration of LYS, α-lg and β-lg in mare milk were (0.52±0.06)、(3.38±0.32) and (2.64±0.37) μg/L, respectively.
reversed-phase high-performance liquid chromatography (RP-HPLC); mare milk; lysozyme; α-lactalbumin;β-lactoglobulin
硕士研究生(杨洁教授为通讯作者,E-mail:xindayangjie@sina.com)。
国家自然科学基金(31471645)
2016-11-21,改回日期:2017-03-10
10.13995/j.cnki.11-1802/ts.013452
