大豆β-淀粉酶基因在毕赤酵母中的高密度发酵表达
2017-11-03许黎明成春燕韦星明莫祺晖卢汉浪杨祥开
许黎明,成春燕,韦星明,莫祺晖,卢汉浪,杨祥开
(广西科学院 生物研究所,广西 南宁,530007)
大豆β-淀粉酶基因在毕赤酵母中的高密度发酵表达
许黎明*,成春燕,韦星明,莫祺晖,卢汉浪,杨祥开
(广西科学院 生物研究所,广西 南宁,530007)
大豆β-淀粉酶在麦芽糖浆生产上具有应用优势。该研究应用毕赤酵母表达系统异源表达大豆β-淀粉酶,并对重组酶的酶学性质进行了分析,结果显示,其酶学性质没有改变。为了增强重组β-淀粉酶的表达,采用甲醇/山梨醇混合碳源诱导的毕赤酵母表达策略,10 L发酵罐发酵表达的重组β-淀粉酶酶活力为310 U/mL,比单一甲醇诱导提高了36%。研究结果表明,发酵条件优化对提高异源β-淀粉酶在毕赤酵母中的表达有重要参考价值。
β-淀粉酶;毕赤酵母;异源表达;酶学性质;山梨醇
β-淀粉酶(EC3.2.1.2)是外切淀粉酶,其水解直链淀粉产物主要是麦芽糖,水解支链淀粉产物为麦芽糖和β-极限糊精,在啤酒酿造、糖浆制造、纺织和医疗中有重要应用[1-6]。淀粉糖工业中一般将β-淀粉酶或α-淀粉酶与普鲁兰酶联用生产麦芽糖浆,糖化过程中糖化液pH值的下降会影响麦芽糖产量,尽管通过提高糖化温度可以缓解这一问题,但这势必影响β-淀粉酶的稳定性。植物β-淀粉酶在酶活、热稳定性、pH作用范围等方面比微生物β-淀粉酶更具工业生产适应性,目前商品化的β-淀粉酶主要来自大豆、大麦和小麦等,其中大豆β-淀粉酶相比大麦β-淀粉酶对低pH值和高温有更好的耐受性,更适于高麦芽糖的工业生产[7-9]。大豆β-淀粉酶主要通过提取获得,制备过程要消耗大量粮食,成本偏高。与之相比,微生物发酵更有利于酶的大规模工业化生产。大肠杆菌(Escherichiacoli)表达系统和毕赤酵母(Pichiapastoris)表达系统常用于异源蛋白的表达,目前大豆β-淀粉酶在大肠杆菌中已获得了活性表达,但酶活力低,仅为19.61 U/mL,热稳定性较天然大豆β-淀粉酶有所下降,而大豆β-淀粉酶在酵母菌中的表达鲜见报道[10-13]。毕赤酵母具有生长快,易于高密度发酵等优点,而且作为外源蛋白表达系统,还具有真核细胞的翻译后修饰加工功能[14-15],利用其表达的重组大麦β-淀粉酶的酶学性质与天然大麦β-淀粉酶一致[12],表明毕赤酵母特别适用于植物β-淀粉酶基因的表达。毕赤酵母中醇氧化酶1(Alcohol oxidase,AOX1)启动子是一个强启动子,已成功应用于数百种外源蛋白的表达[16-17]。在以甲醇为唯一碳源的诱导表达阶段,毕赤酵母菌体生长与外源基因表达共同竞争碳源,增加了代谢负担,而且高浓度的甲醇会毒害菌体细胞,导致表达效率降低[18-19]。因此,毕赤酵母的高密度发酵可考虑采用混合碳源补料策略,一是补充碳源不足,二是避免甲醇毒害,以提高表达效率。在混合碳源补料策略中,山梨醇是高密度发酵常用辅助碳源,对AOX1的转录抑制较弱,另外还可降低发酵过程中毒性产物的积累,减缓分泌蛋白的胞外降解[20-21]。
基于以上分析,本研究利用毕赤酵母表达系统异源表达大豆β-淀粉酶,构建大豆β-淀粉酶重组菌,分析重组菌的表达特性和重组酶的酶学性质,在此基础上,结合过程工艺的优化,采用甲醇/山梨醇混合碳源补料诱导方式进行高密度发酵表达,提高大豆β-淀粉酶基因在毕赤酵母表达系统中的表达效率。
1 材料与方法
1.1材料
1.1.1 菌株和质粒
P.pastorisGS115和E.coliDH5α菌株为本实验室保存。质粒pPIC9K购自Invitrogen公司,质粒pGEM-SBA为本实验室前期构建保存,含大豆β-淀粉酶(Soybean β-Amylase,SBA)编码基因。
1.1.2 引物
实验所用的引物见表1,由深圳华大基因科技服务有限公司合成。

表1 引物
注:下划线标记的是克隆位点。
1.1.3 主要试剂
DNA限制性内切酶、连接酶、聚合酶和DNA分子参照为Thermo Scientific Fermentas公司产品;质粒提取试剂盒、DNA纯化试剂盒为OMEGA Bio-Tek公司产品。
1.1.4 培养基
实验所需培养基及其配制方法参考Invitrogen公司的《毕赤酵母表达操作手册》。高密度发酵基础培养基BSM和微量元素溶液PTM1配制方法参见文献[22]。
1.2方法
实验的常规分子生物学操作参照《分子克隆实验指南》(第三版)进行。
1.2.1 β-淀粉酶的提取和纯化
采用酸性水提法[13]提取大豆β-淀粉酶。提取的粗酶液经pH6.0磷酸缓冲液稀释后,用AKTA蛋白纯化系统进行分离纯化,凝胶色谱柱为Superdex G75。
1.2.2 β-淀粉酶重组质粒的构建
以pGEM-SBA质粒DNA为模板,SBA-F1/SBA-R1为引物,PCR扩增β-淀粉酶基因。将扩增基因与pPIC9K进行酶切,连接,构建β-淀粉酶重组质粒。酶切位点为EcoR I和NotI。
1.2.3 高拷贝重组毕赤酵母的构建
提取β-淀粉酶重组质粒DNA,用SalI酶进行酶切线性化处理,电转化P.pastorisGS115感受态细胞。取转化液涂布MD平板,30 ℃培养转化子。转化子长出后筛选His+表型和筛选高拷贝转化子。高拷贝转化子筛选的遗传霉素(G418)质量浓度梯度为0.25、0.5、0.75、1.0、1.5、2.0、3.0、4.0 mg/mL。
1.2.4 重组毕赤酵母的诱导表达
淀粉酶酶活力定性检测:将待测重组酵母接种于YPD液体培养基中培养至同一生长周期,取2 μL菌液接种至含适量浓度淀粉的YPD平板,30 ℃培养2~3 d,用I2-IK染色观察淀粉水解圈,以菌株生长状态的优劣和淀粉水解圈的大小为评判,筛选酶活力高的重组菌进行后续诱导表达实验。
将重组酵母接种于BMGY培养基中,30 ℃、170 r/min下培养24 h(OD600≈6.0),转入BMMY培养基中诱导表达。甲醇诱导浓度为0.5%,每24 h补加1次甲醇。诱导发酵6 d后离心收集上清,-20 ℃保存备用。实验设P.pastorisGS115/pPIC9K为对照。
1.2.5 重组β-淀粉酶的纯化
重组β-淀粉酶设计有组氨酸标签(His-tag),可用镍柱亲和层析纯化。
1.2.6 重组β-淀粉酶酶学性质的测定
实验采用纯化的重组β-淀粉酶和天然β-淀粉酶进行酶学性质分析。天然β-淀粉酶从相同来源大豆品种中分离提纯,该酶定义为原始β-淀粉酶。
(1)β-淀粉酶酶活力的测定。采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定β-淀粉酶酶活力。酶活力单位(U/mL)定义为:1 mL酶液在pH 6.5、60 ℃的条件下,1 h水解可溶性淀粉产生1 mg麦芽糖即为1个酶活力单位。
(2)最适反应温度测定。分别测定50、55、60、65、70 ℃温度条件下的β-淀粉酶酶活力,设酶活力最高者为100%,以此计算其他温度条件下的相对酶活力。实验以原始β-淀粉酶为对照。
(3)最适作用pH值的测定。采用20 mmol/L磷酸氢二钠-柠檬酸缓冲液,分别测定pH 3.0、4.0、5.0、6.0、7.0、8.0条件下的β-淀粉酶酶活力,设酶活力最高者为100%,以此计算其他pH值条件下的相对酶活力。实验以原始β-淀粉酶为对照。
(4)酶反应稳定性的测定。将β-淀粉酶置于最适反应温度和最适反应pH条件下保温8 h,每隔1 h取样,冰上静置10 min后测定酶活力,设初始反应酶活力为100%,以此计算剩余酶活力。实验以原始β-淀粉酶为对照。
1.2.7 补料高密度发酵表达
种子液按10%接种量接入10 L全自动发酵罐中。以氨水和磷酸溶液控制pH值为6.0,控制温度30 ℃,调节转速和通气量维持DO在30%以上。当甘油耗尽,DO上升后(DO>60%),开始流加含有1.2% PTM1的50%甘油。当菌体达到一定浓度后(OD600≈200),停止补料。待甘油再次耗尽,继续保持基质匮乏状态1 h(DO>60%)后,开始流加含1.2% PTM1的甲醇或者甲醇与山梨醇按20∶1质量比混合的诱导培养基,并且把温度降低至22 ℃诱导表达,调节转速和通气量,维持DO在10%以上。从发酵开始每隔12 h取样,测定上清液酶活。
2 结果与分析
2.1大豆β-淀粉酶基因的克隆与表达
将PCR扩增的大豆β-淀粉酶基因克隆至pPIC9K,构建得到重组质粒pPIC9K-SBA,电转化P.pastorisGS115,经营养互补筛选,得到重组酵母P.pastorisGS115/pPIC9K-SBA。pPIC9K-SBA的EcoR I和NotI双酶切验证电泳结果见图1A,pPIC9K-SBA有9.3 kb的载体条带和1.5 kb的目的基因条带,对照pPIC9K仅有9.3 kb的载体条带。P.pastorisGS115/pPIC9K-SBA的PCR验证电泳结果见图1B,P.pastorisGS115/pPIC9K-SBA有1.5 kb的目的基因扩增条带,对照P.pastorisGS115/pPIC9K没有扩增条带。结果说明大豆β-淀粉酶重组毕赤酵母P.pastorisGS115/pPIC9K-SBA构建成功。
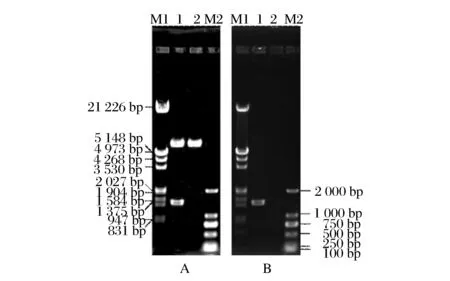
A:M1-Lambda DNA EcoR I+Hind Ⅲ Marker 3 DNA 分子量标准;1-质粒pPIC9K-SBA;2-质粒pPIC9K;M2-DL2000 DNA 分子量标准;B:M1-Lambda DNA EcoR I +Hind Ⅲ Marker 3 DNA 分子量标准;1-菌株P. Pastoris GS115/pPIC9K-SBA;2-菌株P. Pastoris GS115/pPIC9K;M2-DL2000 DNA 分子量标准图1 质粒pPIC9K-SBA和菌株P. pastoris GS115/pPIC9K-SBA 的构建和验证Fig.1 Construction and verification of the plasmid pPIC9K-SBA and strain P. pastoris GS115/pPIC9K-SBA
G418平板抗性筛选高拷贝重组酵母P.pastorisGS115/pPIC9K-SBA转化子的结果如图2所示。当G418质量浓度为0 mg/mL时,所有转化子生长正常,G418质量浓度升至2 mg/mL以上时,部分转化子能够生长,当G418质量浓度升至4 mg/mL时,仅有2个转化子表现出生长优势,分别标记为P.pastorisGS115/pPIC9K-SBA-1(简称1#)和P.pastorisGS115/pPIC9K-SBA-2(简称2#)。后续将这2株菌用于摇瓶发酵表达。

图2 高产β-淀粉酶转化子的G418质量浓度梯度筛选Fig.2 Selection of high β-amylase activity producing transformants on G418 concentration gradient plate
P.pastorisGS115/pPIC9K-SBA淀粉酶酶活力定性检测结果如图3A所示。1#和2#的菌落大小相近,但1#的淀粉水解圈明显比2#大,淀粉水解圈的大小,在一定程度上反映了菌株淀粉酶酶活力的大小。P.pastorisGS115/pPIC9K-SBA摇瓶发酵结束后,发酵上清液经等体积超滤纯化处理后作SDS-PAGE电泳分析,电泳结果如图3B所示,1#和2#表达的重组β-淀粉酶分子量大小约为56 kDa, 1#的目的条带浓度比2#高。发酵上清液经酶活力检测,1#菌株重组β-淀粉酶酶活力为53 U/mL,2#菌株为19 U/mL。
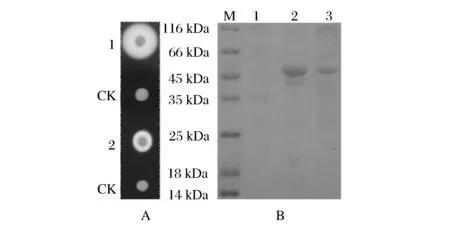
A:1-菌株P. Pastoris GS115/pPIC9K-SBA-1;2-菌株P. Pastoris GS115/pPIC9K-SBA-2;CK-菌株P. Pastoris GS115/pPIC9K; B:M-蛋白质分子量标准;1-菌株P. Pastoris GS115/pPIC9K;2-菌株P. Pastoris GS115/pPIC9K-SBA-1;3-菌株GS115/pPIC9K-SBA-2图3 重组β-淀粉酶的验证Fig.3 Verification of the recombinant β-amylase
结果表明,构建的P.pastorisGS115/pPIC9K-SBA成功分泌表达活性β-淀粉酶蛋白,并且1#菌株的酶表达能力强于2#菌株,适用于下一步发酵实验。
2.2重组酶的酶学性质
2.2.1 最适反应温度
重组β-淀粉酶的最适反应温度测定结果见图4A。在pH 6.5条件下,重组酶酶活力在50~60 ℃时较高,而且随温度升高而升高,60 ℃时达到最高,高于60 ℃酶活力下降,在70 ℃时相对酶活力为(25.67±0.04)%;原始酶的温度反应变化趋势与重组酶相似,60 ℃时酶活力最高,低于60 ℃时酶活力随温度升高而升高,高于60 ℃时酶活力下降,70 ℃时相对酶活力降至(30.33±0.02)%。实验结果表明,重组酶和原始酶的最适反应温度是60 ℃。
2.2.2 最适作用pH值
重组β-淀粉酶的最适作用pH值测定结果见图4B。在60 ℃反应条件下,重组酶酶活力在pH 3.0~6.0之间呈上升趋势,pH 6.0时为最高酶活力,pH值大于6.0后酶活力明显下降;原始酶的pH反应变化趋势与重组酶相似,pH 6.0时达到最高酶活力,pH 3.0~6.0时酶活力逐渐升高,pH值高于6.0时酶活力下降。实验结果表明,重组酶和原始酶的最适作用pH值为6.0。
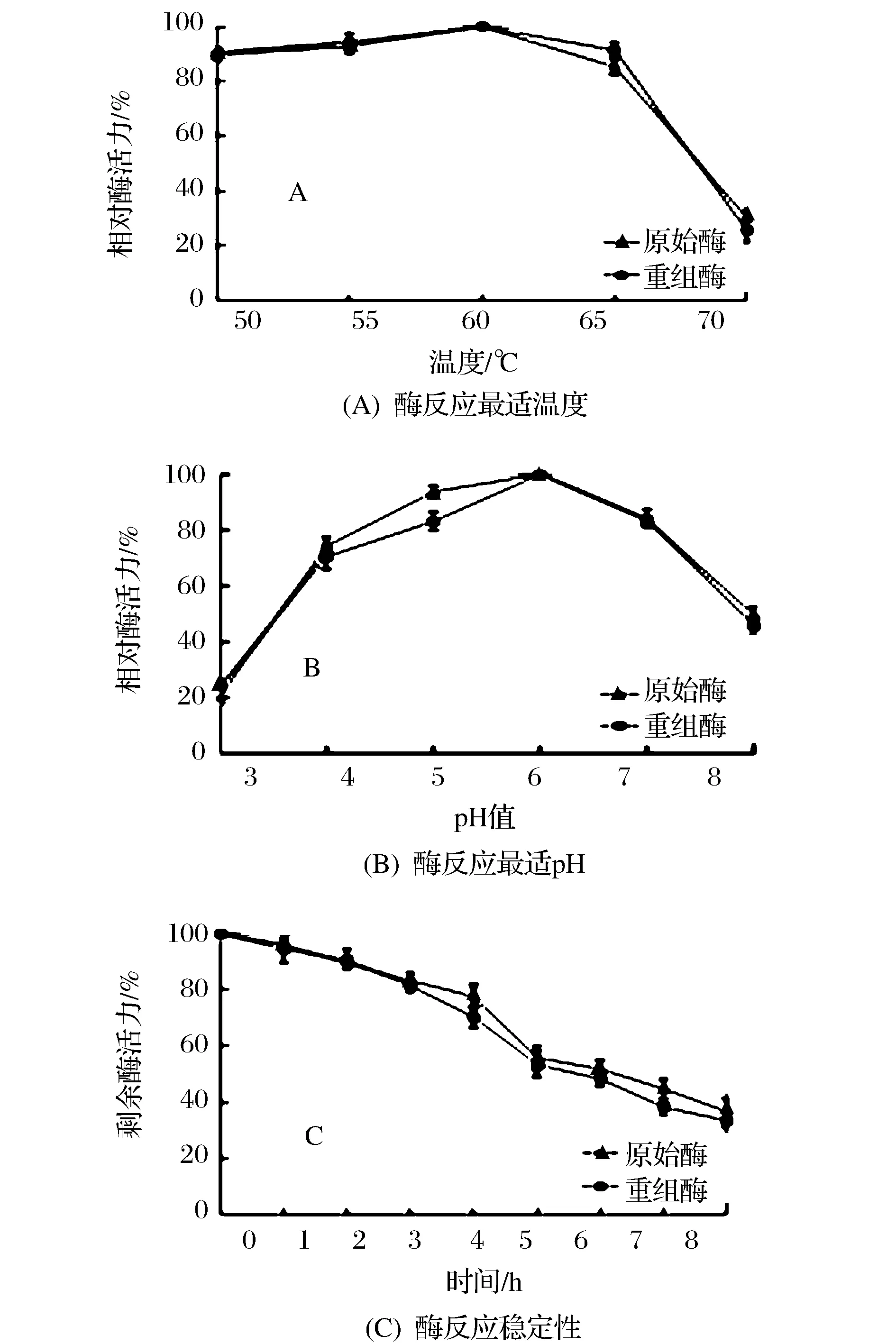
图4 重组酶与原始酶的酶学性质比较分析Fig.4 Comparative analysis of enzymatic properties between recombinant β-amylase and purified β-amylase
2.2.3 酶反应稳定性
重组β-淀粉酶的反应稳定性见图4C。在最适反应温度和最适作用pH条件下温育反应6 h后,重组酶剩余酶活力为(48.33±0.03)%,原始酶剩余酶活力为(51.67±0.03)%。重组酶和原始酶的剩余酶活力无显著差异(p>0.05),二者的酶活半衰期约为6 h。
2.3补料高密度发酵表达β-淀粉酶
取P.pastorisGS115/pPIC9K-SBA-1菌株进行高密度发酵,以单一甲醇碳源流加方式为实验对照,采用甲醇/山梨醇混合碳源流加方式进行10 L发酵罐补料高密度发酵。发酵过程的SDS-PAGE电泳分析如图5所示,酶活力变化如图6所示。发酵过程酶活力呈上升趋势,132 h时,对照组β-淀粉酶酶活力达到228 U/mL,甲醇/山梨醇混合流加方式下β-淀粉酶酶活力达到310 U/mL,与对照组相比,甲醇/山梨醇混合流加提高了β-淀粉酶的表达量,酶活力相应提高了36%,但是其杂蛋白含量也相应增加。
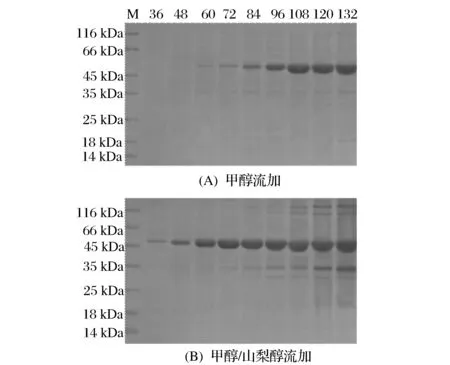
图5 重组β-淀粉酶的表达分析Fig.5 Analysis of the recombinant β-amylase expression
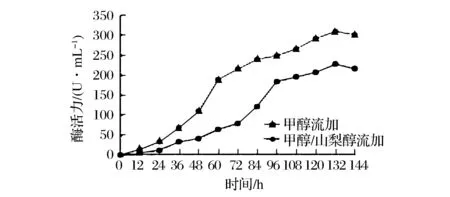
图6 重组β-淀粉酶的酶活力分析Fig.6 Analysis of the recombinant β-amylase enzyme activity
实验结果表明,甲醇/山梨醇混合流加方式比单一甲醇流加方式更能提高β-淀粉酶的发酵表达。
3 讨论
在高麦芽糖生产中,大豆β-淀粉酶对低pH值和高温等工业适应性上表现出良好的耐受性[7-8],目前仅在大肠杆菌表达系统中实现活性表达,表达的重组β-淀粉酶热稳定性较原始β-淀粉酶有所降低。本研究实现了大豆β-淀粉酶在毕赤酵母中的活性表达,重组β-淀粉酶的酶学性质与原始β-淀粉酶一致,表明毕赤酵母较大肠杆菌更适合用于植物来源的β-淀粉酶基因的表达[10-13,23]。
毕赤酵母表达系统是成熟的外源蛋白表达系统[17,24],但与其他酵母表达系统一样,难以实现淀粉水解酶系的异源高表达[12,25]。本研究构建了大豆β-淀粉酶重组毕赤酵母,摇瓶发酵重组酶酶活力为53 U/mL,比报道的大肠杆菌表达系统表达的酶活力高[13]。在此基础上结合过程工艺的优化进行高密度发酵,甲醇单一碳源流加方式下重组酶酶活力为228 U/mL,甲醇/山梨醇混合碳源流加方式下重组酶酶活力为310 U/mL。比较不同发酵方式的重组酶的表达水平,高密度发酵比摇瓶发酵分别提高了330%和485%,甲醇/山梨醇混合碳源流加比甲醇单一碳源流加提高了36%,表明经条件优化的甲醇/山梨醇混合碳源诱导补料流加高密度发酵可以最大提高重组酵母β-淀粉酶的表达量。在毕赤酵母高密度发酵过程中,山梨醇是常用的非抑制性辅助碳源,在外源蛋白诱导表达阶段,山梨醇与甲醇具有不同的代谢途径,山梨醇的加入既缓解了甲醇单独诱导表达能量不足的压力,又改善了甲醇代谢及降解中间毒副产物的能力,因而提高了毕赤酵母的代谢活性和蛋白质合成速率[20-21,26-27]。
目前植物源β-淀粉酶的发酵表达水平偏低[10-12,25],还需要通过进一步的菌株改造,提高β-淀粉酶表达水平。本研究构建的大豆β-淀粉酶重组毕赤酵母,其酶产量虽然与利用毕赤酵母表达系统实现规模生产的植酸酶、脂肪酶、甘露聚糖酶和木聚糖酶等相比还相去甚远[28],但通过甲醇/山梨醇诱导共混补料流加方式提高了大豆β-淀粉酶在毕赤酵母中的异源表达水平,进一步证实了毕赤酵母表达系统以山梨醇为辅助碳源有益于外源蛋白的表达,也说明了在菌株发酵水平一定的前提下,结合过程工艺的优化能够提高菌株的发酵效率,这对于植物源β-淀粉酶的发酵表达具有实际指导意义。
[1] DICKO M H,LEEUWEN S V,BELDMAN G,et al.Purification and characterization of β-amylase fromCurculigopilosa[J].Applied Microbiology and Biotechnology,1999,52(6):802-805.
[2] HEINE V,BUCKOW R,KNORR D.Catalytic activity of beta-amylase from barley in different pressure/temperature domains[J].Biotechnology Progress,2005,21(6):1 632-1 638.
[3] KAPLAN F,DONG Y S,GUY CL.Roles of β-amylase and starch breakdown during temperatures stress[J].Physiologia Plantarum,2006,126(1):120-128.
[4] KAPLAN F,GUY C L.β-Amylase induction and the protective role of maltose during temperature shock[J].Plant Physiology,2004,135(3):1 674.
[5] TETLOW I J,EMES M J.A review of starch-branching enzymes and their role in amylopectin biosynthesis[J].Iubmb Life,2014,66(8):546-558.
[6] 齐继艳,陈舟舟,卢晗等.植物β-淀粉酶[J].植物生理学报,2008,44(2):334-340.
[7] 周春海.大豆β-淀粉酶和大麦β-淀粉酶糖化特性的比较[J].现代食品科技,2011,27(12):1 454-1 456.
[8] 许永苗,李惠安,伍伯良,等.大豆β-淀粉酶在生产麦芽糖浆上的优势[J].食品工程,2014(4):5-6.
[9] PARIS M,JONES M G K,EGLINTON J K.Genotyping single nucleotide polymorphisms for selection of barley β-amylase alleles[J].Plant Molecular Biology Reporter,2002,20(2):149-159.
[10] 夏巧玉,江均平,朱利泉,等.大豆耐热β-淀粉酶基因在大肠杆菌中的表达[J].西南大学学报(自然科学版),2006,28(4):553-557.
[11] 朱培,李崎,朱林江,等.大麦β-淀粉酶基因在大肠杆菌中的异源表达[J].食品与发酵工业,2016,42(6):31-35.
[12] 张萧萧,牛丹丹,沈微,等.β-淀粉酶的表达与酶学性质[J].食品科学,2016,37(3):164-169.
[13] 张广操.耐热大豆β-淀粉酶的筛选及其cDNA在大肠杆菌中的表达[D].北京:中国农业科学院,2005.
[14] LIANG Shu-li,WANG Bin,PAN Li,et al.Comprehensive structural annotation ofPichiapastoristranscriptome and the response to various carbon sources using deep paired-end RNA sequencing[J].BMC Genomics,2012,13(1):738.
[15] JIANG Zi-jun,TONG Guang-jie,CAI Bei-bei,et al.Purification and immunogenicity study of human papillomavirus 58 virus-like particles expressed inPichiapastoris[J].Protein Expression & Purification,2011,80(2):203-210.
[16] BARRIGON J M,VALERO F,MONTESINOS J L.A macrokinetic model‐based comparative meta‐analysis of recombinant protein production byPichiapastorisunder AOX1 promoter[J].Biotechnology & Bioengineering,2015,112(6):1 132-1 145.
[17] MACAULEY-PATRICK S,FAZENDA M L,MCNEIL B,et al.Heterologous protein production using thePichiapastorisexpression system[J].Yeast,2005,22(4):249.
[18] XIE Jing-li,ZHOU Qing-wei,DU Peng,et al.Use of different carbon sources in cultivation of recombinantPichiapastorisfor angiostatin production[J].Enzyme & Microbial Technology,2005,36(3):210-216.
[19] 郭美锦,储炬,庄英萍,等.基于氧碳平衡的重组巴氏毕赤酵母碳源代谢分析[J].化工学报,2003,54(12):1 724-1 728.
[21] HELLWIG S,EMDE F,RAVEN N P G,et al.Analysis of single-chain antibody production inPichiapastorisusing on-line methanol control in fed-batch and mixed-feed fermentations[J].Biotechnology & Bioengineering,2001,74(4):344-352.
[22] WANG Zhi-hao,WANG Yun,ZHANG Dong-xu,et al.Enhancement of cell viability and alkaline polygalacturonate lyase production by sorbitol co-feeding with methanol inPichiapastorisfermentation[J].Bioresource Technology,2010,101(4):1 318-1 323.
[23] YOSHIGI N,OKADA Y,MAEBA H,et al.Construction of a plasmid used for the expression of a sevenfold-mutant barley beta-amylase with increased thermostability inEscherichiacoliand properties of the sevenfold-mutant β-amylase[J].Journal of Biochemistry,1995,118(3):562-567.
[24] 朱泰承,李寅.毕赤酵母表达系统发展概况及趋势[J].生物工程学报,2015,31(6):929-938.
[25] LI Song,SING Suren,WANG Zheng-xiang.Improved expression ofRhizopusoryzaeα-amylase in the methylotrophic yeastPichiapastoris[J].Protein Expression & Purification,2011,79(1):142-148.
[26] CALIK P,CELIK E,OLIVER S G.Recombinant protein production by Mut+strain ofPichiapastorisusing dual carbon sources:methanol and sorbitol[J].New Biotechnology,2009,25(6):S60.
[27] CELIK E,CALIK P,OLIVER S G.Fed-batch methanol feeding strategy for recombinant protein production byPichiapastorisin the presence of co-substrate sorbitol[J].Yeast,2009,26(9):473-484.
[28] RABERT C,WEINACKER D,JR P A,et al.Recombinants proteins for industrial uses:utilization ofPichiapastorisexpression system[J].Sociedade Brasileira de Microbiologia,2013,44(2):351-356.
Expressionofβ-amylasegenefromsoybeaninPichiapastorisbyhighcelldensityfermentation
XU Li-ming*,CHENG Chun-yan,WEI Xing-ming, MO Qi-hui,LU Han-lang,YANG Xiang-kai
(Biology Institute,Guangxi Academy of Sciences,Nanning 530007,China)
Soybean β-amylase has significant performance advantages in maltose production. Therefore, in this study, the soybean β-amylase was heterologously expressed inPichiapastoris. The enzymatic properties of the recombinant β-amylase were examined and found to have no change. To enhance the production of recombinant β-amylase, the methanol/sorbitol co-feeding induction strategy inPichiapastoriswas carried out and the recombinant β-amylase activity reached 310 U/mL in 10 L fermentator, which was 0.36 fold higher than that of strain feeding with methanol alone. These results indicated that heterologous β-amylase expression level could be enhanced by optimizing fermentation condition inPichiapastoris.
β-amylase;Pichiapastoris; heterologous expression; enzymatic properties; sorbitol
硕士研究生(本文通讯作者,E-mail:dawn111305@163.com)。
广西自然科学基金面上项目(2015GXNSFAA139087);广西自然科学基金青年基金项目(2013GXNSFBA019113);广西科学院基本科研业务费资助项目(12YJ25SWS23)
2017-05-04,改回日期:2017-05-18
10.13995/j.cnki.11-1802/ts.014688
