啤酒主要组分在泡沫中的富集及其对泡持性的影响
2017-11-03田金凤王金晶郑飞云李永仙刘春凤钮成拓李崎
田金凤,王金晶,郑飞云,李永仙,刘春凤,钮成拓,李崎*
1(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
啤酒主要组分在泡沫中的富集及其对泡持性的影响
田金凤1,2,王金晶1,2,郑飞云1,2,李永仙1,2,刘春凤1,2,钮成拓1,2,李崎1,2*
1(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
为了探究啤酒中影响泡沫稳定性的主要组分在泡沫生成液中的富集情况,对14种市售啤酒的泡沫生成液、残液、原液进行了分离和收集,并对其中蛋白质、总糖、总多酚的含量以及啤酒的泡持性进行了检测。结果显示,蛋白质在啤酒泡沫中有非常明显的富集,泡沫生成液中蛋白质质量浓度比啤酒残液中高27~74 μg/mL,比啤酒原液中高16~58 μg/mL,而糖类和多酚则没有明显的富集。将3种组分的含量分别与啤酒泡持性进行相关性分析和偏相关性分析,结果表明:(1)蛋白质含量与泡持值之间始终存在很强的正相关,是维持泡沫稳定性的重要因素;(2)糖类能够通过提高啤酒体系黏度、与蛋白质进行共价结合等方式从侧面对啤酒泡持有积极作用;(3)多酚可能与蛋白质交联进而提高泡沫稳定性,但其影响相对较小。
泡持性;蛋白质;糖类;富集;相关性
啤酒是一种营养丰富、历史悠久,且酒精含量较低的饮料酒,至今已有上千年的历史[1]。啤酒泡沫作为其重要的外观特征之一,是酿酒工程师和消费者们评价啤酒质量的一个重要指标[2]。根据欧洲酿造协会的规定,啤酒的泡沫性能评价指标包括起泡性、稳定性、挂杯性、泡沫外观4个部分。其中,泡沫稳定性是最为重要指标,也成为了学者们的研究重点[3]。啤酒泡沫的形成过程较为复杂,在开启啤酒瓶及倾倒啤酒时,啤酒瓶内气压突然减小,啤酒中溶解的过饱和的CO2形成气泡晶核并释放出来。气泡逐渐上浮,膨胀堆积,最终形成啤酒泡沫。泡持性除了受啤酒自身的黏度、疏水性等因素影响外,还受到啤酒中蛋白质等多种组分影响,其中影响啤酒泡沫性质的主要组分有蛋白质、糖类、多酚和异α-酸,而酒精、pH等与泡沫稳定性的相关性很弱[4-9]。
糖类是啤酒中含量最高的物质,但对于糖类尤其是高分子量的多糖对啤酒泡沫稳定性的影响仍存在争议。SARKER等人研究发现,一定量的阿拉伯木聚糖能够提高体系的黏度,与蛋白质交联而提高泡沫稳定性,因此认为阿拉伯木聚糖可以提高啤酒泡沫稳定性[10]。而LUSK等人对啤酒泡沫进行富集后发现,β-葡聚糖在泡沫中没有富集,同时对β-葡聚糖的酶解测试发现,糖化过程中加入β-葡聚糖酶后葡聚糖被降解减少,而啤酒的结果不变,因此认为β-葡聚糖对啤酒泡沫稳定性作用不大[11]。目前关于糖类对啤酒泡沫的影响尚没有明确的结论,仍需要进一步的研究。蛋白质是啤酒中含量较为丰富的另一种物质,国内外关于蛋白质的研究主要集中在对啤酒泡沫蛋白种类的鉴定和分析[12-16],原料中的水溶性蛋白是啤酒泡沫蛋白的最主要来源,其次为酵母在发酵过程中代谢产生的蛋白质。这些蛋白质能够耐高温、抗酶解,经过糖化煮沸发酵等一系列过程,最终存在于啤酒中。目前已经鉴定出来的主要有蛋白质Z、脂转移蛋白、大麦α-淀粉酶抑制剂二聚体-1、大麦醇溶蛋白等[17-18]。多酚是啤酒中另一种含量较高的物质,但目前关于多酚与啤酒泡沫之间的关系的研究较少。BAMFORTH[19]认为多酚与异-α酸作用相似,通过与蛋白质结合以提高泡沫稳定性。而另一方面,在煮沸和酿造过程中,多酚会引起蛋白质特别是浑浊活性蛋白沉淀析出,因此可能会对啤酒泡沫产生一定的负面作用。另外,啤酒中的其他物质如酒精、金属离子等也对泡沫有一定的影响。常认为酒精对啤酒泡沫有着负面的影响,高浓度的乙醇加入泡沫中会直接导致泡沫坍塌。而金属离子的存在有利于提高泡沫稳定性,但在极端情况下可能会导致喷涌。而CO2则无疑是绝对啤酒泡沫质量的重要因素,增加CO2的浓度会形成更多的气泡晶核并提高泡沫稳定性[19]。
目前关于啤酒中影响泡沫性能组分的研究,集中于对啤酒原液中组分的研究,而对啤酒起泡后形成的泡沫液中各种组分的研究较少,对于啤酒中各成分在泡沫中的富集情况仍不清晰。而啤酒泡持性主要依靠起泡后形成的泡沫的稳定性,泡沫液中的各组分及其含量也对啤酒泡持性有一定的影响。本论文选取蛋白质、总糖和总多酚3个指标,对14种市售啤酒的泡沫生成液、原液、残液中这3种组分的含量进行检测以探究不同组分在啤酒泡沫中的富集程度。另一方面,为了探究3种组分之间是否存在相互作用而对啤酒泡沫稳定性有积极的贡献通过相关性分析和偏相关性分析相结合的方法,在考察各种组分与泡持性的相关性的同时,探究啤酒组分之间的关系及共同作用。
1 材料与方法
1.1样品
选取14种市售啤酒作为分析样品。测定泡持性时使用原啤酒样品,其他指标测定时需将样品进行超声除气。酒样信息如表1所示。

表1 实验所用啤酒的信息
1.2试剂
Bradford蛋白浓度测定试剂盒(上海生工)、苯酚、浓硫酸、羧甲基纤维素试剂(CMC/EDTA)、绿色柠檬酸铁铵、氨水等。
1.3仪器与设备
超声波清洗器,昆山超声仪器;20 ℃恒温水浴锅,上海舜宇恒平科学仪器有限公司;UV-2000型分光光度计,美国Unico公司;漩涡搅拌器,美国Scientific Industries公司。
1.4实验方法
1.4.1 啤酒泡持值的测定
啤酒泡持性测定采用超声振荡法。每个样品均做3次平行实验,取平均值。
将啤酒样品置于20 ℃恒温水浴锅中恒温30 min后,使用250 mL量筒准确量取适当体积的啤酒样品(量取过程应尽量避免泡沫的产生)并记录体积(VTotal)。然后将量筒置于超声振荡仪中,在28 kHz的振荡频率下振荡15 s。取出记录振荡开始后30、60、90、120、150、180、210 s时刻对应的液体体积VLiquid,此时形成泡沫液体的体积记为VFoam,即VFoam=VTotal-VLiquid。以时间为横坐标,lnVFoam为纵坐标作图,求得线性趋势方程的率斜k。
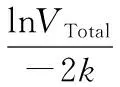
(1)
1.4.2 泡沫生成液的收集
沿1 L的分液漏斗边缘将啤酒样品匀速倒入,至泡沫达到800 mL刻度线。10 s后打开出样阀将液体放出至泡沫恰好流出立即关闭出样阀,泡沫消失后收集得到泡沫生成液,同时收集放出的样品(残液)备用。
1.4.3 泡沫生成液、啤酒原液、残液中的蛋白质含量测定
采用Bradford法测定蛋白质浓度。将试剂盒中的5 mg/mL的牛血清白蛋白用试剂盒中的PBS稀释至200 μg/mL。取8只2 mL离心管标记为1-8号,分别加入0、15、30、60、90、120、150、225 μL,200 μg/mL的BSA标准溶液,并补PBS至300 μL。另取1.5 mL离心管并标记,分别加入150 μL相应浓度的BSA标准溶液和1.5 mL的Bradford试剂,室温下摇匀放置5 min,使用分光光度计测定595 nm下的吸光度,其中1号为空白。以蛋白质量浓度为横坐标,吸光值为纵坐标绘制标准曲线。测定样品时,分别取75 μL样品、75 μL去离子水,加入1.5 mL Bradford试剂,反应5 min后在595 nm下测定吸光值,根据标准曲线计算样品中蛋白质量浓度。
1.4.4 泡沫生成液、啤酒原液、残液中的总糖含量的测定
采用ASBC中的浓硫酸-苯酚分光光度法[20]。取2 mL稀释后的样品于试管中,加入1 mL 50 g/L苯酚溶液,搅拌,吸取5 mL浓硫酸于试管中部,立即以漩涡搅拌器混合;以含2 mL水、1 mL苯酚溶液和5 mL硫酸作为空白对照,含2 mL葡萄糖校准溶液、1 mL苯酚溶液和5 mL硫酸作为校正。在490 nm条件下,用蒸馏水调零后,分别测定空白、标准液和各个样品的吸光度。计算公式:
啤酒中总碳水化合物/[g·(100mL)-1]=[0.9×(样品吸光度-空白吸光度)×2×稀释度]/[(校准溶液吸光度-空白吸光度)×1 000]
(2)
1.4.5 泡沫生成液、啤酒原液、残液中的总多酚含量的测定
采用ASBC中的国际方法[20]。配制1%CMC钠盐(低黏度)溶液加0.2%的乙二胺四乙酸(EDTA),3.5%绿色柠檬酸铁铵溶液,V(去离子水)∶V(浓氨水)=2∶1的氨水溶液。向25 mL容量瓶中加入10 mL样品和8 mL CMC/EDTA并混合;加入0.5 mL绿色柠檬酸铁铵溶液并混合;再添加0.5 mL稀释后的氨水溶液并混合均匀。加水制备得25 mL体系,再次混合。室温下静置10 min后,600 nm下测定吸光值,其中空白样品为包含10 mL样、8 mL CMC/EDTA、0.5 mL稀释后的氨水的25 mL体系。
总多酚含量(mg/L)=吸光值×820
(3)
2 实验结果
2.1啤酒泡持性的测定
采用超声振荡法,对14种市售啤酒进行泡持性测定,每种样品测定3次并取平均值,结果如图1所示。结果显示,由于原料、原麦汁浓度、酿造工艺的不同,啤酒的泡持值差异较大,处于158~320 s之间。

图1 啤酒的泡持性Fig.1 Foam retention of beer
2.2啤酒泡沫生成液、原液、残液中的蛋白质浓度对比
对14种市售啤酒样品分离后的泡沫生成液、残液以及啤酒原液中的蛋白质含量均进行了考察,结果如图2所示。
由图2可以看出,14种样品,啤酒泡沫生成液中的蛋白质含量均远高于啤酒原液和残液中的蛋白质含量。同时,不同种啤酒的蛋白质含量差异较大。啤酒泡沫生成液中的蛋白质质量浓度比啤酒残液中的蛋白质浓度高27~74 μg/mL,比啤酒原液中的蛋白质质量浓度高16~58 μg/mL。蛋白质能够在啤酒泡沫中富集,主要原理是蛋白质具有一定的表面活性,当啤酒瓶被打开时,瓶内过饱和的CO2被释放出来形成气泡并逐渐上浮,在气泡上升的过程中蛋白质能够吸附在气-液界面并被带到泡沫中,最终在啤酒泡沫中实现富集泡沫。蛋白在啤酒泡沫中的富集,一方面取决于蛋白质本身的性质,另一方面取决于啤酒体系的黏度。当啤酒体系中黏度较大时,富集效果越好。蛋白质在啤酒气泡形成过程中有非常明显的富集这一现象,充分说明蛋白质是维持泡沫稳定性的重要组分,对维持泡沫的稳定性有重要意义。
2.3啤酒泡沫生成液、原液、残液中的总糖含量对比
目前关于糖类对啤酒泡沫性质的影响认知不一,有学者认为麦芽中的葡聚糖、阿拉伯木聚糖甚至寡糖能够提高酒液的黏度,进而对啤酒泡沫稳定性有着积极的影响[6]。韩宇鹏等人则认为在糖化和煮沸过程中,糖类能够和蛋白质共价结合,改变蛋白质的结构和理化性质,从而提高啤酒的泡沫稳定性[21]。本实验用浓硫酸-苯酚法考察了啤酒泡沫生成液、残液和原液中的总糖含量,结果见图3。实验结果显示,同一种啤酒的这3个部分中,总糖含量几乎没有差别,说明在啤酒起泡的过程中,糖类没有明显的富集,而是较为均匀地分散在所有体系中。啤酒中的糖类不能在泡沫中富集,可能是由于啤酒中的多数糖类不具有表面活性,因而不能随着气泡的生成而吸附到气液界面上。糖类不是能够直接维持啤酒泡沫稳定性的组分,推测认为糖类可能是通过改善含有蛋白质的啤酒体系的黏度和蛋白质的功能性质,进而改善啤酒的泡沫稳定性。

图3 啤酒的泡沫生成液、原液、残液中总糖含量对比Fig.3 Total saccharide contents of liquid of beer foam,residue liquid and original beer
2.4啤酒泡沫生成液、原液、残液中的总多酚含量对比
多酚在影响啤酒风味的同时,也对啤酒的非生物稳定性有一定的影响。BAMFORTH等人认为,多酚与异-α酸作用相似,通过与蛋白质结合以提高泡沫稳定性。多酚的含量与泡沫稳定性有很强的相关性。对啤酒泡沫生成液、原液、残液中的总多酚含量进行检测,结果显示如图4。总多酚含量在同种啤酒的不同部分的分布没有明显趋势,差异较小,说明在啤酒起泡的过程中,多酚也没有得到明显的富集。

图4 啤酒的泡沫生成液、原液、残液中总多酚含量对比Fig.4 Total polyphenol contents of liquid of beer foam,residue liquid and original beer
2.5相关性分析及偏相关性分析
啤酒泡持性受蛋白质、糖、多酚等多重因素的影响,变量之间的相关关系十分复杂,单纯地分析某一种组分与泡持性之间的线性关系不足以反映他们之间的关系。因此本研究除将不同组分与啤酒泡持性进行相关性分析之外,同时采用偏相关性分析探究在对其他变量进行控制时,更加准确地反映各种组分与啤酒泡持性之间的线性相关程度及组分直接的相互作用。
偏相关性分析也称净相关性分析,是指剔除其他相关因素影响的条件下计算出的变量之间的相关性,例如本研究中对总糖含量与泡持性之间进行偏相关性分析,即为在剔除蛋白质、多酚影响的条件下计算出的相关性。本研究使用Spss Statistic 21软件分别对啤酒原液和泡沫生成液中的组分与泡持值之间进行相关性分析和偏相关性分析。
2.5.1 蛋白质含量和泡持值的相关性分析
对啤酒原液和泡沫生成液中的蛋白质含量与啤酒泡持值分别进行相关性分析和偏相关性分析,结果如表2所示。
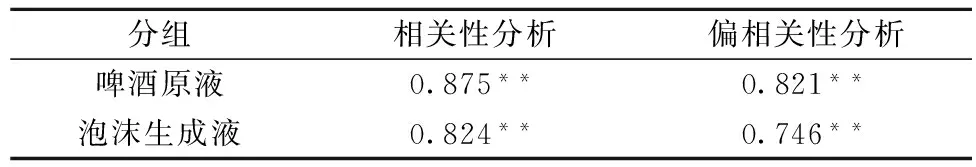
表2 不同组间蛋白质含量和泡持值的相关性及偏相关性分析
注:相关分析采用pearson相关分析, **p<0.01。
从表2可以看出,啤酒原液中和泡沫中蛋白质含量与啤酒泡持性的相关系数差别不大,以啤酒原液中的数据进行分析,结果显示:啤酒原液中的蛋白质浓度与啤酒泡持性的相关系数为0.875(p<0.01),说明蛋白质含量与泡持值之间有很强的正相关;偏相关性分析结果显示,控制变量总糖含量和总多酚含量后,蛋白质浓度与啤酒泡持性的偏相关系数为0.821(p<0.01)。将两项结果结合分析,啤酒中蛋白质含量与泡持值之间存在很强的正相关,而当啤酒中不存在糖类和多酚时,蛋白质含量与泡持性的相关性有一定程度的降低。这一结论充分说明蛋白质是维持啤酒泡沫稳定性的重要因素,而糖类和多酚等物质能在一定程度上对其产生影响。
2.5.2 总糖含量和泡持值的相关性分析
对啤酒原液和泡沫生成液中的总糖含量与啤酒泡持值分别进行相关性分析和偏相关性分析,结果见表3。
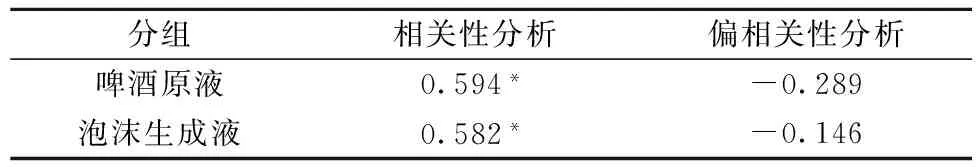
表3 不同组间总糖含量和泡持值的相关性及偏相关性分析
注:相关分析采用pearson相关分析,*p<0.05。
可以看出,啤酒原液中和泡沫中糖类含量与啤酒泡持性的相关系数差别不大,对啤酒原液中的数据进行分析,啤酒原液中的总糖含量与啤酒泡持性的相关系数为0.594(p<0.05),说明在完整的啤酒中总糖含量与泡持性之间存在较为明显的正相关;偏相关性分析显示,控制变量蛋白浓度和总多酚含量后,总糖含量与泡持性之间的偏相关系数为-0.289,相关性可以忽略。这说明当啤酒体系中存在蛋白、多酚等组分时,糖类对提高泡持性有积极的作用;而当不存在蛋白、多酚等组分时,单纯的糖类对泡持性的贡献几乎可以忽略。
这个结论充分证明,糖类的存在对啤酒泡持性起着重要的辅助作用。糖类主要是通过以下几个方面辅助蛋白质以提高泡沫稳定性:一方面,糖类可以提高整个体系的黏度,使更多的蛋白质富集到泡沫中,而本研究分析结果显示,泡沫中的蛋白质含量与啤酒泡持性存在较强的正相关,因此,糖类通过帮助蛋白质富集进一步协助提高了啤酒的泡持性[22];另一方面糖类与蛋白质之间的共价连接,可以改善蛋白质的泡沫性质,从而提高泡沫稳定性[23]。
2.5.3 总多酚含量和泡持值的相关性分析
对啤酒原液和泡沫生成液中的总多酚含量与啤酒泡持值分别进行相关性分析和偏相关性分析,结果如表4所示。
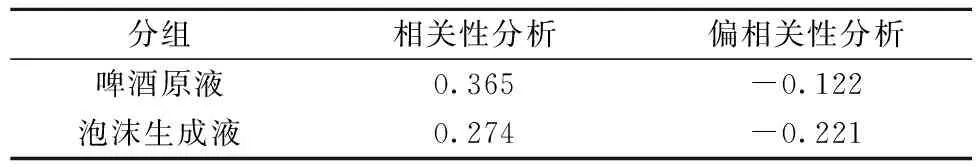
表4 不同组间多酚含量和泡持值的相关性及偏相关性分析
注:相关分析采用pearson相关分析。
啤酒原液中和泡沫中糖类含量与啤酒泡持性的相关系数差别不大,同样以啤酒原液中多酚与泡持值的相关性进行分析,结果显示:啤酒原液中的总多酚含量与啤酒泡持性的相关系数为0.365,表明啤酒中总多酚含量与泡持性之间存在微弱的正相关;偏相关性分析显示,控制变量蛋白浓度和总糖含量后,总多酚含量与泡持性之间的偏相关系数为-0.122,相关性可以忽略。即在整个啤酒体系中,多酚与泡持性之间存在微弱的正相关,对提高啤酒泡沫稳定性有较轻的积极作用,而当体系中不存在蛋白质和糖类等其他组分时,多酚对于泡沫稳定性没有影响。分析认为这主要是因为多酚能够通过与蛋白质交联,改变蛋白质的疏水性和表面张力进而改善泡沫稳定性,而单纯的多酚不具有维持泡沫稳定的能力。而另一方面,由于多酚能与蛋白质结合形成沉淀,使啤酒中蛋白质含量降低进而对泡沫稳定性产生不利影响[24],因此多酚对于啤酒泡沫的影响仍需要进一步探究。
3 结论
对啤酒泡沫生成液、原液、残液中的主要组分含量进行测定,结果显示蛋白质在啤酒泡沫中有非常明显的富集,泡沫生成液中蛋白质质量浓度比啤酒残液中高27~74 μg/mL,比啤酒原液中高16~58 μg/mL;而糖类和多酚在泡沫中没有明显的富集。相关性分析显示,啤酒中蛋白质、总糖、总多酚含量与泡持值的相关性系数分别为0.875、0.594和0.365;而偏相关性分析显示,啤酒中蛋白质、总糖、总多酚含量与泡持值的相关性系数分别为0.821、-0.289和-0.122。两项结果结合分析表明,蛋白质是维持啤酒泡沫稳定性的重要因素;糖类能够通过提高啤酒体系黏度以协助蛋白质富集到泡沫中,与蛋白质进行共价结合等方式从侧面对啤酒泡持有积极作用;多酚可能与蛋白质交联进而提高泡沫稳定性,但其影响较小。啤酒中的组分十分复杂,对啤酒泡沫稳定性的研究除了集中于对蛋白质的研究外,其他组分尤其是糖类与蛋白质之间的相互作用,仍然值得进行更深入的研究。
[1] 顾国贤.酿造酒工艺学[M].北京:中国轻工业出版社,1996:1-3.
[2] 王肇悦,何国庆,刘中山,等.纯生啤酒存放过程中泡沫稳定性与酵母蛋白酶A以及蛋白含量与组成变化的研究[J].中国食品学报,2006,6(4):96-100.
[3] 叶俊华,张峻炎,陆健.啤酒泡沫泡持性测定的研究进展[J].酿酒,2003,30(1):38-39.
[4] BAMFORTH C W.The foaming properties of beer[J].Journal of the Institute of Brewing,1985,91(6):370-383.
[5] FERREIRA I M,JORGE K,NOGUEIRA L C,et al.Effects of the combination of hydrophobic polypeptides,iso-alpha acids,and malto-oligosaccharides on beer foam stability[J].Journal of Agricultural & Food Chemistry,2005,53(12):4 976-4 981.
[6] LEWIS M J.Correlation of beer foam with other beer propeties[J].Technical Quarterly & the Mbaa Communicator,2003,40(2):114-124.
[7] 张吉磊,郑飞云,郝俊光,等.啤酒中异-α酸和蛋白质含量对啤酒泡持性的影响[J].食品与生物技术学报,2010,29(6):905-910.
[8] SIEBERT K J,KNUDSON E J.The relationship of beer high molecular weight protein and foam[J].Technical quarterly-Master Brewers Association of the Americas (USA),1989,26(4):139-146.
[9] EVANS D E,SHEEHAN M C,STEWART D C.The impact of malt derived proteins on beer foam quality.II.The influence of malt foam-positive proteins and non-starch polysaccharides on beer foam quality[J].Journal of the Institute of Brewing,1999,105(3):171-178.
[10] SARKER D K,WILDE P J,CLARK D C.Enhancement of protein foam stability by formation of wheat arabinoxylan-protein crosslinks[J].Cereal Chemistry,1998,75(4):493-499.
[11] LUSK L T,DUNCOMBE G R,KAY S B,et al.Barley beta-glucan and beer foam stability[J].Journal of the American Society of Brewing Chemists,2001,59(4):183-186.
[12] IIMURE T,SATO K.Beer proteomics analysis for beer quality control and malting barley breeding[J].Food Research International,2013,54(1):1 013-1 020.
[13] IIMURE T,TAKOI K,KANEKO T,et al.Novel prediction method of beer foam stability using protein Z,barley dimeric alpha-amylase inhibitor-1 (BDAI-1) and yeast thioredoxin[J].Journal of Agricultural & Food Chemistry,2008,56(18):8 664-8 671.
[14] OKADA Y,IIMURE T,TAKOI K,et al.The influence of barley malt protein modification on beer foam stability and their relationship to the barley dimeric α-amylase inhibitor-I (BDAI-I) as a possible foam-promoting protein[J].Journal of Agricultural & Food Chemistry,2008,56(4):1 458.
[15] 贾娟,王德良,傅力,等.啤酒泡沫活性蛋白质中Z4蛋白质的提取及鉴定[J].食品与发酵工业,2007,33(2):133-136.
[16] SORENSEN S B,BECH L M,MULDBJERG M,et al.Barley lipid transfer protein 1 is involved in beer foam formation[J].Technical Quarterly,1993,30(4):136-145.
[17] IIMURE T,KIHARA M,SATO K,et al.Purification of barley dimeric α-amylase inhibitor-1 (BDAI-1) and avenin-like protein-a (ALP) from beer and their impact on beer foam stability[J].Food Chemistry,2015,172:257-264.
[18] 韩宇鹏,王金晶,田金凤,等.啤酒蛋白及其理化特性研究进展[J].食品与发酵工业,2016,42(9):270-276.
[19] BAMFORTH C W.Beer:a quality perspective[M].Burlinton:Academic Press,2009:3-48.
[20] 美国酿造家协会.ASBC分析方法[M].北京:中国轻工业出版社,2012:317-318.
[21] HAN Y,WANG J,LI Y,et al.Circular dichroism and infrared spectroscopic characterization of secondary structure components of protein Z during mashing and boiling processes[J].Food Chemistry,2015,188:201-209.
[22] CHEN X,WANG J,LI Q.Simultaneous determination of maltooligosaccharides in beer using HPLC-ELSD and their influence on beer foam stability[J].Journal of the American Society of Brewing Chemists,2015,73(1):78-83.
[23] J GOU S,DOULIEZ J P,MOLL D,et al.Evidence of the glycation and denaturation of LTP1 during the malting and brewing process[J].Journal of Agricultural & Food Chemistry,2001,49(10):4 942-4 949.
[24] LEIPER K A,STEWART G G,MCKEOWN I P.Beer polypeptides and silica Gel Part I.Polypeptides involved in Haze formation[J].Journal of the Institute of Brewing,2003,109(1):57-72.
Analysisonenrichmentofmaincomponentsofbeerinbeerfoamanditseffectonfoamretention
TIAN Jin-feng1,2,WANG Jin-jing1,2,ZHENG Fei-yun1,2,LI Yong-xian1,2, LIU Chun-feng1,2,NIU Cheng-tuo1,2,LI Qi1,2*
1(The Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China) 2(School of Biotechnology,Jiangnan University,Wuxi 214122,China)
The beer foam and residue liquid were separated and collected. Then the contents of proteins, total saccharide and total polyphenol and beer foam retention were detected. The results showed that proteins were enriched in beer foam and protein content in beer foam was much higher than that in original beer, but saccharide and polyphenol were not enriched in beer foam. The correlation and partial correlation between beer components and foam retention were also analyzed. The results suggested that there was a strong positive correlation between protein contents and foam retention. Saccharide was able to increase the viscosity of beer and conjugate with proteins to form stable beer foam. Polyphenols might be cross-linked with proteins to improve foam stability, but the impact of polyhenol was smaller than that of saccharide.
foam retention; proteins; total saccharide; enrichment; correlation
硕士研究生(李崎教授为通讯作者,E-mail:liqi@jiangnan.edu.cn)。
国家自然科学基金(No.31571942 & No.31601558);江苏高校优势学科建设工程资助项目(PAPD);江苏省自然科学基金(BK20150159)
2017-02-21,改回日期:2017-05-02
10.13995/j.cnki.11-1802/ts.014103
