商品酶Cellulase A “Amano”3处理提升葵花籽蛋白色泽和功能性质
2017-11-03胡梦姣吕冠薇唐辛悦杨瑞金华霄赵伟张文斌
胡梦姣,吕冠薇,唐辛悦,杨瑞金,3,华霄,3,赵伟,3,张文斌,3*
1(江南大学 食品学院,江苏 无锡,214122) 2(长春医学高等专科学校,吉林 长春,130031) 3(江南大学 食品科学与技术国家重点实验室,江苏 无锡,214122)
商品酶CellulaseA“Amano”3处理提升葵花籽蛋白色泽和功能性质
胡梦姣1,吕冠薇2,唐辛悦1,杨瑞金1,3,华霄1,3,赵伟1,3,张文斌1,3*
1(江南大学 食品学院,江苏 无锡,214122) 2(长春医学高等专科学校,吉林 长春,130031) 3(江南大学 食品科学与技术国家重点实验室,江苏 无锡,214122)
为消除绿原酸对葵花籽蛋白在食品应用中的限制作用,以脱壳葵仁为原料,微酸浸提预先脱除葵仁中部分绿原酸,水媒法提取葵花籽油和蛋白质的同时,添加含绿原酸水解酶活力(3.31 U/g)的商品酶水解残余绿原酸,冷冻干燥得完全脱除绿原酸的葵花籽蛋白质。结果显示,微酸浸提可脱除约76%的绿原酸,酶处理后总脱除率达99.6%。经脱酚和酶处理的葵花籽蛋白色泽明显改善,亮度值L*和红值a*由47.1、-7.4提高至70.3、3.3,持水持油性、乳化稳定性显著提高,溶解性由59.0%提升至87.0%。电泳分析,葵花籽蛋白分子质量集中于10~50 kDa,酶处理后分子质量为34.1 kDa的蛋白条带有一定降解。含绿原酸水解酶活力的商品酶可以完全水解葵仁中残留绿原酸,结合水媒法提油技术制备得到的葵花籽蛋白质具良好的色泽和功能特性,为提取优质葵花籽蛋白质提供了新方法。
葵花籽仁;绿原酸;绿原酸水解酶;水媒法
葵花籽是我国主要的油料作物之一,目前全球产量达4 200万t[1]。葵花籽中含有40%~60%的油脂和20%~31%的蛋白质[2-3]。葵花籽蛋白是一种高营养价值的优质蛋白,氨基酸结构均衡。绿原酸是葵花籽中最主要的多酚类物质,一般含量为1.0%~4.5%[4],具有良好抗氧化活性。但在葵花籽蛋白的提取过程中,绿原酸极易氧化成醌,与蛋白质的极性基团、氨基和亚甲基等基团共价结合,使其成为非反刍动物和家禽无法消化的非营养性物质[5-7]。同时,这一变化也使葵花蛋白质变成消费者难以接受的深绿色。因此,当前富含葵花籽蛋白的葵粕原料只能作为饲料,造成了优质植物蛋白资源的浪费。目前,较常使用的葵花籽蛋白质提取工艺有碱提酸沉、盐溶酸沉和水提醇沉等,其中附依的绿原酸脱除方法主要为热水浸提、有机试剂浸提、超声波辅助提取、膜分离和微波回流辅助法等[3,8]。但绿原酸难以脱除完全,据文献报道,在优化条件下,绿原酸脱除率最高达75%~95%[9]。残余绿原酸仍对葵花籽蛋白有所影响。
水媒法提油技术从20世纪50年代开始蓬勃发展,如今已全面发展出水代法、水酶法和乙醇水提法等多种制油技术。水媒法提油技术提取介质安全无污染,提取条件温和,食用油产品更加营养安全健康[10]。本实验室已完成大量关于水媒法提取葵花籽油、玉米胚芽油、花生油和油茶籽油的工艺研究[11-14],花生油水酶法和油茶籽油乙醇水提法已实现产业化。由于葵花籽蛋白与绿原酸之间的特殊限制作用,对水媒法提葵花籽油过程中的水相葵花籽蛋白的提取研究还未取得明显进展,实验室前期已探索出微酸热浸提脱除葵仁中大部分绿原酸的工艺方法,但仍未达到预期效果。
绿原酸水解酶是一种作用于咖啡酸与奎宁酸之间酯键的特异性水解酶,可催化水解绿原酸。采用绿原酸水解酶处理水解绿原酸,将得到基本脱除绿原酸的葵花籽蛋白质,实现水媒法同步提取葵花籽油和优质水相蛋白。绿原酸水解酶现有产生菌多为黑曲霉[15-16],但绿原酸水解酶尚未商业化,故本研究拟以黑曲霉为生产菌株制得的具绿原酸水解酶杂酶活力的商品酶Cellulase A “Amano”3为研究对象,开展酶法脱除绿原酸制备葵花籽蛋白质的研究,为开发水媒法提取水相葵花籽蛋白工艺提供一条有效途径。
1 材料与方法
1.1材料与仪器
实验材料:市售脱壳葵花籽仁,产于内蒙古五原县(其中脂肪含量60.32%,蛋白质16.52%,碳水化合物13.31%);大豆分离蛋白(蛋白质含量85%),商品酶Cellulase A “Amano”3(绿原酸水解酶活力3.31 U/g),日本天野酶制剂株式会社;绿原酸及咖啡酸标准品(纯度≥ 95%,Sigma),大豆油(金龙鱼有限公司),试验所用化学试剂均为分析纯,国药集团化学试剂有限公司。
实验仪器:高效液相色谱仪(Alliance 2695型,配2998型PDA紫外检测器),美国Waters公司;中药粉碎机(200A),温岭市林大机械股份公司;超级恒温循环槽(MP-501A),上海一恒科技有限公司;自动定氮仪(KDF-103F),上海纤检仪器有限公司;pH计(FE20型),梅特勒-托利多仪器有限公司,台式离心机(CXW-1),上海天美生化有限公司;高速分散器(T50),德国IKA公司;色度仪(TES-135A),泰仕电子工业股份有限公司;垂直电泳槽(MIN-Protein3),美国伯乐公司。
1.2实验方法
1.2.1 葵花籽蛋白质制备工艺
按图1所示流程图制备不同葵花籽蛋白质。为考察绿原酸等酚类对葵花籽蛋白粉的影响,工艺中脱酚和商品酶处理2个工序被选择性弃除,以获得不同的蛋白粉。
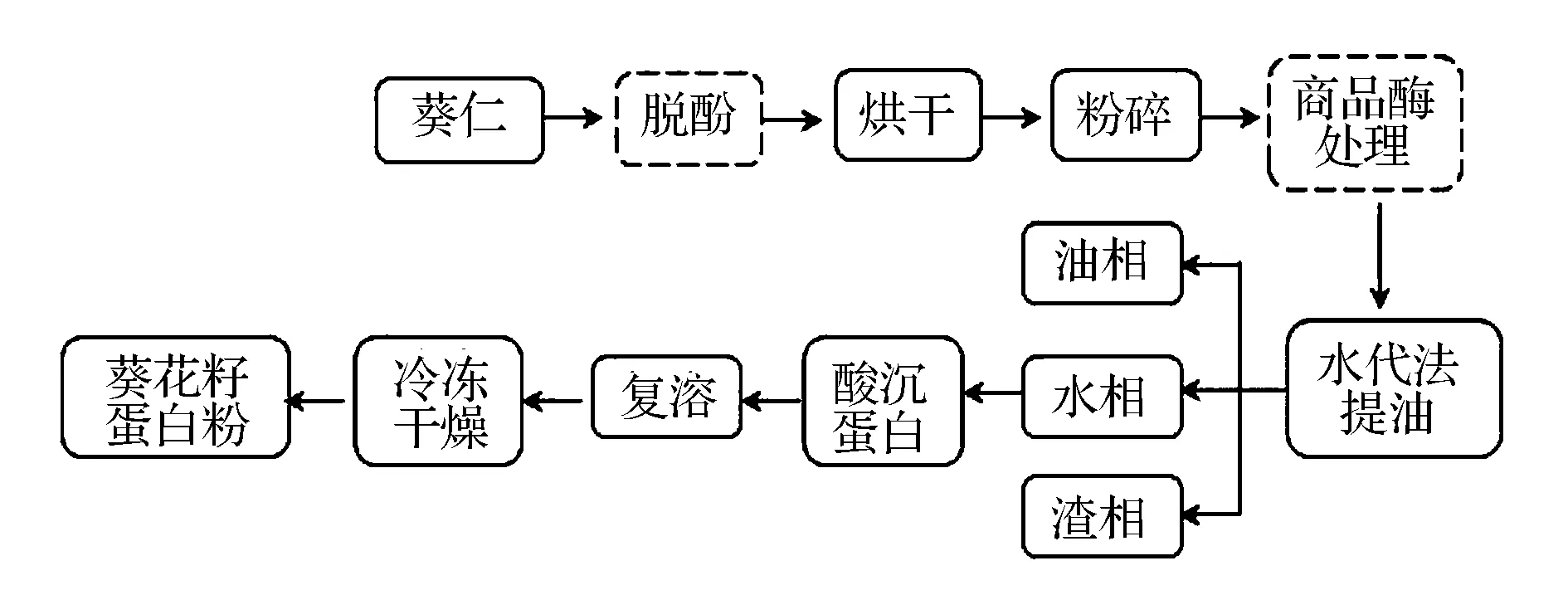
图1 葵花籽蛋白制备工艺(虚线标注的为可选工序)Fig.1 The process for preparation of sunflower seed protein (units in dashed line box are optional)
各工序的具体参数如下。
脱酚:取1 kg葵花籽仁与0.001 mol/L HCl溶液以料水比1∶5(g∶mL),90 ℃搅拌浸提1 h。50目分样筛过滤浸提液,相同条件重复浸提2次。
烘干与粉碎:将得到的脱酚葵花籽仁于60 ℃烘箱中烘干4 h,粉碎备用。
商品酶处理:取粉碎后葵仁200 g,以1∶5(g∶mL)料水比加入1 000 mL去离子水,升温至50 ℃后用1 mol/L HCl 调节体系pH 6.5。以绿原酸水解酶活力/原料:0.3 U/g的比例加入商品酶,反应5 h。
水代法提油:酶解结束后升温至70 ℃,用5 mol/L NaOH调节体系pH至9.0,反应1 h,5 000 r/min离心15 min即得上层油相、中层水相和下层渣相。蛋白多分布于中层水相中。
水相葵花籽蛋白酸沉:用1 mol/L HCl调节水相至等电点pH 4.5,4 ℃静置酸沉1 h,5 000 r/min离心15 min,倒去上清液,沉淀为葵花籽蛋白。
复溶冻干:加入适量去离子水将沉淀复溶,用2.5 mol/L NaOH调节蛋白溶液pH至7.0。冷冻干燥即得不同葵花籽蛋白粉,其中既未做脱酚处理又未做商品酶处理的样品记为SSP(sunflower seed protein),仅做脱酚处理的样品记为DSSP(dephenolized sunflower seed protein),同时经微酸脱酚和商品酶处理的样品记为EDSSP(enzyme-treated dephenolized sunflower seed protein)。
1.2.2 葵花籽蛋白样品中绿原酸残余量的测定
准确称取0.2 g葵花籽蛋白样品于滤纸筒,采用索氏提取器用无水甲醇70 ℃下抽提回流10 h。小心倒出甲醇浸提液,定容至100 mL。取1 mL浸提液,10 000 r/min离心15 min后,经0.22 μm微孔滤膜过滤进样至HPLC。绿原酸标准曲线绘制,以峰面积为纵坐标,绿原酸质量浓度为横坐标,标准曲线方程为y=(1.292x+0.297)×104(R2=0.997 0)。测定并计算葵花籽蛋白样品中绿原酸残余量
高效液相色谱条件:Waters Xbrige C18(4.6 mm×250 mm×5 μm)色谱柱;流动相为乙腈∶2%冰醋酸溶液= 15∶85(体积比);流速0.5 mL/min;检测波长327 nm(PDA检测波长210~400 nm);进样量10 μL[17]。
1.2.3 商品酶中绿原酸水解酶活力测定
称取1 g商品酶粉末,用磷酸盐缓冲液(50 mmol/L,pH 6.5)稀释定容至100 mL制成酶液。参考NIETER等[16]的方法测定商品酶中绿原酸水解酶活力,酶反应体系:650 μL底物溶液(1 mg/mL绿原酸水溶液)+250 μL酶液+100 μL磷酸盐缓冲液。50 ℃反应15 min加入1 mL甲醇终止反应,10 000 r/min离心15 min,经0.22 μm微孔滤膜后进样至HPLC测定,色谱条件同上。商品酶中绿原酸水解酶酶活力单位定义为:在特定条件下每分钟水解释放1 μmol咖啡酸所需的酶量。
1.2.4 蛋白样品色泽测定
采用色度仪测定,每个样品重复测定8次。
1.2.5 蛋白样品相关性质测定
(1)蛋白含量测定:参考凯氏定氮法GB/T 5009.5—2010,蛋白质换算系数为5.30[18]。
(2)溶解性的测定:参考STEPHANIE等的方法并稍作修改[19]。准确称取0.2 g蛋白样品溶于20 mL磷酸盐缓冲液(0.2 mol/L pH7.0),搅拌溶解30 min,4 000 r/min离心15 min。采用半微量凯氏定氮法测定样品和上清液中蛋白含量。
(1)
(3)持水性和持油性的测定:参考MADHUSUDHAN等的方法并稍作修改[20]。准确称取0.2 g蛋白样品于10 mL离心管,加入8 mL去离子水/大豆油,记质量为G1,振荡2 min,6 000 r/min离心15 min,倒出上层清液并称重离心管记G2。持水性/持油性用100 g蛋白所能吸附水/油脂的质量表示:
(2)
(4)乳化性和乳化稳定性的测定:参考PEARCE和KINSELLA的方法,略作修改[21]。取0.1 g蛋白样品溶于25 mL磷酸盐缓冲液(0.2 mol/l pH 7.0),加入10 mL大豆油,以13 500 r/min转速快速搅打1 min。立即吸取底部乳状液100 μL用1 g/L SDS稀释定容至10 mL,测定稀释样品在500 nm处的吸光值A0。将乳化后样品于30 ℃保温60 min,取乳状液100 μL按上述方法稀释测定此时稀释液吸光值,记A60。蛋白样品乳化性(Emulsion Ability,EA)以乳化活力指数(EAI,m2/g)表示:
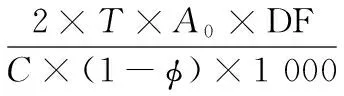
(3)
式中:T,2.303;DF,稀释倍数;C,蛋白质质量浓度,g/mL;φ,乳状液中油相所占的比例,为0.286。
乳化稳定性(ES,min)用乳化稳定指数(ESI,单位为1)表示:
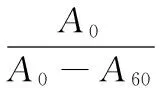
(4)
1.2.6 蛋白样品电泳分析
对葵花籽蛋白样品进行SDS-PAGE分析。配置分离胶浓度为12%,浓缩胶浓度为5%。80 V恒压电泳1~2 h后,用考马斯亮蓝染液染色30 min,再于洗脱液中过夜洗脱,即可看到清晰的电泳蓝色条带。将得到的电泳通过凝胶成像分析软件Image Lab3.0进行条带分析。
1.3数据统计与分析
未加说明的实验均重复3次,计算平均值M和标准偏差SD,结果以M±SD形式表示。采用SPSS19.0、Origin8.6等软件进行数据处理和作图,采用Duncan多重比较法进行差异显著性分析(p<0.05)。
2 结果与讨论
2.1商品酶处理对葵花籽中绿原酸的降解效果
不同葵花籽蛋白样品的绿原酸残留量及液相检测图如表1和图2所示。经过微酸浸提脱酚处理,脱除了葵花籽仁中的大部分绿原酸,并伴有少量咖啡酸产生,DSSP中绿原酸含量仅为SSP的23.9%。经商品酶处理后,EDSSP中无绿原酸检出,基本完全被酶解脱除,达到除去葵花籽蛋白质中绿原酸的目的。

表1 不同处理得葵花籽蛋白中绿原酸残余量
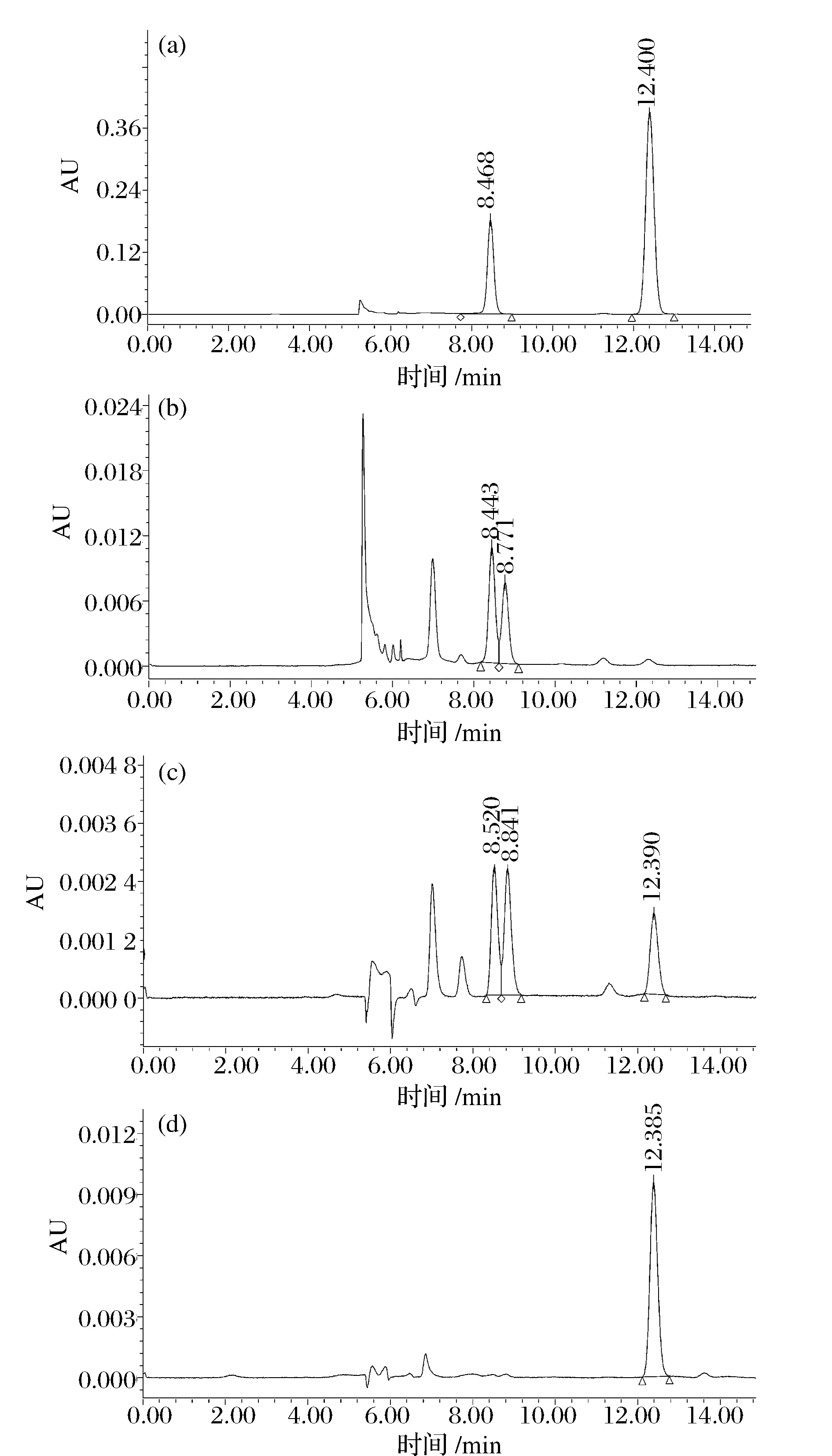
(a)绿原酸(RT=8.468min)和咖啡酸(RT=12.400min)标准品;(b)SSP;(c)DSSP;(d)EDSSP图2 HPLC检测不同处理的葵花籽蛋白中绿原酸残留Fig.2 HPLC determination of the residual cholorogenic acid in different sunflower seed proteins
2.2商品酶处理对葵花籽蛋白色泽变化的影响
不同处理所得葵花籽蛋白色泽差异较大,SFP中绿原酸含量较高呈深绿色,DSSP呈浅绿色,而EDSSP绿色消失呈浅棕色。色差分析结果显示,EDSSPa*值大于零(表2),其他2种蛋白a*值均为负,同时b*值显著高于其他2种蛋白。脱酚处理提高了葵花籽蛋白的亮度,EDSSP和DSSP的L*值分别为71.87和70.25,均显著高于SSP的47.13。

表2 不同处理所得葵花籽蛋白的色度
绿原酸在蛋白质提取过程中发生氧化作用与蛋白结合共价结合,葵花籽蛋白呈现消费者难以接受的深绿色,阻碍葵花籽蛋白进一步开发利用。表2结果表明葵花籽蛋白色泽变化与绿原酸含量呈正相关,微酸脱酚处理脱除葵仁中大部分绿原酸,有少量残留,因此呈浅绿色。而商品酶具有的水解绿原酸杂酶活力将葵仁中绿原酸完全水解产生咖啡酸,蛋白质不再为绿色,大大提升了葵花籽蛋白质色泽。
2.3脱酚及商品酶处理对葵花籽蛋白功能性质的影响
蛋白质是食品加工中的重要配料,对食品品质的影响较大。蛋白质的许多功能特性与溶解度有关,如增稠、起泡、乳化和凝胶作用[22]。中性条件下,蛋白质的溶解性通常是其制备加工过程中首需测定的性质。而持水持油性则是蛋白质应用于肉制品、蛋糕、冰激凌和面包等食品加工过程中的重要考量指标。另外,在油水体系中,蛋白质与脂类的相互作用有利于食品体系的分散及乳浊液的稳定。因此,乳化性质也是蛋白质在食品加工过程中重要功能特征之一。
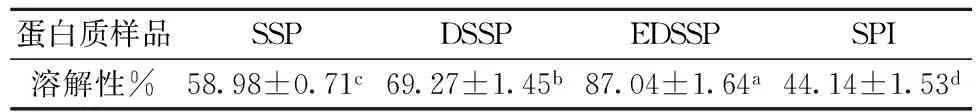
表3 不同处理所得葵花籽蛋白的溶解性
pH 7.0条件下不同处理所得蛋白质的溶解性差异显著。葵花籽蛋白质溶解性高于大豆蛋白(BR级大豆蛋白,未改性处理)。SSP比其他2种脱酚蛋白的溶解性低。EDSSP溶解性最高为87.0%。一方面,微酸脱酚过程中热处理可能使蛋白发生了热聚集,大分子蛋白在碱提时部分沉积于渣相,提取出更多小分子易溶解的蛋白,从而使溶解性上升。另一方面,商品酶处理基本脱除葵花籽中绿原酸,醌-蛋白质共价结合体生成量减少,从而提高蛋白质的溶解性。
由图3可见,大豆蛋白持水能力极强为10.5 g/g,而持油能力差仅为1.91 g/g。与大豆蛋白相比,葵花籽蛋白持水持油能力较均衡,持油能力高于大豆蛋白,持水能力低于大豆蛋白。SSP持水性为3.51 g/g,持油性为3.20 g/g,脱酚处理后的2种葵花籽蛋白的持水持油能力显著提升。DSSP持水性为5.08 g/g,稍高于EDSSP 4.68 g/g,但两者间差异不显著。脱酚浸提过程中,热处理使葵花籽蛋白质三级结构展开,肽链间空隙变大,溶胀度提高,同时疏水性残基更多地暴露于蛋白分子表面,从而使蛋白持水持油能力提高。
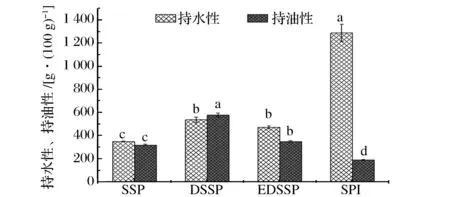
图3 不同处理所得葵花籽蛋白的持水性和持油性Fig.3 The water and oil binding capacity of different sunflower seed proteins
不同蛋白质样品的乳化活性及乳化稳定性如图4所示。葵花籽蛋白的乳化活性均显著优于大豆蛋白,其中SSP乳化活性最高为134 m2/g,DSSP和EDSSP乳化活性稍有降低,两者差异不显著,分别为124 m2/g 和119 m2/g。可能是由于热处理产生了可溶性聚集体,蛋白质分子柔顺性降低,影响蛋白质向油水界面间的移动及分子重排[23],从而使乳化活性有所降低。大豆分离蛋白乳化活性为98.40 m2/g。从乳化稳定性来看,EDSSP乳化稳定性显著提高至114.29,可能由于商品酶对葵花籽蛋白存在一定程度的水解,降低了分子体积,乳状液液珠间的吸引作用小于排斥作用,不易聚结[24],所以乳状液较为稳定。

图4 不同处理所得葵花籽蛋白的乳化性及乳化稳定性Fig.4 The emulsion ability and stability of different sunflower seed proteins
2.4不同处理得葵花籽蛋白SDS-PAGE分析
图5为不同处理得葵花籽蛋白及大豆蛋白SDS-PAGE电泳结果。不同处理所得葵花籽蛋白电泳谱带基本相同,利用Image Lab3.0软件分析,主要包括52.6、49.6、34.1、28.6、20.9、19.4和10.4 kDa等多条蛋白条带,不同相对分子量处蛋白含量分布有所差异。50~250 kDa相对分子量范围内,SSP含量明显高于其他2种不同程度脱酚的葵花籽蛋白。可能由于热浸提过程中,葵花籽蛋白中的大分子量蛋白被降解,或热变性后聚集在渣相中未提出。
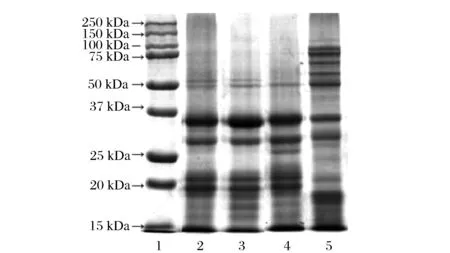
1-Marker;2-SFP;3-ASFP;4-ESFP;5-SPI图5 不同处理所得葵花籽蛋白的SDS-PAGE蛋白电泳Fig.5 SDS-PAGE analysis of different sunflower seed proteins
经商品酶处理后的葵花籽蛋白,大分子量范围内蛋白条带颜色变浅,10~37 kDa相对分子量范围内更均匀分布。与SSP和DSSP相比,EDSSF泳道中52.6 kDa条带消失,34.1 kDa条带变浅,29.2~21.4 kDa附近新增较多条带,15 kDa以下条带加深。这可能是因为商品酶处理过程中不仅水解绿原酸,消除了其与蛋白的共价结合,同时商品酶对葵花籽蛋白产生了一定程度的水解作用,在电泳图中明显表示为小分子量蛋白条带增多。这也合理解释了EDSSP溶解性优于DSSP,更优于SSP。大豆蛋白中蛋白分布差异较大,大分子蛋白质含量高, 溶解性比葵花籽蛋白差。
3 结论
以脱壳葵花籽为原料,结合水媒法提油技术,经过微酸脱酚和商品酶处理制得完全脱除绿原酸的葵花籽蛋白质,色泽良好、亮度高,解决长期以来葵花籽蛋白颜色深绿这一人们难以接受的的困扰。商品酶处理后的葵花籽蛋白质溶解度明显提高,达到87%,优于未脱酚葵花籽蛋白、微酸脱酚葵花籽蛋白和大豆蛋白。与未脱酚葵花籽蛋白相比,商品酶处理后的葵花籽蛋白持水性、持油性和乳化性能等功能特性有所提升。SDS-PAGE电泳图谱结果显示,葵花籽蛋白相对分子质量多集中在10~50 kDa,与未脱酚蛋白相比,商品酶处理后葵花籽蛋白质大分子蛋白有所降解,其他基本保持一致。虽然商品酶中绿原酸水解酶活力相对含量低,但对脱除葵仁中绿原酸作用显著。该研究为后期开展酶法脱除绿原酸、水媒法提取优质葵花籽蛋白质资源提供了有效探索途径。
[1] LIST G.Sunflower seed and oil[J].Lipid Technology,2014,26(1):24-24.
[2] 冷玉娴.水酶法提取葵花籽油和葵花籽蛋白的回收[D].无锡:江南大学,2007.
[3] GONZALEZ P S,VEREIJKEN J M.Sunflower proteins:overview of their physicochemical,structural and functional properties[J].Journal of the Science of Food and Agriculture,2007,87(12):2 173-2 191.
[4] 郑喜群,蒋继丰,刘晓兰,等.水提醇沉法从葵花籽中提取绿原酸[J].食品科学,2006,27(1):159-161.
[5] JAKOBEK L.Interactions of polyphenols with carbohydrates,lipids and proteins[J].Food chemistry,2015,175(1):556-567.
[6] WEISZ G M,CARLE R,KAMMERER D R.Sustainable sunflower processing—II.Recovery of phenolic compounds as a by-product of sunflower protein extraction[J].Innovative Food Science & Emerging Technologies,2013,17(1):169-179.
[7] 王志华,王东洁,赵晋府.葵花籽绿原酸酶法提取工艺研究[J].食品科学,2004,25(1):97-100.
[8] 罗丰收,杨海燕,绪建荣,等.超声波辅助醇提法脱除脱脂葵花籽粕绿原酸工艺研究[J].食品工业,2014,35(9):23-27.
[9] 罗丰收.葵花籽粕蛋白提取及其改性研究[D].乌鲁木齐:新疆农业大学,2014.
[10] 杨瑞金,倪双双,张文斌,等.水媒法提取食用油技术研究进展[J].农业工程学报,2016,32(9):308-314.
[11] LI Peng-fei,GASMALLA M A A,LIU Jun-Jun,et al.Characterization and demusification of cream emulsion from aqueous extraction of peanut[J].Journal of Food Engineering,2016,185(1):62-71.
[12] 刘媛媛,张文斌,李鹏飞,等.水代法提取葵花籽油及乳状液的破除[J].食品工业科技,2016,37(19):180-184,191.
[13] 倪双双,杨瑞金,张文斌,等.乙醇水溶液提取玉米胚芽油的工艺优化[J].农业工程学报,2016,32(7):283-289.
[14] 谢斌,杨瑞金,顾姣.油茶籽粉碎程度对水酶法提油效果的影响[J].食品与机械,2016,32(3):174-177.
[15] ASTHER M,ALVARADO M I E,HAONa M,et al.Purification and characterization of a chlorogenic acid hydrolase fromAspergillusnigercatalysing the hydrolysis of chlorogenic acid[J].Journal of Biotechnology,2005,115(1):47-56.
[16] 卢定强,王俊,凌岫泉,等.一株高产绿原酸水解酶的黑曲霉菌株及其应用:中国,CN101392224[P].2009.03.25.
[17] 徐丹丹,张文斌,杨瑞金,等.大孔吸附树脂对葵仁多酚的分离富集[J].食品与机械,2015(5):210-216.
[18] NIETER A,HAASE A P,KELLE S,et al.A chlorogenic acid esterase with a unique substrate specificity from Ustilago maydis[J].Applied and environmental microbiology,2015,81(5):1 679-1 688.
[19] JUNG S,MAHFUZ A A.Low temperature dry extrusion and high-pressure processing prior to enzyme-assisted aqueous extraction of full fat soybean flakes[J].Food Chemistry,2009,114(3):947-954.
[20] MADHUSUDHAN K T,SINGH N.Effect of heat treatment on the functional properties of linseed meal[J].Journal of Agricultural and Food chemistry,1985,33(6):1 222-1 226.
[21] PEARCE K N,KINSELLA J E.Emulsifying properties of proteins:evaluation of a turbidimetric technique[J].Journal of Agricultural and Food Chemistry,1978,26(3):716-723.
[22] 王盼盼.食品中蛋白质的功能特性综述[J].肉类研究,2010(5):62-71.
[23] 郭凤仙,陈洁.热处理对大豆分离蛋白结构及功能特性的影响[D].无锡:江南大学,2009.
[24] 管军军,裘爱泳,周瑞宝.提高大豆分离蛋白乳化性及乳化稳定性的研究[J].中国油脂,2003,28(11):38-42.
ColorchangeandfunctionalityimprovementofsunflowerseedproteinundertreatmentofacommercialcellulasepreparationCellulaseA“Amano”3
HU Meng-jiao1,LYU Guan-wei2,TANG Xin-yue1,YANG Rui-jin1,3, HUA Xiao1,3,ZHAO Wei1,3,ZHANG Wen-bin1,3*
1(School of Food Science and Technology,Jiangnan Uninversity,Wuxi 214122,China) 2(Changchun Medical College,Changchun 130031,China) 3(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Browning of sunflower seed protein caused by cholorogenic acid (CGA) oxidation limited its usage in food and beverage to great extent. Meanwhile, the solubility, water/oil absorption capacity, emulsification properties also need to be improved for better application. In this study, sunflower seed was submitted to mild acid incubation for CGA removal. The dephenolized seed was then dried, ground, and treated with a commercial cellulase preparation containing CGA hydrolase activity (3.31 U/g) before aqueous extraction of oil and protein. The protein recovered from aqueous phase was freeze-dried for functionality evaluation. It was found that mild acid soaking extracted about 76% CGA and the following enzyme treatment hydrolyzed remained CGA, achieving 99.6% CGA removal in total. The L*, a*values of sunflower seed protein (SSP) varied from 47.1, -7.4 to 70.3, 3.3 for enzyme-treated dephenolized sunflower seed protein (EDSSP). This showed great color improvement with both dephenolization and enzyme treatment. The solubility of SSP (59.0%) increased to 87.0% for EDSSP. Meanwhile, both water and oil absorption capacity showed significant increase. However, though emulsion stability of EDSSP and DSSP was superior to that of SSP, the emulsion activity was lowered significantly. SDS-PAGE analysis showed that the 37 kDa subunit has undergone certain degradation after enzyme treatment, which was consistent with its functionality change. In conclusion, the commercial cellulase containing CGA hydrolase activity could significantly lower remained CGA in sunflower seed. The obtained seed was a good source for aqueous extraction of sunflower seed oil and protein. The improvement of color and functionality would extend its application greatly.
sunflower seed; cholorogenic acid (CGA); chologenic acid hydrolase; aqueous extraction process
硕士研究生(张文斌副教授为通讯作者,E-mail:wbzhang@jiangnan.edu.cn)。
国家自然科学基金(31401635);国家高技术研究发展计划(863计划)(2013AA102104-2)
2017-03-14,改回日期:2017-03-27
10.13995/j.cnki.11-1802/ts.014307
