内镜窄带成像技术结合放大内镜在鉴别结直肠病变中的作用及其学习曲线
2017-11-03杨上文戴木根练庆武周桃梅叶斌何伟莉
杨上文,戴木根,练庆武,周桃梅,叶斌,何伟莉
(浙江省丽水市中心医院 消化内科,浙江 丽水 323000)
内镜窄带成像技术结合放大内镜在鉴别结直肠病变中的作用及其学习曲线
杨上文,戴木根,练庆武,周桃梅,叶斌,何伟莉
(浙江省丽水市中心医院 消化内科,浙江 丽水 323000)
目的探讨内镜窄带成像技术(NBI)在诊断结直肠病变中的作用。明确NBI在实际操作中的学习曲线,为开展该技术的临床医师提供指导。方法回顾性分析2015年6月-2016年6月该院内镜中心4位医师行NBI结合放大内镜检查并发现结直肠病变的289例患者临床资料,所有病变经活检、内镜下治疗或手术后行病理组织学检查,并与佐野分型对照。根据NBI结合放大内镜分为3组,这3组包括可以通过内镜治疗(目标病变)的病变和不能通过内镜治疗(非目标病变)的病变。每位医师检查的目标或非目标病变均达到15例为1组。通过评估4名医师对每组病变的诊断准确性,绘制NBI结合放大内镜检查技术的相关学习曲线。结果在289例患者的结肠镜检查中共发现372处病变,NBI结合放大内镜使用佐野分型在鉴别肿瘤和非肿瘤性病变的准确率为95.1%、敏感性为98.0%、特异性为92.0%。对于目标及非目标病变的诊断准确率第2组相比第1组均有明显提高[分别为81.7% vs 95.1%(P=0.010)和71.7% vs 93.4%(P=0.000)];第2组与第3组病变之间的诊断准确率的差异无统计学意义(P=0.984及P=0.117)。结论NBI结合放大内镜是诊断结直肠病变的有效工具。对于无NBI经验的医师在完成较短的训练计划和一定(对目标及非目标病变各15例)的临床实践后基本掌握其诊断方法,并获得有效、稳定的诊断准确率。
结直肠病变;内镜;诊断;窄带成像;学习曲线
内镜窄带成像技术(narrow-band imaging,NBI)是一项新的内镜光学技术,它利用滤光器过滤普通白光内镜的宽带光谱,仅留下特殊波长的窄带光谱,可用于精确观察病变的表面结构(例如腺凹,pit pattern)以及微血管结构,从而区分增生、腺瘤以及肿瘤等病变。国内外许多学者对NBI在结直肠病变中的应用做了研究,认为NBI结合放大内镜都有助于实时组织学诊断,并且在鉴别增生性息肉和腺瘤性息肉的高诊断准确率上达成一致[1-3]。因此,使用NBI在结肠镜操作的同时,进行实时组织学诊断,判断病变的类型,从而对需要治疗的病变进行息肉切除术、内镜下黏膜切除术(endoscopic mucosal resection,EMR)或内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)等临床治疗,这样既可以避免重复操作以及出现多余的病理费用,也可以避免过度治疗。NBI作为一种新技术是否简单易学这一问题已受到众多内镜学者的关注。近年来,许多国际著名杂志上发表的文章都提及NBI结合放大内镜技术相关的学习曲线[4-6]。但是,这些研究仅包括对NBI数据的评估,而不一定将其应用于常规临床实践。因此,本研究的目的是评估NBI结合放大内镜用于诊断结直肠病变的有效性,并评估与常规临床实践中这种技术相关的学习曲线。现报道如下:
1 资料和方法
1.1 一般资料
1.1.1 纳入标准 2015年6月-2016年6月无论何种病因来我院行结肠镜检查、年龄18~78岁、使用NBI结合放大内镜的检查过程中发现息肉或肿瘤等病变的患者被纳入本研究。
1.1.2 排除标准 ①不愿意签署知情同意书;②长期服用非甾体类抗炎药;③确诊或怀疑有炎症性肠病(溃疡性结肠炎、克罗恩氏病等)者;④有遗传性或非遗传性息肉病的患者;⑤考虑到幼年性息肉以及锯齿状息肉没有明确的佐野毛细血管模式(capillary,CP)分型,故需排除此类病变。研究期间共有295例患者入组,男164例,女131例,平均年龄(58.3±10.5)岁。其中,6例病理结果显示为幼年性息肉或锯齿状息肉故排除,共纳入289例病例。
1.2 内镜系统
本研究采用Olympus CV-260SL图像处理中心,CLV-260SL氙气冷光源装置和CF-H260AZL/I放大内镜,以及LUCERA图像处理系统。使用Olympus CF-H260AZL/I结肠镜(奥林巴斯,东京,日本)进行结肠镜检查。使用结肠镜手柄上的相同按钮激活和停用双频带NBI滤波器(例如415 nm/30 nm和540 nm/30 nm)。使用氙灯作为光源,并且使用单色电荷耦合器件检测器,便于收集具有1 080条水平线分辨率的高清图像。此外,LUCERA CV-260SL处理器(奥林巴斯)提供高达70~100倍的放大倍率。
1.3 内镜结果评价及分组
1.3.1 课程培训 4位医师在研究前参加了由佐野宁教授亲自授课的NBI相关知识课程培训,课程内容包括NBI原理以及佐野分型、佐野CP分型等相关信息,培训过程中包括各种类型的病变在普通白光、NBI、NBI+放大内镜以及色素内镜下的图片识别。课程由提出佐野分型的佐野宁教授亲自讲解,课后有一次预测试,参加者需对给出的病变图片作出相应的诊断,测试中的图片由佐野宁教授提供,其中包含了各种类型的病变,测试以病理结果作为金标准。
1.3.2 内镜下评价采用佐野CP分型 CP Ⅰ型:表现为规则的六角形蜂窝样结构微血管,不易被内镜所发现;CP Ⅱ型:表现为正常或较为增粗的血管围绕腺管周围呈管状或卵圆状分布,部分蜂窝样结构微血管残存,较易被内镜观察;CP ⅢA:表现为正常或较粗血管卷入不规则腺管周围,蜂窝样结构的微血管部分被破坏,但仍可被内镜所发现;CP ⅢB:微血管网状结构完全被破坏,血管显示粗细不一致和分布不均或呈无结构状。
1.3.3 分组 由于CP Ⅱ型病变提示腺瘤性病变,CPⅢA型病变提示早期肿瘤且浸润深度小于1 000μm,这两种类型的病变都是内镜下治疗的指征,在此项研究中笔者把这两类病变定义为目标病变,意为这些类型的病变都是内镜下治疗的目标。而CP Ⅰ型提示增生或炎症型病变,不需要内镜下治疗,CP ⅢB型提示浸润程度较深的恶性肿瘤也不适合内镜下治疗,故把这两类病变定义为非目标病变。根据检查日期的顺序,分别将目标病变和非目标病变分为3组,每组各15例。研究期间医师发现病变后连续入组患者,直至每位医师检查的目标病变及非目标病变均达到45例,若入组期间目标病变已达45例,而非目标病变未达45例,则继续入组病变,直至非目标病变达到45例,期间目标病变超过45例部分计入第3组,反之亦然。医师每周可以获得病理结果反馈。
1.4 预测试
预测试采用读片模式,分别对内镜下获得的病变照片进行独立诊断。预测试中使用的病变共40例。其中,增生性病变9例,腺瘤性病变18例,浅表肿瘤6例,深部浸润肿瘤7例。整个测试过程需在40 min内完成,每例病变仅提供一张NBI放大内镜下的图片,4位医师需独立给出病变的佐野CP分型结果。测试结束后根据病理结果统计诊断准确率。
1.5 检查过程
1.5.1 结肠镜检查顺序 结肠镜操作术前常规肠道准备,4位医师(拥有5 000例以上结肠镜操作经验,但是几乎没有NBI使用经验)分别使用普通白光内镜进行检查,进镜至回盲部,使用足够的时间退镜,并仔细观察结肠黏膜,发现病变后的检查顺序如下:①尽量冲洗和吸净病变表面残留的粪便及影响观察的黏液;②观察病变的整体形态,并记录下病变的位置、大体形态及大小;③切换至NBI模式同时对病变放大进行观察,观察病变表面微血管形态记录下佐野CP分型,并拍摄照片;④活检取材、内镜治疗或手术后标本送病理组织学检验;⑤若患者有多处病变,仅记录首先发现的3处病变。
1.5.2 组织学检查 所有被发现的病变,均通过活检、息肉切除术、EMR、ESD或手术取得组织标本,用生理盐水浸泡送病理组织学检查。病理标本常规用石蜡包埋、按4μm的厚度切片后以苏木精-伊红染色,必要时用免疫组化染色,由我院病理科行病理学诊断。
1.6 学习曲线
4名医师需评估目标和非目标病变各3组,每组15例。在学习过程中,连续登记入选患者,直到获得目标和非目标病变各45例。在以前的一项有关NBI学习曲线的研究中,缺乏NBI经验的内镜专家能够在操作44例后胜任[7]。然而,普通学员在常规临床实践中掌握NBI技术比单单训练图片可能更困难。因此,本研究将样本数量加倍(>90例)。由于患者被陆续地加入分组,在病理检查结果出来之前无法确定目标与非目标病变,持续增加每组入选患者,直到获得45个病变的病理结果为止,然后比较分析3组病变的诊断准确度,以评估每个内镜医师的学习曲线。
1.7 统计学方法
采用SPSS 19.0统计软件进行分析,计量资料用均数±标准差(±s)表示,采用t检验。采用χ2检验或Fisher精确检验来确定方差的差异。P<0.05为差异有统计学意义。对4位医师预测验的结果的一致程度采用κ检验,若κ<0.20则认为一致度差,若κ为0.21~0.40则认为一致度较差,若κ为0.41~0.60则认为一致度一般,若κ为0.61~0.80认为一致度较好,若κ为0.81~1.00则认为一致度极佳。本研究中考虑到医师对于新技术的学习效应,故统计诊断准确率、敏感性及特异性时需将学习过程中的数据排除(根据统计结果,排除了目标病变及非目标病变的第1组数据)。
2 结果
2.1 预测试的结果
4位医师使用佐野CP分型与测试,预测试中使用的病变共40例。其中,增生性病变9例,腺瘤性病变18例,浅表肿瘤6例,深部浸润肿瘤7例。NBI结合放大内镜图像的诊断准确率为91.8%(147/160,95%CI:87.5~95.4)。4位医师的诊断准确率分别为 90.0%(36/40)、92.5%(37/40)、95.0%(38/40)和90.0%(36/40),差异无统计学意义(χ2=4.38,P=0.215),组内一致度极佳(κ=0.91)。
2.2 一般情况
所有入组患者均进镜至回盲部并完成检查,在295例患者中共发现各类病变372处。其中,增生及炎性病变147处,腺瘤性病变186处,浸润深度小于1 000μm的早期肿瘤18处,浸润深度大于1 000μm的肿瘤21处。372处病变中位于直肠190处,乙状结肠79处,降结肠26处,横结肠43处,升结肠24处,回盲部10处。按佐野CP分型,Ⅱa型149处,Ⅰs型88处,Ⅰps型89处,Ⅰp型46处。病变平均大小为(9.5±0.7)mm,其中小于5.0 mm(包括5.0 mm)的病变138处,6.0~10.0 mm的病变149处,大于10.0 mm的病变85处。见表1。
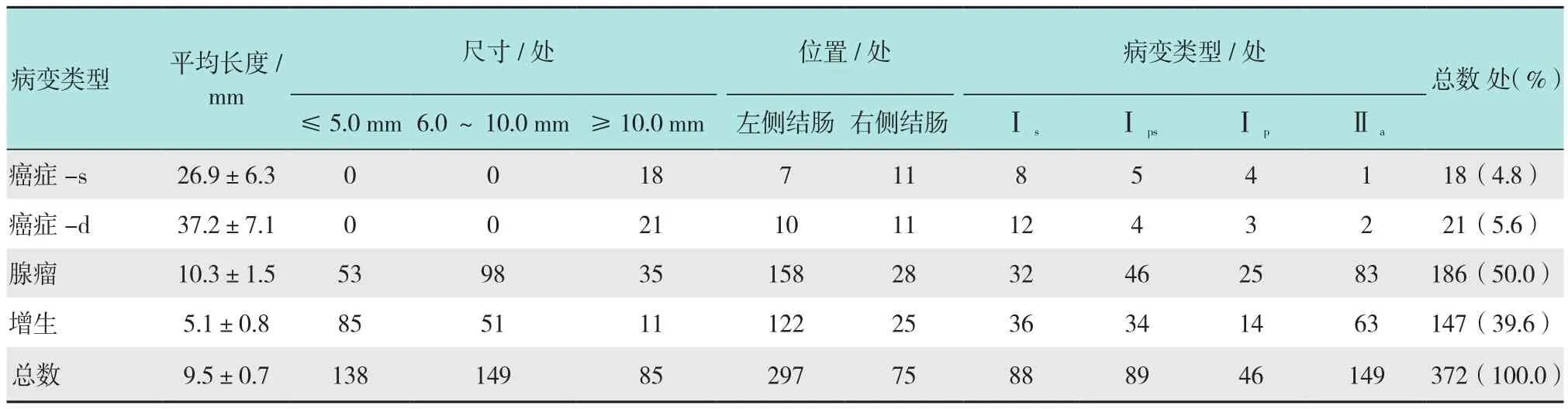
表1 结肠直肠病变的临床病理特征Table 1 Clinicopathological features of the colorectal lesions detected
2.3 NBI鉴别结直肠病变的准确率
NBI结合放大内镜鉴别结直肠病变的总体诊断准确率为94.1%(191/203;95%CI:91.1~97.2)。针对佐野分型病变,小于5.0 mm、6.0~10.0 mm以及大于10.0 mm的病变,其诊断准确率分别为95.1%、(77/81;95%CI:90.3 ~ 99.9)、95.9%(70/73;95%CI:91.8~ 99.9)及 89.8%(44/49;95%CI:82.5~ 97.1),3者之间的差异无统计学意义(χ2=4.15,P=0.213)。对增生性、腺瘤性以及肿瘤病变的诊断准确率分别 为 92.8%(77/83;95%CI:87.8~ 97.9)、95.4%(103/108;95%CI:91.9~ 99.2) 及 91.7%(11/12;95%CI:83.8~99.9),3者之间的差异无统计学意义(χ2=4.07,P=0.293)。NBI结合放大内镜使用佐野分型在鉴别肿瘤和非肿瘤性病变的准确率为95.1%、敏感性为98.0%、特异性为92.0%。见表2。
2.4 组织学诊断与佐野分型的关系
在佐野CP Ⅰ型的77处病变中,增生及炎症性病变77(100.0%)处;佐野CP Ⅱ型的109处病变中,增生性病变6(5.5%)处,腺瘤性病变103(94.5%)处;佐野CP Ⅲ型的17处病变中,腺瘤5(29.4%)处,肿瘤12(70.6%)处。在CP Ⅲ型的病变中,发现9处ⅢA型病变,其中腺瘤性病变3(33.3%)处,浸润深度小于1 000μm的浅表早期肿瘤6(66.7%)处;发现ⅢB型病变8处,其中腺瘤性病变2(25.0%)处,浸润深度小于1 000μm的浅表早期肿瘤1(12.5%)处,浸润深度大于1 000μm的肿瘤5(62.5%)处。见表3和4。
2.5 NBI结合放大内镜的学习曲线
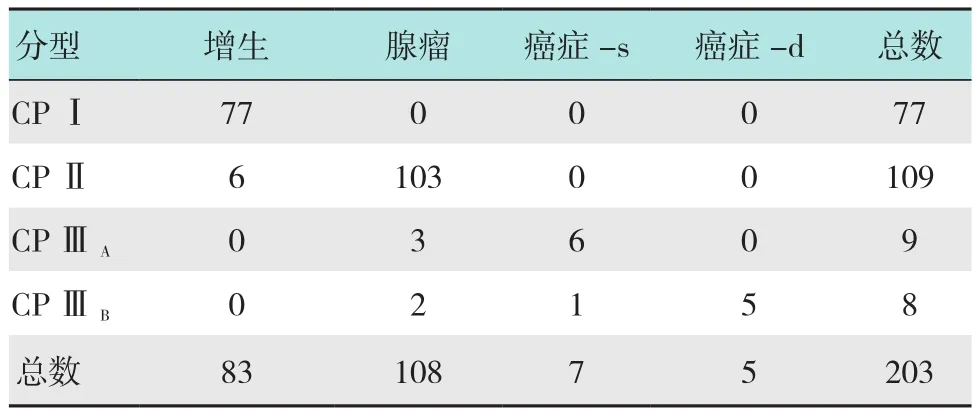
表3 CP分型与病理结果之间的一致性 处Table 3 Agreement between Capillary Pattern(CP)classification and pathological results n
4位医师检查的患者年龄与性别以及发现的病变数量、类型、大小之间差异均无统计学意义。3组非目标病变的诊断正确率分别为71.7%(43/60)、93.4%(57/61)和88.5%(54/61),其中第2组的诊断准确率较第1组有明显提高(P=0.000),而第2组与第3组之间的差异无统计学意义(P=0.117)。3组目标病变的诊断准确率分别为81.7%(49/60)、95.1%(58/61)和92.7%(64/69),其中第2组的诊断准确率明显高于第1组(P=0.010),而第2组与第3组之间差异无统计学意义(P=0.984)。此外无论是目标病变还是非目标病变4位医师在第2组15例病变中,诊断准确率均明显高于第1组的15例病变。见表5 。
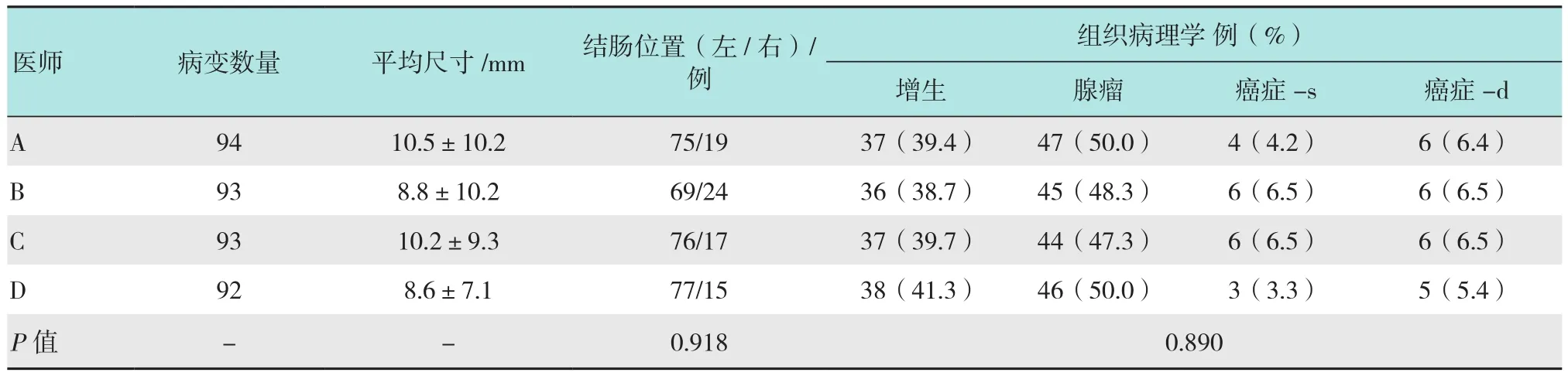
表4 4个受训内镜医师在目前的研究中病变的检测情况Table 4 Lesions detected by the four endoscopists trained in the present study
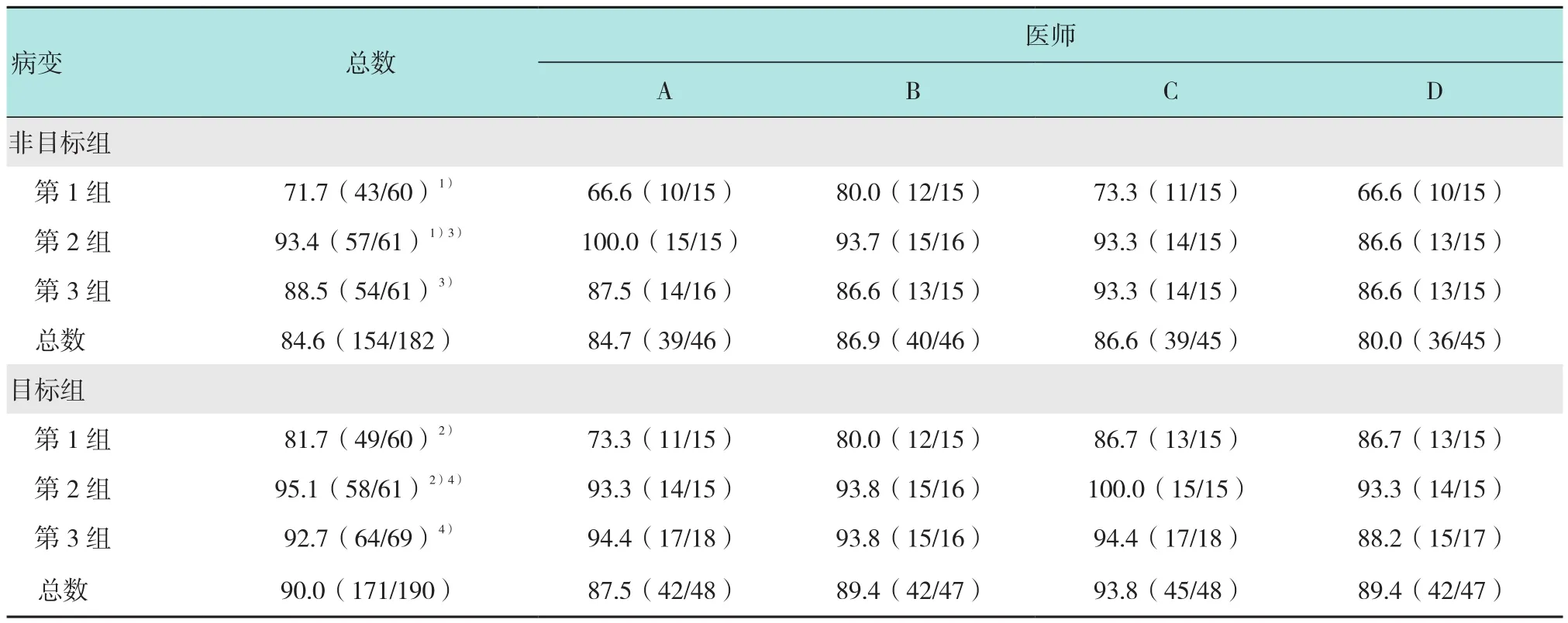
表5 目标组和非目标组的内镜诊断准确率 %Table 5 Endoscopic diagnostic accuracy for target and non-target lesions %
3 讨论
现代电子内镜系统由于可以提供清晰可视化的图像,已成为各大综合性医院内镜中心的标准配置。同时,借助黏膜检查技术,可实现即时的内镜下组织学诊断,使这些技术的潜力变得更加明显。病理组织学诊断仍然是鉴别肿瘤及非肿瘤性病变的金标准,但仅仅依靠病理诊断来鉴别结直肠病变,往往需要重复内镜操作及重复病理诊断,在增加患者医疗费用的同时也增加了医务人员的工作量,人们迫切期望内镜技术在拥有高准确性和稳定性的基础上能够鉴别肿瘤及非肿瘤性病变。NBI是一种创新的光学技术,是非侵入性的且简单易行的黏膜表面构造和微血管形态观察工具,易于使用,已被证实可用于诊断结肠直肠病变,多项研究评估了NBI的使用潜力,可促进结肠息肉的实时组织学诊断的发展,研究数据一致表明,熟练的NBI操作者能够准确地区分增生病变与腺瘤性息肉[8-9]。然而,NBI需要内镜医师掌握足够的技能。因此,内镜医师在临床上学习和应用这项技术是掌握NBI的关键。
此 前 PATEL[10]、SINGH[11]、RAMESHSHANKER[12]等的研究描述了NBI结合放大内镜在诊断结直肠病变中的学习曲线,并指出对于没有相关经验的临床医生,在经过短期的培训课程或计算机模拟软件培训后可获得良好的诊断准确率及较高的组间一致性。然而这些研究仅仅是使用佐野CP分型对病变图片进行判断,并没有获得实际操作中的数据。在本研究中,同以往的NBI学习曲线文章相似,也采用了培训加预测试的模式,4位医师对于NBI在结直肠病变中的应用几乎没有了解的情况下,经过了短时间的培训后,其前测试的准确率达到了95.1%,与EAST及HEER等[13-14]的结果相符,可见NBI原理及其诊断标准(佐野CP分型)较易掌握,并可以通过短暂的学习在鉴别结直肠病变的诊断上达到较高的准确率。但是在实际操作中,目标病变及非目标病变的诊断准确率(尤其是第1组的诊断准确率81.7%和71.7%均低于预测验的结果)。造成这一结果的原因可能有以下几点:①放大内镜需要内镜医师稳定的操作以及对放大倍率和距离的熟练掌控,以获取清晰的图片用于诊断;②在实际操作中病变的部位、肠道准备的情况以及病变表面的黏液等都会影响医师的判断;③实际操作中需要经验的累积以获得做出独立判断的信心。由此可见,单纯靠专业的NBI医师在操作中获得的图片来做出诊断从而得出的结果仅仅反应了参与者对佐野分型的掌握程度,并不能完全反映内镜医师在实际操作中的诊断准确率。在实际操作中,内镜医师对放大内镜操作的掌握程度以及肠道和病变的情况都会影响最终的诊断准确率。
研究表明浸润深度小于1 000μm的早期肠道肿瘤几乎没有发生淋巴转移的风险,这一类的病变适合于内镜下治疗;相反浸润深度大于1 000μm的肠道肿瘤发生淋巴转移的风险约为6.0%~12.0%[15],不适合内镜下治疗。同时,肿瘤的浸润深度并不能通过内镜活检标本来鉴别,只有在内镜治疗或手术后将标本行病理组织学检查时才能了解其浸润深度。若对于浅表肿瘤行外科手术治疗,则称为治疗过度,因不必要的手术增加了治疗风险,同时也增加了患者的住院天数;若对于深部浸润肿瘤行内镜治疗,则为治疗不足,需进一步追加手术;无论是治疗过度还是治疗不足都会增加不必要的医疗费用,都应极力避免其发生。基于以上原因,内镜下鉴别结直肠肿瘤的浸润深度就显得十分重要。在未来的研究中,应包括更多的病变,特别是癌性病变,以评估与癌性病变相关的学习曲线。
NBI具有高的鉴别诊断精确度,并且代表提高准确诊断结肠直肠病变的必要诊断技术的新方法,同时NBI还具有其他临床优势。首先,在结肠镜检查过程期间的常规白光内镜视图可以使用结肠镜的控制手柄上的单个按钮几乎瞬时切换到NBI视图。第二,NBI不需要染料或染色溶液来检测和区分肿瘤性或者非肿瘤性病变。在临床中,已经使用常规的白光内镜检查来诊断结肠直肠病变,报道显示[16]常规白光结肠镜检查增生性和腺瘤性病变分化的诊断准确性不能令人满意。然而,内镜诊断是临床所必需的,为了获得病理样本,笔者切除了所有被怀疑为腺瘤的病变。对于疑似增生的病变,常常犹豫是否需要进行病理检查的切除。在最近的一项研究中,KALTENBACH等[17]使用NBI国际结肠直肠内镜分型(narrow band imaging international colorectal endoscopic,NICE)“切除和丢弃”策略获得了良好的结果,通过该策略可以改善结肠镜筛查病变的成本效益。然而,需要更多的前瞻性研究来证明这种方法对于临床诊断的可用性、可行性和可靠性。具体来说,需要对小病变(例如<5.0 mm)进行研究,以确定对于没有NBI经验的内镜专家在应用了“切除和丢弃”策略后需要多少病例能准确诊断病变。
综上所述,NBI和佐野CP分型用于临床诊断结肠直肠病变是有效的。此外,笔者证实对于没有NBI操作经验的内镜医生,在完成短期培训课程和实践后,可以获得有效的、稳定的诊断准确性。
[1]NONAKA T, INAMORI M, HONDA Y, et al. Can magnifying endoscopy with narrow-band imaging discriminate between carcinomas and low grade adenomas in gastric super ficial elevated lesions[J]. Endosc Int Open, 2016, 4(11): E1203-E1210.
[2]UTSUMI T, IWATATE M, SANO W, et al. Polyp detection,characterization, and management using narrow-band imaging with/without magni fication[J]. Clin Endosc, 2015, 48(6): 491-497.
[3]邱全兴, 汤瑜, 徐威, 等. 放大内镜结合窄带成像技术靶向活检诊断早期胃癌价值[J]. 中华实用诊断与治疗杂志, 2016, 30(12):1233-1235.
[3]QIU Q X, TANG Y, XU W, et al. The value of magnifying endoscopy combined with narrow-band imaging in targeted biopsy for early gastric cancer[J]. Chinese Journal of Practical Diagnosis and Therapy, 2016, 30(12): 1233-1235. Chinese
[4]HIGASHI R, URAOKA T, KATO J, et al. Diagnostic accuracy of narrow-band imaging and pit pattern analysis significantly improved for less-experienced endoscopists after an expanded training program[J]. Gastrointest Endosc, 2010, 72(1): 127-135.
[5]RAGHAVENDRA M, HEWETT D G, REX D K. Differentiating adenomas from hyperplastic colorectal polyps: narrow-band imaging can be learned in 20 minutes[J]. Gastrointest Endosc,2010, 72(3): 572-576.
[6]IGNJATOVIC A, THOMAS-GIBSON S, EAST J E, et al.Development and validation of a training module on the use of narrow-band imaging in differentiation of small adenomas from hyperplastic colorectal polyps[J]. Gastrointest Endosc, 2011, 73(1):129-133.
[7]DAI J, SHEN Y F, SANO Y, et al. Evaluation of narrow-band imaging in the diagnosis of colorectal lesions: Is a learning curve involved[J]. Digestive Endoscopy, 2013, 25(2): 180-188.
[8]MCGILL S K, SOETIKNO R, RASTOGI A, et al. Endoscopists can sustain high performance for the optical diagnosis of colorectal polyps following standardized and continued training[J].Endoscopy, 2015, 47(3): 200-206.
[9]TAKEMURA Y, YOSHIDA S, TANAKA S, et al. Computer-aided system for predicting the histology of colorectal tumors by using narrow-band imaging magnifying colonoscopy (with video)[J].Gastrointestinal Endoscopy, 2012, 75(1): 179-185.
[10]PATEL S G, RASTOGI A, AUSTIN G, et al. Gastroenterology trainees can easily learn histologic characterization of diminutive colorectal polyps with narrow band imaging[J]. Clinical Gastroenterology and Hepatology, 2013, 11(8): 997-1003.
[11]SINGH R, BHAT Y M, THURAIRAJAH P H, et al. Is narrow band imaging superior to high-de finition white light endoscopy in the assessment of diminutive colorectal polyps[J]. Journal of Gastroenterology and Hepatology, 2013, 28(3): 472-478.
[12]RAMESHSHANKER R, WILSON A. Electronic imaging in colonoscopy: clinical applications and future prospects[J]. Curr Treat Options Gastroenterol, 2016, 14(1): 140-151.
[13]EAST J E, SUZUKI N, BASSETT P, et al. Narrow band imaging with magnification for the characterization of small and diminutive colonic polyps: pit pattern and vascular pattern intensity[J]. Endoscopy, 2008, 40(10): 811-817.
[14]HERR H, DONAT M, DALBAGNI G, et al. Narrow-band imaging cystoscopy to evaluate bladder tumours--individual surgeon variability[J]. BJU International, 2010, 106(1): 53-55.
[15]ALVAREZ HERRERO L, CURVERS W L, BANSAL A, et al.Zooming in on Barrett oesophagus using narrow-band imaging:an international observer agreement study[J]. European Journal of Gastroenterology and Hepatology, 2009, 21(9): 1068-1075.
[16]ROGART J N, JAIN D, SIDDIQUI U D, et al. Narrow-band imaging without high magnification to differentiate polyps during real-time colonoscopy: improvement with experience[J].Gastrointestinal Endoscopy, 2008, 68(6): 1136-1145.
[17]KALTENBACH T, HEWETT D, SANO Y, et al. Development,validation, and proof of concept of bedside use of the narrow band imaging international colorectal endoscopic (NICE)classi fication to facilitate resect & discard strategy[J]. Journal of Gastroenterol and Hepatol, 2011, 26: 133-134.
Evaluation of narrow-band imaging in the diagnosis of colorectal lesions and learning curve
Shang-wen Yang, Mu-gen Dai, Qing-wu Lian, Tao-mei Zhou, Bin Ye, Wei-li He
(Department of Gastroenterology, Lishui Central Hospital, Lishui, Zhejiang 323000, China)
ObjectiveTo evaluate the usefulness of narrow-band imaging with magni fication in differentiating colorectal lesions, and assess for a learning curve, to gave help for the clinician, who want to carry out the technique.MethodWe retrospectively analyzed the clinical data of 289 patients who underwent NBI combined with magnification by four endoscopic physician, from June, 2015 to June, 2016, all the lesions were biopsied,endoscopic treatment or postoperative pathology and pathological examination, and the Sano classi fication control.All lesions were divided into three groups according to the NBI combined with magnifying endoscopy, these three sets included both lesions requiring endoscopic treatment (e.g. target lesions) and lesions that were not, or could not be, treated by endoscopy (e.g. nontarget lesions). Each physician examined the target or non-target lesion reached 15 cases as a group. By assessing the diagnostic accuracy of the four physicians for each group of lesions, an associated learning curve of NBI combined with magnifying endoscopy was developed.ResultIn 289 patients, 372 lesions were found by colonoscopy. NBI combined with magnifying endoscopy was 95.1%, 98.0% and 92.0%, respectively,in the identification of tumor and non-neoplastic lesions. The accuracy of the diagnosis of target and non-target lesions was significantly higher in group 2 than in group 1 [81.7% vs 95.1% (P= 0.010) and 71.7% vs 93.4%(P= 0.000)]. There was no signi ficant difference in the diagnostic accuracy between group 2 and group 3 (P= 0.984 andP= 0.117).ConclusionIt is very useful to use narrow-band imaging and Sano CP analysis in the differential diagnosis of colorectal lesions. The endoscopists who had never used NBI or no knowledge of NBI can have effective and stable diagnostic accuracy after using NBI with magnification to diagnose 15 target and non-target lesions respectively.
colorectal lesions; endoscopy; diagnosis; narrow-band imaging; learning curve
R445.9
A
10.3969/j.issn.1007-1989.2017.09.010
1007-1989(2017)09-0052-07
2017-03-27
叶斌,E-mail:408252097@qq.com
(吴静 编辑)
