自身免疫性胰腺炎继发囊性病变的影像特征分析
2021-08-05王佳妮张斌斌刘朋张洁杨正汉靳二虎
王佳妮 张斌斌 刘朋 张洁 杨正汉 靳二虎
自身免疫性胰腺炎(autoimmune pancreatitis,AIP)是由于自身免疫异常所导致的一种特殊类型的慢性胰腺炎[1-2]。AIP 病人的胰腺实质出现囊性病变既往较为罕见,但近年国内外有关AIP 伴有胰腺实质内囊性病变的个案报道逐渐增多[3-5]。国内文献有关AIP 胰腺实质内囊性病变影像特征的报道很少,仅在论述AIP 相关影像特征时偶有提及[6],而且缺乏对其演变及转归的系统性观察报道。为进一步了解AIP 继发胰腺囊性病变的影像特征,本研究收集一组AIP 继发胰腺实质内囊性病变的病人资料,总结其CT 和MRI 影像特征并进行随访观察。
1 资料与方法
1.1 一般资料 回顾性收集2014 年1 月—2020年6 月于首都医科大学附属北京友谊医院诊断为AIP 的病人45 例。首发症状包括黄疸(7 例)、上腹部疼痛(7 例)和体质量下降(5 例)。纳入标准:①AIP 诊断符合2011 年AIP 国际诊断标准共识[7]。②AIP 病人在本院进行首诊,且至少接受2 次CT和/或MRI 增强扫描检查。③首次或随访影像检查发现胰腺实质内囊性病变。④病人均有完整的临床、实验室检查和影像检查资料。排除标准:①CT 和MRI 影像质量差,影响病变观察;②经穿刺活检或手术切除后病理证实AIP 同时伴有胰腺囊腺瘤、胰腺导管内乳头状黏液性肿瘤等肿瘤性疾病。最终纳入9 例AIP 伴胰腺实质囊性病变病人,均为男性,年龄 46~86 岁,平均(56.3±7.9)岁。9 例病人均经口服激素治疗并接受CT 和MRI 增强检查随访,随访时间为12~63 个月,中位随访时间45 个月。
1.2 检查方法 CT 检查:采用GE 公司的Lightspeed 64 排CT 扫描设备,行平扫联合增强扫描。病人取仰卧位,扫描范围自膈顶至髂前上棘。扫描参数:管电压120kV,管电流125~300 mA,准直层厚0.5~0.75 mm,螺距 0.6~1.25,重建层厚 3 5 mm,重建间隔3~5 mm,多平面3D 容积再现(VR)重组层厚0.5~1.0 mm,间隔0.3~0.5 mm。增强扫描经肘静脉注入对比剂碘海醇(含碘 320 mg/mL)80~100 mL,延迟25 s、60 s 采集动脉期及静脉期影像。MRI 检查:采用 GE Discovery MR750 3.0 T MR 设备,8 通道相控阵体部表面线圈。病人取仰卧位,扫描范围自膈顶至双肾下极水平。扫描序列:横断面脂肪抑制快速扰相梯度回波(fast spoiled gradient recalled echo,FSPGR)-T1WI,TR 200 ms,TE 2.7 ms;横断面单次激发快速自旋回波(signal shot fast spin echo,SSFSE)-T2WI,TR 1 000 ms,TE 80 ms;横断面脂肪抑制 FSE T2WI,TR 6 000 ms,TE 106.5 ms;扩散加权成像(DWI),激励次数 4 次,b=0、800 s/mm2;FSPGR T1WI 动态增强扫描经肘静脉团注对比剂钆喷替酸葡甲胺(Gd-DTPA,0.5 mmol/mL),注射剂量 0.1 mmol/kg,流率 2 mL/s,延迟 25、60、240 s 扫描以获得动脉期、静脉期及延迟期影像。MR 胆胰管成像(MRCP)采用屏气二维采集技术,SSFSE 重T2加权成像序列,以体轴为中心,间隔5°重建并最终形成12 幅影像。
1.3 影像分析 由2 名具有15 年工作经验的放射科医师共同阅片,意见分歧时通过讨论达成一致。观察内容包括:①首诊时胰腺实质、胰周(是否出现假包膜,是否累及胰周血管)及病变部位胰管的影像表现;②胰腺内囊性病变的特征,包括病灶出现时间(初诊、治疗后)、数目、部位、大小、形态、密度/信号特点、强化方式以及激素治疗后的转归(消失、变小)。
2 结果
2.1 首诊AIP 胰腺实质、胰周及病变部位胰管影像表现 9 例AIP 病人中8 例胰腺实质呈弥漫性肿大,1 例仅体尾部肿大。CT 平扫显示胰腺实质病变均呈低密度;MRI 上均表现为脂肪抑制FSPGR T1WI 上呈稍低信号,脂肪抑制FSE/SSFSE T2WI 上呈稍高信号,DWI 上呈明显高信号,表观扩散系数(ADC)图上呈低信号。CT/MRI 增强扫描显示9 例AIP 胰腺实质病变均呈延迟强化,胃底、胃大小弯侧及脾门处静脉迂曲扩张(因脾静脉受累而出现胰源性区域性门静脉高压)。6 例胰腺周围可见假包膜,在CT 平扫呈等或稍低密度,MRI 脂肪抑制FSPGR T1WI 和脂肪抑制FSE/SSFSE T2WI 上均呈低信号。9 例MRCP 均显示主胰管不规则狭窄(图1)。
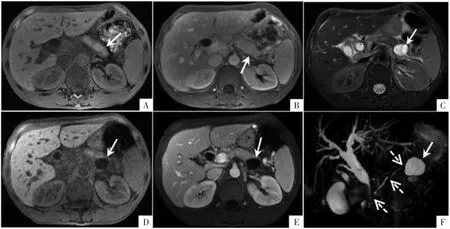
图1 AIP 病人,男,45 岁。初次MRI 检查横断面脂肪抑制FSPGR T1WI(A)显示胰腺肿胀,胰周见稍低信号的假包膜(箭)。横断面增强扫描静脉期(B)显示脾静脉凹凸不平,强化不均匀(箭)。病人停药后复发,横断面MRI 脂肪抑制FSE T2WI(C)和横断面脂肪抑制FSPGR T1WI(D)显示胰腺尾部新出现一个囊性病灶(箭),信号均匀,横断面增强扫描静脉期(E)病灶未见强化(箭),脾门区静脉迂曲。MRCP(F)显示胰腺段胆总管狭窄,上游胆管扩张;主胰管粗细不均、断续显示(虚箭),胰尾病灶呈高信号(箭)。
2.2 AIP 继发胰腺内囊性病变的特征
2.2.1 囊性病变的出现时间 9 例AIP 病人中5 例在首诊时胰腺实质内已出现囊性病变,其中3 例接受激素治疗后囊性病变完全消失,随访期间未再出现;1 例经激素治疗后在随访期间囊性病变体积减小,尚未完全消失;1 例经激素治疗后胰体部囊性病变消失,病情缓解停药后在胰头部新出现囊性病变。另4 例AIP 病人首诊时影像检查胰腺实质内未见囊性病变,其中3 例在激素治疗减量期影像随访发现胰腺内囊性病变,1 例在病情缓解停用激素后影像复查发现胰腺实质内出现囊性病变。
2.2.2 囊性病变的数目、部位及大小 9 例AIP 病人共发现16 个囊性病变,其中4 例为多发,5 例为单发;7 个囊性病变位于胰头,2 个位于胰颈,7 个位于胰尾;8 个囊性病变为首诊时影像检查发现,另8个为复查时新出现。16 个囊性病变中截面积最大者为 5.0 cm×2.5 cm(图 2),最小者为 0.8 cm×0.6 cm。
2.2.3 囊性病变的形态及强化方式 16 个囊性病变中,13 个经过激素治疗,余3 个为最后一次影像随访时新发现。在经过激素治疗的13 个囊性病变中,11 个呈形态规则的类圆形,2 个形态不规则;病变于CT 平扫上均呈低密度;病变在MRI 脂肪抑制FSPGR T1WI 上均呈明显低信号,4 个在脂肪抑制FSE /SSFSE T2WI 上呈不均匀高信号,且胰周脂肪间隙模糊,9 个呈均匀高信号。随访时新发现的3 个囊性病变均呈形态规则的类圆形,CT 平扫呈低密度,MRI 脂肪抑制FSPGR T1WI 呈明显低信号,脂肪抑制FSE /SSFSE T2WI 上呈均匀高信号。CT 和MRI 增强扫描时,16 个囊性病变均呈无强化的单房结构。
2.2.4 囊性病变的激素治疗后转归 随访发现,经激素治疗的13 个囊性病变中11 个完全消失,随访时间为 3~30 个月,平均(11.45±8.11)个月;2 个明显缩小,1 个由 5.0 cm×2.5 cm 缩小至 0.8 cm×0.6 cm(图 2),随访时间 10 个月,另 1 个由 1.2 cm×0.8 cm缩小至0.5 cm×0.5 cm,随访时间8 个月。
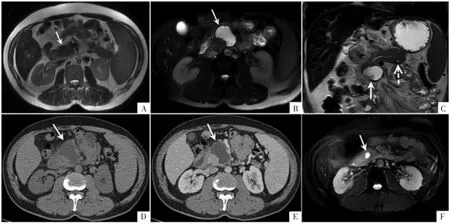
图2 AIP 病人,男,49 岁。初次MRI 检查横断面SSFSE T2WI(A)显示胰头形态饱满(箭),未见囊性病灶。病人停药后复发,横断面脂肪抑制FSE T2WI(B)和冠状面SSFSE T2WI(C)显示胰头内一不均匀高信号的囊性病灶(箭),大小5.0 cm×2.5 cm,形态不规则,胰尾部(C)另见一较小高信号囊性病灶(虚箭)。横断面CT 平扫(D)显示胰头部囊性病灶呈低密度(箭),横断面CT 增强扫描静脉期(E)显示病灶无强化(箭)。病人再次接受治疗后复查,横断面脂肪抑制FSE T2WI(F)显示胰头囊性病灶明显变小(箭)。
3 讨论
AIP 继发胰腺内囊性病变已有文献报道[8-10],发生率可达9.7%~22.4%[11]。本组AIP 病人中胰腺内囊性病变的发生率为20.0%(9/45 例),与上述文献报道结果基本一致。此外,本研究发现有5 例AIP 病人在首诊时胰腺实质内已出现囊性病变,此特点既往文献鲜有报道。
3.1 AIP 胰腺实质内囊性病变的形成机制 AIP 继发囊性病变的主要原因是病变部位胰管狭窄、梗阻,进而导致上游胰管内高压及胰液潴留,形成潴留性囊肿[8]。如果上皮细胞从囊壁脱落,潴留性囊肿可转变为假性囊肿[11-13]。本研究中9 例AIP 病人病变部位胰管均出现不规则狭窄,与文献[8]报道的结果基本相符,进一步佐证囊性病变的形成主要由于胰管不规则狭窄、闭塞所致。此外,本组有5 例AIP病人在接受激素治疗后影像检查发现胰腺实质内新出现囊性病变,同时病变部位胰管呈不规则狭窄、闭塞,结合临床考虑这5 例病人均处于复发状态。由此可见,在激素治疗维持期及停药期间新出现的囊性病变可能与胰管狭窄残留或复发有关,进一步推测,新出现的囊性病变可能提示病人病情复发,但此观点需要更大样本量来进一步分析证实。
Kubota 等[10]研究认为,AIP 病人伴有胰源性门静脉高压所致的静脉曲张,是囊性病变形成的独立预测因子。AIP 病变处的大量IgG4 阳性浆细胞可对胰周血管形成局部炎性浸润,使其管腔狭窄、闭塞,继而形成胰源性区域性门静脉高压和静脉曲张[14-15]。本组9 例病人均出现胰源性门静脉高压和区域性静脉曲张。因此,早期发现AIP 累及胰周血管时,无论是否存在囊性病变,都应积极给予激素治疗,以防止胰腺内形成新的囊性病变。
3.2 AIP 继发胰腺内囊性病变的影像特征 AIP 胰管狭窄所致的潴留囊肿在胰腺体尾部发生率较高,可达 76.5%~91.7%,这与胰管的解剖结构有关[9,11,16]。当背胰导管胰头段退化不全而形成副胰管时,由于胰头部主胰管、副胰管同时引流胰液,而胰体尾部仅有主胰管引流胰液,因此AIP 胰管狭窄所致的潴留囊肿更易发生在胰腺体尾部[9]。本组囊性病变仅有7 个(7/16,43.8%)发生在胰尾部,与上述文献报道的发生率有所不同,考虑与本组病例样本量较小有关。
本组治疗有效的13 个胰腺囊性病变中,4 个囊性病变在MRI 脂肪抑制FSE/SSFSE T2WI 呈不均匀高信号,结合此影像特点考虑这4 个病变为胰腺实质内的包裹性坏死。由此推断,AIP 胰腺实质内的囊性病变除文献[8,11]报道的潴留囊肿外,还可为胰腺实质内包裹性坏死。最新出现的3 个囊性病变,结合影像表现及临床病史,考虑其均为潴留囊肿。此外,对比囊性病变在CT 和MRI 的影像表现,本研究结果显示MRI 对分析囊内容物成分较CT 更具有优势。囊性病变在MRI 脂肪抑制FSE/SSFSE T2WI 上的信号特点(均匀/不均匀)可一定程度反映囊内容物的成分,由此推断囊性病变为潴留囊肿或包裹性坏死。
本组经过激素治疗的AIP 囊性病变明显变小或完全消失,推测可能与病人接受治疗后有效缓解胰管狭窄,促进胰液释放有关。Kubota 等[10]报道,激素通常对直径>5.5 cm 的AIP 囊性病变治疗效果欠佳。本组研究显示最大的囊性病变为5.0 cm×2.5 cm,经过治疗后明显变小。AIP 继发的胰腺囊性病变也会发生破裂、出血以及感染等[13,17]。因此,当影像检查发现AIP 病人的胰腺实质内出现囊性病变时,经过CT 或MRI 影像特征评估及鉴别诊断确诊后,建议尽早进行激素治疗。
3.3 鉴别诊断 有研究[18-19]发现AIP 病人偶伴发胰腺囊腺瘤、胰腺导管内乳头状黏液性肿瘤等肿瘤性囊性病变,因此鉴别诊断尤为重要:①胰腺囊腺瘤,浆液性囊腺瘤以微囊型多见,典型影像表现为病变中心可见放射状分隔且伴有钙化;黏液性囊腺瘤为单房或多房的囊性肿物,其内伴强化的结节及分隔[20]。②胰腺导管内乳头状黏液肿瘤,主胰管及分支胰管内单发或多发的囊实性肿物,受累胰管膨胀性扩张[21]。此外,临床观察及影像随访提示激素治疗有效,可作为鉴别诊断依据之一。
本研究作为回顾性研究,尚存在以下局限性:①分析随访病例影像时,少数病人的MR 扫描序列前后不完全一致;②样本量偏小,可能存在偏倚;③本研究中明显减小的囊性病灶最终是否会完全消失,还需进一步随访观察。
总之,胰腺囊性病变在AIP 中并不少见,其为胰腺实质内潴留囊肿或包裹性坏死。这些囊性病变可见于AIP 首诊病人,也可新发于CT 或MRI 随访期间。囊性病变可为单发或多发,CT 平扫呈低密度,MRI 脂肪抑制FSPGR T1WI 呈明显低信号,脂肪抑制FSE/SSFSE T2WI 序列呈均匀或不均匀的高信号,增强扫描病变无强化。直径<5.0 cm 的囊性病变可经激素治疗后显著变小甚至完全吸收。充分认识AIP 继发胰腺内囊性病变的影像特征,有助于及时发现并做出正确诊断,进而为临床治疗提供可靠依据。
