miR-374b靶向PD-1/PD-L1信号通路增强CIK杀伤肿瘤细胞效应
2017-10-13曾江正卢彦达何志惠雷俊华
黄 芬 曾江正 卢彦达 洪 涛 何志惠 雷俊华
(海南医学院第一附属医院肿瘤内科 海南医学院第一附属医院肿瘤学部,海南 海口 571100)
miR-374b靶向PD-1/PD-L1信号通路增强CIK杀伤肿瘤细胞效应
黄 芬 曾江正 卢彦达 洪 涛 何志惠 雷俊华
(海南医学院第一附属医院肿瘤内科 海南医学院第一附属医院肿瘤学部,海南 海口 571100)
目的探讨miR-374b在增强细胞因子诱导杀细胞(CIK)抗肿瘤中的作用及机制。方法采用传统方法培养CIK,用流式细胞确定CIK细胞群且分选出CIK;流式分析HepG2、PLC、H1299、A549的程序性坏死蛋白(PD)-L1表达;采用双荧光素酶系统检测miR-374b在PD-1上的结合,siRNA技术干扰降低miR-374b基因的表达;酶联免疫吸附(ELISA)检测CIK的γ干扰素(IFN-γ)表达;乳酸脱氢酶(LDH)释放法检测CIK体外杀伤肿瘤细胞的能力;过继回输检测CIK体内杀伤肿瘤细胞的能力。结果双荧光素酶系统显示miR-374b可以直接作用于PD-1基因上;HepG2、PLC、H1299、A549肿瘤细胞系都有比较高的PD-L1表达;miR-374b抑制剂会降低CIK分泌IFNr的水平,抑制CIK在体内和体外对肿瘤细胞的杀伤能力;PD-1 siRNA会提高CIK分泌IFN-γ的水平,增强CIK在体内和体外对肿瘤细胞的杀伤能力。结论miR-374b可以直接作用于PD-1基因的表达,抑制miR-374b可以增强CIK杀伤肿瘤能力,干扰PD-1表达可以提高CIK抑制肿瘤能力。
细胞因子诱导杀伤细胞;PD-1/PD-L1;流式细胞术
细胞因子诱导杀伤细胞(CIK)是新一代肿瘤过继免疫治疗的首选方案。程序性死亡蛋白(PD)-1可表达于B细胞、自然杀伤(NK)细胞、树突细胞(DC),还有活化的单核细胞。其主要表达于活化的T细胞表面,与其配体相互作用,抑制外周组织中的持续免疫反应,并且阻止自身组织受到免疫损伤〔1〕。PD-1 的配体包括 PD-L1 和 PD-L2,主要在巨噬细胞、单核细胞中表达。肿瘤细胞上的PD-L1与T细胞表面的PD-1相互作用,可以诱导对抗肿瘤的T细胞凋亡,从而产生免疫逃逸〔2〕。miR-374b在对抗肿瘤中具有重要作用〔3〕。CIK对抗肿瘤细胞可能通过miR374b调控PD-1/PD-L1信号通路来进行。本文拟对此进行分析。
1 材料与方法
1.1仪器与试剂 T细胞培养基:RPMI-1640培养基,10%FBS(Gibco 900-108),青霉素/链霉素溶液(Gibco 15140-122),2-巯基乙醇(Invitrogen 21985-023)。流式荧光抗体:购于Biolegend公司。IFN-γ的ELISA检测试剂盒购自eBioscience公司。SYBR Green:takara公司。流式仪器:calibur,BD LSRFortessa;分选仪器:BDFACSAria Ⅱ。
1.2CIK 的诱导和培养 将来源于健康志愿者的外周血用淋巴细胞分离液(Ficoll)采用密度梯度离心法分离出外周血单个核细胞。在48孔板中,每孔种植5×106,加入1 ml RPMI1640培养置于 37℃、5% CO2培养箱中培养 2 h。收集非贴壁细胞调整细胞浓度为 1×106/孔,并加入1 000 U/ml γ-干扰素(IFN-γ)继续培养,24 h后加入50 ng/ml抗人CD3 及1 000 U/ml白细胞介素(IL)-2,每3天换液1次,并补充IL-2。在培养14、21、28 d收集细胞并进行免疫表型CD3+CD56+的检测。
1.3细胞介导的细胞毒作用 采用乳酸脱氢酶(LDH)释放法检测。特异性杀伤活性的计算:杀伤活性(%)=〔(OD实验组-OD总自然释放)/(OD最大释放组-OD总自然释放)〕×100%。
1.4细胞因子刺激 将分离得到的细胞在1 ml T细胞培养基中,加入25 ng/ml PMA和1 μg/ml离子霉素并孵0.5 h。再加 2 μmol/L莫能菌素继续孵育4~5 h。
1.4.1流式抗体标记 (1)表面抗体标记:将细胞重悬在100 μl磷酸盐缓冲液(PBS)中,按照1×106细胞标1 μl流式抗体。置于冰中避光孵育30 min,再加2 ml PBS洗1~2次。(2)胞质细胞因子与核内转录因子标记:购买Ebioscience公司胞质与核固定液,按照说明书进行固定标记。
1.4.2RT-PCR检测 将分离得到的细胞提取RNA,反转录成cDNA,用SYBR Green 进行荧光定量PCR检测。
1.5过继回输实验 取40只患黑色素瘤鼠的肿瘤组织8 mm3,皮下移植到免疫缺陷的NOD/SCID鼠体内,分成4组,每组10只。肿瘤移植1 w后,一组尾静脉注射PBS作为对照,一组尾静脉注射培养的人CIK,一组尾静脉注射加了miR374b抑制剂培养的人CIK,一组尾静脉注射了加PD-1 siRNA的人CIK。细胞数为1×107/只,每周注射一次,连续6 w。观察记录小鼠的存活情况。
1.6统计学方法 采用SPSS17.0软件行单因素方差分析。
2 结 果
2.1培养、分离及鉴定CIK(CD3+CD56+T) 在第14天,同时表达CD3+CD56+的CIK比例达到最大(图1)。由图2可见,使用PD-1 siRNA作用于CIK后,从mRNA和Western印迹结果都显示,CIK的PD-1表达明显降低。
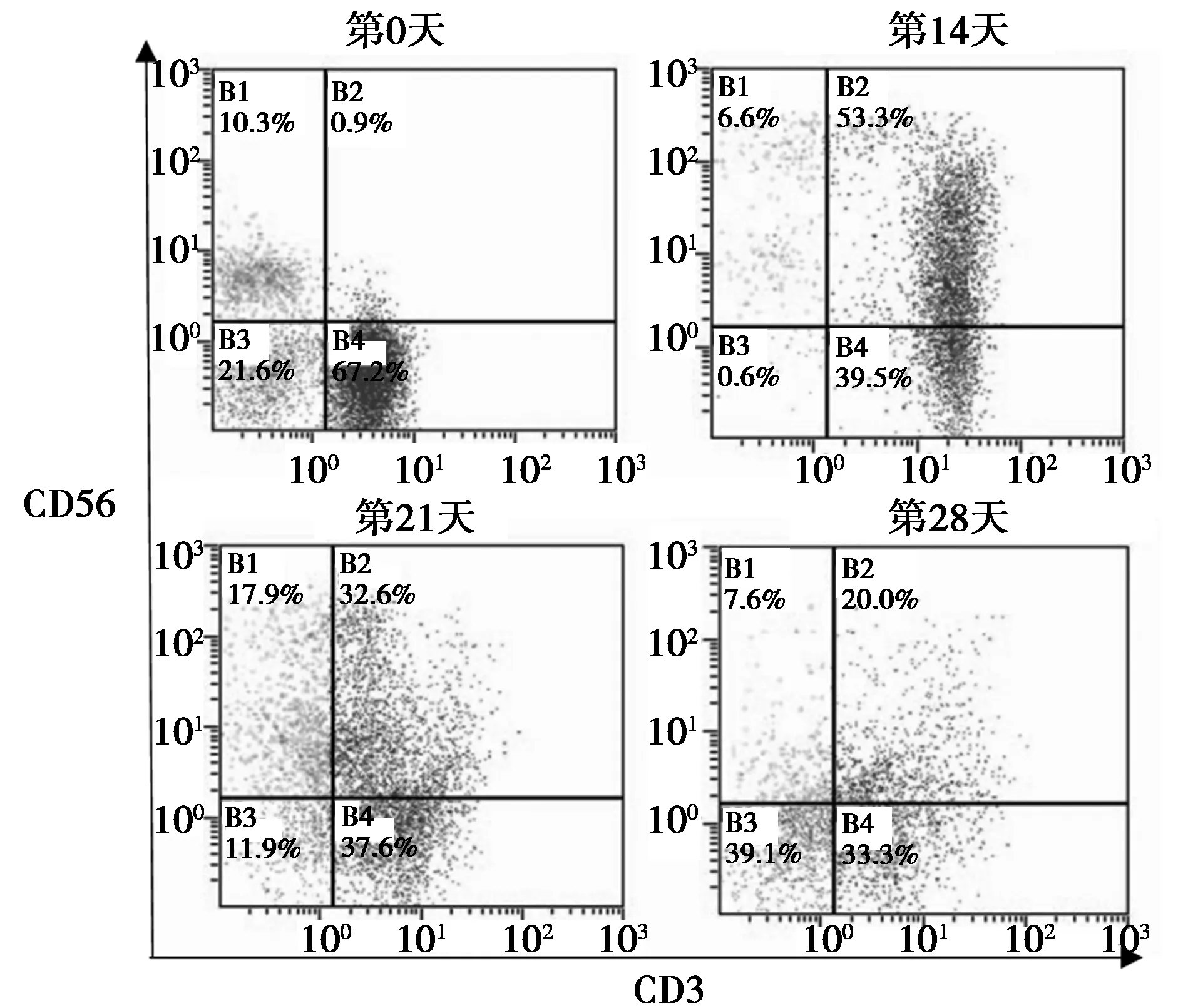
图1 流式细胞术分析与分选CIK细胞
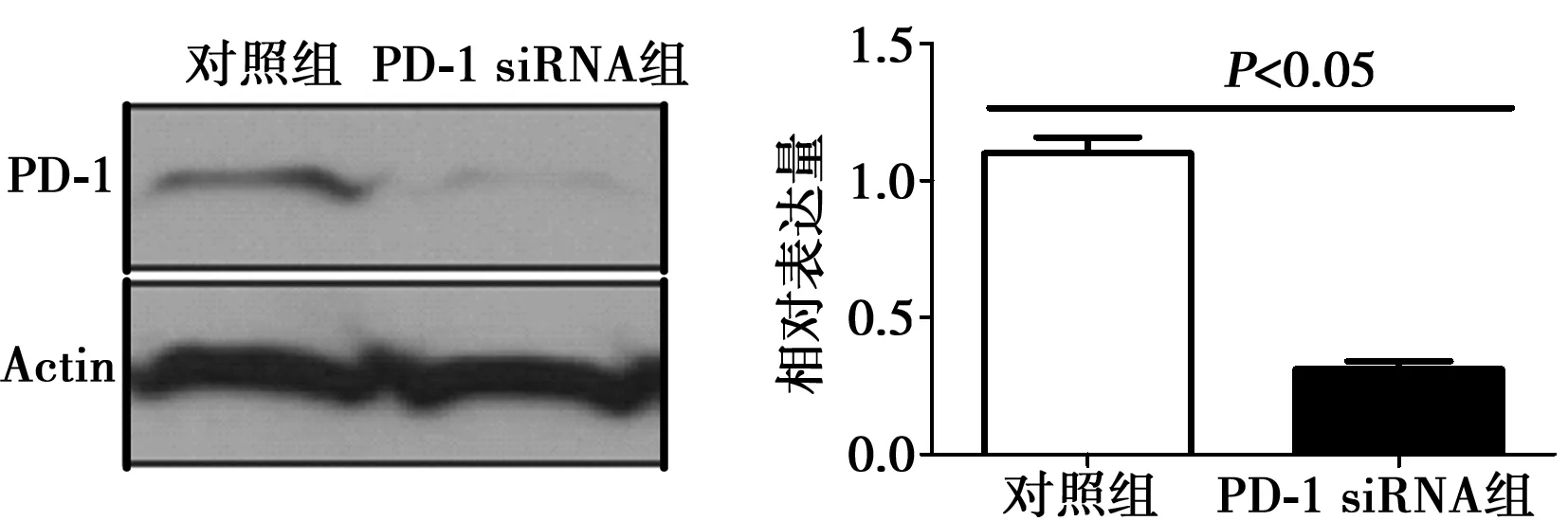
图2 RT-PCR与Western印迹检测PD-1 siRNA抑制CIK细胞的PD-1表达
2.2双荧光素酶系统检测及验证miR-374与PD-1的靶向关系 连接了miR374b的荧光活性低于PGL3质粒空载(P<0.05)。见图3。2.3流式细胞仪分析HepG2、PLC、H1299、A549的PD-L1表达情况 PD-L1 在HepG2、PLC、H1299、A549 4种细胞系里都有比较高的表达,其在肺癌细胞株H1299中表达最高,在A549细胞系中表达相对最低(P<0.01)。见图4。
2.4CIK分泌IFN-γ能力的测定 加入miR374b抑制剂的CIK,相比没有处理组的,其分泌IFN-γ的能力显著下降(P<0.01),而如果转入能降低PD-1表达的PD-1 siRNA后,,其分泌IFN-γ能力显著上升(P<0.001)。见图5。
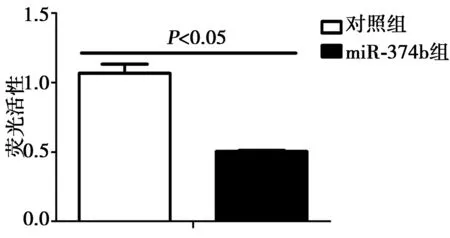
图3 双荧光素酶系统检测miR-374与PD-1的靶向关系
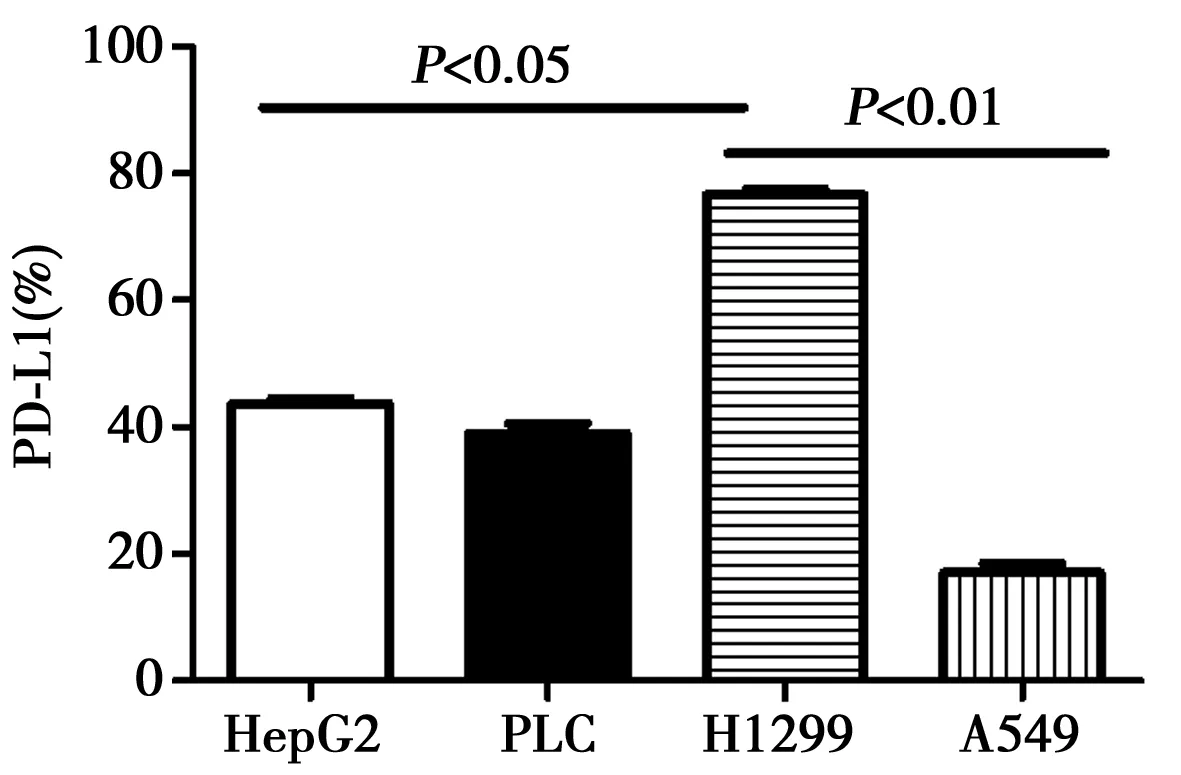
图4 流式细胞仪分析HepG2、PLC、H1299、A549的PD-L1表达
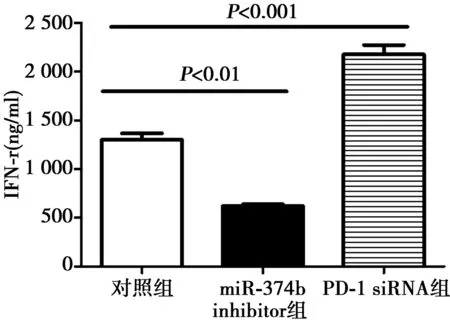
图5 ELISA检测CIK细胞分泌IFN-γ水平
2.5LDH释放法检测CIK细胞杀伤肿瘤细胞的能力 正常情况下,CIK对4种肿瘤细胞具有良好的杀伤效率。而加入了miR374b抑制剂,CIK对肿瘤细胞杀伤能力明显减弱。同时采用siRNA将CIK上的PD-1表达降低后,CIK杀伤肿瘤细胞能力又有进一步提高(P<0.05)。见图6。
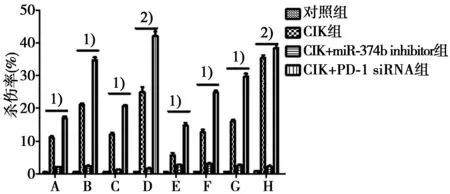
A:HopG2 24 h;B:HopG2 48 h;C:PLC 24 h;D:PLC 48 h;E:H1299 24 h;F:H1299 48 h;G:A549 24 h;H:A549 48 h;1)P<0.05,2)P<0.01图6 LDH释放法检测CIK细胞体外抗肿瘤能力
2.6CIK过继回输检测体内杀伤肿瘤细胞 过继回输了CIK的小鼠,其存活率明显高于没有过继回输CIK的小鼠。在培养CIK过程中,加入了miR374b抑制剂的CIK抗肿瘤效果明显降低,加入PD-1 siRNA的CIK抗肿瘤能力显著升高(P<0.01)。见图7。
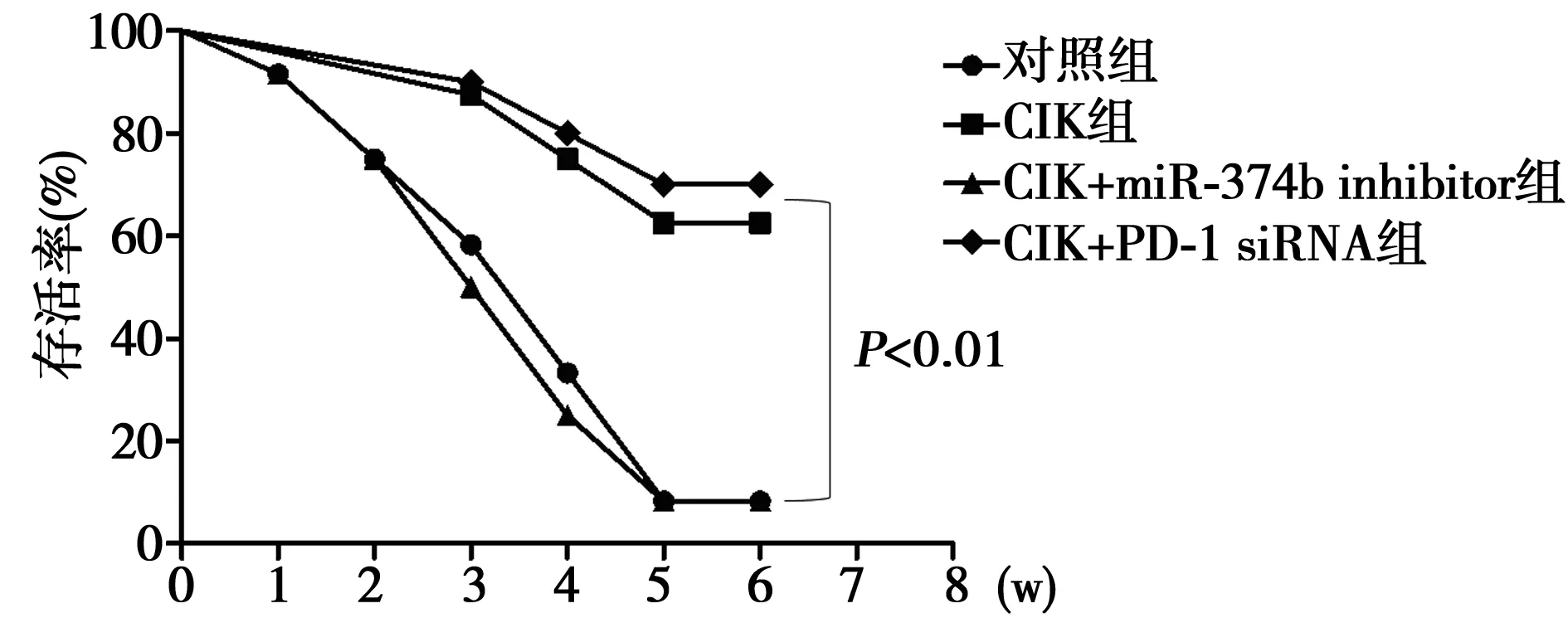
图7 过继回输检测CIK细胞体内抗肿瘤能力
3 讨 论
CIK在治疗肿瘤中疗效显著,特别是CIK不会被控制免疫力的药物所抑制,临床试验治疗也发现CIK在治疗肿瘤病人中具有安全性和有效性〔4〕。采用CIK的免疫治疗,通过刺激免疫系统及增加抗肿瘤能力,可以克服化疗所带来的药物耐受〔5〕。同时在动物实验中,在将人的淋巴瘤细胞打入免疫缺陷小鼠体内后,输入CIK可以明显延长小鼠的存活时间〔6〕。本研究也说明CIK对肿瘤确实有比较好的治疗效果。PD-1/PD-L1信号通路在抗肿瘤的研究中发挥着重要作用。研究发现,PD-1/PD-L1信号通路参与了肿瘤的免疫逃逸,表达PD-L1的肿瘤细胞抵抗T细胞抗肿瘤的能力增强,同时增强其侵袭能力,而如果采用PD-L1阻断抗体,这种能力被逆转〔7〕。而在PD-1缺失的小鼠中,其体内肿瘤细胞生长受到了抑制,并且在肿瘤小鼠模型中采用抗PD-1,PD-L1抗体,可以显著提高小鼠生存率〔8〕。本研究结果提示肿瘤细胞表达PD-L1与T细胞上的PD-1结合后,有助于肿瘤细胞的免疫逃逸。
miRNA通过结合mRNA,在基因的转录后调控中发挥着重要作用。研究发现,miRNAs 跟MAPK信号通路的超活化相关,在PC-3前列腺癌细胞中过表达miR-374b可以降低血管内皮生长因子(VEGF)-A的表达,miR-374b 可以结合到VEGF-A,从而抑制骨肉瘤细胞的血管形成〔9〕。本研究结果表明miR-374b参与了PD-1/PD-L1信号通路,通过降低CIK上PD-1表达,解除了肿瘤细胞通过PD-L1对表达PD-1T细胞的免疫抑制作用,从而提高CIK对肿瘤细胞的杀伤作用。
1Boussiotis VA,Chatterjee P,Li L.Biochemical signaling of PD-1 on T cells and its functional implications〔J〕.Cancer J,2014;20(4):265-71.
2Benson DM Jr,Bakan CE,Mishra A,etal.The PD-1/PD-L1 axis modulates the natural killer cell versus multiple myeloma effect:a therapeutic target for CT-011,a novel monoclonal anti-PD-1 antibody〔J〕.Blood,2010;116(13):2286-94.
3Xie J,Tan ZH,Tang X,etal.miR-374b-5p suppresses RECK expression and promotes gastric cancer cell invasion and metastasis〔J〕.World J Gastroenterol,2014;20(46):17439.
4Jiang JT,Shen YP,Wu CP,etal.Increasing the frequency of CIK cells adoptive immunotherapy may decrease risk of death in gastric cancer patients〔J〕.World J Gastroenterol,2010;16(48):6155-62.
5Liu P,Chen L,Huang X.The antitumor effects of CIK cells combined with docetaxel against drug-resistant lung adenocarcinoma cell line SPC-A1/DTX in vitro and in vivo〔J〕.Cancer Biother Radiopharm,2009;24(1):91-8.
6Yun YS,Hargrove ME,Ting CC.In vivo antitumor activity of anti-CD3 induced activated killer cells〔J〕.Cancer Res,1989;49(17):4770-4.
7Spranger S,Koblish HK,Horton B,etal.Mechanism of tumor rejection with doublets of CTLA-4,PD-1/PD-L1,or IDO blockade involves restored IL-2 production and proliferation of CD8(+) T cells directly within the tumor microenvironment〔J〕.J Immunother Cancer,2014;2(1):3.
8Iwai Y,Terawaki S,Honjo T.PD-1 blockade inhibits hematogenous spread of poorly immunogenic tumor cells by enhanced recruitment of effector T cells〔J〕.Int Immunol,2005;17(2):133-44.
9Miller PC,Clarke J,Koru-Sengul T,etal.A novel MAPK-microRNA signature is predictive of hormone-therapy resistance and poor outcome in ER-positive breast cancer〔J〕.Clin Cancer Res,2015;21(2):373-85.
〔2017-03-11修回〕
(编辑 袁左鸣)
R3
A
1005-9202(2017)19-4724-03;
10.3969/j.issn.1005-9202.2017.19.015
2016海南省科技项目资助(No.ZDYF2016107)
曾江正(1978-),男,硕士,主要从事肿瘤化疗及生物免疫治疗研究。
黄 芬(1980-),女,硕士,副主任医师,主要从事实体肿瘤的生物免疫治疗研究。
