高血压大鼠大小动脉血管重构的差异比较*
2017-09-22万明慧宋伟国
万明慧, 宋伟国, 2, 梁 英, 3△
(1潍坊医学院, 山东 潍坊 251053; 2潍坊科技学院, 山东 寿光 262700;3山东大学附属千佛山医院保健科, 山东 济南 250014)
高血压大鼠大小动脉血管重构的差异比较*
万明慧1, 宋伟国1, 2, 梁 英1, 3△
(1潍坊医学院, 山东 潍坊 251053;2潍坊科技学院, 山东 寿光 262700;3山东大学附属千佛山医院保健科, 山东 济南 250014)
目的: 探讨自发性高血压大鼠(SHR)大、小动脉血管重构的差异。方法: 以20周龄雄性SHR为实验组,同龄Wistar-Kyoto (WKY)大鼠为对照组。每周测量体重和血压,43周龄大鼠麻醉取血,留取胸主动脉和肠系膜小动脉组织。HE染色观察比较大、小动脉形态学变化,天狼星红-维多利亚蓝染色检测胶原纤维和弹力纤维变化,激光扫描共聚焦显微镜和Western blot分析Ⅰ、Ⅲ型胶原蛋白的表达,透射电子显微镜观察动脉超微结构变化,原位末端标记法(TUNEL)和增殖细胞核抗原(PCNA)检测评估血管壁细胞凋亡与增殖情况。结果: 小动脉血管内径(ID)和血管腔横截面积(LCSA)减小,壁厚内径比(WT/ID)和壁腔横截面积比(WCSA/LCSA)增大,外膜成纤维细胞增殖并部分迁移,胶原增多,以III型胶原增多为主,血管壁细胞的增殖指数和凋亡指数增加;主动脉ID、LCSA、WT/ID和WCSA/LCSA均增大,中层血管平滑肌细胞(VSMCs)肥大增生明显,胶原增多,血管壁细胞的增殖指数和凋亡指数增加。结论: 高血压大鼠大、小动脉血管重构差异明显,小动脉以基质增多,特别是外膜III型胶原蛋白增多为主,血管壁细胞凋亡增加;大动脉以血管壁细胞增生,特别是VSMCs增生、肥大为主。
主动脉; 肠系膜小动脉; 血管重构; 胶原; 细胞凋亡
高血压血管重构(vascular remodeling in hypertension)是指由于高血压导致全身血管阻力增高、结构改变,主要涉及血管管径及血管成分的改变,是一个动态的变化过程[1]。血管重构是高血压病发生和发展的病理基础,同时也是靶器官受损的表现。对其进行干预是目前高血压病一级预防和二级预防的主要策略。既往对血管重构的研究侧重于血管内皮细胞和中膜[2],近年来大量的研究表明血管外膜的成纤维细胞(adventitia fibroblast,AF)参与并促进胶原的增生,在调控血管生理和病理重构方面同样发挥着重要作用[3]。本实验以自发性高血压大鼠(spontaneous hypertensive rat,SHR)为实验组,Wistar-Kyoto (WKY)大鼠为正常对照组,对比观察SHR肠系膜小动脉及胸主动脉血管重构的特征性变化。
材料和方法
1实验动物
20 周龄雄性SHR和WKY大鼠各 10 只,体重 150~180 g,采购于北京维通利华实验动物技术有限公司,动物检验合格,合格证编号为SCXK(京)2012-0001。
2主要试剂和仪器
兔抗大鼠collagen Ⅰ和collagen Ⅲ抗体购于Abcam;抗增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)单抗购于NeoMarkers;原位末端标记法(TdT-mediated dUTP nick end labeling,TUNEL)凋亡试剂盒购于Roche。荧光显微镜(Olympus BX51);DP71图像采集系统(Olympus);Carl Zeiss LSM710激光扫描共聚焦显微镜(Zeiss);透射电镜(Hitachi H800型)。
3实验方法
3.1动物分组及饲养 选取20周龄雄性SHR与WKY大鼠各10只,分别为SHR-C组和WKY-C组。所有大鼠均饲养于山东大学药理实验动物中心,室温(22±1)℃、12 h光照/12 h黑暗,自由摄食和饮水,适应性饲养1周后用于实验。
3.2血压及体重的测量 每周四上午测量大鼠体重,用大鼠尾动脉间接测量法——尾套法测量大鼠的收缩压,每只大鼠重复3次,取平均值。
3.3取材及标本的处理 大鼠43周龄时,用10 %水合氯醛将大鼠麻醉,腹主动脉取血,测定血清总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、甘油三酯(triglyceride,TG)、血糖(blood sugar,BS)、血肌酐(serum creatinine,SCr)及血尿素氮(blood urea nitrogen,BUN),迅速取出肠系膜动脉三级血管及胸主动脉,每组大鼠动脉组织一部分放入4 %甲醛中固定,用于HE染色和形态学观察;一部分用3 %戊二醛固定,用于观察超微结构;其余放入液氮中,用于Western blot检测。
3.4病理学观察 取放入4%甲醛溶液中固定的动脉组织,常规处理制成石蜡切片,用HE及天狼星红-维多利亚蓝染色。各组随机选取来自不同大鼠的切片,于光学显微镜明视野下观察常规病理变化,测量血管内径(inner diameter,ID)、血管壁厚度(wall thickness,WT),计算出血管壁横截面积(wall cross-sectional area,WCSA)、血管腔横截面积(luminal cross-sectional area,LCSA)、壁厚内径比(ratio of WT to ID,WT /ID)及壁腔横截面积比(ratio of WCSA to LCSA,WCSA/LCSA),并观察胶原纤维与弹力纤维的变化;偏振光显微镜下观察各组Ⅰ、Ⅲ型胶原的分布。
3.5Ⅰ、Ⅲ型胶原的表达 间接免疫荧光组织化学染色配合激光扫描共聚焦显微镜分析Ⅰ/Ⅲ型胶原的表达,以异硫氰酸荧光素荧光标记二抗,DAPI染色,Zeiss LSM 710型激光扫描共聚焦显微镜观察。绿色荧光激发波长为488 nm,在480 nm~510 nm波长之间观察,胶原呈绿色荧光;DAPI染色的细胞核呈红色荧光。各组随机选取来自于不同大鼠的切片,每张切片在镜下随机选取3个视野,用IPP软件进行积分吸光度(IA)测定(IA=荧光面积×面积积分荧光强度),随后提取组织总蛋白,采用Western blot法检测胶原蛋白的表达。
3.6超微结构的观察 取固定于3%戊二醛的肠系膜小动脉及主动脉进行包埋、切片、染色,将制成的切片在透射电镜下观察主动脉超微结构变化,并选取典型视野拍照。
3.7PCNA与TUNEL染色 采用免疫组织化学染色检测PCNA的表达, TUNEL检测细胞凋亡情况,各组随机选取来自不同大鼠的切片,每张切片随机选取10个视野,计算增殖指数(proliferation index,PI)与凋亡指数(apoptotic index,AI)。PI或AI=10个视野中的PCNA阳性细胞或凋亡细胞总数/总细胞数×100 %。
4统计学处理
所有统计分析均应用SPSS 13.0软件处理,计量资料以均数±标准差(mean±SD)表示,两组间均数比较采用非配对t检验,以P<0.05为差异有统计学意义。
结 果
1血压、体重及血清指标的比较
与WKY-C组大鼠相比,SHR-C组大鼠的血压明显升高,差异有统计学意义(P<0.01),然而,对于体重、BUN、SCr、BS、TG、TC及LDL-C,两组大鼠间的差异无统计学显著性,见图1、表1。

Figure 1. The systolic blood pressure (SBP) and body weight of the rats. Mean±SD.n=10.**P<0.01vsWKY-C group.
图1大鼠收缩压和体重变化的比较

表1 大鼠BUN、SCr、BS、TG、TC及LDL-C的检测结果
2各组大鼠动脉血管形态学变化的比较
2.1HE染色 WKY-C组大鼠肠系膜小动脉及主动脉形态大致正常,各层分界清楚,血管内膜光滑,中膜无肥大增生、平滑肌排列规则,外膜无增厚。SHR-C 组肠系膜小动脉管壁增厚,管腔狭窄,中层血管平滑肌细胞(vascular smooth muscle cells,VSMCs)排列紊乱,外膜增厚明显,细胞增生;主动脉管壁增厚,以中层增厚最为明显,VSMCs肥大增生,中层弹性膜排列紊乱、疏松,厚薄不均且断裂,部分内膜脱落,见图2。
2.2天狼星红-维多利亚蓝双染观察 天狼星红-维多利亚蓝双染偏振光显微镜下观察,在明场时,胶原被染成红色,弹力纤维被染成蓝绿色;在暗场时,Ⅰ型胶原被染成红色,Ⅲ型胶被染成浅绿色。WKY-C组大鼠肠系膜小动脉与主动脉均属于正常状态,胶原分布正常;SHR-C组肠系膜小动脉单层弹性纤维无明显变化,但管壁红色胶原纤维重度增生,而主动脉在管壁胶原增生的情况下,蓝绿色弹性纤维严重破坏,结构紊乱。经过 Image-Pro Plus 图像分析系统进行定量检测分析显示,与WKY-C组比较,SHR-C组大鼠小动脉ID和LCSA明显减小(P<0.01),WT、WCSA、WT/ID和WCSA/LCSA明显增大(P<0.01),但主动脉ID、LCSA、WT、WCSA、WT/ID和WCSA/LCSA均明显增大,差异有统计学意义(P<0.01或P<0.05)。SHR-C组肠系膜小动脉与主动脉胶原面积百分比显著高于WKY-C组,且小动脉增加更明显(P<0.01),肠系膜小动脉弹性纤维面积百分比无统计学差异,弹性纤维面积与胶原面积比值显著低于WKY-C组大鼠(P<0.05);但主动脉SHR-C组弹性纤维面积显著高于WKY-C组(P<0.05),弹性纤维面积与胶原面积比值的差异无统计学显著性(P>0.05),见图3~7。

Figure 2. The HE staining of arterial tissues in the rats. A: WKY-C group of mesenteric small artery; B: SHR-C group of mesenteric small artery; C: WKY-C group of aorta; D: SHR-C group of aorta.
图2大鼠动脉组织HE染色

Figure 3. The staining with Sirius red-Victoria blue of the arterial tissues in the rats. The A, C, E and G were under the light field, and the B, D, F and H were under the dark field. A and B: WKY-C group of mesenteric small artery; C and D: SHR-C group of mesenteric small artery; E and F: WKY-C group of aorta; G and H: SHR-C group of aorta.
图3大鼠动脉组织天狼星红-维多利亚蓝染色
2.3Ⅰ、Ⅲ型胶原的分布及表达 使用激光共聚焦显微镜对Ⅰ、Ⅲ型胶原进行荧光分析,胶原被染成绿色,细胞核被染成红色。WKY-C组大鼠动脉组织可见正常密度的胶原纤维,Ⅰ型胶原纤维主要分布在外膜,Ⅲ型胶原主要分布在中膜及外膜;与其相比,SHR-C组动脉管壁细胞核数目增多,Ⅰ型胶原纤维增多,弥漫性分布于中膜平滑肌胞浆、间质以及外膜,Ⅲ型胶原亦增多,弥漫分布于中膜及外膜,大小动脉分布基本一致,但小动脉胶原增加更为显著,尤以外膜显著。荧光定量分析结果显示:与 WKY-C组相比,SHR-C组Ⅰ、Ⅲ型胶原的表达增多,且小动脉更为显著(P<0.01),尤以III型胶原最为明显(P<0.01);主动脉以I型胶原增加为主,差异有统计学意义。Western blot检测显示SHR-C组大、小动脉Ⅰ、Ⅲ型胶原蛋白表达水平增加,与激光扫描共聚焦显微镜定量分析结果基本一致,见图8~10。
2.4超微结构的变化 透射电镜下WKY-C组血管超微结构正常,胶原多分布于血管外膜,少量分布于中膜,内皮细胞、VSMCs以及AF形态正常。 SHR-C组肠系膜小动脉内膜损伤严重,部分脱落,可见凋亡细胞,中膜VSMCs肥大增生,排列紊乱,伴有内质网扩张的成纤维细胞迁移至中膜,甚至迁移的AF出现表型转化特征:细胞膜出现密斑,伴随胶原纤维大量增生;主动脉内皮细胞损伤严重,部分脱落,出现虫蚀样增生修复,基底膜破坏,内弹力层断裂,分布紊乱,中层VSMCs肥大增生,胞浆内细胞器明显增多,甚至迁移至皮下,中层还出现大量胶原成分,与细胞外基质交织,但AF未见明显改变,见图11、12。
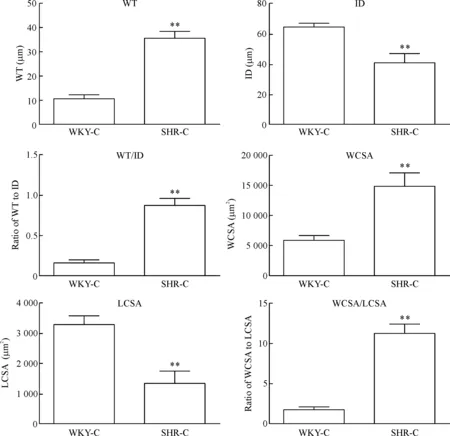
Figure 4. The morphological changes of the mesenteric small artery in the rats. Mean±SD.n=6.**P<0.01vsWKY-C group.
图4大鼠肠系膜小动脉形态学参数的变化
2.5PCNA的表达与TUNEL法检测细胞凋亡的比较 PCNA表达阳性的血管壁细胞被染成棕黄色,凋亡细胞的细胞核也被染成棕黄色。WKY-C组细胞的PCNA表达与凋亡均处于正常状态,SHR-C组动脉壁中膜及外膜细胞PCNA 阳性细胞较多,PI增高(P<0.01),且与WKY-C组相比,主动脉PCNA表达阳性更加明显;另外,SHR-C组大鼠肠系膜小动脉及主动脉凋亡细胞明显增多,AI增高(P<0.01),与WKY-C组相比,小动脉凋亡更加明显,见图13、14。
讨 论
在2010年,中国死亡人数中超过三分之一的人死于心血管疾病[4],而高血压是中风、心衰、心肌梗死等心血管疾病的危险因素[5],机制复杂。研究证明动脉血管是高血压首先累及的靶器官,高血压状态下血管结构和功能的改变即为高血压血管重构,而血管紧张素、氧化应激等参与血管重构的发生发展[6],其特征是VSMCs肥大、细胞外基质增加、血管壁增厚等[7]。虽然血管重构最初是一个适应过程,但长期的压力过载,会加重血管疾病、循环系统疾病和器官病理生理学的损害[8]。Dzau等[9]在1994年就将血管重构进行了分类,其中一种类型是血管内膜、中膜增厚,内径减小,壁厚与管腔比增加,这种类型主要出现在高血压的小动脉,可能是由于VSMCs及其它细胞和非细胞成分重排所致,其特点是血管阻力大、收缩反应强;另一种类型是血管外径、内径均增大,壁厚与管腔比减小,这种类型主要出现在高血压的大动脉 ,可见大小动脉的血管重构截然不同。
本研究对比了大小动脉高血压血管重构的差异,结果显示SHR主动脉血管壁增厚,ID和LCSA显著增大,具有代表意义的WT/ID和WCSA/LCSA 比值增加,这也与既往研究结果相符[10],但肠系膜小动脉在WT增厚的基础上,其ID和LCSA减小,具有与主动脉截然不同的特征性改变。既往实验观察高血压患者肠系膜小动脉血管的病理变化,发现形态学改变同样为WT增厚,ID减小,其中最具代表意义的WT/ID和WCSA/LCSA 比值增加。故有人在总结血管重构时提出小动脉以VSCMs增生为主,主动脉以肥大为主。

Figure 5. The morphological changes of the aorta in the rats. Mean±SD.n=6.*P<0.05,**P<0.01vsWKY-C group.
图5大鼠主动脉形态学参数的变化

Figure 6. The changes of collagen and elastin fibers in the mesenteric small artery of the rats. Mean±SD.n=6.*P<0.05,**P<0.01vsWKY-C group.
图6大鼠肠系膜小动脉组织胶原、弹力纤维的变化
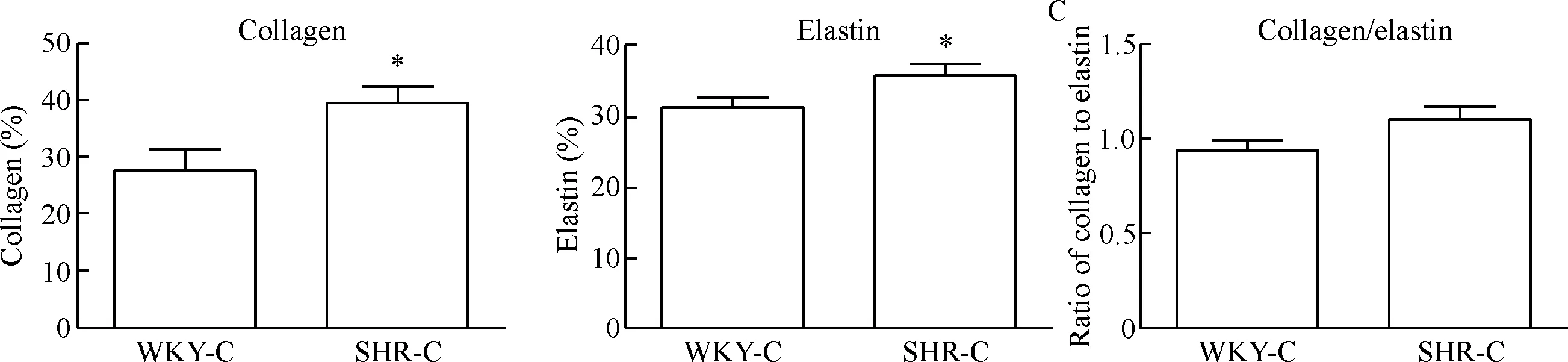
Figure 7. The changes of collagen and elastin fibers in the aorta of the rats. Mean±SD.n=6.*P<0.05vsWKY-C group.
图7大鼠胸主动脉组织胶原、弹力纤维的变化

Figure 8. The quantitative analysis of type Ⅰ and Ⅲ collagens in mesenteric small artery by confocal laser-scanning microscopy. Mean±SD.n=6.**P<0.01vsWKY-C group.
图8激光扫描共聚焦显微镜定量分析肠系膜小动脉Ⅰ、Ⅲ型胶原的表达

Figure 9. The quantitative analysis of type Ⅰ and Ⅲ collagens in aorta by confocal laser-scanning microscopy. Mean±SD.n=6.*P<0.05vsWKY-C group.
图9激光扫描共聚焦显微镜定量分析胸主动脉Ⅰ、Ⅲ型胶原的表达
血管重构的特征还包括细胞外基质的改变。细胞外基质主要包括胶原蛋白、弹性蛋白、层黏连蛋白和纤维黏连蛋白等,其中胶原是主要成分,占干重的 20%~50%,以Ⅰ型和Ⅲ型胶原为主,胶原合成与降解平衡失调在血管重构的发生发展过程中发挥重要作用[11]。我们的研究结果显示,高血压小动脉存在以胶原增生为主的特征性重构。虽然大小动脉胶原均有增加,但是小动脉外膜胶原的增生更显著,且定量分析结果显示小动脉以Ⅲ型胶原增加尤为明显。由于Ⅰ、Ⅲ型胶原主要分布于外膜,因此小动脉的变化主要体现于外层,导致血管壁增厚、胶原增多,也与大动脉血管重构明显不同。

Figure 10. The protein expression of type Ⅰ and Ⅲ collagens determined by Western blot. A: the protein expression of mesenteric small artery; B: the protein expression of the aorta. Mean±SD.n=6.*P<0.05,**P<0.01vsWKY-C group.
图10Westernblot法检测Ⅰ、Ⅲ型胶原蛋白的表达

Figure 11. The images of the ultrastructural changes in the mesenteric small arterial tissue observed under transmission electron microscope. A and D: WKY-C group; B, C and E: SHR-C group.
图11透射电子显微镜观察大鼠肠系膜小动脉组织的超微结构

Figure 12. The images of the ultrastructural changes in the aortic tissue under transmission electron microscope. A, C and E: WKY-C group; B, D and F: SHR-C group.
图12透射电子显微镜观察大鼠主动脉组织的超微结构
近年来随着高血压研究的深入,血管外膜在血管重构中的作用越来越受到人们的重视。作为血管外膜主要细胞成分,AF在血管重构过程中因病理刺激、细胞增长因子的表达而出现活化、迁移、表型转化[12],同时胶原纤维合成增加,过度沉积在血管壁[13];而AF到肌成纤维细胞的表型转化一直被认为是血管重构的关键[14]。我们通过电镜观察到肠系膜小动脉中膜存在VSMCs肥大增生,排列紊乱,同时伴有内质网扩张的AF迁移至中膜,甚至迁移的AF出现表型转化特征;而AF的活化迁移伴有中膜、外膜胶原大量增生,血管壁增厚。但在电镜中,我们并未发现主动脉AF的迁移,只有中层出现比小动脉明显的VSMCs肥大增生,细胞器明显增多,内有空泡状线粒体,内弹力层分裂,出现大量胶原成分,与细胞外基质交织。这提示大动脉的血管重构与小动脉不同,它是以中层VSMCs的肥大增生为主。既往实验也证明大动脉血管重构的其中一种形式就是血管扩张,这主要是细胞或非细胞成分主动调整血管壁的结果,外部或内部直径的扩大,从而导致壁腔比例降低,本实验的主动脉血管重构就属于此种形式。

Figure 13. The protein expression of PCNA in the arterial vascular wall. Mean±SD.n=6.*P<0.05,**P<0.01vsWKY-C group.
图13PCNA蛋白在大鼠动脉血管壁的表达

Figure 14. The cell apoptosis of arterial vascular wall examined by TUNEL staining. Mean±SD.n=6.*P<0.05,**P<0.01vsWKY-C group.
图14TUNEL检测大鼠动脉血管壁的细胞凋亡情况
在实验中我们还检测了细胞PCNA表达与凋亡,以评价其在高血压血管重构中的地位,发现大、小动脉血管壁细胞PCNA表达阳性与凋亡均明显增加,但大、小动脉相比,主动脉的增殖更加显著,而小动脉的凋亡更加显著。这提示高血压主动脉血管壁增厚主要与细胞增殖有关,而小动脉血管壁细胞凋亡与增生共存,血管壁却仍呈明显增厚重构,可能是高血压时动脉壁虽有细胞凋亡增多,但仍存在包括VSMCs、AF在内的细胞增生活跃、迁移,分泌过多的胶原蛋白及其它ECM等非细胞成分沉积于血管壁,导致壁细胞的凋亡、增殖与胶原增生失衡,即非细胞成分——胶原大量增多占主导地位的小动脉重构特征,证明动脉重构是一个多因素、多种细胞、多种病变共同参与的动态病理过程。
综上所述,在排除体重、血糖、血脂及肾功能的干扰后,主动脉血管重构以VSMCs肥大增生为主,伴胶原增多,呈现出ID、LCSA、WT/ID、WCSA/LCSA增大的形态学特点,同时血管壁细胞PI增加,凋亡增多,与既往研究结果相符;而小动脉以非细胞成分——胶原增多为主,以外膜III型胶原蛋白增多最为明显,并伴AF的迁移及表型转化,呈现出ID和LCSA减小、WT/ID和WCSA/LCSA增大的形态学改变,且血管壁细胞增生与凋亡共存,具有不同于大动脉重构的鲜明特征性改变。本实验从细胞、组织及动物整体水平多方面观察比较大、小动脉血管重构的差异,以期为防治心血管疾病的基础疾病——血管重构提供实验数据和理论依据。
[1] 邓 轩, 蒋 灿, 郑文武. 高血压血管重构的研究进展[J]. 西南军医, 2016, 18(04):369-373.
[2] Kolluru GK, Bir SC, Kevil CG. Endothelial dysfunction and diabetes: effects on angiogenesis, vascular remodeling, and wound healing[J]. Int J Vasc Med, 2012, 2012:918267.
[3] Bersi MR, Bellini C, Wu J, et al. Excessive adventitial remodeling leads to early aortic maladaptation in angiotensin-induced hypertension[J]. Hypertension, 2016, 67(5): 890-896.
[4] Lewington S, Lacey B, Clarke R, et al. The burden of hypertension and associated risk for cardiovascular mortality in China[J]. JAMA Intern Med, 2016, 176(4):524-532.
[5] Barnett CF, Alvarez P, Park MH. Pulmonary arterial hypertension: diagnosis and treatment[J]. Cardiol Clin, 2016, 34(3):375-389.
[6] Liang Y, Wang J, Gao H, et al. Beneficial effects of grape seed proanthocyanidin extract on arterial remodeling in spontaneously hypertensive rats via protecting against oxidative stress[J]. Mol Med Rep, 2016, 14(4):3711-3718.
[7] Mulvany MJ. Small artery remodeling in hypertension[J]. Curr Hypertens Rep, 2002, 4(1):49-55.
[8] Drummond GR, Selemidis S, Griendling KK, et al. Combating oxidative stress in vascular disease: NADPH oxidases as therapeutic targets[J]. Nat Rev Drug Discov, 2011, 10(6):453-471.
[9] Dzau VJ, Gibbons GH, Morishita R, et al. New perspectives in hypertension research. Potentials of vascular biology[J]. Hypertension, 1994, 23(6 Pt 2):1132-1140.
[10] Cwynar M, Wojciechowska W, Kawecka-Jaszcz K, et al.Mechanisms of large artery remodeling[J]. Przegl Lek, 2002, 59 Suppl 3:1-8.
[11] Hansen NU, Willumsen N, Sand JM, et al. Type Ⅷ collagen is elevated in diseases associated with angiogenesis and vascular remodeling[J]. Clin Biochem, 2016, 49(12):903-908.
[12] Bhogal RK, Stoica CM, McGaha TL, et al. Molecular aspects of regulation of collagen gene expression in fibrosis[J]. J Clin Immunol, 2005, 25(6):592-603.
[13] Zhang L, Li Y, Liu Y, et al. STAT3-mediated MMP-2 expression is required for 15-HETE-induced vascular adventitial fibroblast migration[J]. J Steroid Biochem Mol Biol, 2015, 149:106-117.
[14] Li G, Chen SJ, Oparil S, et al. Directinvivoevidence demonstrating neointimal migration of adventitial fibroblasts after balloon injury of rat carotid arteries[J]. Circulation, 2000, 101(12):1362-1365.
(责任编辑: 卢 萍, 宋延君)
Comparison of vascular remodeling between small artery and aorta in spontaneous hypertensive rats
WAN Ming-hui1, SONG Wei-guo1, 2, LIANG Ying1, 3
(1Weifang Medical University, Weifang 251053, China;2Weifang College of Science and Technology, Shouguang 262700, China;3Department of Geriatric Cardiology, Qianfoshan Hospital of Shandong University, Jinan 250014, China. E-mail: 18663707866@163.com)
AIM: To examine the difference of vascular remodeling between aorta and small artery in sponta-neous hypertensive rats (SHR) and control rats.METHODS: Male SHR (20-week-old) were used as experiment group, and age matched male Wistar-Kyoto (WKY) rats were used as control group. The systolic blood pressure and body weight were measured once a week. At 43 weeks old, the rats were anaesthetized, blood samples were collected, and thoracic aorta and mesenteric small artery tissue were harvested. The morphological changes of the arterial tissue were observed with HE staining. The collagen and elastine fibers were detected by the Sirius red-Victoria blue staining. The protein expression of type I and III collagens were analyzed by confocal laser-scanning microscopy and Western blot. The changes of the vascular ultrastructure were imaged by transmission electron microscopy. The expression of proliferating cell nuclear antigen (PCNA) and the cell apoptosis in the arterial wall were examined by immunohistochemical method and TdT-mediated dUTP nick and labeling (TUNEL) detection.RESULTS: The inner diameter (ID) and luminal cross-sectional area (LCSA) of mesenteric small artery were decreased, whereas ratio of wall thickness (WT) to ID (WT/ID) and ratio of wall cross-sectional area (WCSA) to LCSA (WCSA/LCSA) were increased. Meanwhile, adventitia fibroblast migrated to the media, with overload collagens, especially collagen Ⅲ. Proliferation index (PI) and apoptotic index (AI) of the mesenteric small artery wall cells were increased. The ID, LCSA, WT/ID and WCSA/LCSA of the aorta were increased. Moreover, the vascular smooth muscle cells (VSMCs) showed hypertrophy and hyperplasia, with overload collagens. The PI and AI of the aortic wall cells were increased.CONCLUSION: The difference of vascular remodeling between the aorta and small artery is significant. The small artery mainly appears hyperplasia of matrix, especially the adventitial collagen Ⅲ. Meanwhile, the cell apoptosis in the small artery wall is increased. The aorta mainly appears hyperplasia and hypertrophy of media VSMCs.
Aorta; Mesenteric small artery; Vascular remodeling; Collagen; Apoptosis
1000- 4718(2017)09- 1564- 10
2017- 03- 15 [
] 2017- 06- 09
山东省科技发展计划(No. 2014GSF118043)
R363; R544.1
A
10.3969/j.issn.1000- 4718.2017.09.005
△通讯作者 Tel: 0531-89269216; E-mail: 18663707866@163.com
