藏红花素促进颈动脉损伤小鼠体内EPCs动员及损伤血管的再内皮化*
2017-09-22杨维华张清芬周敬群
杨维华, 张清芬, 王 刚, 周敬群△
(1三峡大学附属仁和医院心血管内科,湖北 宜昌 443001; 2武汉大学中南医院心血管内科,湖北 武汉 430000)
藏红花素促进颈动脉损伤小鼠体内EPCs动员及损伤血管的再内皮化*
杨维华1, 张清芬1, 王 刚2, 周敬群1△
(1三峡大学附属仁和医院心血管内科,湖北 宜昌 443001;2武汉大学中南医院心血管内科,湖北 武汉 430000)
目的: 研究藏红花素对颈动脉损伤小鼠外周血中内皮祖细胞(endothelial progenitor cells, EPCs)动员的影响及其作用机制。方法: 利用导丝损伤的方法构建C57BL/6小鼠颈动脉损伤模型,动物分为假手术组(sham组)、生理盐水处理模型组(model组)和藏红花素低、中、高剂量(10、50和100 μmol·kg-1·L-1)处理组。在3 d时,利用流式细胞术检测各组颈动脉损伤小鼠体内外周血中EPCs动员情况;7 d时,利用酶联免疫吸附法检测各组颈动脉损伤小鼠外周血血清中促血管修复因子——血管内皮生长因子(vascular endothelial growth factor,VEGF)、基质细胞衍生因子1(stromal-derived factor-1, SDF-1)、碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)、表皮生长因子(epidermal growth factor, EGF)和基质金属蛋白酶9(matrix metalloproteinase-9, MMP-9)的含量变化;14 d时,利用依文思蓝和苏木精-伊红染色分别检测各组颈动脉损伤小鼠损伤血管再内皮化和内膜增生情况;同时采用real-time PCR检测各组颈动脉损伤小鼠损伤段血管中促修复因子相关受体——血管内皮生长因子受体2(vascular endothelial growth factor receptor 2, VEGFR-2)、CXC趋化因子受体4(CXC chemokine receptor-4, CXCR4)、碱性成纤维细胞生长因子受体(basic fibroblast growth factor receptor, bFGFR)和表皮生长因子受体(epidermal growth factor receptor, EGFR)的mRNA表达水平。结果: 与sham组相比,model组颈动脉损伤小鼠外周血中EPCs动员量和促血管修复因子VEGF、SDF-1、bFGF、EGF、MMP-9的含量上升(P<0.05);损伤血管再内皮化面积下降而增生内膜面积和增生内膜与中层膜面积比显著升高(P<0.05);损伤段血管中促修复因子相关受体VEGFR-2、CXCR4、bFGFR和EGFR的表达水平亦上升(P<0.05)。而与model组相比,不同浓度藏红花素处理组颈动脉损伤小鼠外周血中EPCs动员量和促血管修复因子VEGF、SDF-1、bFGF、EGF、MMP-9含量均显著上升(P<0.05);损伤血管再内皮化面积逐渐上升而增生内膜面积和增生内膜与中层膜面积比逐渐下降(P<0.05);损伤段血管中促修复因子相关受体基因VEGFR-2、CXCR4、bFGF-R和EGFR的表达水平随之逐渐上升(P<0.05)。结论: 藏红花素能够促进颈动脉损伤小鼠体内EPCs细胞动员及损伤血管的再内皮化,从而对损伤血管发挥修复作用。
藏红花素; 内皮祖细胞; 血管损伤; 细胞动员; 再内皮化; 血管修复
经皮冠状动脉成形术(percutaneous transluminal coronary angioplasty,PTCA)是治疗冠心病的主要手段之一,但由于PTCA术中易造成血管内皮损伤,从而影响相关心血管疾病的治愈和康复率[1]。同时其它因素所致的血管内皮损伤均容易导致粥样斑块的形成,是血管损伤性疾病发生、发展的重要病理生理基础[2]。内皮祖细胞(endothelial progenitor cells,EPCs)是一种能够直接分化成内皮细胞的前体细胞,主要来源于骨髓、外周血等,能够在血管损伤修复中发挥重要作用[3]。
藏红花素(crocin, Cro)又名番红花甙,属于糖苷类,是从传统中药藏红花中提取的主要有效活性成分之一[4]。近来研究表明藏红花素具有舒经活络、通经化瘀、散瘀开结、消肿止痛等功效,能够全面提高人体免疫力,并改善心肌供血,明显增加冠状动脉的血流量[5]。藏红花素可用于防治心血管以及衰老相关疾病,但目前关于藏红花素能否促进血管内皮损伤修复的研究尚未见。因此,本研究利用导丝损伤C57BL/6小鼠颈动脉血管构建血管损伤模型,探讨藏红花素通过促进EPCs动员对损伤血管进行修复的机制。
材料和方法
1主要材料试剂
8周龄的SPF级健康雄性C57BL/6小鼠100只,购自华中科技大学同济医学院实验动物中心[动物许可证号SCXK(鄂)2011-2014],在本科室实验室进行常规适应性饲养1周。
藏红花素购自Sigma;FITC标记的单克隆兔抗鼠CD34和APC标记的单克隆兔抗鼠血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR-2)流式细胞术抗体购自美国B&D公司;血管内皮生长因子(vascular endothelial growth factor,VEGF)、基质细胞衍生因子1(stromal-derived factor-1,SDF-1)、表皮生长因子(epidermal growth factor,EGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和基质金属蛋白酶9(matrix me-talloproteinase-9, MMP-9) ELISA试剂盒购自北京博奥生物公司;依文思蓝染色液和HE染色液购自北京鼎国生物公司;总RNA提取液、逆转录试剂盒和real-time PCR试剂盒购自TaKaRa。
2实验方法
2.1颈动脉损伤小鼠模型的构建 按照参考文献[6]中方法,利用导丝损伤C57BL/6小鼠颈总动脉建立颈动脉损伤模型。随机选择80只小鼠以0.3%的戊巴比妥腹腔注射麻醉。手术打开颈右侧动脉鞘,在颈总动脉近心端和颈内动脉远心端用丝线活结结扎阻断血流,结扎颈外动脉远心端,用医用弹性导丝经颈外动脉插入颈总动脉,旋转来回抽送3次,使颈总动脉内皮剥落。结扎颈外动脉穿刺段,松开结扎活结使血流恢复,缝合小鼠颈部切口。术后随机挑选5只颈动脉损伤小鼠损伤段血管,切片后HE染色确保损伤段颈总动脉血管内皮细胞剥落,小鼠颈动脉损伤模型构建成功。
2.2小鼠分组处理 将构建成功的颈动脉损伤模型C57BL/6小鼠分成4组,每组20只。第1组每只小鼠尾静脉注射0.2 mL生理盐水作为模型(model)组;其它3组分别尾静脉注射低、中、高剂量(10、50和100 μmol·kg-1·L-1)的藏红花素(每只0.2 mL),分别为Cro-LD、Cro-MD和Cro-HD组;同时提前选择20只C57BL/6小鼠作为假手术(sham)组(与模型组小鼠操作相同但不用导丝损伤颈动脉血管内皮细胞)。
2.3流式细胞术检测各组小鼠中EPCs动员情况 各组小鼠连续处理3 d后,随机选取5只,麻醉后手术经心脏取血约1 mL,用D-Hanks液同体积稀释。加入1.5倍的Percol分离液,1 200×g,离心30 min,取中间细胞层,再用D-Hanks液洗涤。用M199细胞培养基重悬细胞分别加入FITC标记的单克隆抗鼠CD34和APC标记的单克隆抗鼠VEGFR-2流式抗体各10 μL,室温避光孵育20 min后,0.01 mol/L PBS (pH 7.4)洗涤1遍后,经BD cantoⅡ流式细胞仪检测各组小鼠外周血中动员的EPCs细胞(CD34+/VEGFR-2+)含量。
2.4ELISA检测各组小鼠血清中促血管修复因子 各组小鼠在连续处理7 d后,每组随机选择5只,按照上述方法麻醉,手术取心脏循环外周血于1 mL EP管中。不加肝素室温静置30 min,3 000×g离心20 min,取血清备用。按照参考文献[7]方法并分别根据ELISA试剂盒说明,检测各组颈动脉损伤小鼠外周血血清中血管损伤促修复相关因子VEGF、SDF-1、EGF、bFGF和MMP-9的含量变化。
2.5小鼠颈动脉损伤段血管再内皮化和内膜增生情况的检测 各组小鼠连续处理14 d时,随机选择5只。麻醉后经过尾静脉注射Evans blue 染液(25 mg/kg)。10 min后取小鼠损伤侧颈总动脉近颈动脉分叉处血管约5 mm。切开小鼠颈总动脉可见未内皮化血管呈蓝色,而再内皮化血管不着色。采用Lucia软件测量染色血管和总血管面积,计算各组小鼠颈动脉损伤再内皮化情况=内皮化面积/损伤血管总面积。同时对所取血管切片后HE染色,血管HE染色增生内膜层为血管内皮膜层向管腔中延伸层,外膜层为松散结缔组织层,中膜层为内膜和外膜层中间主要为弹性膜层,使用Olympus BX53在固定视野和放大倍数下拍照和Image-Pro Plus软件自动区分血管增生内膜和中膜层并计算中膜和新生内膜面积,以评估血管内膜增生情况。
2.6Real-time PCR检测小鼠颈动脉损伤段血管促修复因子相关受体mRNA的表达 各组小鼠在连续处理14 d时,每组随机挑选5只。麻醉后处死,取颈动脉损伤段血管于匀浆器内研磨均匀,并加入1 mL的总RNA提取试剂提取各组小鼠损伤段血管的总RNA。每组取500 ng的总RNA按照逆转录方法反转得到cDNA模板。分别根据小鼠促血管修复因子VEGF的受体VEGFR-2、SDF-1的受体CXCR4、EGF的受体EGFR、bFGF的受体bFGFR及内参照GAPDH的cDNA序列设计real-time PCR引物(由上海生工公司合成,具体序列见表1)。利用Bio-Rad的IQ5实时荧光定量RCR系统检测各组小鼠颈动脉损伤段血管中促血管修复因子相关受体VEGFR-2、CXCR4、EGFR和bFGFR mRNA的表达情况。

表1 促血管修复因子相关受体的real-time PCR引物序列
3统计学处理
利用SPSS 17.0软件进行统计学分析。实验数据用均数±标准差(mean±SD)表示。所有数据进行方差齐性分析后,多组间比较采用单因素方差(one-way ANOVA)分析,组间均数间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1藏红花素促进颈动脉损伤小鼠体内EPCs动员
流式细胞术检测发现藏红花素可以显著促进颈动脉损伤小鼠体内外周血中EPCs动员,结果见图1。各组小鼠外周血中动员的EPCs能够经CD34和VEGFR-2共同标记,而经藏红花素处理组小鼠外周血中标记的EPCs动员量逐渐上升。经过统计发现,与sham组相比,model组颈动脉损伤小鼠生理盐水处理后外周血中EPCs动员量有所上升(P<0.05);而与model组相比,经不同浓度藏红花素处理组颈动脉损伤小鼠外周血中动员的EPCs含量均上升更显著(P<0.05)。
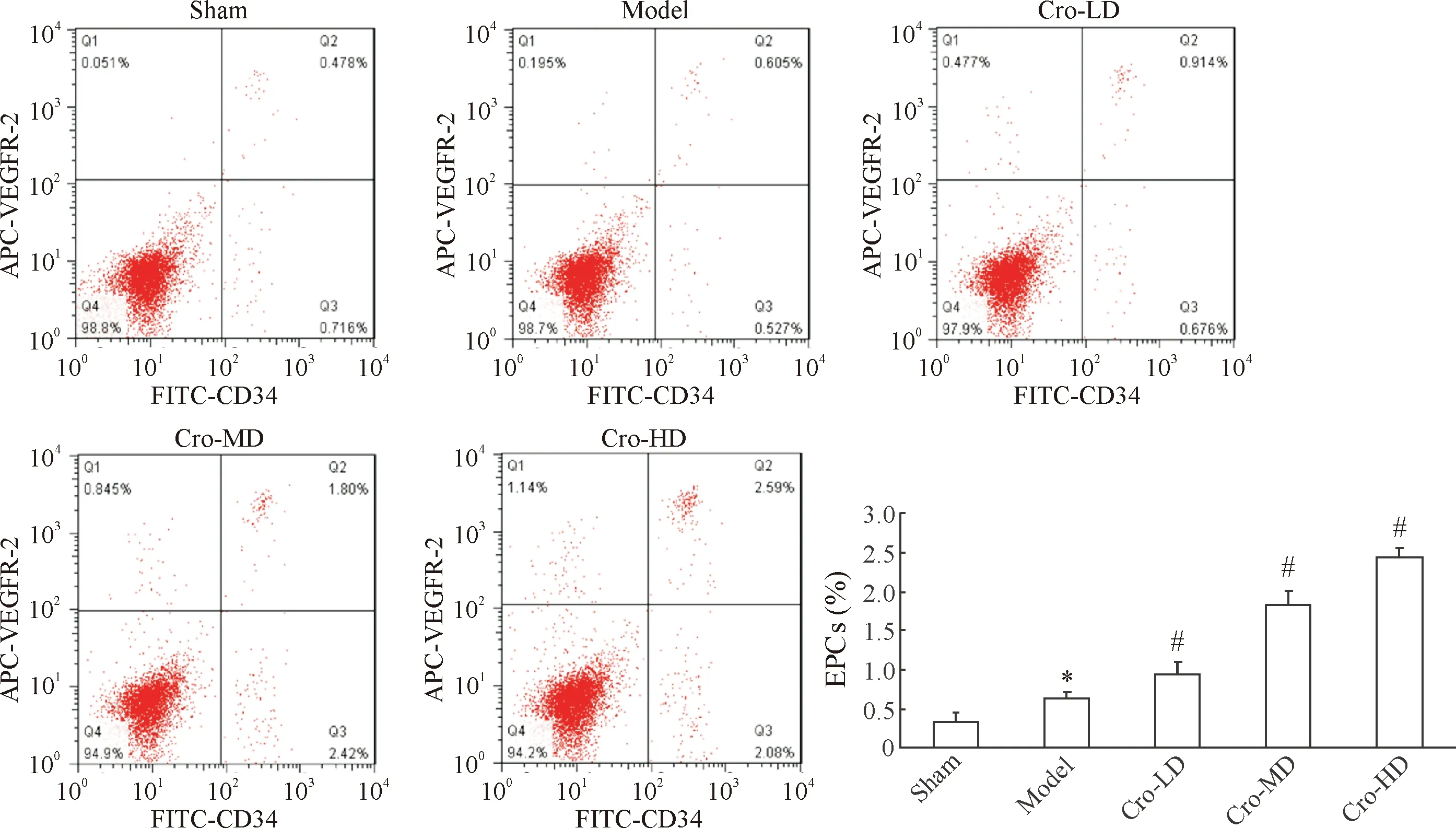
Figure 1. The effect of crocin on EPCs mobilization in peripheral blood of mice with carotid artery injury. Mean±SD.n=5.*P<0.05vssham group;#P<0.05vsmodel group.
图1藏红花素对颈动脉损伤小鼠体内外周血中EPCs动员的影响
2藏红花素促进颈动脉损伤小鼠血清中促血管修复因子水平
ELISA检测发现不同浓度藏红花素连续诱导处理7 d后能够显著促进颈动脉损伤小鼠血清中促血管修复因子VEGF、SDF-1、bFGF和EGF的含量。经过统计发现,与sham组相比,model组颈动脉损伤小鼠血清中VEGF、SDF-1、bFGF和EGF含量均有所上升(P<0.05);而与model组相比,不同浓度藏红花素处理的颈动脉损伤小鼠血清中VEGF、SDF-1、bFGF和EGF含量逐渐上升,并具有一定浓度依赖效应(P<0.05),见表2。
表2藏红花素对颈动脉损伤小鼠外周血清中促血管修复因子含量的影响
Table 2. The effect of crocin on the content of vascular repair factors in peripheral blood of mice with carotid artery injury (ng/L. Mean±SD.n=5)

GroupVEGFSDF-1bFGFEGFMMP-9Sham22±684±894±946±523±6Model55±9*116±10*133±11*98±9*48±9*Cro-LD96±11#146±9#180±12#128±8#97±8#Cro-MD138±10#198±12#235±11#186±9#147±9#Cro-HD189±12#273±16#305±12#212±12#195±12#
*P<0.05vssham group;#P<0.05vsmodel group.
3藏红花素促进颈动脉损伤小鼠内皮化
通过伊文思蓝染色检测发现,模型组小鼠颈动脉损伤段再内皮化较少,而经过不同浓度藏红花素处理14 d后,小鼠颈动脉损伤段再内皮化均逐渐增加。经过统计发现,与sham组相比,model组小鼠血管再内皮化面积显著下降(P<0.05);而与model组相比,不同浓度藏红花素处理组小鼠血管再内皮化面积逐渐上升(P<0.05),见图2。
4藏红花素降低颈动脉损伤小鼠内膜增生
通过HE染色检测发现不同浓度的藏红花素能够抑制颈动脉损伤小鼠损伤段血管内膜增生(红色箭头标示增生内膜层)。与sham组相比,model组小鼠颈动脉损伤后血管增生内膜面积和血管增生内膜与中层膜面积比显著升高(P<0.05);而与model组相比,不同浓度藏红花素处理后的小鼠颈动脉损伤后血管增生内膜面积和血管增生内膜与中层膜面积比均逐渐减少(P<0.05),见图3。
5藏红花素促进颈动脉损伤小鼠损伤段血管促修复因子相关受体基因的表达
Real-time PCR检测发现藏红花素能够显著促进颈动脉损伤小鼠损伤段血管促修复因子VEGF的受体VEGFR-2、SDF-1的受体CXCR4、EGF的受体EGFR和bFGF的受体bFGFR表达水平,见图4。

Figure 2. The effect of crocin on vascular re-endothelialization in mice with carotid artery injury. Mean±SD.n=5.*P<0.05vssham group;#P<0.05vsmodel group.
图2藏红花素对颈动脉损伤小鼠血管再内皮化的影响

Figure 3. Effect of crocin on intimal hyperplasia in mice with carotid artery injury. A: HE staining (×200); B: vascular intimal hyperplasia area; C: vascular proliferation intima and media area ratio. Mean±SD.n=5.*P<0.05vssham group;#P<0.05vsmodel group.
图3藏红花素对颈动脉损伤小鼠血管内膜增生的影响

Figure 4. The effect of crocin on the mRNA expression of vascular repair factor-related receptors in the injured segments of carotid artery in mice. Mean±SD.n=5.*P<0.05vssham group;#P<0.05vsmodel group.
图4藏红花素对颈动脉损伤小鼠损伤段血管中促修复因子相关受体mRNA表达的影响
经过统计,与sham组相比,model组小鼠颈动脉损伤后损伤段血管中VEGFR-2、CXCR4、EGFR和bFGFR mRNA的表达水平均上升(P<0.05);而与model组相比,不同浓度藏红花素处理后的小鼠颈动脉损伤段血管中VEGFR-2、CXCR4、EGFR和bFGFR mRNA的表达水平均显著上升(P<0.05)。
讨 论
血管损伤性疾病如动脉粥样硬化等容易导致心力衰竭、肢体坏死、瘫痪等后果,是严重威胁人类健康的疾病[8]。同时临床上广泛开展PTCA治疗冠心病,往往由于手术对血管内皮的损伤,容易发生冠状动脉再狭窄现象,影响心血管疾病治疗成功和康复率[9]。因此,如何促进血管内皮细胞修复和再生是治疗血管损伤疾病的关键。研究表明[10],当机体血管发生损伤时,可通过药物刺激,使EPCs从骨髓动员到外周血中,并循环至血管损伤区域分化成内皮细胞对损伤血管进行修复[11]。同时研究发现通过促进EPCs动员并加快其从骨髓进入体循环到达损伤部位分化成内皮细胞,能够利于抑制损伤血管的内膜增生、血栓形成,并降低血管再狭窄率[12]。藏红花素是少见的水溶性的类胡萝卜素,是传统藏药藏红花的主要色素成分,具有多种活性作用[13]。研究表明藏红花素除了抗肿瘤外,还发挥细胞保护作用,其主要药理作用包括抗动脉粥样硬化、抗氧化、抗炎症等[14]。藏红花素因其较好的水溶性和兼具的抗肿瘤、促进细胞保护的作用,成为研究最广、最具应用前景的新药物之一。最新研究揭示藏红花素能够促进骨髓造血干细胞集落形成,但关于其能否促进骨髓中EPCs动员,发挥血管损伤修复作用尚未知[15]。本研究中采用导丝损伤C57BL/6小鼠颈动脉构建血管损伤模型,利用不同浓度藏红花素诱导处理后,流式细胞术检测发现藏红花素处理组小鼠外周血中CD34+和VEGFR+的EPCs动员量均显著增加,并具有一定浓度效应,直接说明藏红花素能够促进颈动脉损伤小鼠体内EPCs从骨髓动员至外周血。
为进一步揭示藏红花素能否发挥促进颈动脉损伤小鼠血管修复作用,本研究利用依文思蓝染色法对藏红花素诱导处理后的颈动脉损伤端血管,直接观察血管内皮化修复情况。研究中发现藏红花素能够显著增加损伤段颈动脉血管的再内皮化面积,说明藏红花素对损伤血管再内皮化修复具有积极作用。临床开展PTCA时,血管内支架植入及球囊扩张时会对血管内皮造成剥落损伤,而血管内皮损伤后容易发生增生性再狭窄现象[16]。而相关研究证实,损伤血管的再内皮化能够抑制血管中膜平滑肌增殖造成的内膜增生情况[17]。本研究中不同浓度藏红花素诱导处理颈动脉损伤小鼠后取出血管HE染色,检测新生内膜面积、新生内膜与中膜层相对面积比来评价损伤血管内膜增生及修复情况。结果显示藏红花素处理组小鼠损伤段颈动脉血管新生内膜面积和内中膜面积比均逐渐降低,说明藏红花素能够有效抑制内皮损伤血管的内膜增生,并可能通过促进EPCs动员对血管损伤修复以维持血管功能。
但藏红花素是如何促进EPCs动员发挥修复血管作用的呢?有研究表明SDF-1、bFGF、EGF、VEGF等细胞因子参与到血管的损伤修复中,它们通过促进EPCs细胞增殖、迁移、黏附至血管损伤处而诱导血管新生和修复[18]。VEGF是目前所知的最强的诱导血管损伤修复和血管生成因子,同时SDF-1、bFGF、EGF等因子均能够促进血管内皮中VEGF的生成,并具有协同作用,在EPCs动员、分化中发挥作用[19]。MMP-9是作用于血管内皮细胞基质的主要胶原蛋白酶,研究认为其在血管细胞的增殖和迁移中发挥作用,同时可通过EPCs动员促进血管新生和损伤修复[20]。本研究中利用ELISA检测发现不同浓度藏红花素能够显著促进各组颈动脉损伤小鼠血清中VEGF、SDF-1、bFGF、EGF和MMP-9等促血管修复因子的含量并具有浓度效应,说明藏红花素可通过促进外周血中VEGF、SDF-1、bFGE、EGF和MMP-9水平而发挥刺激EPCs动员修复损伤血管的作用。一般细胞因子在体内可通过旁分泌、自分泌或内分泌等方法发挥作用,本研究中经藏红花素处理后的颈动脉损伤小鼠外周血中VEGF、SDF-1、bFGF、EGF和MMP-9水平显著上升,其可能来自损伤血管的自分泌,也可能来自其它受刺激细胞的旁分泌,但这些血管损伤促修复因子的具体来源需要进一步验证分析。为了探究颈动脉损伤小鼠外周血血清中VEGF、SDF-1、bFGF、EGF和MMP-9等促血管修复因子如何发挥作用,本研究同时检测了各组小鼠损伤段血管促修复因子相关受体VEGFR-2、CXCR4、bFGFR和EGFR mRNA的表达水平,发现在不同浓度藏红花素作用下,受体基因表达水平均随之显著上升,说明颈动脉损伤小鼠外周血中增加的VEGF、SDF-1、bFGF、EGF等因子可能循环至损伤血管处与其受体结合发挥作用。但关于藏红花素具体对损伤血管发挥修复作用的分子机制和信号通路有必要进一步研究。
综上所述,本研究首次发现传统中药藏红花中有效成分藏红花素能够通过增加VEGF、SDF-1、bFGF、EGF和MMP-9等促血管修复因子水平,促进EPCs动员和血管再内皮化作用,进而对损伤血管进行修复。本研究对于临床防治血管内皮损伤性心血管疾病具有重要指导价值。
[1] Gori T, Münzel T. Endothelial dysfunction after stenting and scaffolding of coronary arteries[J]. Clin Hemorheol Microcirc, 2014, 58(1):175-181.
[2] 万 强, 杨玉萍, 刘中勇. 丹参酮ⅡA通过抑制p38 MAPK通路减轻PM2.5对血管内皮细胞的损伤[J]. 中国病理生理杂志, 2016, 32(4):597-601.
[3] 崔 斌, 黄 岚, 武晓静, 等. 内皮祖细胞移植对血管内膜修复的影响[J]. 中国病理生理杂志, 2007, 23(4):625-628.
[4] 杨武韬. 中药藏红花的鉴别方法及有效成分的药理作用[J]. 中国医药指南, 2014, 12(25):302-303.
[5] 吴 扬, 潘瑞蓉, 王玉琴. 藏红花素对大鼠缺氧心肌的保护作用及其机制研究[J]. 中国循环杂志, 2011, 26(1):61-64.
[6] 代文静, 张 军, 周敬群, 等. 转化生长因子-α 在小鼠颈动脉损伤血管修复中的作用[J]. 中国循环杂志, 2015, 30(4):384-389.
[7] 常鹏宇, 崔 爽, 姜 新, 等. 脂肪干细胞修复辐射诱导的肠血管损伤研究[J]. 中华放射医学与防护杂志, 2014, 34(9):652-657.
[8] Riegler J, Liew A, Hynes SO, et al. Superparamagnetic iron oxide nanoparticle targeting of MSCs in vascular injury[J]. Biomaterials, 2013, 34(8):1987-1994.
[9] Moon HE, Byun K, Park HW, et al. COMP-Ang1 potentiates EPC treatment of ischemic brain injury by enhancing angiogenesis through activating AKT-mTOR pathway and promoting vascular migration through activating Tie2-FAK pathway[J]. Exp Neurobiol, 2015, 24(1):55-70.
[10] Ke X, Shu XR, Wu F, et al. Overexpression of the β2AR gene improves function and re-endothelialization capacity of EPCs after arterial injury in nude mice[J]. Stem Cell Res Ther, 2016, 7(1):1-9.
[11] Li X, Chen C, Wei L, et al. Exosomes derived from endothelial progenitor cells attenuate vascular repair and accelerate reendothelialization by enhancing endothelial function[J]. Cytotherapy, 2016, 18(2):253-262.
[12] Lacquaniti A, Giardina M, Lucisano S, et al. Neutrophil gelatinase-associated lipocalin (NGAL) and endothelial progenitor cells (EPCs) evaluation in aortic aneurysm repair[J]. Curr Vasc Pharmacol, 2013, 11(6):1001-1010.
[13] 吴 扬, 潘瑞蓉, 耿 鹏. 藏红花素抗心肌细胞低氧损伤作用及其机制研究[J]. 中国应用生理学杂志, 2010, 26(4):453-457.
[14] 潘瑞蓉, 吴 扬, 耿 鹏, 等. 藏红花素对大鼠心肌细胞缺氧损伤的保护作用[J]. 江苏大学学报: 医学版, 2011, 21(2):131-134.
[15] 丁雯雯. 藏红花素对骨髓造血干/祖细胞集落形成的影响[D]. 青岛: 青岛大学, 2013.
[16] King TF, McDermott JH. Endothelial progenitor cells and cardiovascular disease[J]. J Stem Cell, 2014, 9(2):93-99.
[17] Bakogiannis C, Tousoulis D, Androulakis E, et al. Circulating endothelial progenitor cells as biomarkers for prediction of cardiovascular outcomes[J]. Curr Med Chem, 2012, 19(16):2597-2604.
[18] Karazizi C, Onerup A, Larsson P, et al. The effect of exercise on angiogenic factors in the healthy mouse heart: a short report[J]. Exp Clin Cardiol, 2014, 20(1):2332-2341.
[19] Paczkowska E, Go b-Janowska M, Bajer-Czajkowska A, et al. Increased circulating endothelial progenitor cells in patients with haemorrhagic and ischaemic stroke: the role of endothelin-1[J]. J Neurol Sci, 2013, 325(1-2):90-99.
[20] 李玉明, 李海涛, 王新芳, 等. ISO通过ADPRC、PI3K-Akt和FOXO3a上调MMP-9促进血管平滑肌细胞增殖与迁移[J]. 中国病理生理杂志, 2015, 31(10):1801-1802.
(责任编辑: 陈妙玲, 罗 森)
Crocin promotes mobilization of EPCs and re-endothelialization of damaged blood vessels in mice with carotid artery injury
YANG Wei-hua1, ZHANG Qing-fen1, WANG Wang2, ZHOU Jing-qun1
(1Department of Cardiology, Affiliated Renhe Hospital of China Three Gorges University, Yichang 443001, China;2Department of Cardiology, Zhongnan Hospital of Wuhan University, Wuhan 430000, China. E-mail: zhoujingqun-1@medmail.com.cn)
AIM: To study the effect of crocin on the mobilization of endothelial progenitor cells (EPCs) in the peripheral blood of the mice with carotid arterial injury and its mechanism.METHODS: The carotid artery injury model of the C57BL/6 mice was established by the method of wire injury. The animals were divided into sham operation group, saline-treated model group, and low dose, medium dose and high dose (10, 50 and 100 μmol·kg-1·L-1, respectively) of crocin treatment groups. The mobilization of the EPCs in peripheral blood of the mice with carotid artery injury was detected by flow cytometry at 3 d. The changes of vascular endothelial growth factor (VEGF), stromal-derived factor-1 (SDF-1), basic fibroblast growth factor (bFGF), epidermal growth factor (EGF) and matrix metalloproteinase-9 (MMP-9) in the peripheral blood of the mice with carotid artery injury were detected by enzyme-linked immunosorbent assay at 7 d. The vascular re-endothelialization and intimal hyperplasia of the mice with carotid artery injury were detected by Evans blue and hematoxylin-eosin staining. At the same time, real-time PCR was used to detect the mRNA expression of vascular repair factor-related receptors, vascular endothelial growth factor receotor-2 (VEGFR-2), CXC chemokine receptor-4 (CXCR4), basic fibroblast growth factor receptor (bFGFR) and epidermal growth factor receptor (EGFR), in the injured segments of carotid arteries.RESULTS: Compared with sham group, the EPCs mobilization and the content of vascular repair factors VEGF, SDF-1, bFGF, EGF and MMP-9 in peripheral blood were increased in model group (P<0.05). The area of vascular endothelium was decreased, while the area of intimal hyperplasia and the ratio of intimal to medial membrane area were increased significantly (P<0.05). The expression levels of VEGFR-2, CXCR4, bFGFR and EGFR were also increased in the injured segments of carotid arteries (P<0.05). Compared with model group, the EPCs mobilization and the content of vascular repair factors VEGF, SDF-1, bFGF, EGF and MMP-9 in peripheral blood were significantly increased in different concentrations of crocin-treated mice with carotid artery injury (P<0.05). The area of vascular endothelium was gradually increased, while the area of intimal hyperplasia and the ratio of intimal to medial membrane area were gradually decreased (P<0.05). The expression levels of VEGFR-2, CXCR4, bFGFR and EGFR were also gradually increased in the injured segments of cartid arteries (P<0.05).CONCLUSION: Crocin promotes the mobilization of EPCs and the re-endothelialization of damaged blood vessels in the mice with carotid artery injury, thus repairing the injured vasculature.
Crocin; Endothelial progenitor cells; Vascular injury; Cell mobilization; Re-endothelialization; Vascular repair
1000- 4718(2017)09- 1574- 07
2016- 10- 19 [
] 2017- 05- 02
湖北省教育厅自然科学研究计划重点项目(No. D20091308)
R285.5; R363.2+1
A
10.3969/j.issn.1000- 4718.2017.09.006
△通讯作者 Tel: 0717-6555530; E-mail: zhoujingqun-1@medmail.com.cn
