AngⅡ/AT1R通路通过激活人脐静脉内皮细胞PP2A导致eNOS Ser1177磷酸化水平下调*
2017-09-22王阿磊王凌霄姜君财陆德琴
王阿磊, 丁 菁, 王凌霄, 张 倩, 黄 华, 姜君财, 陆德琴
(贵州医科大学病理生理教研室,贵州 贵阳 550025)
AngⅡ/AT1R通路通过激活人脐静脉内皮细胞PP2A导致eNOS Ser1177磷酸化水平下调*
王阿磊, 丁 菁, 王凌霄, 张 倩, 黄 华, 姜君财, 陆德琴△
(贵州医科大学病理生理教研室,贵州 贵阳 550025)
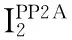
血管紧张素Ⅱ; 血管紧张素Ⅱ1型受体; 蛋白磷酸酶2A; 内皮型一氧化氮合酶; 磷酸化
诸多研究表明,肾素-血管紧张素系统(rennin-angiotensin system,RAS)的激活与高血压、心血管结构重塑、动脉粥样硬化等密切相关[1-2]。血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)作为RAS的主要递质,通过作用于其特异性血管紧张素Ⅱ1型受体(angiotensin II type 1 receptor,AT1R)可以导致血管内皮功能障碍(vascular endothelial dysfunction,VED)。而VED发生时,内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)活性降低,一氧化氮(nitric oxide,NO)合成减少[3]。目前已公认,eNOS/NO功能障碍是VED的重要表现之一。因此,eNOS/NO常被作为反映血管内皮功能的一个重要指标。蛋白磷酸酶2A(protein phosphatase 2A,PP2A)是一种丝/苏氨酸残基蛋白磷酸酶,其通过可逆性的磷酸化使已经磷酸化的蛋白质去磷酸化,从而在多种生物学事件中起着负反馈调节作用[4]。有文献报道PP2A是使磷酸化eNOS (Ser1177)去磷酸化的主要蛋白磷酸酶[5-6]。本课题组在前期双肾单夹肾血管性高血压大鼠的研究中也曾发现,肾血管性高血压大鼠血清AngⅡ水平升高, PP2A活性增强, eNOS Ser1177磷酸化水平下降, eNOS/NO功能障碍。但是关于AngⅡ/AT1R通路激活血管内皮PP2A的分子机制目前尚不清楚。因此,本研究以体外培养人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)为实验对象,应用AngⅡ刺激,并给予AT1R特异性阻断剂坎地沙坦(candesartan,CAN)进行干预,初步探讨AngⅡ/AT1R通路激活PP2A的可能分子机制,为临床防治内皮功能障碍相关性心脑血管疾病提供实验依据。
材料和方法
1实验试剂及仪器
2主要方法
2.1HUVECs细胞的培养 在超净工作台中将HUVECs接种于培养瓶中,用含有10% FBS的高糖培养基在CO2孵育箱中培养,每隔2 d更换1次培养基以维持细胞良好的生长状态,待细胞生长融合至70%~90%时,用0.25%胰蛋白酶消化细胞传代,待细胞生长到约70%融合时,用含1% FBS的高糖培养基静止培养12 h,使细胞达到同步化后分组用于实验。实验用传15代以内的细胞。
2.2细胞鉴定 在6孔板中进行细胞爬片后,待细胞融合至40%~50%时,用含1% FBS的高糖培养基静止12 h,PBS洗3次,用4%多聚甲醛固定,用兔抗人VIII因子相关抗原抗体和兔抗人CD34抗体作为I抗,按1∶100比例稀释,SABC法进行免疫细胞化学染色。PBS孵育作为阴性对照。镜下胞质内出现棕黄色颗粒即为阳性细胞。200倍显微镜下随机取5个视野计数阳性细胞,计算阳性细胞率(%)=阳性细胞数/细胞总数×100%。
2.3实验分组 待HUVECs生长融合至70%~80%左右时,使用含1% FBS的高塘培养基静止培养12 h。将HUVECs随机分为control组、AngⅡ组(AngⅡ终浓度为1×10-7mol/L和1×10-6mol/L,处理12 h)、单纯CAN组和CAN+AngⅡ组。其中单纯CAN组,根据文献报道[7-8]采用对AT1R具有明显阻断作用的CAN,终浓度为1×10-6mol/L。CAN+AngⅡ组中CAN的使用浓度同单纯CAN组,预处理3 h,AngⅡ的使用浓度和时间同AngⅡ组。
2.4Western blot检测蛋白水平 提取各组细胞总蛋白,BCA法测蛋白浓度,余蛋白热变性后用SDS-PAGE分离,恒流电转膜至PVDF膜上,5%脱脂牛奶常温封闭1 h,TBST洗膜,加入相应Ⅰ抗4 ℃孵育过夜。第2 d,TBST洗膜,常温孵育相应Ⅱ抗1 h,TBST洗膜,ECL显影曝光。Bio-Rad凝胶成像系统采集图片并分析灰度值,以β-tubulin为内参照,结果以目的条带和β-tubulin条带积分吸光度比值表示,以正常对照组积分吸光度值为100%。以上结果至少重复3批独立实验,每批重复检测3次。
2.5各组培养基中NO含量检测 收集培养基后,按照NO检测试剂盒说明书进行操作,检测样品中硝酸盐及亚硝酸盐的含量,通过比色法在全波长酶标仪上测A值。培养基中NO的含量(μmol/L)=(测定A值-空白A值)/(标准品A值-空白A值)×标准品浓度(20 μmol/L)×稀释倍数(4倍)。
3统计分析
采用SPSS 17.0统计软件进行分析,计量资料数据以均数±标准差(Mean±SD)表示。多组样本均数比较进行方差齐性检验,组间比较采用单因素方差分析(one-way ANOVA),方差齐者两两比较采用SNK-q法。以P<0.05为差异有统计学意义。
结 果
1细胞鉴定结果
免疫细胞化学染色结果显示,VIII因子相关抗原和CD34表达阳性的HUVECs细胞质内出现大量棕黄色颗粒,而阴性对照组HUVECs细胞质内未出现棕黄色颗粒。经计算阳性细胞率为100%,见图1。

Figure 1. The expression of factor VIII-related antigen and CD34 in the HUVECs (SABC, ×200). A: negative control; B: the positive expression of factor VIII-related antigen; C: negative control; D: the positive expression of CD34.
图1VIII因子相关抗原和CD34在HUVECs中的表达
2CAN预处理对AngⅡ刺激HUVECs后eNOS蛋白表达和eNOSSer1177磷酸化水平的影响
给予 1×10-7mol/L和1×10-6mol/L的AngⅡ分别处理HUVECs 12 h后,与control组比较,AngⅡ组eNOS Ser1177磷酸化水平下调(P<0.05);与同一浓度的AngⅡ组比较,CAN预处理组eNOS Ser1177磷酸化水平上调(P<0.05)。各组间eNOS蛋白表达的差异无统计学显著性,见图2。
3各组培养基中NO的含量
给予1×10-7mol/L和1×10-6mol/L的AngⅡ分别处理HUVECs 12 h后,与control组比较,AngⅡ组培养基中的NO含量减少(P<0.05);与同一浓度的AngⅡ组比较,CAN预处理组培养基中的NO含量增加(P<0.05),见图3。
4CAN预处理对AngⅡ刺激HUVECs后PP2Ac蛋白表达和PP2AcTyr307磷酸化水平的影响
给予1×10-7mol/L和1×10-6mol/L的AngⅡ分别处理HUVECs 12 h后,与control组比较,AngⅡ组PP2Ac Tyr307磷酸化水平下调(P<0.05);与同一浓度的AngⅡ组比较,CAN预处理组的PP2Ac Tyr307磷酸化水平上调(P<0.05)。各组间PP2Ac蛋白表达的差异无统计学显著性,见图4。
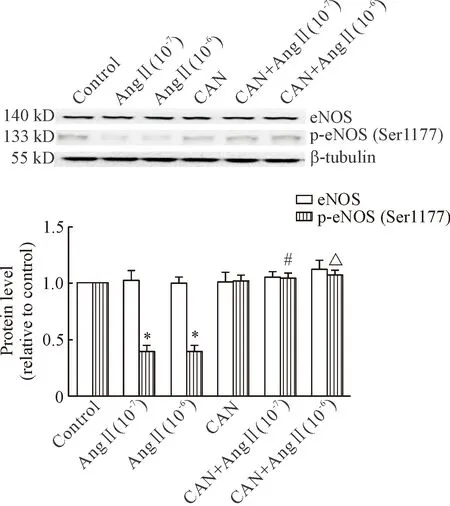
Figure 2. The protein levels of eNOS and p-eNOS (Ser1177) in the HUVECs treated with AngⅡ and/or CAN for 12 h. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsAngⅡ (10-7) group;△P<0.05vsAngⅡ (10-6) group.
图2CAN预处理对AngⅡ刺激HUVECs后eNOS蛋白表达和eNOSSer1177磷酸化水平的影响

Figure 3. NO content in the culture medium in each group. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsAng II (10-7)group;△P<0.05vsAng II (10-6) group.
图3各组培养基中NO含量的变化

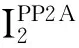
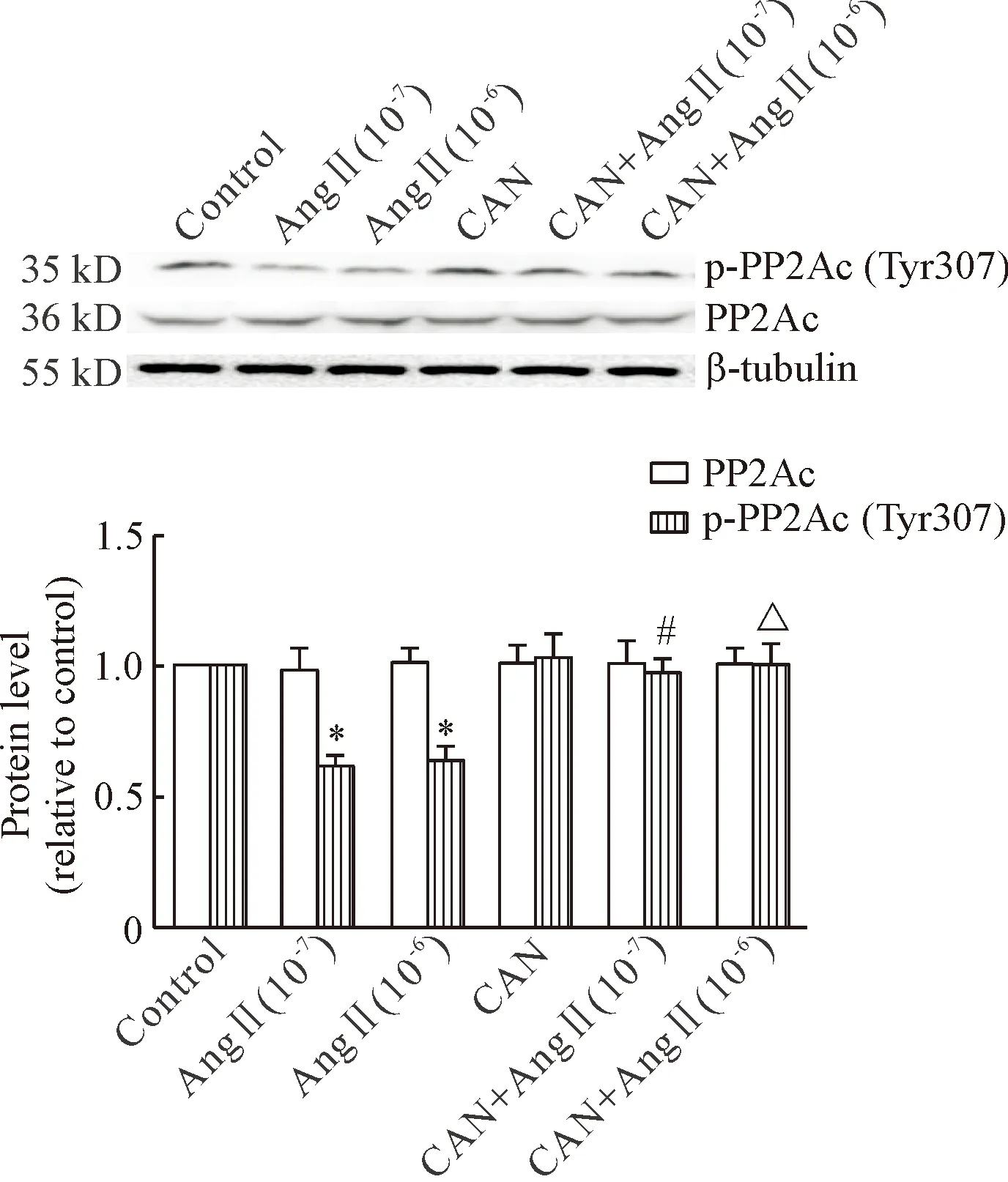
Figure 4. The protein levels of PP2Ac and p-PP2Ac (Tyr307) in the HUVECs treated with AngⅡ and/or CAN for 12 h. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsAngⅡ (10-7) group;△P<0.05vsAngⅡ (10-6) group.
图4CAN预处理对AngⅡ刺激HUVECs后PP2Ac蛋白表达和PP2AcTyr307磷酸化水平的影响
讨 论
本研究中所使用的HUVECs经SABC法鉴定为高纯度的内皮细胞,该细胞株已经被广泛用于内皮细胞的相关研究,因此可用于本研究观察内皮细胞经AngⅡ刺激后eNOS磷酸化和PP2A活性的改变及可能的机制。
1AngⅡ下调eNOSSer1177磷酸化水平由AT1R介导
eNOS的活性调控是一个复杂过程,包括基因转录、翻译和翻译后水平的调控。目前已知eNOS Ser1177是eNOS在翻译后多个磷酸化调控位点中非常重要的位点之一,该位点磷酸化可显著上调eNOS活性。大量研究已表明,心血管疾病发病过程中内皮依赖的血管舒张功能受损的表现之一为eNOS Ser1177磷酸化水平下调,eNOS活性降低,NO合成减少[9-11]。特异性AT1R阻断剂如CAN、洛沙坦等,能减轻高血压、动脉粥样硬化等疾病所引起的内皮功能障碍。有研究报道AngⅡ可通过作用于AT1R,引起内皮细胞中eNOS Ser1177磷酸化水平下调,NO合成减少,而eNOS蛋白表达无明显变化[12]。而CAN可上调eNOS蛋白表达,增加eNOS活性,从而发挥内皮细胞保护作用[13]。但也有研究报道CAN可上调eNOS Ser1177磷酸化水平,增强eNOS活性,促进NO释放,但对eNOS蛋白表达无明显影响[8]。本研究对HUVECs中eNOS蛋白表达、eNOS Ser1177磷酸化水平和培养基中NO含量进行了检测。结果显示,AngⅡ处理组eNOS蛋白表达无明显变化,eNOS Ser1177磷酸化水平明显下调,NO产量减少,CAN预处理虽未改变eNOS蛋白的表达水平,但可明显上调eNOS Ser1177磷酸化水平。这提示在HUVECs中AngⅡ可通过AT1R介导的信号通路下调eNOS Ser1177磷酸化水平,降低eNOS活性,减少NO的合成,AngⅡ和CAN均对eNOS蛋白表达水平无明显影响。
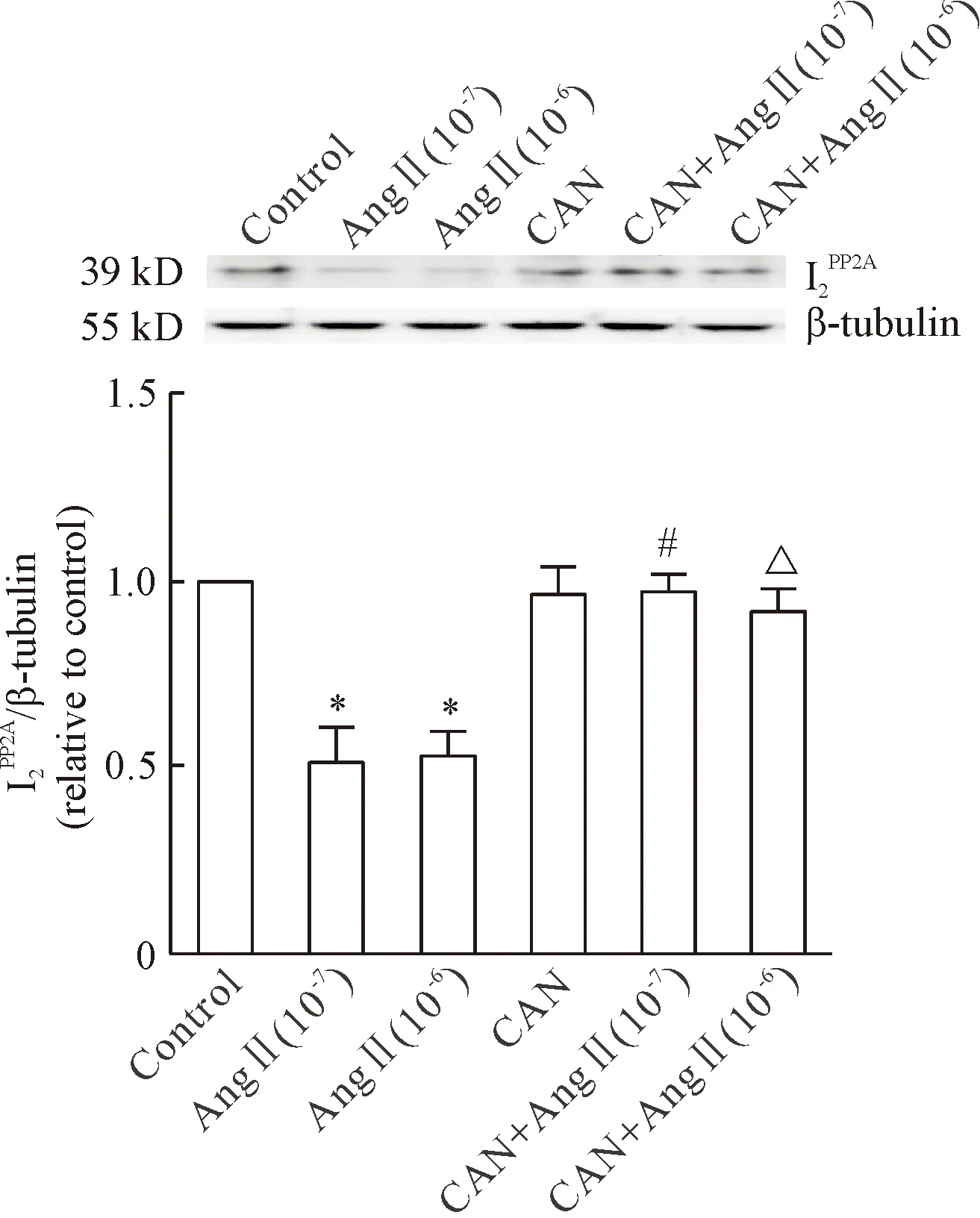
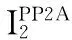
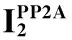
2AngⅡ/AT1R通路激活HUVECs中PP2A可能的分子机制
Michell等[5]已报道PP2A能使eNOS的Ser1177位点发生去磷酸化。本课题组在前期双肾单夹肾血管性高血压大鼠的研究中发现,肾血管性高血压大鼠血清AngⅡ水平升高,PP2A活性增强,eNOS Ser1177磷酸化水平下降,eNOS/NO功能障碍。那么,在AngⅡ/AT1R通路导致eNOS Ser1177磷酸化水平降低的过程中,PP2A活性增强的分子机制如何,目前尚未完全阐明。

文献报道,神经酰胺可激活PP2A,后者调控eNOS活性,即可以通过去磷酸化蛋白激酶B (Akt),进一步下调eNOS Ser1177磷酸化水平,也可以直接使磷酸化eNOS (Ser1177)去磷酸化,从而使eNOS活性降低[6]。在全反式维甲酸诱导的内皮功能障碍的研究中发现,给予PP2Ac亚基 siRNA可降低PP2A活性,导致eNOS Ser1179磷酸化水平上调[18],表明PP2A可直接使eNOS Ser1177位点去磷酸化。本实验所观察的AngⅡ通过AT1R通路下调eNOS Ser1177磷酸化水平,是PP2A活性增强后的直接去磷酸化作用,还是通过其它蛋白激酶如Akt的间接作用,还有待进一步研究。
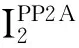
[1] 林善锬. 肾素-血管紧张素系统认识的演变及其临床意义[J]. 中华高血压杂志, 2007, 15(Suppl 1):3-5.
[2] 陈卫兵, 张国元, 殷 明. Losartan抗高血压左室肥厚的细胞学机制研究[J]. 中国病理生理杂志, 2002, 18(2):120-123.
[3] 蒋 文, 李南方. 肾脏病变与高血压关系的研究现状[J]. 中华高血压杂志, 2011, 19(4):317-319.
[4] Lambrecht C, Haesen D, Sents W, et al. Structure, regulation, and pharmacological modulation of PP2A phosphatases[J]. Methods Mol Biol, 2013, 1053:283-305.
[5] Michell BJ, Chen ZP, Tiganis T, et al. Coordinated control of endothelial nitric-oxide synthase phosphorylation by protein kinase C and the cAMP-dependent protein kinase[J]. J Biol Chem, 2001, 276(21):17625-17628.
[6] Zhang QJ, Holland WL, Wilson L, et al. Ceramide me-diates vascular dysfunction in diet-induced obesity by PP2A-mediated dephosphorylation of the eNOS-Akt complex[J]. Diabetes, 2012, 61(7):1848-1859.
[7] Wang C, Qian X, Sun X, et al. Angiotensin II increases matrix metalloproteinase 2 expression in human aortic smooth muscle cells via AT1R and ERK1/2[J]. Exp Biol Med, 2015, 240(12):1564-1571.
[8] Barauna VG, Mantuan PR, Magalhães FC, et al. AT1 receptor blocker potentiates shear-stress induced nitric oxide production via modulation of eNOS phosphorylation of residues Thr495and Ser1177[J]. Biochem Biophys Res Commun, 2013, 441(4):713-719.
[9] Butt E, Bernhardt M, Smolenski A, et al. Endothelial nitric-oxide synthase (type Ⅲ) is activated and becomes calcium independent upon phosphorylation by cyclic nuc-leotide-dependent protein kinases[J]. J Biol Chem, 2000, 275(7):5179 -5187.
[10] 袁文金, 李玉光, 谭学瑞. 一氧化氮的抗炎作用与动脉粥样硬化[J]. 中国病理生理杂志, 2003, 19(9):1276-1278.
[11] Pluta RM. New regulatory, signaling pathways and sources of nitric oxide[J].Acta Neurochir Suppl, 2011, 110(1):7-12.
[12] Tassone EJ, Sciacqua A, Andreozzi F, et al. Angiotensin (1-7) counteracts the negative effect of angiotensin Ⅱ on insulin signalling in HUVECs[J]. Cardiovasc Res, 2013, 99(1):129-136.
[13] Kataoka H, Murakami R, Numaguchi Y, et al. Angiotensin II type 1 receptor blockers prevent tumor necrosis factor-α-mediated endothelial nitric oxide synthase reduction and superoxide production in human umbilical vein endothelial cells[J]. Eur J Pharmacol, 2010, 636(1-3):36-41.
[14] McCluskey A, Sim AT, Sakoff JA. Serine-threonine protein phosphatase inhibitors: development of potential the-rapeutic strategies[J]. J Med Chem, 2002, 45(6):1151-1175.
[15] Liu R, Zhou XW, Tanila H, et al. Phosphorylated PP2A (tyrosine 307) is associated with Alzheimer neurofibrillary pathology[J]. J Cell Mol Med, 2008, 12(1):241-257.
[16] Liu X, Wang Z, Xia Y, et al. Losartan-induced hypotension leads to tau hyperphosphorylation and memory deficit[J]. J Alzheimers Dis, 2014, 40(2):419-427.
[17] Bharath LP, Ruan T, Li Y, et al. Ceramide-initiated protein phosphatase 2A activation contributes to arterial dysfunctioninvivo[J]. Diabetes, 2015, 64(11):3914-3926.
[18] Park JH, Sung HY, Lee JY, et al. B56α subunit of protein phosphatase 2A mediates retinoic acid-induced decreases in phosphorylation of endothelial nitric oxide synthase at serine 1179 and nitric oxide production in bovine aortic endothelial cells[J]. Biochem Biophys Res Commun, 2013, 430(2):476-481.
(责任编辑: 卢 萍, 罗 森)
AngⅡ/AT1R pathway activates PP2A to down-regulate p-eNOS (Ser1177) in human umbilical vein endothelial cells
WANG A-lei, DING Jing, WANG Ling-xiao, ZHANG Qian, HUANG Hua, JIANG Jun-cai, LU De-qin
(Department of Pathophysiology, Guizhou Medical University, Guiyang 550025, China. E-mail: dqlu91@hotmail.com)

Angiotensin II; Angiotensin II type 1 receptor; Protein phosphatase 2A; Endothelial nitric oxide synthase; Phosphorylation
1000- 4718(2017)09- 1558- 06
2017- 03- 28 [
] 2017- 06- 01
国家自然科学基金资助项目(No.31460267); 贵州省科学基金资助项目(黔科合LH字[2014]7088)
R363; R543
A
10.3969/j.issn.1000- 4718.2017.09.004
△通讯作者 Tel: 0851-86910068; E-mail: dqlu91@hotmail.com
