慢性高原病患者血清GC-TOF-MS代谢组学的初步研究*
2017-09-22曹学锋白振忠格日力
曹学锋, 白振忠, 马 兰, 马 爽, 格日力
(青海大学医学院高原医学研究中心,青海 西宁 810001)
慢性高原病患者血清GC-TOF-MS代谢组学的初步研究*
曹学锋, 白振忠, 马 兰, 马 爽, 格日力△
(青海大学医学院高原医学研究中心,青海 西宁 810001)
目的: 研究慢性高原病患者气相色谱飞行时间质谱(GC-TOF-MS)代谢组学的变化,并鉴定血清代谢图谱的内源性代谢物,探讨青海玉树世居藏族居民潜在的差异性代谢标志物。方法: 收集10例青海玉树世居藏族慢性高原病患者(CMS组)和10例世居高原健康藏族居民(control组)血清,利用GC-TOF-MS代谢组学和多元回归分析方法,如主成分分析法(PCA)、偏最小二乘法判别分析(PLS-DA)和正交偏最小二乘法判别分析(OPLS-DA)模式识别分析各代谢物的变化。结果: PCA、PLS-DA和OPLS-DA模式判别分析结果显示,两组血清代谢组均表现出明显聚类型分布。CMS组血清中延胡索酸、肌苷、植烷酸、2,2-二甲基丁二酸、β-酮己二酸、异亮氨酸、甘氨酸、丝氨酸、L-半胱氨酸、瓜氨酸、三甲基赖氨酸、1-磷酸葡萄糖和核糖水平显著高于control组;CMS组血清中下降的代谢物有硫酸、草酸、谷氨酰胺和来苏糖。结论: 慢性高原病患者和高原健康藏族居民血清代谢物水平有显著性差异,这些血清代谢物的改变可能参与了慢性高原病的发生与发展。
慢性高原病; 气相色谱飞行时间质谱; 代谢组学
青藏高原 、内蒙古高原 、黄土高原和云贵高原上有大约6 000~8 000万人口居住在海拔2 500 m以上的高原地区。在北美、墨西哥、美国西部高原地区世居人口相对较少,但高海拔地区进入人口在逐年增加,估计其居民罹患慢性高原病(chronic mountain sickness,CMS)的概率将增加5%~10%[1]。慢性高原病是长期生活在海拔2 500 m以上高原的世居者或移居者,对高原低氧环境逐渐失习服而导致的临床综合征,主要表现为红细胞增多(女性 Hb ≥190 g/L, 男性Hb ≥210 g/L),当患者移居到低海拔地区后,其临床症状逐渐消失,如果再返回高海拔地区则病情复发[2-4]。
慢性高原病的发生伴随着患者机体的病理生理变化,使得机体的代谢物也随之发生相应变化。系统生物学的出现为研究高原习服失败相关疾病发病机制提供了新的思路,基因组、蛋白质组、转录组、代谢组等组学相关分析方法为系统生物学研究提供了强有力的工具。代谢组学的研究内容是生物体对病理生理刺激或基因修饰产生的代谢物质的质和量的动态变化。作为全新的研究手段己被广泛应用于生理、病理、药物毒性研究等方面。代谢组学研究最主要两个技术平台是磁共振技术和质谱技术[5]。
目前对慢性高原病发病机制的研究表明,其发生发展过程并不是一个脏器的问题,而是全身各系统相互作用的结果,如高原红细胞增多症、高原心脏病、高原高血压等都属于慢性高原病范畴[4]。本课题的研究目的为运用代谢组学方法研究慢性高原病代谢组学改变,以期为慢性高原病的发病机制研究提供实验依据。
材料和方法
1研究对象和血样采集
本课题研究对象为青海省玉树州清水河地区(4 300 m)世居藏族人群,分为世居藏族CMS组(男8例,女2例),同海拔地区世居藏族健康居民(男3例,女7例)设为对照(control)组。慢性高原病的诊断依2004年发布的国际慢性高原病标准[2]“青海标准”,即女性Hb≥190 g/L, 男性Hb≥210 g/L,且排除有心肺疾患的病人。Control组女性Hb≤150 g/L, 男性Hb≤160 g/L。本课题研究对象签订知情同意书并获得青海大学伦理委员会的批准。
研究对象在安静状态下检测血氧饱和度并采集7~10 mL静脉血,将血样4 ℃、12 000 r/min离心10 min,吸取上清液到冻存管,于液氮中保存,汽车运送至西宁进行实验。
2主要试剂和仪器
L-2-氯苯丙氨酸购自上海恒柏生物科技有限公司;衍生化试剂BSTFA(含1% TMCS)购自 REGIS Technologies;甲醇、乙腈、正庚烷均购自上海安谱实验科技股份有限公司;氧铵盐、吡啶购自Sigma;GC色谱仪(Agilent);质谱仪(LECO);明澈纯水仪(Millpore)。
3主要方法
3.1代谢物萃取 取100 μL血清样本,加入0.4 mL甲醇,再加入20 μL L-2-氯苯丙氨酸,漩涡混匀;紧接着将样本4 ℃、12 000 r/min离心15 min;小心地取出0.39 mL上清于2 mL进样瓶(甲烷硅基化)中。每个样本各取13 μL混合成质量控制(quality control,QC)样本。
3.2代谢物衍生化 在真空浓缩器中干燥提取物;向干燥后的代谢物加入50 μL甲氧胺盐试剂(甲氧胺盐酸盐溶于吡啶;20 g/L),轻轻混匀后,放入烘箱中80 ℃孵育20 min;向每个样品中迅速加入70 μL BSTFA(含有1% TCMS),将混合物70 ℃孵育1 h;冷却至室温,向混样的样本中加入10 μL FAMEs(饱和脂肪酸甲酯标准混合液)混匀,上机检测。
3.3质谱检测 运用配有Agilent DB-5MS毛细管柱(30 m×250 μm×0.25 μm)的Agilent 7890气相色谱飞行时间质谱联用仪进行检测。GC-TOF-MS具体分析条件如下:进样量为1 μL,不分流模式;载气为氦气;前进样口吹扫流速:3 mL/min;柱流速 1 mL/min;柱温 50 ℃保持1 min,以20 ℃/min的速率上升至320 ℃,保持5 min;前进样口温度为280 ℃;传输线温度为280 ℃;离子源温度为220 ℃;电离电压为-70 eV;扫描方式 85~600 m/z;扫描速率 20 spectra/s;溶剂延迟为4.93 min。摸索样本GC-TOF-MS检测最优代谢物萃取及检测方法。
3.4系统稳定性检测 运用GC-TOF-MS 代谢组学研究,稳定的实验方法才能获得可靠地实验数据。本研究由不同样本取等量混合后得到QC样本,并多次连续进QC样本,使仪器达到稳定状态;其次,所有样本以内标(L-2氯苯丙氨酸)的保留时间(R.T.)数值标准差为0.002521,说明系统十分稳定,这是质量控制之一;还有,通过饱和脂肪酸甲酯建立方程计算得到每个峰的保留时间指数,只有跟数据库中标品的保留时间指数相差在5 000以内,才能定性有效,以确保数据稳定性和准确性。
3.5差异代谢物筛选及鉴别 通过OPLS-DA分析过滤不相关的正交信号,获得差异性代谢物。本项目采用 OPLS-DA 模型第一主成分的VIP(variable importance in the projection)值(阈值为1),并结合t检验的P值(阈值为0.05)来寻找差异性表达代谢物。既以阈值VIP>1和P<0.05作为CMS组和control组代谢物筛选标准,即阈值VIP>1和P<0.05化合物是具有显著性差异的化合物。
4统计学处理
Chroma TOF 4.3X软件和LECO-Fiehn Rtx5数据库被用于原始峰值筛检、基线数据过滤以及基线校准、峰对齐、反卷积分析、峰鉴别、峰面积计算。 保留时间指数(retention index,RI)方法用于峰值鉴别。用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,均数差异比较采用t检验,以P<0.05为有差异有统计学意义。
结 果
1CMS组与control组人口学特征和血常规结果
两组年龄、身高、体重、收缩压、舒张压、血氧饱和度的差异没有统计学显著性;红细胞计数、红细胞压积、血红蛋白浓度、慢性高原病评分的差异有统计学显著性(P<0.01),见表1。这说明本研究所选择研究对象符合实验要求。
表1研究对象人口学特征和血常规检测数据表
Table 1. Demographic characteristics and blood routine of human subjects (mean±SD.n=10)

IndexCMSControlPvalueAge(year)36.7±16.4338±10.700.8363Height(cm)165.6±7.49159±7.390.0628Weight(kg)69.9±8.1962.5±9.940.0859Systolicpressure(mmHg)124.5±18.03114.6±13.080.1769Diastolicpressure(mmHg)87.3±9.1381.1±9.840.1614RBC(×1012/L)6.97±0.815.06±0.270.0000Hematocrit(%)72.3±6.4249.2±2.400.0000Hemoglobin(g/L)217.3±14.72145.9±9.500.0000Oxygensaturation(%)82.6±6.9986.5±3.200.1261CMSscore7.1±2.191.94±1.340.0000
RBC: red blood cell; CMS score: chronic mountain sickness score.
2模式识别判别分析
主成分分析法(principal component analysis,PCA)模式识别方法对世居藏族CMS组和同海拔世居藏族control组的血清代谢组进行模式判别分析,结果显示CMS组与control组主成分积分值基本集中分布于椭圆形散点置信区内的区域,表明CMS患者与control组之间存在血清主成分代谢物的差异。两组偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA)和正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)显示呈聚类型分布于椭圆形散点置信区内的2个区域,表明CMS患者与control组之间存在代谢物的显著差异,结果显示PLS-DA和OPLS-DA模式识别效果优于PCA,见图1。
3差异代谢物结果
CMS组延胡索酸、肌苷、植烷酸、2,2-二甲基丁二酸、β-酮己二酸、1-磷酸葡萄糖、核糖、异亮氨酸、甘氨酸、丝氨酸、L-半胱氨酸、瓜氨酸和三甲基赖氨酸表达水平明显高于control组,而硫酸、草酸、谷氨酰胺和来苏糖表达水平明显低于control组(VIP>1,P<0.05),见表2。
4ROC曲线分析结果
异亮氨酸、延胡索酸、1-磷酸葡萄糖、瓜氨酸、肌苷和甘氨酸的ROC曲线下面积(area under roc curve,AUC)值分别为0.8958、0.89、0.84、0.8、0.7125和0.7042,见图2。AUC值在0.9和0.7之间,代表这一生物标志物有比较高的诊断准确性。异亮氨酸、延胡索酸、1-磷酸葡萄糖和瓜氨酸可能是慢性高原病血清生物标志物。
讨 论
我国有大量人口生活在高海拔缺氧地区,长期缺氧对机体产生非常不利的影响,CMS是严重影响高原居民和移居人群健康的疾病。2004年在中国青海西宁举行的国际高原医学第六届世界大会定义CMS发生于海拔超过2 500 m土著人群或居民,其特点是红细胞增多和高血红蛋白浓度(男性Hb≥210 g/L,女性Hb≥190 g/L),严重的低氧血症(低SaO2),严重的肺动脉高压,其可能发展为肺心病,导致充血性心力衰竭[4]。居住在秘鲁的矿业城市塞罗迪帕斯科镇,海拔4 300 m的CMS的发病率估计为15.6%[6]。在青海高原CMS患病率随海拔升高而增高,海拔 2 267 m~2 980 m 为1.05%,3 128 m~3 968 m 为 3.75%,4 006 m~5 226 m 为 5.83%。CMS患病率汉族男性为7.77%,女性为 1.76%[7]; 藏族男性为 1.78%,女性为0.56%,男性患病率约为女性的 4 倍[7];这些报道说明种族、性别不同在遗传、代谢等方面对高原低氧、高寒、强紫外线环境适应可能存在差异。

Figure 1. PCA, PLS-DA and OPLS-DA analysis of GC-TOF-MS metabolite profiles. A: the PCA score plot showed that the CMS samples and control subjects were scattered into 2 different regions. The X-axis, t[1], and Y-axis, t[2], indicating the first and second principal components, respectively; B: the PLS-DA score plot showed that the CMS samples and control subjects were scattered into 2 different regions. The X-axis, t[1], and Y-axis, t[2], indicating the first and second principal components, respectively (R2Y=0.954 ,Q2=0.46); C: the OPLS-DA score plot showed that the CMS samples and control subjects were scattered into 2 different regions. The X-axis, t[1], and Y-axis, t[2], indicating the first and second principal components, respectively (R2Y=0.954,Q2=0.357); D: the OPLS-DA loading plot was constructed to display the relationship between the X-variables and the Y-variables for the first predictive component and the first Y-orthogonal component. The horizontal axis represented the X-loadings p and the Y-loadings q of the predictive component. The vertical axis represented the X-loadings p(o) and the Y-loadings s(o) for the Y-orthogonal component. X-variables situated in the vicinity of the dummy Y-variables had the highest discriminatory power between the classes.
图1气相色谱飞行时间质谱联用PCA、PLS-DA和OPLS-DA的代谢物判别分析图
由于灵敏度、分辨率、峰值和重现性等方面的优越性,GC-TOF-MS代谢组学技术已被广泛应用于代谢物鉴定和量化。本研究模型解释率及预测率都比较高, PLS-DA得分图R2Y=0.954 ,Q2=0.46,提示该模型稳定可靠。PLS-DA和OPLS-DA得分图可以看出,两组样本之间无交叉重叠,说明两组血清样本之间存在比较明显的差异。
在高原低氧环境中,人体的正常代谢将可能做一些调整以适应环境变化和保持相对的动态平衡状态,这对人体抵抗外界高原环境变化具有重要意义。本研究表明, CMS组与对照组比较,乳酸水平没有显著性差异,可能是CMS的发病机制与乳酸代谢没有明显相关性。相反,1-磷酸葡萄糖和延胡索酸在CMS组中含量显著增加,表明CMS患者机体的能量代谢,在低压低氧环境条件下并不是如有文献报道的从有氧氧化转化为了无氧酵解。然而世居高原健康藏族居民,尽管血乳酸水平升高,无氧酵解增强,但其血红蛋白浓度正常,没有出现慢性高原病,其机制还有待阐明。一般而言,当机体能量需求不能满足时,通过有氧氧化减弱而无氧酵解增强,从而导致乳酸水平升高[9]。无氧酵解可以大大提高三磷酸腺苷的产生速度,以确保机体低氧环境中的能量需求供应[10]。
在这项研究中,多种氨基酸的水平在CMS组显著增加,包括异亮氨酸、甘氨酸、丝氨酸、瓜氨酸、L-半胱氨酸和三甲基赖氨酸。此外,谷氨酰胺与control组相比显著减少。CMS组的瓜氨酸水平比control组高,表明CMS患者的氮代谢可能增强。尿素循环中氨和二氧化碳转化为尿素并生成一个分子延胡索酸,这与延胡索酸含量升高的表现是一致的。瓜氨酸的代谢通路中, 一氧化氮合酶催化精氨酸转化为瓜氨酸和一氧化氮(一种内源性血管舒张因子,可改善血液流变性和保持微循环的畅通),有文献报道,脑缺血后给与NO合成底物 L-精氨酸后,血清 NO浓度升高,可减轻脑缺血并保护海马神经元[11],以此推测在慢性高原病患者NO浓度可能也是升高的。异亮氨酸作为一种重要必需氨基酸,参与调节体内多种代谢和功能,异亮氨酸可提高雌鼠血清抗氧化能力[12],说明CMS患者为适应高原低氧环境机体可能存在抗氧化能力增强的状态。甘氨酸是是机体内源性抗氧化剂谷胱甘肽(glutathione,GSH)的组成氨基酸,大量文献报道,在某些病理情况下,甘氨酸具有抗炎、抗损伤、免疫调节和细胞保护等促进机体防御作用[13]。丝氨酸不但参与蛋白质的合成,而且是合成磷脂酰丝氨酸、鞘脂、核苷酸及甘氨酸的前体,丝氨酸可通过激活甘氨酸受体减少脑梗死体积,减轻脑水肿[14]。异亮氨酸、延胡索酸、1-磷酸葡萄糖、瓜氨酸、肌苷和甘氨酸的AUC值分别为0.895 8、0.89、0.84、0.8、0.712 5和0.704 2。因此,CMS组上述氨基酸具有较高代谢水平可能表明机体在氨基酸层面存在积极代偿反应。谷氨酰胺参与人体多种代谢,当机体酸性物质过多时,其经肾小管上皮细胞谷氨酰胺酶水解生成谷氨酸和氨,氨结合H+来促进H+从尿中排出,从而降低H+浓度,谷氨酰胺血清代谢水平下降,维持机体内环境稳态;再者,谷氨酸可在谷氨酸脱氢酶的作用下分解为α-酮戊二酸,可能参与合成谷胱甘肽,缓解CMS的氧化应激损伤[15]。

表2 CMS组与control组比较差异表达的代谢物
RT: retention time; VIP: variable importance for the projection.
肌苷是腺苷酸分解产物,其与炎症、缺氧和组织损伤有关[16]。肌苷升高可能与适应低氧环境有关,还可能有助于调节CMS的炎症过程。在缺氧条件下肌苷可渗透进入细胞增强酶的活性,尤其是辅酶和丙酮酸氧化酶,从而促进细胞代谢。CMS组血清肌苷水平增高表明肌苷可能参与藏族慢性高原病患者机体抗缺氧损伤反应。核糖在CMS组显著高于对照组,在高原缺氧的疾病状态下,ATP 的分解速度大于合成速度,绝大部分ATP 的降解产物 IMP 可通过补救途径重新合成 ATP, 小部分IMP 会进一步降解,以嘌呤形式流失, 进而导致核苷酸不断减少,细胞可再通过补救合成途径弥补流失的ATP,其中核糖含量是限制其恢复速度的重要因素。核糖作为人体重要的能量代谢物质具有很好的改善心脏缺血[17]、 提升心脏功能[18]、增强肌体能量代谢、 缓解肌肉酸痛等功能,具有有效的抗氧化作用[19]。上述核糖的功用可能说明,CMS患者核糖升高的可能机制是机体为适应低氧而作出的代偿适应性反应。至于其他有差异代谢物如磷酸甲酯、2 2-二甲基丁二酸、来苏糖、β-酮己二酸和植烷酸在 CMS组显著升高的机制还不明确。然而,它们都有比较高的VIP值和显著性,进一步的研究可能需要关注这些代谢物的功能,以排除假阳性的可能。
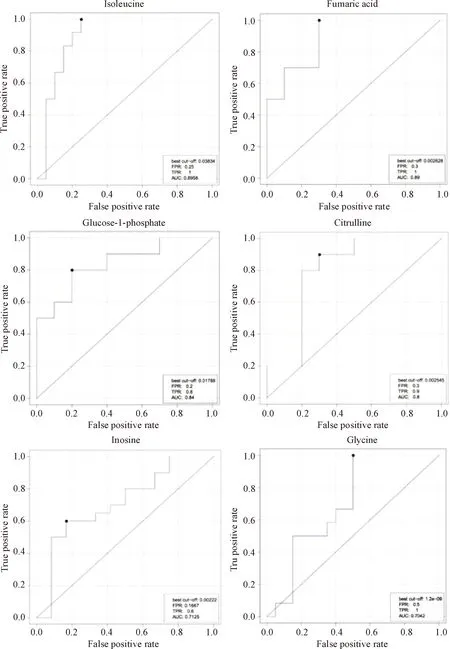
Figure 2. ROC graphs of metabolites with the highest AUC values.
图2具有较高AUC值代谢物ROC曲线图
[1] Zhou D, Udpa N, Ronen R, et al. Whole-genome sequencing uncovers the genetic basis of chronic mountain sickness in Andean highlanders[J]. Am J Hum Genet, 2013, 93(3):452-462.
[2] Stream JO, Luks AM, Grissom CK. Lung disease at high altitude[J]. Expert Rev Respir Med, 2009, 3(6):635-650.
[3] Monge CC, Arregui A, Leon-Velarde F. Pathophysiology and epidemiology of chronic mountain sickness[J]. Int J Sports Med, 1992, 13(Suppl 1):S79-S81.
[4] Leon-Velarde F, Maggiorini M, Reeves JT, et al. Consensus statement on chronic and subacute high altitude diseases[J]. High Alt Med Biol, 2005, 6(2):147-157.
[5] Brindle JT, Antti H, Holmes E, et al. Rapid and noninvasive diagnosis of the presence and severity of coronary heart disease using1H-NMR-based metabonomics[J]. Nat Med, 2002, 8(12):1439-1444.
[6] Leon-Velarde F, Arregui A, Vargas M, et al. Chronic mountain sickness and chronic lower respiratory tract disorders[J]. Chest, 1994, 106(1):151-155.
[7] 吴天一. 我国青藏高原慢性高原病研究的最新进展[J]. 中国实用内科杂志, 2012, 32(5):321-323.
[8] Alonso A, Marsal S, JuliA. Analytical methods in untargeted metabolomics: state of the art in 2015[J]. Front Bioeng Biotechnol, 2015, 3:23.
[9] Mamtimin B, Upur H, Hao FH, et al. Plasma metabonomic analysis with1H nuclear magnetic resonance revealing the relationship of different tumors and the disease homology theory of traditional Uyghur medicine[J]. Chin J Integr Med, 2011, 17(2): 111-115.
[10]Cloarec O, Dumas ME, Trygg J, et al. Evaluation of the orthogonal projection on latent structure model limitations caused by chemical shift variability and improved visualization of biomarker changes in1H NMR spectroscopic metabonomic studies[J]. Anal Chem, 2005, 77(2):517-526.
[11]孙保亮, 张苏明, 夏作理,等.一氧化氮与脑血管痉挛性神经元损伤和 L-精氨酸的作用[J]. 中国病理生理杂志, 2004 , 20(1):76-79.
[12]宫碧霜,任 曼,靳二辉,等. 异亮氨酸对大鼠血清抗氧化水平及脾脏组织结构的影响[J]. 安徽科技学院学报, 2015, 29(6):1-5.
[13]Xu FL,You HB, Li XH, et al. Glycine attenuates endotox in induced liver injury by downregulating TLR4 signaling in Kupffer cells [J]. Am J Surg, 2008, 196(1)139-148.
[14]Wang GH, Jiang ZL, Chen ZQ, et al. Neuroprotective effect of L-serine against temporary cerebral ischemia in rats[J].J Neurosci Res, 2010, 88(9):2035-2045.
[15]Williams MD, Zhang X, Belton AS, et al. HMGA1 drives metabolic reprogramming of intestinal epithelium during hyperproliferation, polyposis, and colorectal carcinogenesis[J].J Proteome Res, 2015,14(3):1420-1431.
[16]Eltzschig HK. Adenosine: an old drug newly discovered[J]. Anesthesiology, 2009, 111(4):904-915.
[17]Bayram M, St Cyr JA, Abraham WT. D-ribose aids heart failure patients with preserved ejection fraction and diastolic dysfunction: a pilot study[J]. Ther Adv Cardiovasc Dis, 2015, 9(3):56-65.
[18]Dunne L, Worley S, Macknin M. Ribose versus dextrose supplementation, association with rowing performance: a double-blind study[J]. Clin J Sport Med, 2006, 16(1):68-71.
[19]Addis P, Shecterle LM, St Cyr JA. Cellular protection during oxidative stress: a potential role for D-ribose and antioxidants[J]. J Diet Suppl, 2012, 9(3):178-182.
(责任编辑: 陈妙玲, 余小慧)
Preliminary study of patients with chronic mountain sickness by GC-TOF-MS based serum metabolomics analysis
CAO Xue-feng, BAI Zhen-zhong, MA Lan, MA Shang, GE Ri-li
(Research Center for High Altitude Medical Sciences, Qinghai University Medical College, Xining 810001, China. E-mail:geriligao@hotmail.com)
AIM: To evaluate specific metabolomics profiles in the serum of patients with chronic mountain sickness (CMS) and to explore the potential metabolic biomarkers in the native Tibetans living on the Qinghai-Tibet Pla-teau.METHODS: A gas chromatography time-of-flight mass spectrometry (GC-TOF-MS) approach as a metabolomics technique was used to evaluate metabolic differences. The native Tibetan CMS patients (n=10) and healthy Tibetan controls (n=10) were enrolled from YuShu in Qinghai province in this study. The serum samples were collected and analyzed by GC-TOF-MS coupled with a series of multivariate statistical analyses such as principal component analysis (PCA), partial least squares discriminant analysis (PLS-DA) and orthogonal partial least squares discriminant analysis (OPLS-DA).RESULTS: The intergroup differences between CMS patients and control subjects have been observed. A list of differential metabolites and several top altered metabolic pathways have been identified. The levels of fumaric acid, an intermediate in the tricarboxylic acid (TCA) cycle, and inosine were highly upregulated in the CMS patients, suggesting a greater effort to hypoxic adaptation in high elevation area. Other differential metabolites, such as methyl phosphate, 2-ketoadipate, lyxose and phytanic acid were also identified. Importantly, the differential metabolites possessed higher area under the ROC curve (AUC) values, indicating an excellent clinical ability for the prediction of CMS. Increased levels of amino acids (isoleucine, glycine, serine, L-cysteine, citrulline and trimethyllysine) were detected in CMS group, yet significantly decreased levels of sulfuric acid, oxamic acid, lyxose and glutamine were also detected in CMS group than those in control group. At the same time, the levels of ribose and glucose-1-phosphate were markedly elevated in CMS group (P<0.05).CONCLUSION: The metabolic activities are significantly altered in the serum of CMS patients. High altitude hypoxia may act on the disturbed glucose metabolism and amino acid metabolism in part of the Tibetan triggered by CMS.
Chronic mountain sickness; Gas chromatography time-of-flight mass spectrometry; Metabolomics
1000- 4718(2017)09- 1676- 07
2016- 12- 01 [
] 2017- 04- 13
国家重点基础研究发展计划(973计划)项目(No. 2012CB518200);国家自然科学基金资助项目(No. 31571231);青海-犹他联合重点实验室项目(No. 2014-ZJ-Y39);青海大学医学院中青年科研基金资助项目(No. 2015-KY-2)
R363
A
10.3969/j.issn.1000- 4718.2017.09.023
△通讯作者 Tel: 0971-6108393; E-mail: geriligao@hotmail.com
