三氧化二砷对MRL/lpr狼疮鼠T-bet/GATA3信号通路的影响*
2017-09-22朱晓芳胡宏叶李永吉朱小春
朱晓芳, 胡宏叶, 李永吉, 朱小春, 张 章, 陈 丹△
(温州医科大学附属第一医院 1风湿免疫科, 2肿瘤外科, 浙江 温州 325000)
三氧化二砷对MRL/lpr狼疮鼠T-bet/GATA3信号通路的影响*
朱晓芳1, 胡宏叶2, 李永吉1, 朱小春1, 张 章1, 陈 丹1△
(温州医科大学附属第一医院1风湿免疫科,2肿瘤外科, 浙江 温州 325000)
目的: 本文旨在探讨三氧化二砷(arsenic trioxide,ATO)对MRL/lpr狼疮鼠T-bet/GATA3信号通路的影响及其作用机制。方法: 将20周龄MRL/lpr狼疮鼠和正常C57BL/6J小鼠随机分组,分别接受ATO (0.4 mg·kg-1·d-1)和同体积生理盐水(NS)治疗2个月,分离脾脏淋巴细胞,然后用实时荧光定量PCR法检测T-bet、GATA3、IFN-γ、IL-4的mRNA水平及T-bet/GATA3 mRNA的比值,Western blot法检测T-bet和GATA3的蛋白表达,ELISA法检测血清中IFN-γ和IL-4的浓度。结果: (1)MRL/lpr狼疮鼠NS组T-bet、IFN-γ的mRNA及蛋白表达、T-bet/GATA3 mRNA比值均高于C57BL/6J小鼠NS组(P<0.05),而GATA3、IL-4的mRNA及其蛋白表达均低于C57BL/6J小鼠NS组(P<0.05);(2) 在MRL/lpr狼疮鼠中,与NS组相比,ATO组T-bet、IFN-γ的mRNA及蛋白表达、T-bet/GATA3 mRNA比值均下降(P<0.05),而2组中GATA3、IL-4的mRNA及蛋白表达无明显差异;(3) 在C57BL/6J小鼠中,NS组和ATO组之间以上指标均无显著性差异。结论: ATO可能通过影响MRL/lpr狼疮鼠T-bet/GATA3信号通路,降低T-bet表达,从而减少Th1型细胞因子IFN-γ的表达和分泌。
三氧化二砷; MRL/lpr狼疮鼠; T-bet/GATA3信号通路; IFN-γ; IL-4
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种病因不明的,以自身抗体产生过多和多器官受累为特点的自身免疫性疾病[1]。研究发现Th1/Th2比例的失衡及其相应细胞因子网络的紊乱是导致SLE发病的重要机制[2-3]。而Th细胞分化是由相关的转录因子调控,其中T-bet(T-box基因家族新型的转录因子)和GATA结合蛋白3(GATA binding protein 3,GATA3)分别是Th1和Th2细胞分化的主要驱动者[4],二者表达异常可以影响免疫应答,从而导致免疫调控网络失衡。并且有研究表明SLE病人及狼疮模型鼠中存在T-bet/GATA3信号通路的异常[5]。三氧化二砷(arsenic trioxide,ATO)是我国传统中药砒霜的主要成分,已成功应用于急性白血病及一些肿瘤的治疗[6-7]。国外研究[8]及我们的前期研究[9-10]均表明ATO是一种治疗SLE很有前景的药物,但ATO是否是通过对MRL/lpr狼疮鼠T-bet/GATA3信号通路的影响来调节狼疮鼠Th1/Th2比例的失衡是本次研究的目的。
材料和方法
1动物
20周龄MRL/lpr狼疮鼠20只,体重36~42 g,20周龄C57BL/6J小鼠20只,体重20~22 g,购自中国科学院上海实验动物中心,饲养在温州医学院动物实验中心SPF级动物房。
2主要试剂和器材
三氧化二砷钠注射针剂(哈尔滨伊达药业有限公司);小鼠淋巴细胞分离液(北京索莱宝);鼠细胞因子ELISA试剂盒(深圳晶美生物工程有限公司);Trizol购自Invitrogen;RT-qPCR试剂盒购自TOYOBO;实验中所用引物由Invitrogen合成,具体序列见表1;实时荧光定量PCR 仪采用ABI的StepOne Plus Real-time PCR System;垂直电泳仪(Bio-Rad);酶标仪(Bio-Tek)。
3主要方法
3.1实验分组 MRL/lpr狼疮鼠和C57BL/6J小鼠均随机平均分成2组:(1)ATO组:0.4 mg·kg-1·d-1,腹腔注射;(2)生理盐水(NS)组:作为阴性对照组,根据ATO溶液体积按体重取量,腹腔注射。给药持续2个月,于实验起点和终点采尾血标本,分离血清于 -70 ℃保存待测。

表1 引物序列
3.2脾脏淋巴细胞制备 药物或NS作用2月后,颈椎脱臼法处死小鼠后,无菌条件下取出脾脏,用200目筛网轻轻研磨脾脏过滤成单细胞悬液,采用密度梯度离心法自脾脏单细胞悬液中分离小鼠淋巴细胞,用冷PBS洗涤2次,重悬于10% FCS-RPMI-1640中,调整细胞浓度为2×109/L,台盼蓝染色法测定细胞存活率(>98%)。
3.3血清IFN-γ、IL-4浓度的测定 采用ELISA法,严格按试剂盒说明书操作,显色后在全自动酶标仪上450 nm波长处读取吸光度(A)值,通过绘制标准曲线求出指标含量。
3.4实时荧光定量PCR法检测各组细胞T-bet、GATA3、IFN-γ及IL-4 mRNA的表达 用Trizol法抽提RNA,测定RNA浓度,取 2 μg的RNA按照说明书进行逆转录反应。以β-actin 为内参照,用实时荧光定量PCR进行T-bet、GATA3、IFN-γ、IL-4以及β-actin 产物扩增及结果分析。PCR循环条件设置为:94 ℃10 min;94 ℃ 20 s、60 ℃ 1 min,扩增50个循环;反应完成后再于95 ℃ 15 s、60 ℃ 1 min、95 ℃ 15 s绘制熔解曲线。根据Livak和Schmittgen设计的阈值法测定目的基因的相对表达水平,目的基因量以2-ΔΔCt法计算,将C57BL/6J小鼠NS组(C57 NS)作为样本校正,其表达水平设置为1,ΔΔCt=[Ct目的基因(其它实验组)-Ct内参照(其它实验组)]-[Ct目的基因(C57 NS)-Ct内参照(C57 NS)]。
3.5Western blot法检测T-bet、GATA3蛋白的表达 收集脾脏淋巴细胞,用RIPA裂解液提取总蛋白,BCA法检测待测蛋白的浓度。将10 μg蛋白样品与4倍体积上样缓冲液混匀,100 ℃加热10 min充分变性。经15% SDS-PAGE后,转移至PVDF膜。加入5%脱脂奶粉室温2 h封闭。加 I 抗GATA3、T-bet(1∶500稀释)4℃孵育过夜。加 II 抗IgG(1∶5 000稀释)室温孵育2 h。应用ECL发光液,曝光成像。图像经Quantity One分析软件分析各条带的光密度值,以GAPDH作为内参照,比较各组T-bet、GATA3分别与GAPDH的灰度比值。
4统计学处理
使用SPSS 17.0统计学软件进行分析。实验数据以均数±标准差(mean±SD)表示,进行方差齐性检验后根据样本的性质采用两样本t检验。以P<0.05为差异有统计学意义。
结 果
1RT-qPCR法分析各组T-bet、GATA3、IFN-γ及IL-4的mRNA表达
与C57BL/6J小鼠NS组相比,MRL/lpr狼疮鼠NS组T-bet和IFN-γ的mRNA表达升高,而GATA3和IL-4的mRNA表达下降。ATO能下调MRL/lpr狼疮鼠T-bet和IFN-γ的mRNA表达,而ATO对MRL/lpr狼疮鼠GATA3和IL-4的mRNA表达无明显影响。ATO对C57BL/6J小鼠的T-bet、GATA3、IFN-γ和IL-4 mRNA 的表达无明显影响,见图1。
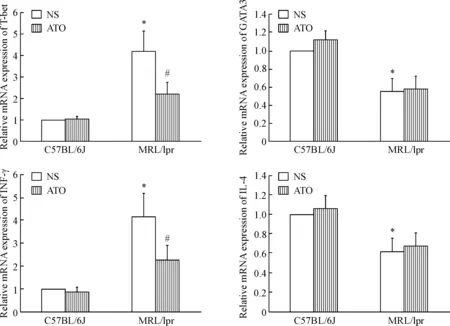
Figure 1. Samples were analyzed by RT-qPCR to measure the mRNA levels of T-bet, GATA3, IFN-γ and IL-4. Mean±SD.n=10.*P<0.05vsC57BL/6J NS group;#P<0.05vsMRL/lpr NS group.
图1实时荧光定量PCR分析各组T-bet、GATA3、IFN-γ及IL-4的mRNA表达
2分析各组T-bet/GATA3mRNA比值的变化
与C57BL/6J小鼠NS组相比,MRL/lpr狼疮鼠NS组T-bet/GATA3 mRNA比值升高,ATO能下调MRL/lpr狼疮鼠T-bet/GATA3 mRNA比值,见表2。
3Westernblot法分析各组T-bet和GATA3蛋白的表达
与C57BL/6J小鼠NS组相比,MRL/lpr狼疮鼠NS组中T-bet蛋白表达升高,而GATA3蛋白表达下降。ATO能下调MRL/lpr狼疮鼠中T-bet的蛋白表达,而对GATA3的蛋白表达无明显影响。ATO对C57BL/6J小鼠的T-bet和GATA3蛋白表达无明显影响,见图2。

表2 各组T-bet/GATA3 mRNA比值的比较
**P<0.01vsC57BL/6J NS group;#P<0.05vsMRL/lpr NS group.

Figure 2. The protein expression of T-bet and GATA3 in MRL/lpr mice and C57BL/6J mice were determined by Western blot analysis. Mean±SD.n=10.*P<0.05vsC57BL/6J NS group;#P<0.05vsMRL/lpr NS group.
图2Westernblot法检测各组T-bet和GATA3的蛋白表达
4ELISA测定血清中IFN-γ和IL-4浓度的变化
用ELISA法检测各组外周血IFN-γ和IL-4的浓度,结果发现,与C57BL/6J小鼠NS组相比,MRL/lpr狼疮鼠NS组中血清IFN-γ的分泌升高,IL-4的分泌下降。ATO能减少MRL/lpr狼疮鼠中IFN-γ的分泌,而对IL-4的分泌无明显影响。ATO对C57BL/6J小鼠IFN-γ和IL-4的分泌无明显影响,见图3。

Figure 3. The serum levels of IFN-γ and IL-4 in the MRL/lpr mice and C57BL/6J mice. Mean±SD.n=10.*P<0.05,**P<0.01vsC57BL/6J NS group;##P<0.01vsMRL/lpr NS group.
图3ELISA法检测各组小鼠血清中IFN-γ和IL-4的浓度
讨 论
SLE是一种原因不明的累及多系统的自身免疫性疾病[1],在SLE的治疗中糖皮质激素和免疫抑制剂仍然是一线治疗药物,这些药物能延长患者的寿命,但是往往伴随严重的毒副作用[11],这为寻找新的治疗SLE的高效低毒的药物提供契机。Bobé等[8]的研究表明砷制剂ATO在SLE的治疗中有较好的疗效,而我们的前期研究[9-10]也证实ATO能延长狼疮鼠的寿命,改善狼疮鼠的病情,并伴有较少的毒副作用,但ATO治疗SLE的具体机制尚待进一步的研究。有研究发现SLE中存在转录因子T-bet/GATA3信号通路的表达异常[5],但ATO是否通过T-bet/GATA3信号通路对SLE起到治疗作用尚不清楚,因此本研究以MRL/lpr狼疮鼠为试验对象,观察ATO对MRL/lpr狼疮鼠T-bet/GATA3信号通路的影响。
T淋巴细胞在SLE的发病中有着重要的作用,然而初始T细胞转化为Th1、Th2的过程中受多种因素影响,其中转录因子T-bet和GATA3在Th细胞分化发育中发挥重要的作用。T-bet是近年哈佛大学的Szabo等[12]发现的重要的Th1转录因子,它在Th1细胞的分化及效应功能维持中起了关键的作用,研究发现T-bet正调控Th1细胞的发育,引起Th1型细胞因子IFN-γ基因的染色质重塑,激活IFN-γ基因转录[12]。而GATA3属于GATA转录因子家族,在Th2细胞分化中发挥了中心性的作用,GATA3正调控Th2细胞的发育,引起Th2型细胞因子IL-4基因染色质重塑,从而诱导IL-4的产生[13]。近来一些研究表明,通过一些干预调节T-bet、GATA3的活性,可以引起Th1/Th2的变化,从而达到控制疾病的目的[14]。
文献报道SLE的免疫紊乱趋向于以Th1型为主,表现为以IFN-γ为代表的Th1型细胞因子显著升高,从而引发相关的组织脏器损伤[15]。在本次实验中,我们发现与正常C57BL/6J小鼠相比,MRL/lpr狼疮鼠中T-bet/GATA3 mRNA比值升高,转录因子T-bet的mRNA及其蛋白表达升高,而GATA3的mRNA及其蛋白表达下降。同时,我们发现MRL/lpr狼疮鼠中Th1型细胞因子IFN-γ的表达与分泌增加,Th2型细胞因子IL-4的表达与分泌下降。这一结果表明SLE是以Th1型细胞因子水平升高,Th2型细胞因子水平下降为特点的Th1/Th2偏移性免疫性疾病。本次研究中我们还发现,MRL/lpr狼疮鼠经ATO干预后,T-bet/GATA3 mRNA比值下降,转录因子T-bet的mRNA及其蛋白表达下降,IFN-γ的表达与分泌下降。并且IFN-γ的表达增减与T-bet/GATA3 mRNA比值、转录因子T-bet的表达增减相一致,故而我们可以估测ATO可能通过调节SLE异常的T-bet/GATA3信号通路,下调T-bet/GATA3 mRNA比值,抑制T-bet的表达,干预T细胞分化的上游环节,进而抑制Th1型免疫反应,而趋向于保护性的Th2型反应。而Bobé 等[8]研究证实ATO能减少IL-18、IFN-γ的分泌,减轻组织损伤,这也从另一侧面反映了ATO可以阻断Th1型免疫反应,从而达到治疗SLE的目的。
综上所述,我们可以推测ATO可能通过影响T-bet/GATA3信号通路,下调T-bet的表达,抑制Th1型免疫反应,减少Th1型细胞因子IFN-γ的表达和分泌,从而使狼疮鼠失衡的Th1/Th2反应相对地向Th2型免疫反应方向漂移。但ATO又是通过什么途径或什么机制使T-bet转录因子发生变化,还待进一步研究。
[1] Kuper BC, Failla S. Systemic lupus erythematosus: a multisystem autoimmune disorder[J]. Nurs Clin North Am, 2000, 35(1):253-265.
[2] Nakashima H, Akahoshi M, Masutani K. Th1/Th2 balance of SLE patients with lupus nephritis[J]. Rinsho Byori, 2006, 54(7):706-713.
[3] Choi EW, Lee M, Song JW, et al. Mesenchymal stem cell transplantation can restore lupus disease-associated miRNA expression and Th1/Th2 ratios in a murine model of SLE[J]. Sci Rep, 2016, 6: 38237.
[4] Kanhere A, Hertweck A, Bhatia U, et al.T-bet and GATA3 orchestrate Th1 and Th2 differentiation through lineage-specific targeting of distal regulatory elements[J]. Nat Commun, 2012, 3:1268.
[5] Yu B, Shao Y, Yue X, et al. Copy number variations of Interleukin-12B and T-bet are associated with systemic lupus erythematosus[J]. Rheumatology (Oxford), 2011, 50(7):1201-1205.
[6] Yang H, Lin S, Cui J. Identifying arsenic trioxide (ATO) functions in leukemia cells by using time series gene expression profiles[J]. Gene, 2014, 535(2):312-317.
[7] 任玮玮, 李 弘, 张 洹. 三氧化二砷对肝癌细胞生长抑制作用差异性探讨[J]. 中国病理生理杂志, 2004, 20(7):1179-1182.
[8] Bobé P, Bonardelle D, Benihoud K, et al. Arsenic trioxide: A promising novel therapeutic agent for lymphoproliferative and autoimmune syndromes in MRL/lpr mice[J]. Blood, 2006, 108(13):3967-3975.
[9] 王晓冰, 陈培荣, 张 挺, 等. 三氧化二砷对MRL/lpr狼疮鼠IFN-γ、IL-4表达和Th1-Th2平衡的影响[J]. 细胞生物学杂志, 2008, 30(4):509-514.
[10] Xia XR, Hong XU, Zhu XC. Effects of arsenic trioxide on survival rate and autoimmune responses of lupus mice[J]. Chin J Pharm Toxicol, 2007, 21(6):482-486.
[11] Cunnane G, Lane NE. Steroid-induced osteoporosis in systemic lupus erythematosus[J]. Rheum Dis Clin North Am, 2000, 26(2) :311-329.
[12] Szabo SJ, Sullivan BM, Stemmann C, et al. Distinct effects of T-bet in TH1 lineage commitment and IFN-gamma production in CD4 and CD8 T cells[J]. Science, 2002, 295(5553): 338-342.
[13] Tindemans I, Serafini N, Di Santo JP, et al. GATA-3 function in innate and adaptive immunity[J]. Immunity, 2014, 41(2):191-206.
[14] Lin Y, Zhou X, Guo W, et al. RhIL-11 treatment normalized Th1/Th2 and T-bet/GATA-3 imbalance in human immune thrombocytopenic purpura (ITP)[J]. Int Immunopharmacol, 2016, 38:40-44.
[15] Hasegawa K, Hayashi T, Maeda K. Promotion of lupus in NZBx NZWF1 mice by plasmids encoding interferon (IFN)-gamma but not by those encoding interleukin (IL)-4[J]. J Comp Pathol, 2002, 127(1):1-6.
Effects of arsenic trioxide on T-bet/GATA3 signal pathway in MRL/lpr mice
ZHU Xiao-fang1, HU Hong-ye2, LI Yong-ji1, ZHU Xiao-chun1, ZHANG Zhang1, CHEN Dan1
(1Department of Rheumatology,2Department of Surgical Oncology, The First Affiliated Hospital of Wenzhou Medical University, Wenzhou 325000, China. E-mail: june8587@outlook.com)
AIM: To investigate the effect of arsenic trioxide (ATO) on T-bet/GATA3 signal pathway in MRL/lpr mice.METHODS: MRL/lpr mice and C57BL/6J mice at the age of 20 weeks were chosen and then divided in 2 different sub-groups, respectively. The mice in 2 sub-groups
ATO (0.4 mg·kg-1·d-1) and sodium chloride (NS, volume weight-determined) by intraperitoneal injection respectively for 2 months. Afterward, the spleens were isolated from the MRL/lpr and C57BL/6J mice under pathogen-free condition and the suspensions were prepared. The mRNA level of T-bet, GATA3, IFN-γ,IL-4 and the mRNA ratio of T-bet/GATA3 were detected by RT-qPCR. The protein expression of T-bet and GATA3 was determined by Western blot. The serum levels of IFN-γ and IL-4 were measured by ELISA.RESULTS: The mRNA and protein levels of T-bet, IFN-γ and the mRNA ratio of T-bet/GATA3 in NS group of MRL/lpr mice were higher than those in NS group of C57BL/6J mice (P<0.05). However, the GATA3 and IL-4 were lower in NS group of MRL/lpr mice in both mRNA and protein level (P<0.05 ). In MRL/lpr mice, the mRNA and protein levels of T-bet, IFN-γ and the mRNA ratio of T-bet/GATA3 were lower in ATO group compared with NS group (P<0.05), no difference was found in GATA3 and IL-4. No difference of the indexes mentioned above between ATO group and NS group in C57BL/6J mice was observed.CONCLUSION: ATO may affect the signaling pathway of T-bet/GATA3 to down-regulate the mRNA expression and the protein secretion of IFN-γ by decreasing the expression of T-bet in MRL/lpr mice.
Arsenic trioxide; MRL/lpr mice; T-bet/GATA3 signal pathway; IFN-γ; IL-4
1000- 4718(2017)09- 1708- 05
2017- 03- 03 [
] 2017- 07- 18
温州科技局重大项目(No. Y20090240)
R593.2; R363
A
10.3969/j.issn.1000- 4718.2017.09.028
△通讯作者 Tel: 0577-55579268; E-mail: june8587@outlook.com
